右美托咪定对氧糖剥夺后星形胶质细胞反应性增殖的影响*
2016-07-05廖明锋迟晓慧赵以林
廖明锋, 迟晓慧, 杨 柳, 赵以林, 冯 丽
华中科技大学同济医学院附属同济医院麻醉学教研室,武汉 430030
右美托咪定对氧糖剥夺后星形胶质细胞反应性增殖的影响*
廖明锋,迟晓慧,杨柳,赵以林,冯丽△
华中科技大学同济医学院附属同济医院麻醉学教研室,武汉430030
摘要:目的探讨右美托咪定对氧糖剥夺后星形胶质细胞反应性增殖的影响。方法采用出生1~2 d的SD大鼠,提取原代星形胶质细胞,将其随机分为5组:对照组(C组)、氧糖剥夺/复氧(OGD/R)组、右美托咪定+OGD/R组(Dex+OGD/R组)、α2肾上腺能受体抑制剂育亨宾+OGD/R组(YHB+OGD/R组)和右美托咪定+育亨宾+OGD/R组(Dex+YHB+OGD/R组)。缺糖缺氧1 h后,复糖复氧培养24 h制备OGD/R模型。C组星形胶质细胞仅做正常培养;OGD/R组星形胶质细胞制备OGD/R模型;Dex+OGD/R组星形胶质细胞于OGD处理1 h后,于复糖的培养液中加入终浓度为10 μmol/L的右美托咪定;YHB+OGD/R组星形胶质细胞于OGD/R处理前30 min向培养液中加入终浓度为10 μmol/L的育亨宾,之后制备OGD/R模型;Dex+YHB+OGD/R组于OGD/R处理前30 min向培养液中加入终浓度为10 μmol/L的育亨宾,其它处理同Dex+OGD/R组。EdU法检测细胞增殖能力;Western blot法测定增殖细胞核抗原(PCNA)、胶质纤维酸性蛋白(GFAP)、磷酸化STAT3(p-STAT3)的蛋白表达水平;ELISA法测定培养液中白细胞介素-6(IL-6)和睫状神经营养因子(CNTF)的浓度。结果与C组比较,OGD/R组EdU阳性细胞率,PCNA、GFAP、p-STAT蛋白表达水平,培养液中IL-6和CNTF释放量均显著增高(均P<0.05);与OGD/R组比较,Dex+OGD/R组EdU阳性细胞率,PCNA、GFAP、p-STAT蛋白表达水平,培养液中IL-6和CNTF释放量较低(均P<0.05);与Dex+OGD/R组比较,Dex+YHB+OGD/R组EdU阳性细胞率,PCNA、GFAP、p-STAT3蛋白表达水平,培养液中IL-6和CNTF释放量均较高(均P<0.05)。结论右美托咪定可缓解氧糖剥夺后星形胶质细胞反应性增殖。
关键词:右美托咪定;氧糖剥夺;胶质细胞反应性增殖;缺血性损伤
星形胶质细胞反应性增殖是脑中风或创伤后出现的中枢神经系统特征性改变[1]。在急性脑中风早期,星形胶质细胞可通过分泌神经营养因子缓解神经元损伤[2]。然而,随着病程的发展,反应性增殖的星形胶质细胞会逐渐形成胶质瘢痕,阻碍神经再生和轴索再生等生理过程,影响患者神经功能恢复[1]。因此,抑制星形胶质细胞反应性增殖已成为促进脑中风后神经功能改善的重要目标。
右美托咪定是临床麻醉及重症监护室中常用的镇静药物[3]。动物研究表明,右美托咪定可缓解脑缺血造成的神经元损伤和凋亡[4]。然而,右美托咪定能否减轻缺血后星形胶质细胞反应性增殖尚不清楚。因此,本实验拟制备大鼠原代星形胶质细胞氧糖剥夺/复氧(OGD/R)模型,探讨右美托咪定对氧糖剥夺后星形胶质细胞反应性增殖的影响及其可能机制。
1材料与方法
1.1主要仪器与试剂
右美托咪定(批号:90619DK,Abott公司,美国),DMEM/F12培养液、无糖DMEM培养液、胎牛血清(Gibco公司,美国),育亨宾(批号:731242,Sigma公司,美国),EdU检测试剂盒(批号:C10341-1,广州市锐博生物科技有限公司),IL-6和睫状神经营养因子(CNTF)的ELISA检测试剂盒(批号分别为EK0412、EK0324,武汉博士德生物有限公司),抗增殖细胞核抗原(PCNA)、胶质纤维酸性蛋白(GFAP)、磷酸化STAT(p-STAT3)、STAT3抗体(批号依次为1310、12389、9145、12640,Cell Signaling Technology公司,美国),抗β-actin抗体(批号:BM0627,武汉博士德生物有限公司),荧光显微镜(Nikon公司,日本)。
1.2原代星形胶质细胞培养
参照文献[5],使用出生1~2 d的新生SD大鼠(购自华中科技大学同济医学院实验动物学部),用于提取并培养皮层星形胶质细胞。快速取出大鼠皮层置于冰上,剪碎后使用0.125%胰蛋白酶于37 ℃下消化10 min。以2×106/瓶的密度种入多聚赖氨酸包被的培养瓶(底面积25 cm2)中。每瓶加入5 mL含10%胎牛血清、100 U/mL青霉素及链霉素的DMEM/F12培养液。细胞在37 ℃含5% CO2的湿润环境中培养,每3天换培养液1次。细胞培养7~9 d后,达到细胞融合状态,于37℃在细胞摇床上以500 r/min的转速摇动细胞6 h,弃去培养液,以除去小胶质细胞和少突胶质细胞污染。之后,消化细胞传代,以1×105/孔的密度种入12孔板中,每孔中加入1 mL DMEM/F12培养液。24 h后,采用星形胶质细胞标记物GFAP和DAPI荧光染色,鉴定星形胶质细胞纯度。
1.3氧糖剥夺/复氧模型的建立
参照文献[6],建立OGD/R模型。将传代后星形胶质细胞培养液换为无糖DMEM培养液。随后将培养板置于缺氧培养箱中,5 L/min的速度吹入95% N2和5% CO2的混合气体,1 h后将培养板取出,换回原DMEM/F12培养液,于原培养箱培养24 h。
1.4实验分组
星形胶质细胞随机分为5组:对照组(C组)、OGD/R组、右美托咪定+OGD/R组(Dex+OGD/R组)、α2肾上腺能受体抑制剂育亨宾+OGD/R组(YHB+OGD/R组)和右美托咪定+育亨宾+OGD/R组(Dex+YHB+OGD/R组)。C组星形胶质细胞仅做正常培养;OGD/R组星形胶质细胞制备OGD/R模型;Dex+OGD/R组星形胶质细胞于OGD处理1 h后,于复糖的培养液中加入终浓度为10 μmol/L的右美托咪定[7];YHB+OGD/R组星形胶质细胞于OGD/R处理前30 min向培养液中加入终浓度为10 μmol/L的育亨宾[7],之后制备OGD/R模型;Dex+YHB+OGD/R组于OGD/R处理前30 min向培养液中加入终浓度为10 μmol/L的育亨宾,其它处理同Dex+OGD/R组。
1.5EdU阳性细胞率检测
参照文献[8],以EdU阳性细胞率反映细胞增殖情况。各组随机取6孔,于OGD/R后,参照厂家说明书向培养液中加入终浓度为10 μmol/L的EdU孵育12 h。PBS漂洗后,加入4%多聚甲醛固定细胞。细胞固定后,加入含0.3% Triton X-100的PBS破膜8 min,随后加入试剂盒中Apollo©567及Hoechst 33342染料分别孵育30 min和10 min。孵育完成后,荧光显微镜下EdU标记的细胞核发红色荧光,Hoechst 33342标记所有细胞的细胞核发蓝色荧光。EdU阳性细胞率=(EdU阳性细胞数/ Hoechst 33342标记细胞数)×100%。
1.6Western blot检测
各组随机取6孔,使用Western blot法检测星形胶质细胞PCNA、GFAP和p-STAT的表达水平。各组细胞培养孔中加入RIPA裂解液,刮下细胞,BCA试剂盒测定裂解产物中蛋白定量。样本行聚丙烯酰胺凝胶电泳后,将蛋白转至0.2 μm孔径的PVDF。5%脱脂牛奶中室温封闭1 h后,加入一抗(抗PCNA抗体,1∶1 000;抗GFAP抗体,1∶2 000;抗p-STAT抗体,1∶500;抗STAT抗体,1∶1 000;抗β-actin抗体,1∶500)4 ℃孵育过夜。次日TBST液漂洗后,加入生物二抗(1∶5 000)室温孵育2 h,行ECL显影,使用Image Lab 3.0软件进行灰度分析。
1.7ELISA法测定神经元IL-6和CNTF释放水平
参照厂家说明书,在96孔板中加入培养液或标准品,并相继加入工作液和显色剂孵育2 h。分光光度计上测量吸光度值(A450 nm)。根据标准品的吸光度值分别绘制标准曲线后,计算培养液中IL-6及CNTF的蛋白表达水平。
1.8统计学方法
2结果
2.1原代星形胶质细胞培养鉴定
免疫荧光结果显示,培养细胞中星形胶质细胞(GFAP阳性)纯度大于95%(图1),可行后续实验。
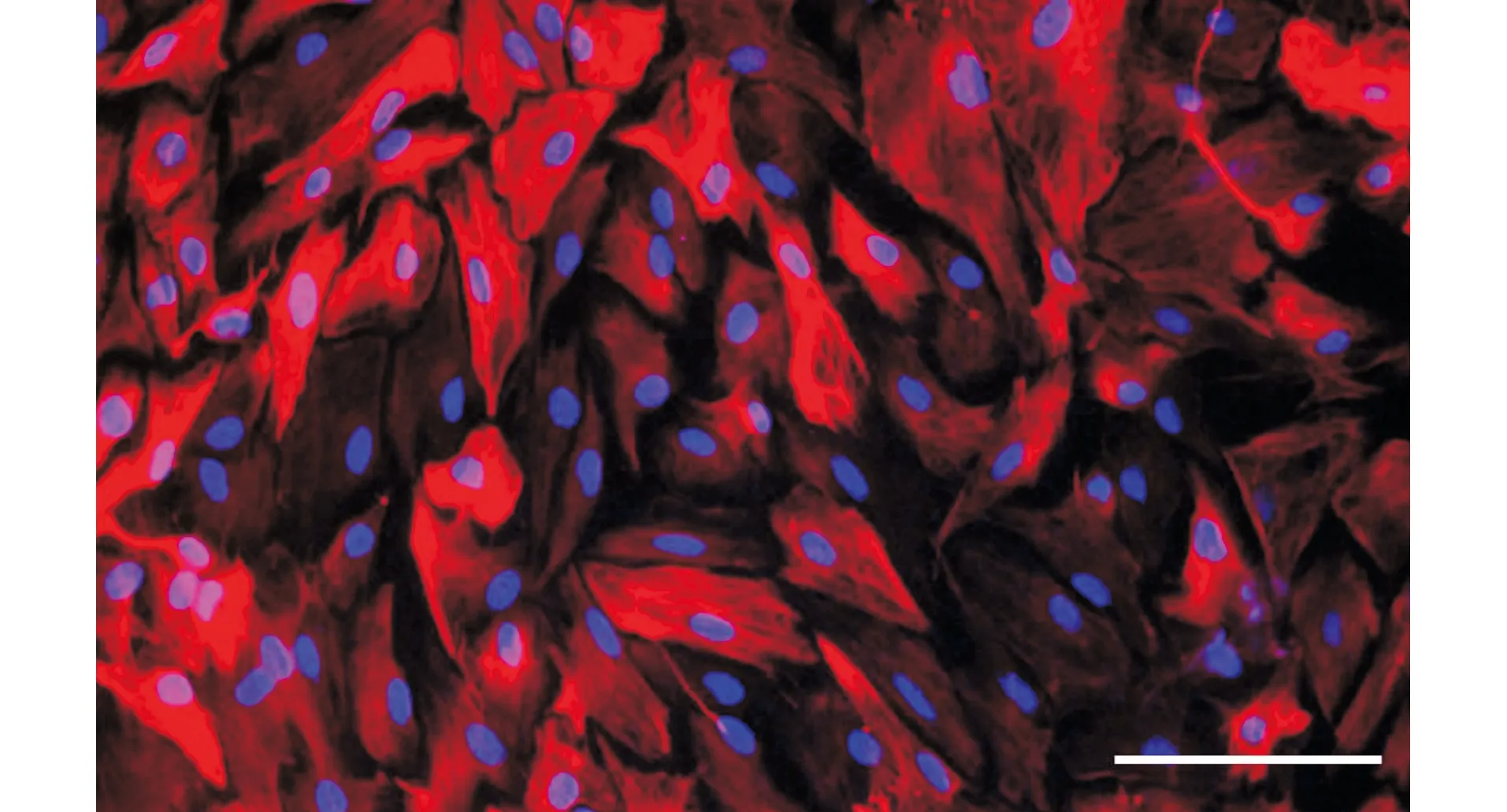
GFAP阳性细胞发红色荧光(Cy3标记),DAPI标记细胞核发蓝色荧光;标尺为50 μm图1 原代星形胶质细胞纯度鉴定Fig.1 Identification of the purity of primary astrocytes isolated from the neonatal rats
2.2各组星形胶质细胞EdU阳性细胞率及PCNA、GFAP蛋白表达水平的比较
与C组比较,OGD/R组星形胶质细胞EdU阳性细胞率、PCNA及GFAP蛋白表达水平显著增高(均P<0.05);与OGD/R组比较,Dex+OGD/R组星形胶质细胞EdU阳性细胞率、PCNA及GFAP蛋白表达水平降低(均P<0.05);与Dex+OGD/R组比较,Dex+YHB+OGD/R组星形胶质细胞EdU阳性细胞率、PCNA及GFAP蛋白表达水平增高(均P<0.05)。见图2、3和表1。

Apollo©567染料标记EdU+细胞发红色荧光(白色三角所示),Hoechst 3342标记细胞核发蓝色荧光;标尺为50 μm;A:C组;B:OGD/R组;C:Dex+OGD/R组;D:YHB+OGD/R组;E:Dex+YHB+OGD/R组图2 各组星形胶质细胞EdU阳性细胞率的检测Fig.2 Comparison of the proportion of EdU-positive cells in cultured astrocytes between groups

A:C组;B:OGD/R组;C:Dex+OGD/R组;D:YHB+OGD/R组;E:Dex+YHB+OGD/R组图3 各组星形胶质细胞PCNA及GFAP蛋白表达水平的检测Fig.3 Comparison of the protein expression levels of PCNA and GFAP in cultured astrocytes between groups
2.3各组星形胶质细胞IL-6、CNTF释放量及p-STAT3蛋白表达水平的比较
与C组比较,OGD/R组星形胶质细胞IL-6、CNTF释放量及p-STAT3蛋白表达水平显著增高(均P<0.05);与OGD/R组比较,Dex+OGD/R组星形胶质细胞培养液IL-6、CNTF释放量及p-STAT3蛋白表达水平显著降低(均P<0.05);与Dex+OGD/R组比较,Dex+YHB+OGD/R组星形胶质细胞IL-6、CNTF释放量及p-STAT3蛋白表达水平显著增高(均P<0.05)。见表2和图4。

表1 各组星形胶质细胞EdU阳性细胞率及PCNA、GFAP蛋白表达水平的比较
与C组比较,aP<0.05;与OGD/R组比较,bP<0.05;与Dex+OGD/R组比较,cP<0.05

表2 各组星形胶质细胞IL-6、CNTF释放量及p-STAT3蛋白表达水平的比较
与C组比较,aP<0.05;与OGD/R组比较,bP<0.05;与Dex+OGD/R组比较,cP<0.05

A:C组;B:OGD/R组;C:Dex+OGD/R组;D:YHB+OGD/R组;E:Dex+YHB+OGD/R组图4 各组星形胶质细胞p-STAT3蛋白表达水平的检测Fig.4 Comparison of the protein expression of phospho-STAT3 in cultured astrocytes between groups
3讨论
氧糖剥夺/复氧模型是体外模拟脑缺血再灌注损伤的常用模型。已有研究采用星形胶质细胞无糖缺氧环境处理1 h合并复糖复氧培养24 h的方法,模拟了脑缺血损伤后的星形胶质细胞反应性增殖[6]。因此,本研究亦采用此法制备氧糖剥夺/复氧模型。结果表明,氧糖剥夺/复氧后星形胶质细胞EdU阳性细胞率、增殖细胞核抗原(PCNA)及星形胶质细胞标记物GFAP蛋白表达水平均显著增加,说明星形胶质细胞反应性增殖诱导成功。
右美托咪定可通过特异性激活α2肾上腺素能受体产生镇静作用并减慢心率,从而改善血流动力学[9]。同时,已有研究表明,右美托咪定可直接作用于星形胶质细胞,通过促进其释放脑源性神经营养因子(BNDF),缓解谷氨酸诱发的兴奋性神经元损伤[10]。本研究结果表明,10 μmol/L的右美托咪定可显著缓解氧糖剥夺后星形胶质细胞EdU阳性细胞率、PCNA及GFAP蛋白表达水平的增加,提示右美托咪定可缓解氧糖剥夺后星形胶质细胞反应性增殖。而α2肾上腺素能受体抑制剂育亨宾处理可逆转右美托咪定的抗星形胶质细胞增殖效果。这就说明,右美托咪定可作用于星形胶质细胞的α2肾上腺素能受体,抑制氧糖剥夺后星形胶质细胞反应性增殖。
研究表明,多种细胞因子(如IL-6和CNTF)在星形胶质细胞反应性增殖中发挥关键作用[1]。脑缺血后,星形胶质细胞产生并释放IL-6和CNTF[1,11-12],激活细胞内STAT3信号通路[13],最终诱发胶质瘢痕形成。而条件性敲除STAT3基因,可显著减轻胶质瘢痕形成和GFAP过表达[14]。最新研究表明,右美托咪定可通过抑制STAT3信号通路激活而缓解肾等缺血再灌注损伤[15]。本研究结果显示,右美托咪定可显著减少氧糖剥夺后星形胶质细胞IL-6和CNTF的释放,并缓解STAT3信号通路的激活,而这些效果可被α2肾上腺素能受体抑制剂育亨宾所逆转。这就提示,右美托咪定可通过特异性激活α2肾上腺素能受体,缓解氧糖剥夺后IL-6和CNTF释放及下游STAT3通路激活。
综上所述,右美托咪定可通过特异性激活α2肾上腺素能受体,抑制氧糖剥夺后星形胶质细胞IL-6和CNTF释放及下游STAT3通路激活,缓解星形胶质细胞反应性增殖。
参考文献
[1]Sofroniew M V.Molecular dissection of reactive astrogliosis and glial scar formation[J].Trends Neurosci,2009,32(12):638-647.
[2]Barreto G E,Sun X,Xu L,et al.Astrocyte proliferation following stroke in the mouse depends on distance from the infarct[J].PLoS One,2011,6(11):e27881.
[3]吴新民,许幸,王俊科.静脉注射右美托咪啶辅助全身麻醉的有效性和安全性[J].中华麻醉学杂志,2007,27(9):773-776.
[4]Kuhmonen J,Haapalinna A,Sivenius J.Effects of dexmedetomidine after transient and permanent occlusion of the middle cerebral artery in the rat[J].J Neural Transm (Vienna),2001,108(3):261-271.
[5]王睿娴,袁超,沈露露,等.姜黄素对 TNF-α 诱导大鼠星形胶质细胞 MCP-1 表达和释放的影响[J].中华麻醉学杂志,2013,33(8):916-919.
[6]Schmid-Brunclik N,Burgi-Taboada C,Antoniou X,et al.Astrocyte responses to injury:VEGF simultaneously modulates cell death and proliferation[J].Am J Physiol Regul Integr Comp Physiol,2008,295(3):R864-R873.
[7]Feng S,Cong S,Zhang X,et al.MicroRNA-192 targeting retinoblastoma 1 inhibits cell proliferation and induces cell apoptosis in lung cancer cells[J].Nucleic Acids Res,2011,39(15):6669-6678.
[8]Mantz J,Josserand J,Hamada S.Dexmedetomidine:new insights[J].Eur J Anaesthesiol,2011,28(1):3-6.
[9]Brissaud O,Lebon S,Schwendimann L,et al.Neuroprotective effects of dexmedetomidine against glutamate agonist-induced neuronal cell death are related to increased astrocyte brain-derived neurotrophic factor expression[J].Anesthesiology,2013,118(5):1123-1132.
[10]Drogemuller K,Helmuth U,Brunn A,et al.Astrocyte gp130 expression is critical for the control of toxoplasma encephalitis[J].J Immunol,2008,181(4):2683-2693.
[11]Herrmann J E,Imura T,Song B,et al.STAT3 is a critical regulator of astrogliosis and scar formation after spinal cord injury[J].J Neurosci,2008,28(28):7231-7243.
[12]秦汉,程江霞,赵彬,等.右美托咪定联合浅低温处理对大鼠脑缺血术后认知功能的影响[J].华中科技大学学报: 医学版,2014,43(1):76-78,89.
[13]Okada S,Nakamura M,Katoh H,et al.Conditional ablation of Stat3 or Socs3 discloses a dual role for reactive astrocytes after spinal cord injury[J].Nat Med,2006,12(7):829-834.
[14]Si Y,Bao H,Han L,et al.Dexmedetomidine protects against renal ischemia and reperfusion injury by inhibiting the JAK/STAT signaling activation[J].J Transl Med,2013,11(1):141.
[15]吴志林,褚淑娟,姚尚龙,等.不同剂量右美托咪定预处理对大鼠心肌缺血再灌注损伤以及炎症反应的影响[J].华中科技大学学报: 医学版,2015,44(4):445-447.
(2016-03-02收稿)
Effects of Dexmedetomidine on Reactive Astrocyte Proliferation after Oxygen-glucose Deprivation
Liao Mingfeng,Chi Xiaohui,Yang Liuetal
DepartmentofAnesthesiology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
AbstractObjectiveTo investigate the effects of dexmedetomidine on reactive astrocyte proliferation after oxygen-glucose deprivation.MethodsPrimary astrocytes were harvested from newborn SD rats of postnatal day 1-2.They were randomly divided into 5 groups:control group (Group C),oxygen-glucose deprivation/reperfusion (OGD/R) group (Group OGD/R),dexmedetomidine+OGD/R group (Group Dex+OGD/R),yohimbine+OGD/R group (Group YHB+OGD/R) and dexmedetomidine+yohimbine+OGD/R group (Group Dex+YHB+OGD/R).The model of OGD/R was established by replacing the standard astrocyte culture medium (DMEM/F12) with glucose-free medium and then immediately exposing cells to 95% N2 and 5% CO2 in the anaerobic chamber at 37°C for 1 h,followed by a return to standard culture conditions for another 24 h.The astrocytes in Group OGD/R were subjected to OGD/R treatment as described above.Those in Group C were not exposed to OGD.The treatment for Group Dex+OGD/R was the same as for Group OGD/R,except that 10 μmol/L dexmedetomidine was added to the normal medium during reoxygenation.The treatment for Group YHB+OGD/R was the same as for Group OGD/R,except that 10 μmol/L of α2 adrenergic receptor antagonist yohimbine was added to medium 30 min before OGD/R treatment.In Group Dex+YHB+OGD/R,10 μmol/L yohimbine was added to medium 30 min before OGD/R treatment and 10 μmol/L dexmedetomidine to medium during reoxygenation.The 5-ethynyl-2’-deoxyuridine (EdU) assay was used to evaluate the astrocyte proliferation after OGD/R treatment.Western blotting was applied to detect the protein levels of proliferating cell nuclear antigen (PCNA) and glial fibrillary acidic protein (GFAP),phospho-signal transducer and activator of transcription 3 (STAT3).ELISA assay was used to determine the concentrations of interlukin-6 (IL-6) and ciliary neurotrophic factor (CNTF) in the medium.ResultsThe proportion of EdU-positive cells,the protein levels of PCNA,GFAP,p-STAT,and the release of IL-6,CNTF were increased in group OGD/R when compared with group C.They were significantly decreased in group Dex+OGD/R as compared with group OGD/R and group Dex+YHB+OGD/R.ConclusionDexmedetomidine is capable of attenuating reactive astrocyte proliferation after oxygen-glucose deprivation.
Key wordsdexmedetomidine;oxygen-glucose deprivation;reactive astrocyte proliferation;ischemic injury
中图分类号:R971.3
DOI:10.3870/j.issn.1672-0741.2016.03.004
*国家自然科学基金资助项目(No.81500982);湖北省卫生计生委资助项目(No.WJ2015MB008)
廖明锋,男,1983年生,主治医师,E-mail:liao_mf@163.com
△通讯作者,Corresponding author,E-mail:sweetlili23@126.com
