shRNA沉默TRAF6基因对急性肝损伤小鼠炎症反应的影响
2016-07-05张芙蓉何生松许娟娟董继华
陈 锋, 张芙蓉△, 何生松, 庞 然, 许娟娟, 董继华
1武汉市妇女儿童医疗保健中心(武汉市儿童医院)重症医学科,武汉 430016 华中科技大学同济医学院附属协和医院 2感染科 3消化内科 4中心实验室,武汉 430022
shRNA沉默TRAF6基因对急性肝损伤小鼠炎症反应的影响
陈锋1,张芙蓉1△,何生松2,庞然2,许娟娟3,董继华4
1武汉市妇女儿童医疗保健中心(武汉市儿童医院)重症医学科,武汉430016华中科技大学同济医学院附属协和医院2感染科3消化内科4中心实验室,武汉430022
摘要:目的通过shRNA沉默肿瘤坏死因子受体相关因子6(tumour necrosis factor receptor associated factor 6,TRAF6)基因表达,研究TRAF6沉默基因对内毒素/D-氨基半乳糖(LPS/D-GalN)诱导的急性肝衰竭小鼠炎症反应的影响。方法通过体外实验筛选针对TRAF6基因的最有效小干扰RNA(siRNA)序列,采用流体力学注射法将pTRAF6-shRNA表达质粒转染BALB/c小鼠,24 h后重复注射1次。第2次注射后24 h,予LPS/D-GalN腹腔注射制备急性肝衰竭内毒素炎症模型。设正常对照组、模型对照组、空白质粒/LPS组及RNAi/LPS组。观察各组小鼠肝脏病理变化,Real-time PCR检测TRAF6、IL-6及COX-2 mRNA的表达,ELISA检测血清TNF-α、IL-1β及TGF-β1水平变化,Western blot检测肝细胞TRAF6、NF-κB p65的表达。结果Real-time PCR及Western blot检测显示,pTRAF6-shRNA1能有效沉默TRAF6 mRNA及蛋白表达,其中TRAF6 mRNA表达较正常小鼠下降约60.13%,TRAF6蛋白表达降低约52.08%,差异均有统计学意义(均P<0.01)。ELISA检测显示各组小鼠TNF-α、IL-1β均于造模后8 h达到峰值,TGF-β1于16 h达到峰值;RNAi/LPS组小鼠血清TNF-α、IL-1β及TGF-β1水平明显低于同时间点模型对照组。Real-time PCR结果显示RNAi/LPS组小鼠IL-6、COX-2及TRAF6 mRNA表达下降,与模型对照组比较差异均有统计学意义(均P<0.01)。Western blot结果显示RNAi/LPS组小鼠肝组织总蛋白NF-κB p65表达水平显著高于正常对照组(P<0.05),与模型对照组无差异,而胞核NF-κB p65明显低于模型对照组(P<0.05)。结论pTRAF6-shRNA可能通过下调NF-κB p65水平,抑制炎症相关细胞因子和炎性介质表达水平,从而减轻内毒素/半乳糖诱导的小鼠急性肝损伤。
关键词:TRAF6;RNA干扰;TLR4信号通路;NF-κB;急性肝衰竭
急性肝功能衰竭(acute liver failure,ALF)是临床危重疾患之一,目前的内科综合治疗效果不理想,病死率高达80%。目前普遍认为,由内毒素(lipopolysaccharide,LPS)诱导的以肿瘤坏死因子(tumour necrosis factor,TNF)为核心的炎症反应在肝衰竭中扮演着重要的角色[1-2],上调这些细胞因子是机体防御细菌感染的主要机制,但是过度表达可以加剧肝脏炎性损伤,导致病情恶化。因此,理论上有效阻断LPS信号转导通路对防治过度炎症反应有重要价值。TRAF6[Tumor necrosis factor(TNF)receptor-associated factor-6]作为介导NF-κB信号转导的一个关键衔接蛋白,在LPS/Toll样受体4(Toll-like receptor,TLR4)信号转导通路中发挥重要调节作用,可介导多条信号通路(TNF-α、IL-1和RANKL通路),最终激活转录因子NF-κB、AP-1、PKB/Akt等,介导病原体相关分子模式(pathogen-associated molecular pattern,PAMP)引起的天然和获得性免疫及炎症反应[3-4]。因此,本实验设计构建重组质粒pGCsi-TRAF6-shRNA,利用RNA干扰(RNA interference,RNAi)技术,以内毒素/半乳糖(LPS/D-GalN)诱导的急性肝衰竭小鼠为研究对象,研究体内抑制TRAF6基因表达对急性肝衰竭内毒素炎症反应的影响。
1材料与方法
1.1材料
LPS(EscherichiacoliO111:B4)及D-氨基半乳糖购自美国Sigma公司;脂质体Trans Fectin购自美国Bio-rad公司;TRIzol、MTT、DMSO购自美国Invitrogen公司;质粒中提试剂盒购自Omega公司;逆转录试剂盒、SYBR Green Real-time PCR试剂盒购自TOYOBO公司;ELISA试剂盒(TNF-α、IL-1β、TGF-β1)购自美国Cusabio公司;TRAF6、NF-kB p65多克隆抗体购自Santa Cruz公司。
重组质粒pGCsi-TRAF6-shRNA由本实验室前期构建[5]。以GenBank已公布的小鼠TRAF6 mRNA序列(NM009424)为参考序列,用美国Invitrogen公司的在线设计软件BLOCK-iTTMRNAi Designer,筛选出4条理论上最佳siRNA序列:shRNA1(900-920)、shRNA2(1303-1323)、shRNA3(2324-2344)、shRNA4(3285-3305)。LOOP结构选用了TCAAGAG,末端以polyT作为RNA聚合酶Ⅲ终止信号,两端设计有BamHⅠ和HindⅢ酶切位点。shRNA寡核苷酸序列及Negative-shRNA表达载体由北京毅新兴业科技有限公司合成提供,构建的真核表达载体经酶切和测序鉴定证明完全正确。
1.2重组质粒pGCsi-TRAF6-shRNA筛选
前期实验中,将pGCsi-TRAF6-shRNA质粒分别转染入培养的RAW264.7细胞中,采用Real-time PCR及Western blot法检测TRAF6基因及蛋白的表达情况,筛选出质粒pTRAF6-shRNA1具有最佳的沉默效率[6],且MTT检测显示,TRAF6基因沉默后,其细胞体外增殖活性无明显差异,故将质粒pTRAF6-shRNA1用于以下实验中。
1.3实验分组及处理
SPF级6~8周龄雄性BALB/c小鼠[动物质量合格证号:SCXK(鄂)2004-0007],体质量(20±2)g,购自华中科技大学同济医学院实验动物中心。按照随机对照原则分组,各组处理如表1所示。本实验采用流体力学注射法进行肝靶向性基因转染,即将相当于小鼠体重9%体积的液体(含质粒)于5~7 s内经鼠尾静脉均匀快速注入[7-8]。首先,将pTRAF6-shRNA1或空白质粒100 μg经脂质体包埋[质粒(g)/脂质体(L)按1∶2比例混合]后,溶于林格氏液(Ringer’s Solution)制成混合液。其中,正常对照组、模型对照组仅给予林格氏液尾静脉注射,RNAi/LPS组、空白质粒/LPS组给予含有质粒的混合液尾静脉注射,24 h后重复注射1次。第3天,除正常对照组外,各组小鼠均予LPS(20 μg/kg)联合D-GalN(600 mg/kg)腹腔注射。
另设RNAi组、空白质粒组(每组8只小鼠),仅予pTRAF6-shRNA1或空白质粒尾静脉注射,不予LPS/D-GalN注射,用于检测质粒注射后TRAF6基因沉默效果。
分别于LPS/D-GalN注射后4、8 h,用毛细玻管由眼眶后静脉丛采血,离心后取上清冻存。LPS/D-GalN注射16 h后,将小鼠用乙醚麻醉,开腹后腹主动脉取血,离心后冻存;并取最大肝叶100~200 mg肝组织,快速冻存于液氮中备用。取同一肝叶5 mm×6 mm肝组织予4%多聚甲醛中固定,石蜡包埋。切片用于行苏木精-伊红(hematoxylin-eosin,HE)染色。

表1 动物分组及处理方法
1.4肝组织切片HE染色
肝组织固定、包埋后,制成4 μm厚的石蜡切片。HE染色后,常规脱水,透明,封片。镜下观察肝组织病理改变。
1.5细胞因子TNF-α、IL-1β、TGF-β1检测
酶联免疫吸附(ELISA)法测定血清TNF-α、IL-1β及TGF-β1水平。按照试剂盒说明书步骤操作,应用全自动酶标定量测定仪进行检测。
1.6荧光定量PCR检测TRAF6、IL-6、COX-2 mRNA表达
提取总RNA后,按照逆转录试剂盒说明书合成cDNA。PCR引物由应用软件Prima5.0设计(表2),由上海生工公司合成。选用ABI 7700HT实时定量PCR仪。荧光定量PCR反应体系为25 μL,内含500 ng cDNA模板,终浓度为250 nmol/L的上下游引物及SYBR Green Realtime PCR Master Mix 12.5 μL。反应条件为94 ℃ 60 s;94 ℃ 15 s;退火15 s;70 ℃ 45 s,荧光收集,40个循环。以相对Ct值(即2-ΔΔCt)表示目的基因的相对表达量[9-10],每个样本重复3次。

表2 荧光定量PCR引物序列
1.7Western blot检测TRAF6、NF-κB p65蛋白表达
分别取肝组织50 mg,按试剂盒说明提取肝组织总蛋白和核蛋白,-70℃保存,考马斯亮蓝法检测样品蛋白浓度。取20 μg蛋白,上样于10%SDS-聚丙烯酰胺凝胶,电泳后转膜,5%脱脂奶粉封闭液室温孵育45 min,分别加入抗TRAF6多抗(1:200)、NF-κB p65抗体(1:500)和β-actin蛋白抗体,4℃过夜,辣根过氧化物酶二抗(1:3 000)室温孵育1 h,显色后以β-actin为内参照,用AlphaEaseFC 4.0图像分析软件进行吸光度分析。
1.8统计学方法
2结果
2.1TRAF6 mRNA及TRAF6蛋白表达检测
荧光定量PCR检测显示(图1),pTRAF6-shRNA1第2次质粒转染后16 h时,RNAi组小鼠肝组织TRAF6 mRNA表达比正常小鼠明显降低,TRAF6 mRNA表达受到抑制,约下降了60.13%,差异有统计学意义(P<0.01)。空白质粒对TRAF6 mRNA表达无明显影响,空白质粒组与正常小鼠比较差异无统计学意义(P>0.05)。LPS/D-GalN腹腔注射后16 h,模型对照组、空白质粒/LPS组肝组织TRAF6 mRNA表达较正常组明显增高(P<0.01),模型对照组与空白质粒/LPS组相比差异无统计学意义(P>0.05);造模后,RNAi/LPS组小鼠肝组织TRAF6 mRNA表达较模型对照组明显降低(P<0.01)。

A:正常对照组;B:模型对照组;C:RNAi/LPS组;D:空白质粒/LPS组;E:RNAi组;F:空白质粒组;与正常对照组比较,**P<0.01;与模型对照组比较,▲▲P<0.01图1 荧光定量PCR检测TRAF6 mRNA表达变化Fig.1 Fluorescent quantitative PCR assay for detection of relative mRNA expression of TRAF6
Western blot检测(图2)显示,质粒转染后小鼠(RNAi组)的肝组织TRAF6/β-actin 积分吸光度比值为(0.49±0.21),比正常对照组小鼠(1.02±0.16)降低了约52.08%,差异有统计学意义(均P<0.01);空白质粒对TRAF6蛋白表达无明显影响[空白质粒组为(1.01±0.09)],与正常小鼠比较差异无统计学意义(P>0.05)。予小鼠LPS/D-GalN腹腔注射16 h后,模型对照组(1.73±0.08)、空白质粒/LPS组(1.70±0.05)小鼠肝组织TRAF6蛋白表达较正常小鼠明显增高(P<0.01),模型对照组与空白质粒/LPS组相比无明显差异(P>0.05);RNAi干预小鼠(RNAi/LPS组)肝组织TRAF6蛋白表达(1.36±0.03)较模型对照组降低(P<0.05)。
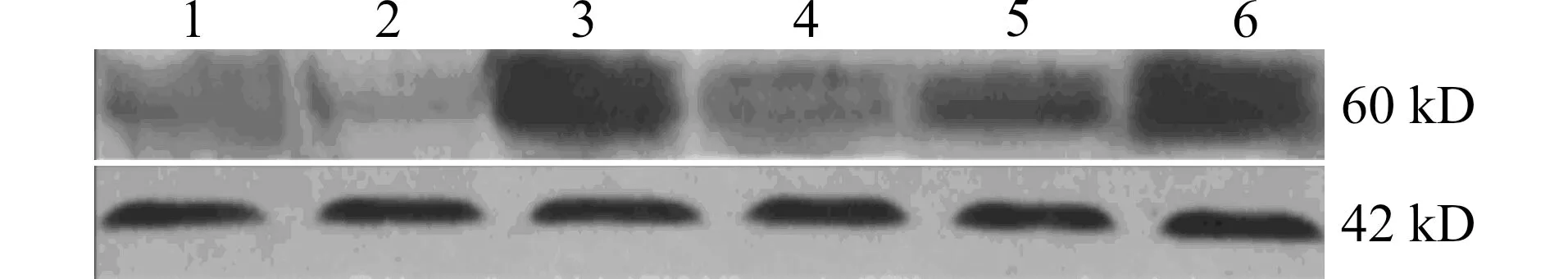
1:正常对照组;2:RNAi组;3:模型对照组;4:空白质粒组;5:RNAi/LPS组;6:空白质粒/LPS组图2 各组小鼠TRAF6蛋白表达变化Fig.2 Changes of TRAF6 protein expression in mice in each group
2.2各组小鼠肝脏变化
HE染色(图3)可见,正常对照组小鼠肝小叶结构完整,肝板排列整齐,肝细胞以中央静脉为中心呈放射状排列。模型对照组和空白质粒/LPS组小鼠肝小叶结构破坏,肝细胞出现弥漫性出血性坏死。RNAi/LPS组小鼠肝小叶结构不同程度破坏,肝细胞内可见点片状坏死,与模型对照组相比,肝细胞坏死程度明显减轻。
2.3小鼠血清细胞因子表达变化
ELISA结果(表3)显示,造模后,模型对照组小鼠血清TNF-α、IL-1β表达水平均于8 h达到高峰,而TGF-β1水平持续升高。模型对照组、空白质粒/LPS组小鼠血清TNF-α、IL-1β及TGF-β1均明显升高,两组比较差异无统计学意义(均P>0.05)。RNAi/LPS组小鼠血清TNF-α、IL-1β及TGF-β1浓度均显著低于同时间点模型对照组,差异均有统计学意义(均P<0.01)。
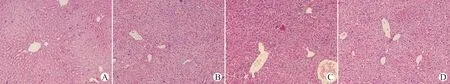
A:正常对照组;B:模型对照组;C:RNAi/LPS组;D:空白质粒/LPS组图3 小鼠肝组织病理变化(HE染色,×200)Fig.3 Pathological changes of mouse liver tissues(HE staining,× 200)
2.4小鼠肝组织IL-6、COX-2 mRNA的表达变化
如表4所示,LPS/D-GalN腹腔注射后16 h,模型对照组、空白质粒/LPS组肝组织IL-6、COX-2 mRNA表达均较正常对照组明显增高(均P<0.01),模型对照组与空白质粒/LPS组相比差异均无统计学意义(均P>0.05);RNAi/LPS组小鼠肝组织IL-6 mRNA表达较模型对照组明显降低(P<0.01),与正常对照组比较差异无统计学意义(P>0.05)。RNAi/LPS组COX-2 mRNA表达较模型对照组也有所降低(P<0.05),但较正常对照组仍有升高,且差异具有统计学意义(P<0.05)。
2.5Western blot检测NF-κB p65表达
造模后16 h,提取各组小鼠肝组织总蛋白和核蛋白,并定量。Western blot结果(图4、表5)显示,正常对照组总蛋白和核蛋白内NF-κB p65表达水平较低;模型对照组总蛋白和核蛋白NF-κB p65表达水平明显增高,且胞核与总蛋白中NF-κB p65比值增加,提示急性肝衰竭小鼠NF-κB活性表达增加。空白质粒/LPS组小鼠NF-κB p65表达变化与模型对照组相似,两组比较差异无统计学(P>0.05)。RNAi/LPS组小鼠肝组织总蛋白NF-κB p65表达水平高于正常对照组小鼠(P<0.05),与模型对照组比较两组间差异无统计学意义(P>0.05);但其细胞核NF-κB p65蛋白明显低于模型对照组,差异有统计学意义(P<0.05)。
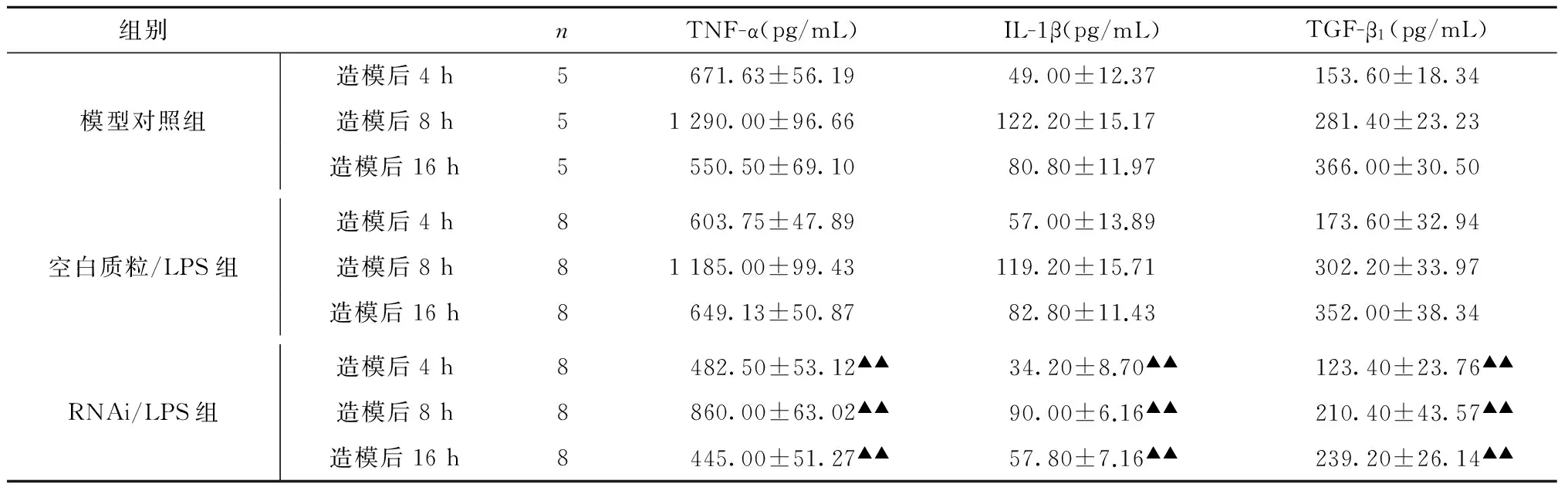
组别nTNF-α(pg/mL)IL-1β(pg/mL)TGF-β1(pg/mL)模型对照组造模后4h5671.63±56.1949.00±12.37153.60±18.34造模后8h51290.00±96.66122.20±15.17281.40±23.23造模后16h5550.50±69.1080.80±11.97366.00±30.50空白质粒/LPS组造模后4h8603.75±47.8957.00±13.89173.60±32.94造模后8h81185.00±99.43119.20±15.71302.20±33.97造模后16h8649.13±50.8782.80±11.43352.00±38.34RNAi/LPS组造模后4h8 482.50±53.12▲▲ 34.20±8.70▲▲ 123.40±23.76▲▲造模后8h8860.00±63.02▲▲90.00±6.16▲▲210.40±43.57▲▲造模后16h8445.00±51.27▲▲57.80±7.16▲▲239.20±26.14▲▲
与模型对照组比较,▲▲P<0.01
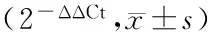
表4 鼠肝组织TRAF6、IL-6、COX-2 mRNA表达
与正常对照组比较,*P<0.05**P<0.01;与模型对照组比较,▲P<0.05▲▲P<0.01
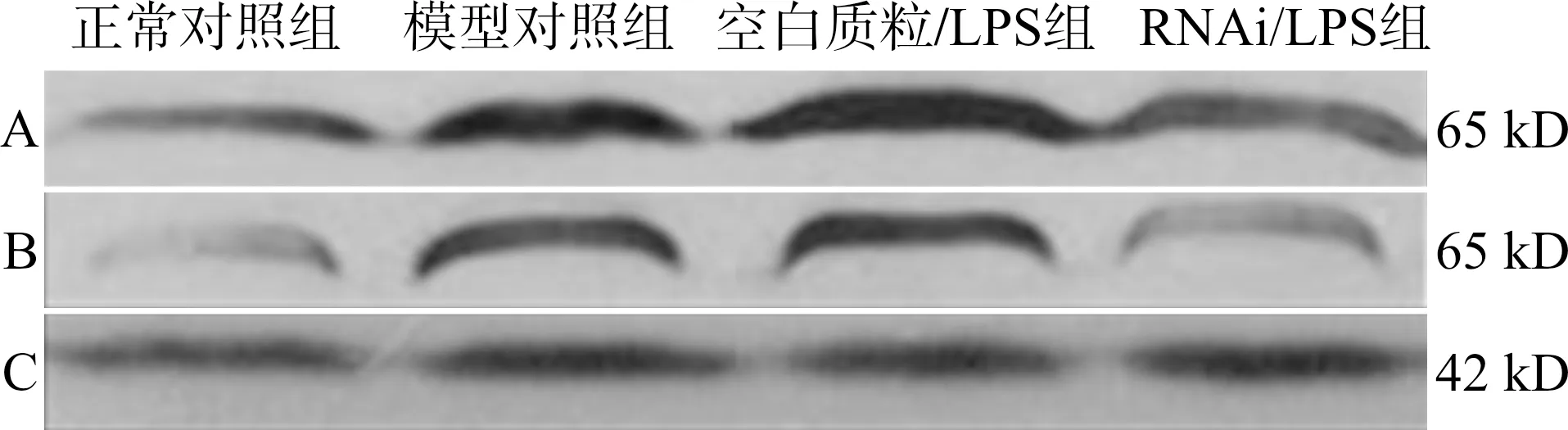
A:总蛋白NF-κB p65;B:核蛋白NF-κB p65;C:β-actin图4 各组小鼠NF-κB p65蛋白表达变化Fig.4 Changes of NF-κB p65 protein expression in mice in each group
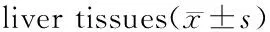

组别n总蛋白NF-κBp65/β-actin核蛋白NF-κB/β-actin正常对照组50.82±0.040.37±0.05模型对照组81.33±0.03**1.05±0.03**RNAi/LPS组81.15±0.03*0.73±0.04*▲空白质粒/LPS组81.44±0.05**1.12±0.04**
与正常对照组比较,*P<0.05**P<0.01;与模型对照组比较,▲P<0.05
3讨论
急性肝衰竭时常导致血浆内毒素水平升高,出现肠源性内毒素血症,即所谓“二次打击”。D-GalN与LPS联合应用引起肝损伤同时伴有肠源性内毒素血症的形成,但不损伤其他主要脏器,出现的肝损害表现与临床肝衰竭较相近,而且是可重复的,是一种较为理想的肝衰竭动物模型。采用D-GalN与LPS联合给药建立模型是目前学术界十分常用的方法[11-12]。因此本实验选择D-GalN与LPS联合用药制造急性肝衰竭动物模型。
流体力学注射法(hydrodynamics-based procedure)是一种快速大容量的裸质粒溶液的体内注射方法。借助该方法,目的或治疗基因可经鼠尾静脉转染动物活体器官,并在靶器官内高效表达[7]。该法具有一定的“肝靶向性”,因此特别适用于肝脏疾病相关研究。前期实验已证实,应用流体力学注射脂质体/质粒DNA复合物,目的基因可在小鼠肝脏高效表达,对肝组织病理无明显影响[8]。而且我们还发现,脂质体包裹质粒可明显提高裸质粒的转染率,但由于脂质体价格较高,动物实验需要量大的原因,在本实验中,我们应用100 μg裸质粒重复2次尾静脉注射入小鼠体内,以提高质粒转染率。本实验中,第2次pTRAF6-shRNA1转染后16 h,小鼠肝组织TRAF6 mRNA表达受到抑制,Western blot检测结果也显示,质粒转染后小鼠的肝组织TRAF6蛋白表达也明显受到抑制。
急性肝衰竭内毒素炎症反应中的关键因素是炎症因子的即时产生,特别是TNF-α。TNF-α是一种多效应的生物活性分子,在肝衰竭的发病机制中发挥重要作用。TNF-α既可以直接引起细胞损伤,也能通过激活NF-κB刺激其它促炎症介质(如IL-1β、IL-6和NO)释放扩大炎症级联反应,是内毒素血症介导组织器官损害的主要介质之一[13-14]。以往研究显示,TNF-α基因敲除小鼠或抗TNF-α抗体可完全对抗LPS产生的毒性[15]。虽然,上调这些细胞因子是机体防御细菌感染的主要机制,但其过度表达可以造成机体免疫紊乱和炎症损伤。本实验结果显示,造模后,模型对照组小鼠血清TNF-α和IL-1β浓度明显升高,于8 h达高峰,TRAF6基因沉默后小鼠TNF-α和IL-1β浓度均显著降低,8 h时,RNAi/LPS组TNF-α和IL-1β表达水平分别是模型对照组小鼠的67%和71%。Real-time PCR检测结果显示,模型对照组小鼠肝组织IL-6 mRNA表达较正常组明显增高(P<0.01),RNAi/LPS组IL-6 mRNA表达较模型对照组明显降低(P<0.01),可见TRAF6基因沉默对TNF-α、IL-1β和IL-6有抑制作用。
转化生长因子β1(TGF-β1)是一种重要的免疫调节性细胞因子,能抑制巨噬细胞激活,近年来,因其在组织发生、发育及损伤后修复、免疫抑制的重要作用,已成为当今研究的热点[16-17]。Dambach等[18]研究发现,NF-κB(P50)的活性丧失与TNF-α、IL-10表达下降和IL-4、TGF-β1表达增多有关,表明NF-κB能通过炎症因子和抗炎因子表达增多或减少调控肝脏炎症损伤。因此,为了证实阻断TRAF6具有对致炎和抗炎细胞因子的双重调节作用,本实验选择同时检测TGF-β1水平。研究发现,模型对照组小鼠血清TGF-β1表达水平持续增高,RNAi/LPS组小鼠血清TGF-β1浓度显著低于同时间点模型组(P<0.01)。16 h时RNAi/LPS组TGF-β1表达水平是模型组的64%。结果表明,动物体内TRAF6基因沉默不仅能抑制促炎症细胞因子(TNF-α、IL-1β、IL-6)增长,也能抑制抗炎症细胞因子(TGF-β1)的分泌。
环加氧酶-2(COX-2)又称前列腺素过氧化物合成酶(prosta glandin hyperoxide synthase,PGHS),是一种诱导型表达蛋白,被认为是“快速反应基因”,在生理状态下存在于细胞内,多数组织内检测不到,在细胞受到炎症刺激物质如细菌脂多糖或细胞因子如IL-1等刺激后则大量产生,因此,COX-2是病理状态下过度炎症反应的诱导酶类,与炎症程度相关,在炎症发展中具有重要作用[19]。本实验研究结果显示,模型组小鼠肝组织COX-2 mRNA表达较正常组明显增高,RNAi/LPS组COX-2 mRNA表达较模型组明显降低(P<0.05),表明TRAF6基因沉默可明显抑制急性肝衰竭小鼠肝组织COX-2 mRNA表达。
NF-κB是二聚体形式的核转录因子,在细胞质中NF-κB与其抑制蛋白IκB-α结合,呈无活性状态,TNF-α等刺激后,经过细胞内复杂的信号转导途径,激活IKK-α、IKK-β,引起NF-κB向核内移位,激活相应的靶基因,诱导多种细胞因子(如IL-1、IL-6、IL-12、TNF-α)、粘附分子、趋化因子(如IL-8、补体C3)、免疫识别受体和急性期反应蛋白的基因表达,正反馈放大炎症反应[20-24]。本实验结果证实,pTRAF6-shRNA1可有效地控制急性肝衰竭模型炎症反应,减轻肝组织总蛋白和核蛋白内NF-κB p65表达,并能明显抑制NF-κB核转位,说明pTRAF6-shRNA1可能通过下调NF-κB p65水平,抑制NF-κB p65核转位,抑制炎症相关细胞因子和炎性介质表达水平,从而减轻内毒素/半乳糖诱导的小鼠急性肝损伤,同时提示在急性肝衰竭内毒素炎症中应用RNA干扰技术体内转染干预治疗是可行的。
我们的实验由于时间和经费的限制,仅从内毒素炎症的控制角度观察了RNAi干扰后TRAF6下游炎症因子及NF-κB的表达,并未能观察TRAF6基因沉默后,有关急性肝衰竭小鼠肝组织超微结构、细胞凋亡及其对肝细胞再生的影响,这将是我们今后进一步研究的方向。
参考文献
[1]Ou T T,Kuo C Y,Chyau C C,et al.Improvement of lipopolysaccharide-induced hepatic injuries and inflammation with mulberry extracts[J].J Sci Food Agric,2013,93(8):1880-1886.[2]Badmann A,Keough A,Kaufmann T,et al.Role of TRAIL and the pro-apoptotic Bcl-2 homolog Bim in acetaminophen-induced liver damage[J].Cell Death Dis,2011,9(2):171-175.
[3]Arcipowski K M,Stunz L L,Bishop G A.TRAF6 is a critical regulator of LMP1 functionsinvivo[J].Int Immunol,2014,26(3):149-158.
[4]Wu H,Arron J R.TRAF6,a molecular bridge spanning adaptive immunity,innate immunity and osteoimmunology[J].Bioessays,2003,25(11):1096-1105.
[5]陈锋,何生松,邱荣元,等.小鼠TRAF6基因shRNA真核表达载体的构建与表达[J].世界华人消化杂志,2009,14(20):1406-1411.
[6]Chen F,He S S,Qiu R Y,et al.Influence of silencing TRAF6 with shRNA on LPS/TLR4 signallinginvitro[J].J Huazhong Univ Sci Technol[Med Sci],2010,30(3):278-284.
[7]Sung C M,Yeh C T,Shiau S S.Hydrodynamics-based transfection of the combination of betacellulin and neurogenic differentiation 1 DNA ameliorates hyperglycemia in mice with streptozotocin-induced diabetes[J].Diabetes Technol Ther,2011,13(5):519-525.
[8]陈锋,何生松,吴梅梅,等.不同转染方式对GFP表达质粒在小鼠肝脏的表达影响[J].山东大学学报:医学版,2010,48(1):17-20.
[9]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[10]Aglawe S B,Fakrudin B,Patole C B,et al.Quantitative RT-PCR analysis of 20 transcription factor genes of MADS,ARF,HAP2,MBF and HB families in moisture stressed shoot and root tissues of sorghum[J].Physiol Mol Biol Plants,2012,18(4):287-300.
[11]赵世峰.急性肝衰竭动物模型的建立[J].世界急危重病医学杂志,2006,3(2):1224-1225.
[12]Darnaud M,Garbin K,Dos Santos A,et al.The Reg3α(HIP/PAP)lectin suppresses extracellular qxidative stress in a murine model of acute liver failure[J].PLoS One,2015,10(5):e0125584.
[13]Olmos G,Lladó J.Tumor necrosis factor alpha:a link between neuroinflammation and excitotoxicity[J].Mediators Inflamm,2014,2014:861231-861243.
[14]Blasco-Algora S,Masegosa-Ataz J,Gutiérrez-García M L,et al.Acute-on-chronic liver failure:Pathogenesis,prognostic factors and management[J].World J Gastroenterol,2015,21(42):12125-12140.
[15]Beutler B,Du X,Poltorak A.Identification of Toll-like receptor 4(TLR4)as the sole conduit for LPS signal transduction:genetic and evolutionary studies[J].J Endotoxin Res,2011,7(4):277-280.
[16]Sanjabi S,Zenewicz L A,Kamanaka M,et al.Anti-inflammatory and pro-inflammatory roles of TGF-beta,IL-10,and IL-22 in immunity and autoimmunity[J].Curr Opin Pharmacol,2009,9(4):447-453.
[17]Mia S,Warnecke A,Zhang X M,et al.An optimized protocol for human M2 macrophages using M-CSF and IL-4/IL-10/TGF-β yields a dominant immunosuppressive phenotype[J].Scand J Immunol,2014,79(5):305-314.
[18]Dambach D M,Andrews B A,Moulin F.New technologies and screening strategies for hepatotoxicity:use ofinvitromodels[J].Toxicol Pathol,2005,33(1):17-26.
[19]Greenhough A,Smartt H J,Moore A E,et al.The COX-2/PGE2 pathway:key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J].Carcinogenesis,2009,30(3):377-386.
[20]Kauppinen A,Suuronen T,Ojala J,et al.Antagonistic crosstalk between NF-κB and SIRT1 in the regulation of inflammation and metabolic disorders[J].Cell Signal,2013,25(10):1939-1948.
[21]Sun S C.The noncanonical NF-κB pathway[J].Immunol Rev,2012,246(1):125-140.
[22]陈丽,陈瑞,梁凤霞,等.NF-κB信号通路与胰岛素抵抗[J].华中科技大学学报: 医学版,2015,44(5):608-611.
[23]张柯晴,吕坤聚,朱君祥.FAK、NF-κB及VEGF在非小细胞肺癌中的表达及临床意义[J].中国组织化学与细胞化学杂志,2014,23(6):529-533.
[24]刘桂云,滕学芹,于辉.HMGB1、NF-κBp65、MMP2在子宫内膜腺癌组织中的表达及相关性研究[J].中国组织化学与细胞化学杂志,2014,23(6):538-542.
(2015-12-03收稿)
Effect of Silencing TRAF6 Gene Expression with shRNA on Inflammatory Response in Mice with Acute Liver Injury
Chen Feng1,Zhang Furong1△,He Shengsong2etal
1IntensiveCareUnit,WuhanMedicalandHealthcareCenterforWomenandChildren,Wuhan430016,China2DepartmentofInfectiousDiseases,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
AbstractObjectiveTo examine the effect of silencing tumor necrosis factor(TNF)receptor-associated factor-6(TRAF6)on the inflammatory responses in mice with lipopolysaccharide(LPS)/D-galactosamine(GalN)-induced acute liver failure(ALF).MethodsThe small interfering RNA(siRNA)sequence that could most effectively target TRAF6 was screened out in vitro. The plasmid pTRAF6-shRNA was delivered into BALB/c mice by hydrodynamics-based gene transfection(HGT)twice at an interval of 24 h.Twenty-four h after the second HGT,LPS/D-GalN was intraperitoneally administrated to BALB/c mice to establish the endotoxin-induced inflammatory model of acute liver failure.Animals were divided into four groups:normal control group,model control group,blank plasmid/LPS group and RNAi/LPS group.Blood samples were collected at 4,8 and 16 h after LPS/D-GalN injection.HE staining was used to observe the pathological changes of liver tissues.Meanwhile,TRAF6,interleukin-6(IL-6)and cyclooxygenease(COX)-2 mRNA levels were detected by real-time PCR.Inflammatory cytokines[TNF-α,IL-1β,transforming growth factor(TGF)-β1 and IL-6]were measured by ELISA.Western blot analysis was used to detect TRAF6 and NF-κB p65 expression in the nuclear extracts of hepatocytes.ResultsOur results showed that TRAF6 mRNA and protein expressions were remarkably reduced by 60.13% and 52.08%,respectively,in the mouse liver(P<0.01).ELISA indicated that the secretions of TNF-α,IL-1β and TGF-β1 were markedly increased after LPS/D-GalN injection,with TNF-α,IL-1β peaking at 8 h,and TGF-β1 at 16 h.Furthermore,the levels of TNF-α,IL-1β and TGF-β1 were lower in RNAi/LPS group than in model control group at different detection time points.Real-time PCR showed that IL-6,COX-2 and TRAF6 mRNA levels were obviously lower in RNAi/LPS group than in model control group(P<0.01).Moreover,total NF-κB p65 protein levels were effectively increased in RNAi/LPS group as compared with normal control group(P<0.05).However,NF-κB p65 levels in the nuclear extracts in RNAi/LPS group were significantly lower those in model control group(P<0.05).ConclusionApplication of pTRAF6-shRNA can successfully alleviate LPS/D-GalN-induced acute liver injury in vivo by inhibiting NF-κB activities and decreasing the expression of inflammatory cytokines and inflammatory mediators.
Key wordsTRAF6;RNA interference(RNAi);TLR4 signaling;NF-κB;acute liver failure
中图分类号:R657.3
DOI:10.3870/j.issn.1672-0741.2016.03.008
陈锋,女,1978年生,医学博士,E-mail:jmnba@163.com
△通讯作者,Corresponding author,E-mail:792523496@qq.com
