CTLA-4对儿童急性淋巴细胞性白血病细胞增殖和凋亡的影响*
2016-07-05张冰玉王岑岑金润铭
张冰玉, 郑 芳, 王岑岑, 金润铭
华中科技大学同济医学院附属协和医院儿科,武汉 430022
论著
CTLA-4对儿童急性淋巴细胞性白血病细胞增殖和凋亡的影响*
张冰玉,郑芳,王岑岑,金润铭△
华中科技大学同济医学院附属协和医院儿科,武汉430022
摘要:目的探讨细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte antigen-4,CTLA-4)在儿童急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)细胞中的表达情况,并进一步研究CTLA-4对ALL细胞增殖、凋亡等方面的影响。方法以儿童ALL Nalm-6、Jurkat细胞为模型,探讨CTLA-4在ALL细胞的表达情况。并将Nalm-6、Jurkat细胞与CTLA-4抑制剂共培养,收集细胞,提取蛋白质及mRNA,行CCK-8、Western blot分析、实时定量PCR分析,研究CTLA-4对ALL细胞增殖、凋亡的影响。结果Western blot检测发现ALL细胞表达CTLA-4。经CTLA-4抑制剂处理后,Jurkat细胞的凋亡蛋白Bax、Caspase-3表达量明显增加,Nalm-6细胞凋亡蛋白Caspase-3表达量明显增加;2种细胞抗凋亡蛋白Bcl-2表达量均明显下降;2种细胞ALDH1A1、ALDH1A3、ALDH2 mRNA表达量均明显下降。结论儿童ALL细胞表达CTLA-4分子,CTLA-4抑制剂可以抑制儿童ALL细胞增殖,诱导细胞凋亡,抑制ALDH+的干细胞样肿瘤细胞的生长。抑制CTLA-4有望成为ALL治疗的新方向。
关键词:急性淋巴细胞性白血病;CTLA-4;细胞增殖;细胞凋亡;免疫治疗
白血病(leukemia)是一类具有潜在致命性的造血系统恶性增殖性疾病,是儿科最常见的肿瘤性疾病,约占小儿肿瘤的30%[1],其中急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)约占70%~85%[2],ALL对儿童健康及生命造成了极大的危害,同时造成了家庭和社会的巨大经济负担。虽然近年来随着化疗强度的增加、化疗方案的完善、支持治疗的增多,儿童ALL的缓解率较前明显增加,但是仍有部分患儿不能缓解。细胞毒性T淋巴细胞抗原-4(cytotoxic T lymphocyte antigen-4,CTLA-4)是一种抑制性免疫调节因子[3],其在肿瘤细胞上的存在可能与肿瘤免疫逃避有关。本课题旨在探讨CTLA-4在儿童ALL细胞的表达情况,并进一步研究CTLA-4对ALL细胞增殖、凋亡等方面的影响。
1材料与方法
1.1主要材料
细胞系:本实验使用儿童急性B淋巴细胞性白血病细胞系Nalm-6细胞系和儿童急性T淋巴细胞性白血病细胞系Jurkat细胞系,2种细胞系均为本实验室的冻存细胞。
CTLA-4抑制剂:本实验使用eBioscience公司生产的抗小鼠CTLA-4功能性纯化单克隆抗体(16-1521-85)作为CTLA-4抑制剂。
主要试剂:美国Stem Cell公司生产的ALDEFLOUR流式试剂盒(01700),美国Abcam公司生产的CTLA-4(ab134090)Western blot抗体,美国CST公司生产的β-catenin(8480)、Bax(2772)、Bcl-2(2870)、Caspase-3(9662)Western blot抗体,日本TaKaRa公司生产的PrimeScriptRTMaster Mix逆转录试剂盒(RR036A)和SYBR Premix Ex Tag实时定量PCR试剂盒(RR420A)。
1.2流式细胞分析
利用ALDEFLOUR试剂盒标记细胞内乙醛脱氢酶(aldehyde dehydrogenase,ALDH),经流式细胞仪鉴定ALDH抗原。收集对数生长期的Nalm-6和Jurkat细胞,计数板计数,设3组,每组1×106个细胞。空白组不加任何试剂,对照组加入5 μL ALDH抑制剂DEAB和5 μL ALDEFLOUR试剂,样品组加入5 μL ALDEFLOUR试剂,充分混合均匀。将对照组和样品组放入37℃恒温水浴箱中孵育45 min后,1 000 r/min,5 min,离心,弃上清。以0.5 mL ALDEFLOUR分析缓冲液重悬细胞。上机行流式细胞分析。
1.3增殖抑制实验
收集对数生长期ALL细胞,调整细胞密度至3×104/mL,将细胞悬液接种于96孔细胞板,每孔0.1 mL,添加CTLA-4抑制剂,CTLA-4抑制剂浓度依次为0、0.1、1、10、100、1 000、10 000 ng/mL。培养板置入37℃,95%湿度和5% CO2的培养箱中培养24 h,每孔加入0.01 mL CCK-8试剂,于培养箱中培养180 min,放入酶标仪中检测450 nm下吸光度(A)值,根据公式计算抑制率,抑制率(%)=(A对照孔-A测试孔)/(A对照孔-A空白孔)×100%。
1.4药物处理
收集处于对数生长期的ALL细胞,调整细胞密度至5×105/mL,将细胞悬液接种于6孔细胞培养板,每孔2 mL,部分培养孔添加CTLA-4抑制剂10 mg/mL,另设不添加CTLA-4抑制剂组为对照,37℃,95%湿度和5%CO2培养箱中培养24 h。收集培养板中的细胞,提取蛋白、mRNA,分别用于Western blot和Real-time PCR分析。
1.5Western blot分析
提取正常及药物处理后的Nalm-6细胞和Jurkat细胞的蛋白,行Western blot分析。配制SDS-PAGE胶,60 V预电泳30 min。在各加样孔中加入30 μg相应体积的蛋白质样品,电泳,转膜,室温振荡封闭1 h。将PVDF膜直接放入一抗稀释液中,4℃振荡孵育过夜。用TBST洗膜后将PVDF膜放入二抗稀释液中,室温振荡孵育1 h。再次用TBST洗膜,曝光。经Western blot分析鉴定CTLA-4抗原并分析凋亡蛋白Bax、Caspase-3、抗凋亡蛋白Bcl-2及β连环蛋白(β-catenin)的表达情况。
1.6实时定量PCR分析
细胞经药物处理后提取mRNA,行实时定量PCR分析。利用逆转录试剂盒将提取的mRNA逆转录为cDNA。加入1 μL的cDNA、3.4 μL的无RNAase水、各0.2 μL的正义链和反义链引物、0.2 μL的50× Rox Reference Dye及5 μL的2× SYBR Premix Ex Tag配制成总体积10 μL的反应体系。将反应体系10 μL加入96孔PCR板中,每个样本设置3个重复孔。将96孔PCR板放入ABI 7900序列检测系统中,以95℃ 30 s,95℃ 5 s,60℃ 34 s共40个循环的程序进行PCR反应。利用StepOne 2.3软件获得Ct值,根据公式:待测样本相对值=2-(ΔCt内参-ΔCT样本),计算目的基因表达量。通过实时定量PCR检测,分析ALDH1A1、ALDH1A3、ALDH2基因表达情况。
1.7统计学方法

2结果
2.1抗原表达
经流式细胞术检测,在Nalm-6细胞系中大约有30%的细胞表达ALDH抗原,在Jurkat细胞系中大约有20%的细胞表达ALDH抗原(图1)。经Western blot检测,在Nalm-6细胞和Jurkat细胞中均有CTLA-4表达(图2)。

图1 ALDH的表达Fig.1 Expression of ALDH on ALL cells

图2 CTLA-4的表达Fig.2 Expression of CTLA-4 on ALL cells
2.2CTLA-4对ALL增殖的影响
细胞经药物处理后,加入CCK-8试剂,孵育180 min,测量A值,计算不同药物浓度的抑制率,绘制抑制率曲线(图3)。在0.1、1、10、100、1 000、10 000 ng/mL的CTLA-4抑制剂浓度作用下,Nalm-6细胞抑制率分别为(9.351±1.678)%、(15.900±2.138)%、(18.740±2.068)%、(26.370±2.251)%、(32.288±1.065)%、(38.222±1.460)%,Jurkat细胞抑制率分别是(6.326±1.464)%、(9.718±2.257)%、(11.668±2.199)%、(14.254±0.685)%、(17.197±1.587)%、(20.329±1.172)%。CTLA-4抑制剂可显著影响ALL细胞的增殖。提取CTLA-4抑制剂处理过的Nalm-6和Jurkat细胞中的蛋白质,行Western blot分析发现(图4)CTLA-4抑制剂处理ALL细胞后,细胞中β-catenin的表达量明显降低,差异具有统计学意义,提示其可能通过抑制Wnt/β-catenin信号通路发挥抑制增殖的作用。

图3 CTLA-4抑制剂对ALL细胞增殖的影响Fig.3 Effect of the CTLA-4 inhibitor on the proliferation of ALL cells
2.3CTLA-4对ALL凋亡的影响
Nalm-6和Jurkat细胞与CTLA-4抑制剂共培养24 h后,收集细胞提取蛋白质,进行Western blot分析。添加CTLA-4抑制剂后Jurkat细胞凋亡蛋白Bax和Caspase-3水平显著提高,Nalm-6细胞凋亡蛋白Caspase-3水平显著提高,而2种细胞内的抗凋亡蛋白Bcl-2水平均显著降低(图5)。

与对照组比较,**P<0.01图4 CTLA-4抑制剂对ALL细胞β-catenin表达的影响Fig.4 Effect of the CTLA-4 inhibitor on the β-catenin expression in ALL cells
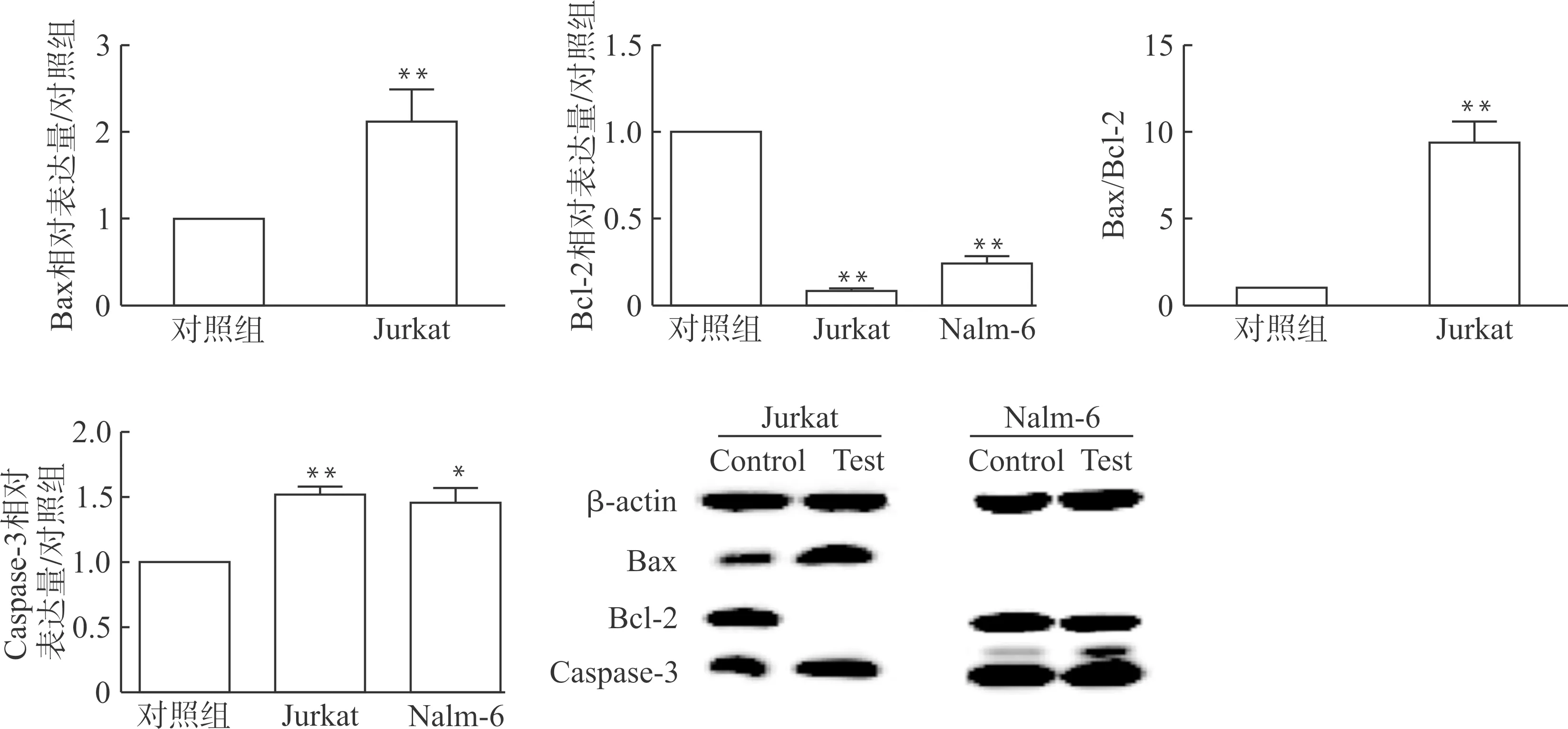
与对照组比较,*P<0.05 **P<0.01图5 CTLA-4抑制剂诱导ALL细胞的凋亡Fig.5 ALL cells apoptosis induced by the CTLA inhibitor
2.4CTLA-4对ALL中ALDH基因表达的影响
细胞经CTLA-4抑制剂处理后,提取mRNA,逆转录获得cDNA后进行实时定量PCR检测,发现细胞内ALDH基因的表达明显降低(图6)。
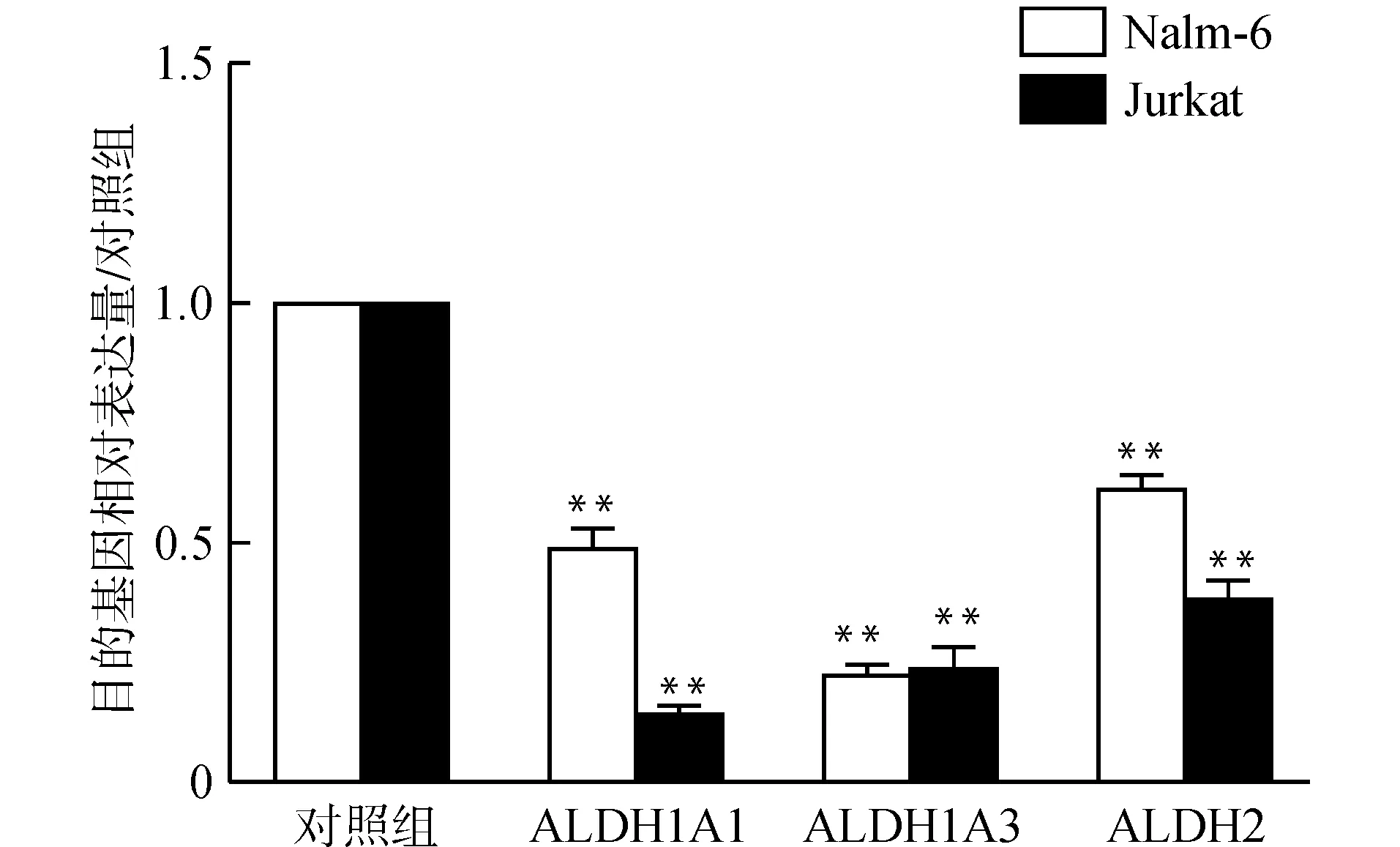
与对照组比较,**P<0.01图6 CTLA-4对ALDH表达的影响Fig.6 Effect of CTLA-4 on the ALDH expression in ALL cells
3讨论
本研究显示:ALL细胞表达CTLA-4;CTLA-4抑制剂能够抑制ALL细胞增殖,诱导ALL细胞凋亡,下调ALDH1A1、ALDH1A3、ALDH2基因表达。结果表明:CTLA-4抑制剂可影响ALL细胞的增殖和凋亡,并能够从干细胞层面上抑制ALL细胞的生长。
ALDH是细胞质中的一组催化乙醛向乙酸转化的同工酶,在早期干细胞分化中促进视黄醇氧化为视黄酸。目前已经在人多发性骨髓瘤、急性骨髓性白血病、脑癌和乳腺癌等多种恶性肿瘤的干细胞中发现ALDH1活性增加[4]。CTLA-4分子表达于活化的CD4+和CD8+T细胞表面,通过阻断正性共刺激信号途径CD28/B7而抑制T细胞增殖、活化及免疫应答[3]。阻断CTLA-4分子能够促进肿瘤中效应T细胞的浸润、炎性细胞因子的分泌及抑制Treg细胞的活性,从而增强抗肿瘤效应[5-6]。我们的结果表明,ALL细胞表达ALDH和CTLA-4,CTLA-4抑制剂可以抑制Jurkat细胞和Nalm-6细胞的增殖。异常的Wnt/β-catenin信号与多种恶性肿瘤的发生有关,CTLA-4抑制剂可下调Jurkat细胞和Nalm-6细胞的β-catenin表达水平,这表明CTLA-4抑制剂可能终止了Wnt/β-catenin信号通路中β-catenin的累积,进而通过抑制Wnt/β-catenin信号来抑制ALL细胞增殖。
诱导凋亡是肿瘤治疗的关键策略。化疗药物可通过直接开放促凋亡途径或关闭抗凋亡途径来诱导细胞凋亡[7]。Caspase-cascade途径和Bcl-2蛋白家族是细胞凋亡的关键部分。Caspase-3是Caspase-cascade途径激活和执行的关键酶[8]。Bcl-2家族在抑制(Bcl-2)或促进(Bax)细胞凋亡中具有举足轻重的作用[9]。已有报道发现Bax与Bcl-2的比值在凋亡过程中可升高[10]。在我们的研究中,CTLA-4抑制剂可使Jurkat细胞中的Bax和Caspase-3蛋白的表达上调,Bax与Bcl-2的比值升高;Nalm-6细胞中的Caspase-3蛋白的表达上调;2种ALL细胞中的Bcl-2蛋白的表达均下调。Nalm-6细胞中Bax蛋白表达呈阴性,Nalm-6细胞可能不表达Bax蛋白,或者表达量过低不能显影。
值得注意的是CTLA-4抑制剂可下调ALDH表达。目前已发现ALDH1酶的活性在多种肿瘤干细胞中增加[4]。而ALDH2功能障碍可能导致多种疾病,包括心血管疾病、神经变性疾病、糖尿病和癌症等[11]。既往实验发现ALDH+MSC-DC疫苗可显著抑制肿瘤的生长[12]。从这个角度上来看,CTLA-4抑制剂抑制ALL细胞增殖可能与抑制ALDH表达有关。ALDH细胞具有干细胞特征[13]。已有报道肿瘤干细胞与肿瘤发生、生长、转移和复发有关[14-15],本实验结果CTLA-4抑制剂下调ALDH表达,提示CTLA-4抑制剂可能作用于ALDH+细胞上,抑制干细胞样细胞增殖,进而抑制ALL细胞的增殖,并诱导ALL细胞凋亡。
总的来说,我们的研究结果表明,ALL细胞表达CTLA-4并且CTLA-4抑制剂可以抑制干细胞样细胞增殖,从而抑制ALL细胞的增殖和诱导ALL细胞的凋亡。抑制CTLA-4有望成为ALL治疗的新方向。
参考文献
[1]Linabery A M,Ross J A.Trends in childhood cancer incidence in the U.S.(1992-2004)[J].Cancer,2008,112:416-432.
[2]黄绍良.小儿血液病临床手册[M].第3版.北京:人民卫生出版,2011:355.
[3]Sharma P,Wagner K,Wolchok J D,et al.Novel cancer immunotherapy agents with survival benefit:recent successes and next steps[J].Nat Rev Cancer,2011,11(11):805-812.
[4]Balicki D.Moving forward in human mammary stem cell biology and breast cancer prognostication using ALDH1[J].Cell Stem Cell,2007,1(5):485-487.
[5]陈莲一,谢林.Sertoli细胞对同种异体调节性T细胞/辅助性T细胞17分化平衡的调节作用[J].华中科技大学学报: 医学版,2014,43(6):626-630,635.
[6]Wu L,Yun Z,Tagawa T,et al.CTLA-4 blockade expands infiltrating T cells and inhibits cancer cell repopulation during the intervals of chemotherapy in murine mesothelioma[J].Mol Cancer Ther,2012,11(8):1809-1819.
[7]Cotter T G.Apoptosis and cancer:the genesis of a research field[J].Nat Rev Cancer,2009,9(7):501-507.
[8]Fan T J,Han L H,Cong R S,et al.Caspase family proteases and apoptosis[J].Acta Biochimica et Biophysica Sinica,2005,37(11):719-727.
[9]Yu C,Liu S L,Qi M H,et al.Herbal medicine Guan Chang Fu Fang enhances 5-fluorouracil cytotoxicity and affects drug-associated genes in human colorectal carcinoma cells[J].Oncol Lett,2015,9(2):701-708.
[10]Salakou S,Kardamakis D,Tsamandas A C,et al.Increased bax/bcl-2 ratio up-regulates caspase-3 and increases apoptosis in the thymus of patients with myasthenia gravis[J].In Vivo,2007,21(1):123-132.
[11]Chen C H,Ferreira J C,Gross E R,et al.Targeting aldehyde dehydrogenase 2:new therapeutic opportunities[J].Physiol Rev,2014,94(1):1-34.
[12]Ning N,Pan Q,Zheng F,et al.Cancer stem cell vaccination confers significant antitumor immunity[J].Cancer Res,2012,72(7):1853-1864.
[13]Boonyaratanakornkit J B,Yue L,Strachan L R,et al.Selection of tumorigenic melanoma cells using ALDH[J].J Invest Dermatol,2010,130(12):2799-2808.
[14]Huang Z,Wu T,Liu A Y,et al.Differentiation and ransdifferentiation potentials of cancer stem cells[J].Oncotarget,2015,6(37):39550-39563.
[15]张娟,武世伍,卓蕊,等.非小细胞肺癌WWOX和ALDH1水平与血管生成的相关性分析[J].中国组织化学与细胞化学杂志,2015,24(6):582-587.
(2016-03-03收稿)
Effect of CTLA-4 on the Proliferation and Apoptosis of Childhood Acute Lymphoblastic Leukemia Cells
Zhang Bingyu,Zheng Fang,Wang Cencenetal
DepartmentofPediatrics,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
AbstractObjectiveTo investigate the expression of cytotoxic T lymphocyte antigen-4(CTLA-4)in childhood acute lymphoblastic leukemia(ALL)cells and the effect of the CTLA-4 inhibitor on the proliferation and apoptosis of childhood ALL cells.MethodsThe expression of CTLA-4 was detected in ALL cells with ALL Nalm-6 and Jurkat cells as cell model.Nalm-6 and Jurkat cells were co-cultured with the CTLA-4 inhibitor and subjected to extraction of protein and mRNA.The effect of CTLA-4 on the proliferation and apoptosis of ALL cells was examined by CCK-8,Western blotting and real-time quantitative PCR,respectively.ResultsWestern blotting showed that CTLA-4 expressed in ALL cells.The expression levels of Bax and Caspase-3 were significantly increased in Jurkat cells and those of Caspase-3 obviously elevated in Nalm-6 cells after treatment with the CTLA-4 inhibitor.The expression levels of Bcl-2 were found to profoundly decrease in both cells treated with the CTLA-4 inhibitor.The expression levels of ALDH1A1,ALDH1A3,and ALDH2 mRNA were markedly down-regulated after treatment with the CTLA-4 inhibitor.ConclusionCTLA-4 was expressed in ALL cells.As the CTLA-4 inhibitor can inhibit the proliferation of ALL cells,induce their apoptosis and suppress the growth ALDH+ stem cell-like tumor cells,CTLA-4 may become a new treatment target of ALL.
Key wordsacute lymphoblastic leukemia;CTLA-4;cell proliferation;cell apoptosis;immunotherapy
中图分类号:R725.5
DOI:10.3870/j.issn.1672-0741.2016.03.001
*国家自然科学基金资助项目(No.81301954)
张冰玉,女,1986年生,博士研究生,E-mail:277245441@qq.com
△通讯作者,Corresponding author,E-mail:jinrunm@qq.com
