植物防御激素介导的信号途径间的交叉对话
2016-07-04丁丽娜杨国兴
丁丽娜,杨国兴
(1 江苏大学 生命科学研究院,江苏镇江 212013; 2 南京农业大学 动物医学院,南京 210095)
植物防御激素介导的信号途径间的交叉对话
丁丽娜1,杨国兴2
(1 江苏大学 生命科学研究院,江苏镇江 212013; 2 南京农业大学 动物医学院,南京 210095)
摘要:植物与病原物相互作用的过程中,植物体内发生一系列的信号传递,并激发植物的防御体系,使植物产生抗病性反应。目前已经明确植物激素如水杨酸、茉莉酸和乙烯在调控抗病和防卫信号传导网络中扮演了重要的角色。该文综述了近年来国内外有关3种信号途径间相互作用方面的研究进展,同时阐述了NPR1、EDS1、MPK4等关键调控蛋白在协调这些复杂关系中的作用,并对今后的研究前景进行了展望。
关键词:防御反应;信号分子;调控蛋白;信号转导途径
在自然界中,植物总是不可避免地受到各种病原物(如细菌、真菌、卵菌、病毒等)的侵袭。植物为了生存在进化过程中逐渐建立了一系列复杂的防御机制,能够很好地协调对抗病原菌的侵染。在植物与病原物相互作用的过程中,植物体内发生一系列的信号传递。目前已知的抗病信号传导途径主要包括水杨酸(salicylicacid,SA)、 茉莉酸(jasmonicacid,JA)和乙烯(ethylene,ET)介导的途径。SA是植物体内含量较低的一种内源酚类物质, 植物在受到许多病原菌侵染后都会大量积累SA。SA与局部抗性和系统获得性抗性的形成密切相关,导致许多病程相关蛋白(如PR-1,PR-2和PR-5)的表达[1]。JA和ET在自然界中普遍存在,是高等植物体内的内源生长调节物质,具有诱导多种次生代谢物的合成、叶片衰老脱落以及果实成熟等广泛的生理功能。JA和ET也是逆境信号分子,在植物组织受到病原菌或昆虫侵袭时快速而大量地积累[2,3]。
依据病原物在寄主内生存的方式,可以将病原物分为活体营养型、坏死营养型和半活体营养型[4,5]。活体营养型病原物只能从活的植物细胞和组织中获得所需要的营养物质进行生长和繁殖,如细菌性青枯病(Ralstonia solanacearum)以及大多数白粉病(Powdery mildew)和霜霉病(Downy mildew)的致病菌。相反,坏死营养型病原物从死的宿主组织中获取生存和繁殖所需要的营养物质,如真菌灰霉病菌(Botrytis cinerea)和黑斑病菌(Alternaria brassicicola)。半活体营养型病原菌,是指在病原物侵入植物时表现为活体营养的生活周期,而随后又产生坏死营养的生活周期,如小麦赤霉病菌(Fusarium graminearum)、稻瘟病菌(Magnaporthe grisea)及尖孢镰刀菌(Fusarium oxysporum)等。在受到不同类型的病原物侵染或昆虫侵袭的时候,植物会产生特异的信号分子,如SA、JA和ET等。它们在产生的数量、组成及时间上不同,使植物初次诱导的防卫反应具有特异性[6]。这些信号分子积累后,就会激活相应的信号转导途径,调控不同的防卫反应,对抗不同的攻击者。一般来说,SA参与激活植物对抗活体或半活体营养型病原菌的防卫反应;JA和ET与植物对抗死体营养型病原菌或食草昆虫的防卫反应相关[4, 7]。然而在自然界中,植物往往需要同时与相继而来的多种病原菌相对抗,这样就会改变植物原初诱导的防卫反应,植物可以通过调节SA、JA和ET的水平,变更防卫相关基因的表达,协调防卫信号转导途径之间复杂的相互关系,从而激活一种有效的防卫反应[8-11]。因此,植物需要有效的调控机制来适应敌对环境的变化。防卫反应-信号转导途径之间的交叉对话为植物提供了这种机制。然而,植物是如何协调这些复杂的相互关系以及其中的分子机制是什么还不是很清楚。在拟南芥中,已经鉴定了一些参与SA、JA和ET交叉对话的关键调控蛋白,使我们对不同信号转导途径间的协同机制有了更好的了解。
1SA、JA和ET介导的防卫信号途径的相互作用
1.1SA和JA信号转导途径的相互作用
许多研究表明SA和JA诱导的信号转导通路存在交叉对话。大部分证据显示SA和JA信号转导途径是相互拮抗的关系(图1)。可能因为如此,SA响应的激活使植物更易于受到与JA防卫反应相关的攻击者的侵袭[12]。在拟南芥中,活体营养型病原菌丁香假单胞菌(Pseudomonas syringae)的毒力菌株引发SA介导的防卫反应,抑制JA信号转导途径,使侵染后的组织更易感死体营养型病原菌黑斑病菌(A. brassicicola)[8]。Koornneef等也有相似的报道。他们发现在多营养级相互作用过程中,SA比JA信号转导途径优先。作者在很多拟南芥的生态型中都检测到了SA介导的对JA响应基因PDF1.2和VSP2的抑制作用[13]。Robert-Seilaniantz等研究结果表明SA对JA信号转导途径的拮抗作用很可能是通过抑制JA介导的对JAZ蛋白的降解实现的[14]。
但是也有一些报道认为SA和JA信号转导途径之间存在协同作用关系。昆虫信息素3-戊醇引发的拟南芥对丁香假单胞菌的免疫反应同时激活了SA和JA防卫信号转导途径[15]。在土豆中,病原物相关的分子模式(PAMP)诱导的防卫反应需要SA和JA途径的协同[16]。同时施加低浓度的SA和JA(10~100μmol/L)比单独施加JA更能增强JA/ET响应基因的表达,表明在植物与病原物相互关系中,激素的浓度对于最终的调控结果是很关键的[17-18]。在拟南芥中有许多基因同时受到SA和JA的诱导,负的交叉对话可能建立在两种激素共同作用的基础上,2种激素的组合可能引起植物转录组的重塑,SA和JA信号转导途径之间的信号网络远比我们想象的要复杂[19]。
1.2SA和ET信号转导途径的相互作用
除了SA和JA,SA和ET的互作在植物与食草昆虫及病原物的适应反应中也发挥了作用。比如拟南芥受到食草昆虫菜青虫(Pieris rapae)咬食后会产生ET,使得咬食后的组织对SA的响应更快,因此更抗芜菁皱缩病毒(TCV)的侵染[20]。在豆科植物苜蓿中,ET信号转导途径通过SA介导的对JA途径的抑制作用调控虫害诱导的防卫反应[21]。Cerato-platanin在拟南芥叶片中可以同时诱导SA和ET介导的防卫反应,而非JA信号转导途径[22]。在烟草中,ET在引发SA依赖的对抗烟草花叶病毒(TMV)的系统获得性抗性中发挥了关键作用[23]。在拟南芥类似超敏反应的病斑突变体1(hrl1)中,防卫基因的表达及对毒力细菌和卵菌病原菌的抗性受到SA和JA/ET防卫信号转导途径的协同调控[24]。Leon-Reyes等研究表明,ET能增强依赖SA/NPR1的PR1表达,并且ET以不依赖NPR1的方式调控SA介导的对JA信号转导途径拮抗作用(图1)[25]。在拟南芥中,两个参与调控ET信号转导途径转录因子EIN3和EIL1负调控依赖SID2的SA的合成,进而削弱病原物相关的分子模式引发的免疫性(PTI)防卫反应[26]。

图1 SA、JA和ET信号转导途径间互作的示意图Fig. 1 Model for the cross-talk between SA-, JA- and ET-dependent signaling pathways
1.3JA和ET信号转导途径相互作用
研究表明JA和ET信号转导途径共同对抗死体营养型病原菌或食草昆虫的侵袭,而SA信号转导途径没有发挥关键作用[27]。在拟南芥中,JA和ET协同调控激活防卫相关基因PR-3、PR-4和PR-12等PR的表达[4, 28]。ERF1是JA和ET信号转导的正调控因子[29]。在植物组织与微生物的互惠共生和致病过程中都有需要JA和ET的协同作用的报道[30-31]。微阵列分析表明在拟南芥中大约有50%的基因同时受到JA和ET诱导[32]。而且在茉莉酸不敏感突变体(coi1)和乙烯不敏感突变体(ein2)中,黑斑病菌(A. brassicicola)侵染不能诱导PDF1.2基因的表达[28, 33]。Laudert等研究表明JA和ET是彼此合成的刺激物,但JA和ET之间并不总是相互协同的,比如JA激活的伤害响应基因受到ET的抑制[34]。ERF1位于JA和ET信号转导途径协同对抗病原菌侵染及ET对JA诱导伤害响应拮抗作用的交汇点(图1)[35-36]。
2SA、JA和ET信号转导途径交叉对话的关键调控蛋白
2.1NPR1NPR1是SA信号转导途径的正调控基因,对于诱导SA依赖的PR基因的表达和系统获得性抗性是很关键的。TGA转录因子是一类含有保守碱性亮氨酸拉链结构域的转录调控因子(bZIP),因识别植物和植物病原菌启动子序列中的TGACG/as-1/ocs元件而得名,调控与防卫相关的PR基因的表达[37]。NPR1与TGA转录因子相互作用激活响应SA的PR基因,抑制JA信号转导途径[38-39]。NPR1在SA与JA信号转导途径的交叉对话中发挥了分子开关的作用(图2)[5, 40]。抑制NPR1依赖的SA信号转导途径可以提高JA依赖的对食草昆虫的抗性[41]。NPR1的核定位对激活SA介导的防卫基因表达是很关键的[42], 但不是抑制JA响应基因表达所必需的。这说明SA与JA之间的拮抗作用可能是通过细胞质NPR1来控制的[43]。
2.2EDS1
EDS1(enhanceddiseasesusceptible1)是活体或半活体营养型病原菌引发的植物基础抗性的正调控因子,对于Toll-白介素-1受体(TIR)类型的核苷酸结合-富含亮氨酸重复(NB-LRR)蛋白引发的抗性也是必需的[44]。EDS1与其互作因子,包括PAD4 (phytoalexindecient4) 和SAG101(senescenceassociatedgene101),参与调控超敏反应/程序性细胞死亡(HR/PCD)和SA的积累,SA又可以通过正反馈环路增强EDS1/PAD4/SAG101表达;EDS1/PAD抑制JA/ET信号转导途径,因此EDS1/PAD4参与调控SA与JA/ET信号转导途径间的拮抗作用(图2)[45]。EDS1在编码CC-NBS-LRR的R蛋白介导的防卫信号转导途径中特异地与SA功能冗余[46]。
2.3WRKY转录因子
WRKY蛋白是植物特异的多基因家族转录因子。这类转录因子因为含有结合DNA的WRKY结构域而命名。在它的N端60个氨基酸中含有保守的WRKYGQK序列,在它的C端含有类似C-C-H-C/H的锌指基序[47]。WRKY转录因子与植物防卫反应及植物衰老有关。在调控依赖SA的防卫反应中WRKY转录因子作用于NPR1及AtMYB44下游[48-49]。在拟南芥中过量表达WRKY70导致SA响应基因的组成性表达,提高对活体营养型病原菌白粉菌的抗性,但是抑制JA响应标记基因PDF1.2的表达,减弱对死体营养型病原菌黑斑病菌的抗性[50-51];相反,如果抑制WRKY70的表达,PDF1.2转录水平的升高,对黑斑病菌的抗性增强[49]。这些结果说明WRKY70充当SA依赖的防卫反应的正调控因子,以及JA依赖的防卫反应的负调控因子(图2)。因此,它在这两种信号转导途径中有分子开关的功能。然而,在wrky70-1突变体中,WRKY70的失活并不能改变对SA和JA的响应,也不能恢复coi1突变体对JA的响应。这说明WRKY70对于SA和JA信号转导途径虽然重要但并不是必不可少的,在调控SA和JA的响应方面可能还存在其它一些与WRKY70功能冗余的调控因子[52]。
在拟南芥野生型植株中WRKY62受到MeJA和SA的协同诱导,但是在npr1-3突变体中诱导现象消失[53]。他们通过分析缺失和获得功能突变体发现WRKY62可以抑制JA响应基因LOX2和VSP2的表达(图2)。这些结果表明在拟南芥中WRKY62可能参与SA介导的对JA响应防卫反应的抑制。水稻的WRKY13也有类似的作用[54]。相反,拟南芥转录因子WRKY33对于死体营养型病原菌灰霉菌的抗性是很关键的,WRKY33的功能突变体可以提高SA的水平,激活SA介导的防卫反应,抑制JA介导的防卫反应[55]。
2.4GRX480
谷光甘肽因子GRX480也是一个影响SA和JA信号转导途径互作关系的调控因子。该蛋白参与蛋白质活性的氧化还原调控。SA诱导的NPR1激活GRX480,然后与TGA转录因子相互作用,调控响应SA的PR基因,抑制响应JA的基因PDF1.2的表达(图2)[56]。Koornneef等报道了SA和JA交叉对话受到氧化还原调控的实验证据[13]。
2.5MPK4
促分裂原活化蛋白4(MPK4)是又一个参与SA和JA信号转导途径交叉对话的关键调控因子。在拟南芥中MPK4负调控SA信号转导途径,正调控JA信号转导途径[57]。在mpk4突变体中,SA水平提高,SA响应的PR基因呈组成性表达,对活体营养型病原菌丁香假单胞杆菌番茄致病变种(Pseudomonas syringaepvtomato)的抗性增强;JA响应基因的表达受到抑制,对死体营养型病原菌黑斑病菌的抗性减弱[57, 58]。EDS1/PAD4功能上位于MPK4的下游,与MPK4的作用相反,激活SA信号转导,抑制JA信号转导(图2)[58]。在拟南芥中,MPK4是PAMP诱导的防卫反应的调控因子。MPK4与WRKY33转录因子在核内以复合体的形式存在,该复合体依赖MPK4的底物MKS1。在受到丁香假单胞菌或细菌鞭毛蛋白抗血清侵染时导致对MPK4的激活及对MKS1的磷酸化,随后引起MKS1和WRKY33从MPK4上释放,激活对抗死体营养型病原菌的靶基因的表达,这其中就包括编码合成抗菌化合物植保素的酶PAD3[59]。
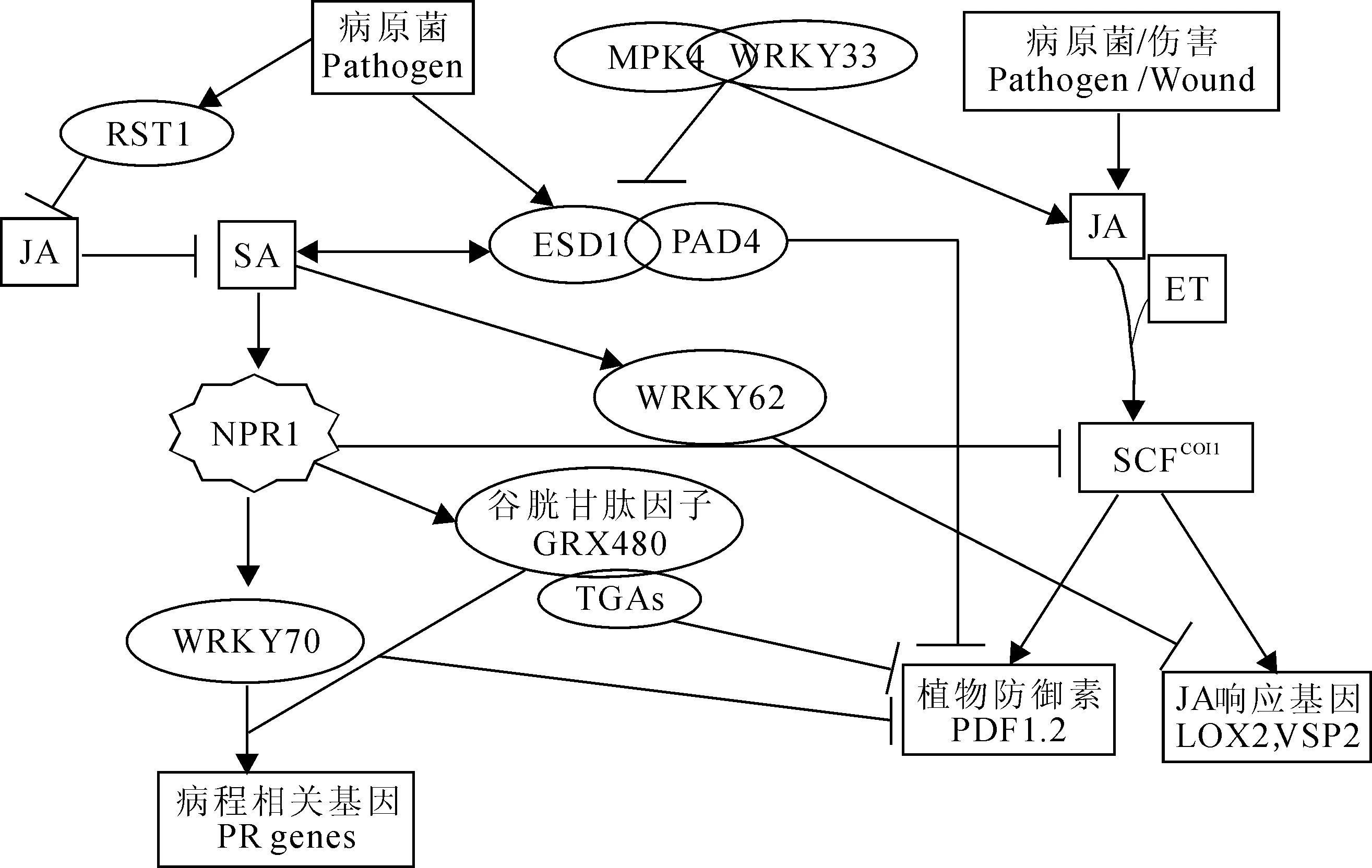
图2 SA, JA和ET信号途径交叉对话的关键调控蛋白的作用模式图Fig. 2 Model for molecular players action in SA, JA and ET signaling cross-talk
2.6RST1
拟南芥RESURRECTION1 (RST1) 基因编码一个定位于质膜的蛋白,预测含有11个跨膜结构域。rst1突变体叶子中角质单体及角质蜡质的量都显著增加。rst1突变体对专性活体营养型真菌白粉菌的感病性增强,对死体营养型真菌灰霉病菌和黑斑病菌的抗病性增强。与此相对应,rst1突变体中JA含量及PDF1.2的表达量均升高,而SA含量及PR1和PR2的表达量降低[60]。因此,RST1是一个新的参与SA与JA/ET介导的防卫反应信号途径间拮抗作用的调控基因(图2)。
3总结和展望
目前研究表明SA、JA、ET依赖的信号转导途径在植物抗病反应中发挥了关键的作用,其中SA被认为主要调控植物对病原菌的防御反应,而植物对食草昆虫和机械损伤产生的抗性反应主要受到JA和ET的调控。越来越多的证据表明这3种信号分子介导的抗病信号传导途径并不是独立的,而是存在着拮抗及协同的相互作用,并以此为基础形成了一个复杂的防御体系。然而,当病原菌抗性增强与昆虫抗性降低相关的时候,植物如何通过权衡取舍的分子机制协调这些复杂的相互关系,以实现对病虫害防御反应的精确调控还需要更深入的研究。尽管目前对植物抗病反应的信号传导的研究取得了一系列进展,但信号途径间协同或拮抗的相互作用的部位及机制仍缺少直接的实验证据。比如目前仅仅知道乙烯响应因子ERF1位于JA和ET信号转导途径协同对抗死体型病原菌侵染的交汇点,但关于其具体的分子机制仍缺少了解。一般认为SA对JA存在拮抗作用,但是对于JA对SA信号传导途径的抑制作用目前并无很多研究报告。另外,我们对于病原物效应物如何通过操纵激素合成和信号转导途径而使植物致病也不是很清楚。
植物抗病性反应机制十分复杂多样,植物与病原物的互作、抗病信号的转导及防卫反应的发生过程中存在着一系列的调节因子和基因,它们为多种防卫信号途径间的交叉反应提供了很大的调控潜力,从而有助于植物优先激活某一个特定的途径,实现对敌对环境的最佳防御。近年来, 国内外不少研究者正致力于寻找信号途径相互间的调控蛋白,但是并非所有有关调控因子的研究结果都一致,比如MPK4及RST1,它们在激素互作中的关键作用仍存在争议,其具体功能以及在激素信号通路中的作用有待进一步的研究。调控蛋白是进行防卫信号途径间交叉对话的基础 ,也是调节植物整体抗病性的关键因子。寻找新的这样的联系点将是今后植物抗病信号途径研究的热点之一。随着分子生物学的发展,在模式植物拟南芥中已分离鉴定到各种类型的抗病突变体,并克隆了基因。运用植物基因工程技术各种转基因抗病植株相继建成并应用到农业生产中,不但为农作物品种的改良开辟了一条新的途径, 同时还将对保护环境和维持生态平衡提供新思路, 具有特别重要的研究意义和广阔的应用前景。
参考文献:
[1]GRANTM,LAMBC.Systemicimmunity[J]. Curr Opin Plant Biol., 2006, 9(4): 414-420.
[2]LOUISJ,BASUS,VARSANIS, et al.Ethylenecontributestomaizeinsectresistance1-mediatedmaizedefenseagainstthephloemsap-suckingcornleafaphid[J]. Plant Physiol., 2015, 169(1): 313-324.
[3]HAEL-CONRADV,ABOU-MANSOURE,DíAZ-RICCIJC, et al.ThenovelelicitorAsEStriggersadefenseresponseagainstBotrytis cinerea in Arabidopsis thaliana[J]. Plant Sci., 241:120-127.
[4]GLAZEBROOKJ.Contrastingmechanismsofdefenseagainstbiotrophicandnecrotrophicpathogens[J]. Annu. Rev. Phytopathol., 2005, 43: 205-227.
[5]SPOELSH,JOHNSONJS,DONGX.Regulationoftradeoffsbetweenplantdefensesagainstpathogenswithdifferentlifestyles[J]. Proc. Natl. Acad. Sci. USA, 2007, 104(47): 18 842-18 847.
[6]DEVOSM,VANOOSTENVR,VANPOECECRM, et al.SignalsignatureandtranscriptomechangesofArabidopsisduringpathogenandinsectattack[J]. Mol. Plant Microbe. Interact, 2005, 18(9): 923-937.
[7]THALERJS,HUMPHREYPT,WHITEMANNK.Evolutionofjasmonateandsalicylatesignalcrosstalk[J]. Trends Plant Sci., 2012, 17(5): 260-270.
[8]BARIR,JONESJD.Roleofplanthormonesinplantdefenceresponses[J]. Plant Mol. Biol., 2009, 69(4): 473-488.
[9]GRANTMR,JONESJD.Hormone(dis)harmonymouldsplanthealthanddisease[J]. Science, 2009, 324(5 928): 750-752.
[10]DINGL,XUH,YIH, et al.Resistancetohemi-biotrophicF.graminearuminfectionisassociatedwithcoordinatedandorderedexpressionofdiversedefensesignalingpathways[J]. PLoS One, 2011, 6(4):e19008.
[11]YANGYX,AHAMMEDGJ,WUC, et al.Crosstalkamongjasmonate,salicylateandethylenesignalingpathwaysinplantdiseaseandimmuneresponses[J]. Current Protein and Peptide Science, 2015, 16(5): 450-461.
[12]NAIDOOR,FERREIRAL,BERGERDK, et al.TheidentificationanddifferentialexpressionofEucalyptus grandispathogenesis-relatedgenesinresponsetosalicylicacidandmethyljasmonate[J]. Front Plant Sci., 2013, 4:43.
[13]KOORNNEEFA,LEON-REYESA,RITSEMAT, et al.Kineticsofsalicylate-mediatedsuppressionofjasmonatesignalingrevealaroleforredoxmodulation[J]. Plant Physiol., 2008, 147(3): 1 358-1 368.
[14]ROBERT-SSILANIANTZA,NAVARROL,BARIR, et al.Pathologicalhormoneimbalances[J]. Curr. Opin. Plant Biol., 2007, 10(4): 372-379.
[15]SONGGC,CHOIHK,RYUCM.Gaseous3-pentanolprimesplantimmunityagainstabacterialspeckpathogen, Pseudomonas syringaepv. tomatoviasalicylicacidandjasmonicacid-dependentsignalingpathwaysinArabidopsis[J]. Front Plant Sci., 2015, 6: 821.
[16]HALIMVA,ALTMANNS,ELLINGERD, et al.PAMP-induceddefenseresponsesinpotatorequirebothsalicylicacidandjasmonicacid[J]. Plant J., 2009, 57(2): 230-242.
[17]MURLAJ,KENTONP,ATZORNR, et al.Theoutcomesofconcentration-specificinteractionsbetweensalicylateandjasmonatesignalingincludesynergy,antagonism,andoxidativestressleadingtocelldeath[J]. Plant Physiol., 2006, 140(1): 249-262.
[18]DINGLN,YANGGX,YANGRY, et al.Investigatinginteractionsofsalicylicacidandjasmonicacidsignalingpathwaysinmonocotswheat[J]. Physiol. Mol. Plant P, 2016,doi:10.1016/j.pmpp.2016.01.002.
[19]PROIETTIS,BERTINIL,TIMPERIOAM, et al.CrosstalkbetweensalicylicacidandjasmonateinArabidopsisinvestigatedbyanintegratedproteomicandtranscriptomicapproach[J]. Mol. Biosyst., 2013, 9(6):1 169-1 187.
[20]DEVOSM,VANW,KOORNNEEFA, et al.Herbivore-inducedresistanceagainstmicrobialpathogensinArabidopsis[J]. Plant Physiol., 2006, 142(1): 352-363.
[21]PAUDELJR,BEDEJC.Ethylenesignalingmodulatesherbivore-induceddefenseresponsesinthemodellegumeMedicago truncatula[J]. Mol. Plant Microbe Interact, 2015, 28(5): 569-579.
[22]BACCELLII,LOMBARDIL,LUTIS, et al.Cerato-platanininducesresistanceinArabidopsisleavesthroughstomatalperception,overexpressionofsalicylicacid-andethylene-signalinggenesandcamalexinbiosynthesis[J]. PLoS One, 2014, 9(6):e100959.
[23]VERBERNEMC,HOEKSTRAJ,BOLJF, et al.Signalingofsystemicacquiredresistanceintobaccodependsonethyleneperception[J]. Plant J., 2003, 35(1): 27-32.
[24]DEVADASSK,ENYEDIA,RAINAR.TheArabidopsis hrl1mutationrevealsnoveloverlappingrolesforsalicylicacid,jasmonicacidandethylenesignalingincelldeathanddefenceagainstpathogens[J]. Plant J., 2002, 30(4): 467-480.
[25]LEON-REYESA,SPOELSH,DELANGEES, et al.EthylenemodulatestheroleofNONEXPRESSOROFPATHOGENESIS-RELATEDGENES1incrosstalkbetweensalicylateandjasmonatesignaling[J]. Plant Physiol, 2009, 149(4): 1 797-1 809.
[26]CHENH,XUEL,CHINTAMANANIS, et al.ETHYLENEINSENSITIVE3andETHYLENEINSENSITIVE3-LIKE1repressSALICYLICACIDINDUCTIONDEFICIENT2expressiontonegativelyregulateplantinnateimmunityinArabidopsis[J]. Plant Cell, 2009, 21(8): 2 527-2 540.
[27]ALONM,MALKAO,EAKTEIMANG, et al.ActivationofthephenylpropanoidpathwayinNicotiana tabacumimprovestheperformanceofthewhiteflyBemisia tabaciviareducedjasmonatesignaling[J]. PLoS One, 2013, 8(10):e76619.
[28]PENNINCKXIA,THOMMABP,BUCHALAA, et al.ConcomitantactivationofjasmonateandethyleneresponsepathwaysisrequiredforinductionofaplantdefensingeneinArabidopsis[J]. Plant Cell, 1998, 10(12): 2 103-2 113.
[29]SHERIFS,EI-SHARKAWYI,PALIYATHG, et al.DifferentialexpressionofpeachERFtranscriptionalactivatorsinresponsetosignalingmoleculesandinoculationwithXanthomonas campestrispv. pruni[J]. J. Plant Physiol., 2012, 169(7): 731-739.
[30]VANWEESSC,VANDERENTS,PIETERSECM.Plantimmuneresponsestriggeredbybeneficialmicrobes[J]. Curr Opin Plant Biol., 2008, 11(4): 443-448.
[31]PLETTJM,KHACHANEA,OUASSOUM,etal.EthyleneandjasmonicacidactasnegativemodulatorsduringmutualisticsymbiosisbetweenLaccaria bicolorandPopulusroots[J]. New Phytol, 2014, 202(1): 270-286.
[32]SCHENKPM,KAZANK,WILSONI, et al.CoordinatedplantdefenseresponsesinArabidopsisrevealedbymicroarrayanalysis[J]. Proc. Natl. Acad. Sci. USA, 2000, 97(21): 11 655-11 660.
[33]THOMMABPHJ,PENNINCKXIAMA,BROEKAERTWF, et al.ThecomplexityofdiseasesignalinginArabidopsis[J]. Curr. Opin. Immuno., 2001, 13(1): 63-68.
[34]LAUDERTD,WEILEREW.Alleneoxidesynthase:amajorcontrolpointinArabidopsis thalianaoctadecanoidsignaling[J]. Plant J., 1998, 15(5): 675-684.
[35]LORENZOO,CHICOJM,S’ANCHEZ-SERRANOJJ, et al.JASMONATE-INSENSITIVE1encodesaMYCtranscriptionfactoressentialtodiscriminatebetweendifferentjasmonateregulateddefenseresponsesinArabidopsis[J]. Plant Cell, 2004, 16(7): 1 938-1 950.
[36]LORENZOO,PIQUERASR,S’ANCHEZ-SERRANOJJ, et al. ETHYLENE RESPONSE FACTOR1integratessignalsfromethyleneandjasmonatepathwaysinplantdefense[J]. Plant Cell, 2003, 15(1): 165-178.
[37]THUROWC,SCHIERMEYERA,KRAWEZKYS, et al.TobaccobZIPtranscriptionfactorTGA2.2andrelatedfactorTGA2.1havedistinctrolesinplantdefenseresponsesandplantdevelopment[J]. Plant J., 2005, 44(1): 100-113.
[38]DONGX.NPR1,allthingsconsidered[J]. Curr Opin Plant Biol., 2004, 7(5): 547-552.
[39]TADAY,SPOELSH,PAJEROWSKA-MUKHTARK, et al.PlantimmunityrequiresconformationalchargesofNPR1viaS-nitrosylationandthioredoxins[J]. Science, 2008, 321(5 891): 952-956.
[40]CAARLSL,PIETERSECM,VANWEESSC.Howsalicylicacidtakestranscriptionalcontroloverjasmonicacidsignaling[J]. Front Plant Sci., 2015, 6: 170.
[41]STOTZHU,KOCHT,BIEDERMANNA, et al.EvidenceforregulationofresistanceinArabidopsistoEgyptiancottonwormbysalicylicandjasmonicacidsignalingpathways[J]. Planta, 2002, 214(4): 648-652.
[42]KINKEMAM,FANW,DONGX.NuclearlocalizationofNPR1isrequiredforactivationofPRgeneexpression[J]. Plant Cell, 2000, 12(12): 2 339-2 350.
[43]SPOELSH,KOORNNEEFA,CLAESSENSSM, et al.NPR1modulatescross-talkbetweensalicylate-andjasmonate-dependentdefensepathwaysthroughanovelfunctioninthecytosol[J]. Plant Cell, 2003, 15(3): 760-770.
[44]HUG,DEHARTAKA,LIY, et al. EDS1intomatoisrequiredforresistancemediatedbyTIR-classRgenesandthereceptor-likeRgeneVe[J]. Plant J., 2005, 42(3): 376-391.
[45]WIERMERM,FEYSBJ,PARKERJE.Plantimmunity:theEDS1regulatorynode[J]. Curr. Opin. Plant Biol., 2005, 8(4): 383-389.
[46]VENUGOPALSC,JEONGRD,MANDALMK, et al.Enhanceddiseasesusceptibility1andsalicylicacidactredundantlytoregulateresistancegene-mediatedsignaling[J]. PLoS Genet, 2009, 5(7):e1000545.
[47]EULGEMT,RUSHTONPJ,ROBATZEKS, et al.TheWRKYsuperfamilyofplanttranscriptionfactors[J]. Trends Plant Sci., 5(5): 199-206.
[48]EULGEMT,SOMSSICHIE.NetworksofWRKYtranscriptionfactorsindefencesignaling[J]. Curr. Opin. Plant Biol., 2007, 10(4): 366-371.
[49]SHIMJS,CHOIYD.DirectregulationofWRKY70byAtMYB44inplantdefenseresponses[J]. Plant Signal Behav, 2013, 8(6):e20783.
[50]LIJ,BRADERG,KARIOLAT, et al.WRKY70modulatestheselectionofsignalingpathwaysinplantdefense[J]. Plant J., 2006, 46(3): 477-491.
[51]SHIMJS,JUNGC,LEES, et al.AtMYB44regulatesWRKY70expressionandmodulatesantagonisticinteractionbetweensalicylicacidandjasmonicacidsignaling[J]. Plant J., 2013, 73(3): 483-495.
[52]RENCM,ZHUQ,GAOBD, et al.TranscriptionfactorWRKY70displaysimportantbutnoindispensablerolesinjasmonateandsalicylicacidsignaling[J]. J. Integr Plant Biol., 2008, 50(5): 630-637.
[53]MAOP,DUANM,WEIC, et al.WRKY62transcriptionfactoractsdownstreamofcytosolicNPR1andnegativelyregulatesjasmonate-responsivegeneexpression[J]. Plant Cell Physiol., 2007, 48(6): 833-842.
[54]QIUD,XIAOJ,DINGX, et al. OsWRKY13mediatesricediseaseresistancebyregulatingdefense-relatedgenesinsalicylate-andjasmonate-dependentsignaling[J]. Mol. Plant Microbe Interact, 2007, 20(5): 492-499.
[55]BIRKENBIHLRP,DIEZELC,SOMSSICHIE. ArabidopsisWRKY33isakeytranscriptionalregulatorofhormonalandmetabolicresponsestowardBotrytis cinereainfection[J]. Plant Physiol., 2012, 159(1): 266-285.
[56]NDAMUKONGI,ABDALLATAA,THUROWC, et al.SA-inducibleArabidopsisglutaredoxininteractswithTGAfactorsandsuppressesJA-responsivePDF1.2transcription[J]. Plant J., 2007, 50(1): 128-139.
[57]PETERSENM,BRODERSENP,NAESTEDH, et al. Arabidopsismapkinase4negativelyregulatessystemicacquiredresistance[J]. Cell, 2000, 103(7): 1 111-1 120.
[58]BRODERSENP,PETERSENM,BJORNNIELSENH, et al. ArabidopsisMAPkinase4regulatessalicylicacid-andjasmonicacid/ethylene-dependentresponsesviaEDS1andPAD4[J]. Plant J., 2006, 47: 532-546.
[59]QIUJL,FIILBK,PETERSENK, et al. ArabidopsisMAPkinase4regulatesgeneexpressionthroughtranscriptionfactorreleaseinthenucleus[J]. EMBO J., 2008, 27(16): 2 214-2 221.
[60]MANGHG,LALUKKA,PARSONSEP, et al.TheArabidopsisRESURRECTION1generegulatesanovelantagonisticinteractioninplantdefensetobiotrophsandnecrotrophs[J]. Plant Physiol., 2009, 151(1): 290-305.
(编辑:裴阿卫)
Cross-talkbetweenDefencePhytohormones-MediatedSignalingPathway
DINGLina1,YANGGuoxing2
(1CollegeofLifeSciences,JiangsuUniversity,Zhenjiang,Jiangsu212013,China; 2CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing, 210095,China)
Abstract:In the process of plant-pathogens interaction, a series of signal transduction and defense system are excited in plant, which triggers rapid and effective defense responses. After activation of defense responses, will cause synthesizing and accumulating of a series of exogenous signaling molecules. The plant hormones salicylic acid (SA), jasmonic acid (JA) and ethylene (ET) are recognized as key players in the regulation of the signaling pathways involved. In this review, the recent research advances on the interaction among the three different signaling pathways are summarized. It also presented the function of several key regulatory proteins such as NPR1,EDS1,MPK4, which are known to play important role in SA and JA/ET signaling cross talk and coordinating their complex relationships. In addition, the prospect of future work is discussed in the review.
Key words:defense response; signal molecular; regulatory proteins; signaling pathway
文章编号:1000-4025(2016)05-1066-7
doi:10.7606/j.issn.1000-4025.2016.05.1066
收稿日期:2016-02-25;修改稿收到日期:2016-04-12
基金项目:国家自然科学基金(31200209);中国博士后科学基金(2013M531277);江苏省博士后科学基金(1201070C);江苏大学高级人才启动基金 (11JDG121)
作者简介:丁丽娜(1982-),女,博士,硕士生导师,研究方向为植物与微生物互作机制。E-mail: lnding6@126.com
中图分类号:Q945.8
文献标志码:A
