不同LEDs复合光质对秋葵组培苗生长和生理特性的影响
2016-07-04李慧敏
李慧敏
(安徽科技学院 生命科学学院,安徽凤阳233100)
不同LEDs复合光质对秋葵组培苗生长和生理特性的影响
李慧敏
(安徽科技学院 生命科学学院,安徽凤阳233100)
摘要:以秋葵品种‘清福’为试材,采用单因素随机区组设计试验,将秋葵顶芽作为外植体(1.0 cm)接种到添加了0.05 g·L-1NAA的MS基本培养基上,然后分别转入荧光灯(CK,对照)、蓝红复合光(BR3∶1、BR1∶1、BR1∶3、BR1∶4)、蓝红黄(BRY=1∶3∶1)、蓝红绿(BRG=1∶3∶1)和蓝红远红复合光(BRFR=1∶3∶1)下进行光照射,考察不同光质对秋葵组培苗生长和生理特征的光效应,筛选适合秋葵组培苗的最优光质。结果显示:(1)不同复合光质处理的秋葵组培苗鲜质量、干质量、根长、茎长和茎粗不同程度增加,并均以BRY处理最高。(2)不同复合光质处理的组培苗根系活力都显著高于对照,且以BRY处理下最大;各光质处理下的幼苗叶片叶绿素和类胡萝卜素含量也以BRY处理最高,并显著高于其余处理。(3)组培苗叶片中SOD、POD和CAT的活性均以BRY处理下最强,CK处理下最弱。(4)各处理组培苗叶片中的可溶性糖、蔗糖、可溶性总碳含量和淀粉含量均以BRY处理最高,其次为BRG处理,CK下较低;叶片可溶性蛋白、游离氨基酸和可溶性总氮的含量均以BRY处理最高,其次为BRG处理,CK下最低。研究表明,蓝红黄复合光显著提高了秋葵组培苗根系活力、光合色素含量、抗氧化酶活性及碳氮代谢和光合产物累积,从而有效促进了秋葵组培苗的生长,可以作为秋葵离体培养的优选光质。
关键词:复合光质;秋葵;组培苗;生理特性;离体培养
秋葵(Abelmoschus esculentusL.),又名黄秋葵、咖啡黄葵、黄蜀葵、羊角豆、毛茄,民间也称“洋辣椒”,为锦葵科秋葵属一年生草本植物,以采食嫩果为主,秋葵的花和种子均可入药,并且其富含锌和硒等微量元素、维生素C和可溶性纤维,能增强人体防癌抗癌能力,对皮肤具有保健作用,具有极高的食用和药用等价值[1]。目前,秋葵的品种选育主要采用人工制种和引种选育的方式。近年来,为满足栽培对杂交种种苗的需要,利用离体快繁技术来保存秋葵杂种优势资源成为了关注的热点[2]。光形态建成,也称为光控制发育过程,是指依赖光控制细胞的分化、结构和功能的改变,最终形成组织和器官的建成。在植物离体快繁中,光对外植体形态建成具有重要作用[3]。植物是通过光受体来感知光谱的变化,光受体主要有吸收红光和远红光的光敏色素、吸收蓝光和紫外光-A(UV-A)的隐花色素、向光色素及其他暗含的光受体[4],光谱变化能激起植物光形态的变化,进而影响植物的生长和发育,这种变化因植物的种类不同而表现各异。
新型高效节能光源LEDs能够发出植物生长所需要的单色光,各种单色光LEDs组合后,可形成与各种植物光合作用和形态建成基本吻合的光谱,可以促进作物的生长发育和光形态建成[5-6]。关于LEDs在植物离体快繁上应用的研究,国内外学者较多的关注集中在花卉[7-15]、果树[16-17]和药用植物[18-19]等园艺植物上。前人的研究表明,与荧光灯相比,LEDs可能更适合作为植物离体培养的光源,但是不同的植物对光的响应也产生了迥异的效应,在具体的应用中可能还需要根据作物的种类或品种筛选适宜的光质。荧光灯是目前离体快繁中广泛使用的光源,迄今关于不同复合LEDs光质对秋葵组培苗的生长和生理特性的影响研究尚未见报道。为寻找适合秋葵离体培养的优质光质,本研究采用8种不同的光质:荧光灯(CK)、4种蓝红复合光(BR3∶1、BR1∶1、BR1∶3、BR1∶4)、蓝红黄(BRY)、蓝红绿(BRG)和蓝红远红复合光(BRFR)对秋葵组培苗进行光处理,并对其生长和生理指标的进行测定分析,以期为植物离体快繁中新型LEDs光质的推广应用提供理论基础和技术支持,以推动LEDs光质在植物离体快繁中的应用。
1材料和方法
1.1材料
挑选大小一致、饱满的秋葵品种‘清福’种子(购于安徽省合肥合丰种业有限公司),在流水中冲洗1h,然后在超净工作台用75%的酒精消毒30s,0.15%的升汞中消毒8min,再用无菌水反复冲洗5~6次,最后将消毒后的种子接入MS基本培养基。
1.2试验设计
试验采用单因素随机区组设计。根据保持光强相同的原则,将7d后子叶展平的秋葵无菌苗切取顶芽(1.0cm)外植体,然后接种在添加了0.05g·L-1NAA的MS基本培养基上,随机放置在8种不同的光质下(表1):荧光灯(CK)、蓝红复合光(BR3∶1、BR1∶1、BR1∶3、BR1∶4)、蓝红黄(BRY)、蓝红绿(BRG)和蓝红远红复合光(BRFR)LEDs(T5,飞利浦照明工业有限公司,中国扬州),根据各光质光强的比值来确定各复合光质的光比例,光强设置为45μmol·m-2·s-1,光周期为12h·d-1,处理周期35d, 保持温度在25~26 ℃,湿度在55%~60%,每个处理45瓶,每瓶4株,试验重复3次。
1.3指标测定及方法
幼苗培养35d后,每小区随机选取5株,每处理选取15株,用直尺测定株高、根长,游标卡尺测定茎粗(茎粗测定部位为下胚轴),最后测定鲜样质量,并在烘干后测定干样质量。同时,每处理随机选取30株,根部选取2cm左右的侧根,叶片选取倒3、倒4叶,参照李合生[20]的方法进行测定以下指标。其中,采用四氮唑法(TTC法)测定根系活力;以80%丙酮提取法测定叶中叶绿素和类胡萝卜素含量;考马斯亮蓝法测定可溶性蛋白含量;超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定;过氧化物酶(POD)活性按愈创木酚法测定;过氧化氢酶(CAT)活性采用高锰酸钾滴定法测定;可溶性糖和淀粉采用蒽酮比色法;蔗糖采用水合茚三酮比色法;可溶性蛋白利用考马斯亮蓝比色法;游离氨基酸采用茚三酮溶液显色方法;可溶性总碳用可溶性糖、蔗糖和淀粉含量的总和表示,可溶性总氮用可溶性蛋白和游离氨基酸的总和表示。

表1 不同LED 光谱能量分布的主要技术参数
1.4数据整理与分析
采用Microsoftexcel2003和SPASS16.0系统进行单因素方差分析和显著性差异检测(Ducan法,P<0.05)。
2结果与分析
2.1不同光质对秋葵组培苗生长的影响
表2显示,与对照(CK)相比,不同复合光质处理秋葵组培苗的鲜质量、干质量、根长、茎长和茎粗不同程度增加,且均达到显著水平(P<0.05)。其中,各生长指标均以BRY处理最高,其比对照增幅分别为62.42%、92.31%、42.12%、29.87%和28.31%;BRG处理仅次于BRY处理,其鲜质量、干质量、根长、茎长和茎粗分别比对照显著增加53.94%、76.92%、34.55%、20.65%和11.45% ;BR1∶3和BR1∶4处理的相应生长指标虽也比对照都显著增加,但是却显著低于最高的BRY处理,而BR1∶3和BR1∶4处理间无显著差别;BR3∶1、BR1∶1和BRFR处理的相应生长指标也比对照都显著增加,但是显著低于BRY和BRG处理,这3个处理间的干质量和茎长无显著差别(表2)。可见,不同复合光处理都能不同程度促进秋葵组培苗的生长,尤其以BRY处理表现最为突出。
2.2不同光质对秋葵组培苗根系活力的影响
根系活力一定程度上可以反映组培苗的生长状况。不同复合光处理的秋葵组培苗的根系活力都显著高于对照(图1)。其中,BRY处理秋葵组培苗的根系活力最大,其次为BRG、BR1∶3、BR1∶1、BR3∶1和BR1∶4处理,其值分别显著高于对照 53.38%、22.97%、15.70%、13.33%、6.73%和6.61%(P<0.05);而BRY和BRG处理又显著高于BR1∶3和BR1∶1处理,但是BR1∶3和BR1∶1、BR3∶1和BR1∶4处理、BRFR和对照之间无显著差别。可见,各复合光处理不同程度上均提高了秋葵组培苗的根系活力,并以BRY处理效果最佳。

表2 不同光质下秋葵组培苗的生长变化
注:同一列中的不同字母代表各处理在0.05水平上存在显著性差异;下同
Note:Differentletterswithinthecolumnindicatesignificantdifferencesamongtreatmentsat0.05level;thesameasbelow
2.3不同光质对秋葵组培苗光合色素含量的影响
光合色素是植物叶片中进行光合作用的物质基础,其含量和组成可以影响植株的生长。图2显示,秋葵组培苗叶片中叶绿素a含量在BRY处理下最大,其次为BRG处理,二者显著高于其他光处理和对照,但是BR1∶3、BR1∶1、BR3∶1、BR1∶4处理间无显著差别,BRFR和CK下显著较小(P<0.05)。组培苗叶绿素b和叶绿素总量在各光质处理间表现趋势基本一致,即在BRY处理下均最大,其次为BRG和BR1∶3处理,再次为BR1∶1、BR1∶4和BR3∶1处理,但BR1∶1、BR1∶4和BR3∶1处理间无显著差别,而BRFR和CK处理下最小,并显著低于其余处理。组培苗类胡萝卜素含量同样在BRY处理下最大,且显著高于其它光照处理;BRG、BR1∶3、BR1∶1、BR3∶1和BR1∶4处理类胡萝卜素含量居中,且其间无显著差别;BRFR和CK类胡萝卜素含含量最小,并显著低于其余处理,但二者间无显著差别。可见,各复合光照处理总体上显著提高了秋葵组培苗叶片光合色素的含量,为促进植株生长奠定了基础,并以BRY处理表现最为突出。

不同字母代表各处理(n=3)在0.05水平上存在显著性差异,下同图1 不同光质处理下秋葵组培苗的根系活力Different letters indicate significant differences at 0.05 level, the same as belowFig. 1 The root activity of A. esculentus plantlets in vitro under different quality lights
2.4不同光质对秋葵组培苗抗氧化活性的影响
如图3,A所示,秋葵组培苗叶片中SOD活性在BRY处理下最高,并显著高于其余处理;其次为BR3∶1和BR1:3处理,且二者之间无显著差别;再次为BRG和BRFR处理,但两处理间亦无显著差别;BR1∶4处理和CK的SOD活性较小,并显著低于其余处理(P<0.05)。秋葵组培苗叶片中POD活性也在BRY处理下最强,并显著高于其余处理;其次为BRG、BR1∶3和BR1∶4处理,但三者之间无显著差别;再次为BR3∶1和BR1∶1处理,但两处理间无显著差别;BRFR处理和CK幼苗的POD活性较小,并显著低于其余处理(图3,B)。秋葵组培苗叶片中CAT活性仍在BRY处理下最高,其次为BRG处理,两者显著高于其余处理;再次为BR3∶1、BR1∶1、BR1∶4和BRFR处理,但四者之间无显著差别;BR1∶3处理和CK幼苗叶片中CAT活性较低,并显著低于其余处理(图3,C)。可见,各复合光照处理总体上显著提高了秋葵组培苗叶片主要抗氧化酶活性,增强了植株生长过程中抗氧化胁迫能力,并以BRY处理表现尤为突出。

图2 不同光质下秋葵组培苗的光合色素含量变化Fig. 2 The photosynthetic pigment content of A. esculentus plantlets in vitro under different quality lights

图3 不同光质下秋葵组培苗SOD、 POD 和CAT活性Fig. 3 The SOD, POD and CAT activities of A. esculentus plantlets in vitro under different quality lights
2.5不同光质对秋葵组培苗光合产物含量的影响
光质可以调控植物光合产物的碳代谢。图4,A显示,秋葵组培苗叶片可溶性糖含量和可溶性总碳含量以BRY处理最高,其次为BRG处理,两者都显著高于其它处理;可溶性糖含量和可溶性总碳含量均在CK下最小,大多都显著低于各复合光处理(P<0.05)。同时,培苗叶片中蔗糖含量仍以BRY处理最高,其次为BRG处理,两者都显著高于其它处理;再次为蓝红复合光处理(BR3∶1、BR1∶1、BR1∶3和BR1∶4),且它们之间无显著差别;CK叶片中蔗糖含量最低,并显著低于各复合光处理(P<0.05)。另外,秋葵组培苗叶片中淀粉含量也以BRY处理最高,其次为BRG和BR1∶3处理,三者都显著高于其它处理;再次为BR1:4和BRFR处理;CK叶片中淀粉含量最低,并显著低于各复合光处理(P<0.05)。可见,不同复合光处理都在不同程度上促进了秋葵组培苗叶片中碳水化合物的积累,尤其以BRY处理最为显著。
光质还可以调控植物光合产物的氮代谢。图4,B显示,秋葵组培苗叶片可溶性蛋白含量以BRY处理最高,其次为BRG和BR1∶1处理,三者都显著高于其它处理;再次为BR1∶4处理,其显著高于BR3∶1、BR1∶3、BRFR和CK处理,但是后四者间无显著差别。同时,秋葵组培苗叶片中游离氨基酸和可溶性总氮含量也均以BRY处理最高,其次为BRG处理,两者都显著高于其它处理;再次为蓝红组合光(BR3∶1、BR1∶1、BR1∶3和BR1∶4)和BRFR处理;CK组培苗叶片中游离氨基酸和可溶性总氮含量最低,并与其他复合光处理差异显著(P<0.05)。可见,各复合光处理均显著提高了秋葵组培苗叶片中氮的积累,并以BRY复合光处理的效果最佳。
3讨论
3.1不同光质对秋葵组培苗生长的促进效应
光不仅是一种能源控制着光合作用,还是一种触发信号,影响着植物的生长和发育。蓝光(400~500nm)、红光(600~700nm)和远红外光(700~800nm)对植物的形态建成起着重要的作用[21]。蓝红黄复合光利于菊花试管苗生长和发育[7];蓝红绿光质培养下的碧玉兰×独占春组培苗植株形态指标综合系数较高[8],虎雪兰组培苗长势也最好[9]。而蓝红组合光有利于文心兰[10]和香蕉[16]生根组培苗的正常生长,且蓝红复合处理下白掌组培苗[11]的根系活力、整株鲜重、地上鲜重和地下鲜重都达到最大值,是替代荧光灯的理想光源;蓝红复合光处理碧玉兰组培苗的根长、植株干重和能效指标最高[12];高蓝红组合光处理的菊花组培苗生长健壮,与荧光灯相比,复合光质具有明显优势,有利于培育壮苗并降低能耗成本[13]。同样,毛地黄组培苗植株在复合光下生长健壮[18]。但是,Jao等[14]发现荧光灯下马蹄莲植株的干物质积累量最大,比LEDs更适合植株生长;Piao等[22]也认为在马铃薯离体培养中荧光灯优于蓝红组合光。而本研究发现,秋葵组培苗在蓝红黄复合光下生长健壮,各种生长指标也表现较佳,不同光质对组培苗生长显示出明显的促进效应。植物对光的应答反应主要是通过不同的光受体接收和转导信号来完成的。红光远红光受体-光敏色素与蓝光受体-隐花色素和向光素都是由发色团以及与之结合的蛋白组成,其光谱敏感性依赖于其发色团吸收不同波长的能力,这些光受体分别接受光质、光量、光照时间和光照方向的变化,并经过信号转换、传递、放大和选择调控,引起不同的反应,使植物适应光环境的变化,完成植物的生命周期[23]。因此,本研究认为蓝红黄复合光质促进了秋葵幼苗的生长。
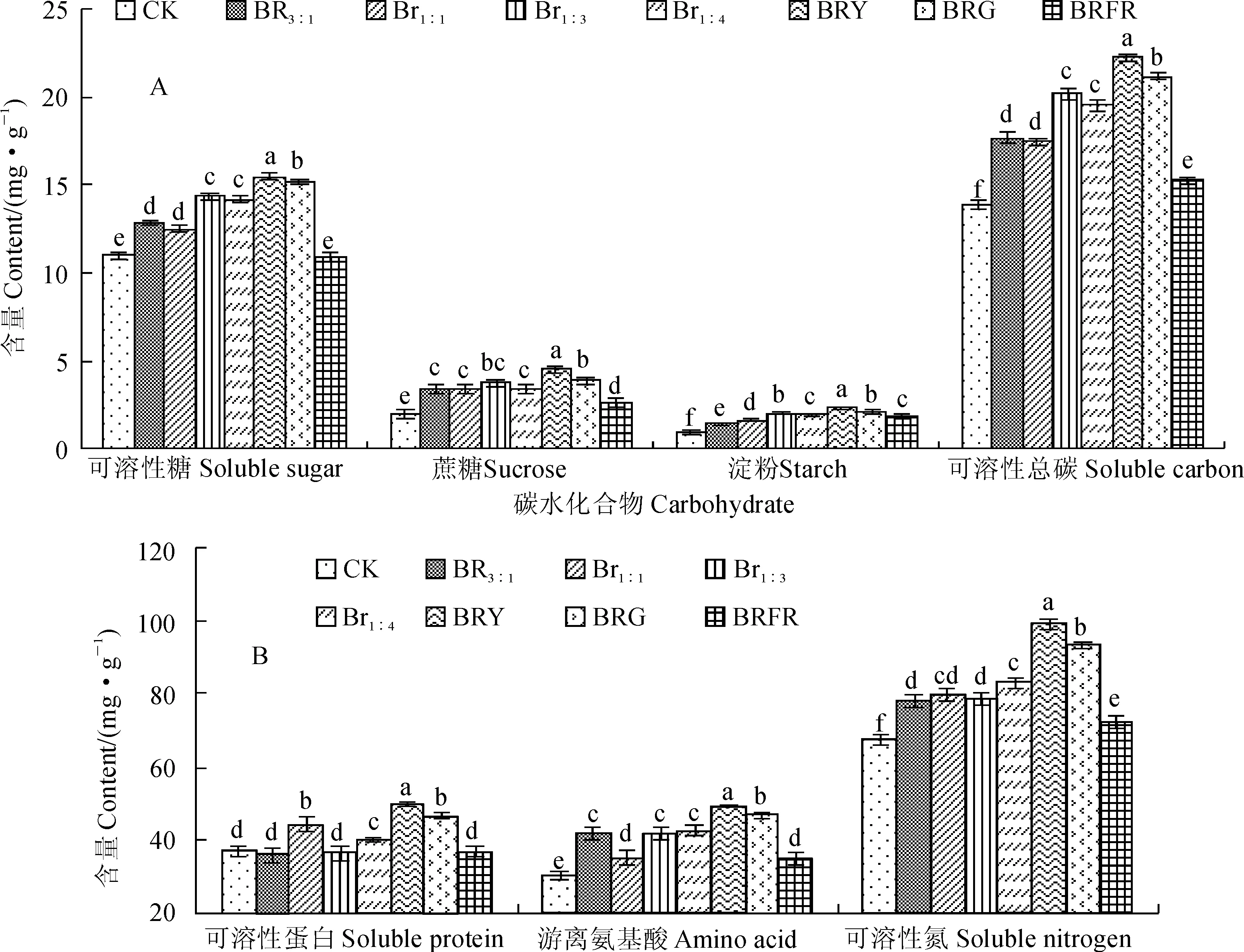
图4 不同光质下秋葵组培苗碳水化合物(A)和氮代谢(B)Fig. 4 The carbohydrate content and nitrogen metabolism of A. esculentus plantlets in vitro under different quality lights
3.2不同光质对秋葵组培苗叶片光合色素含量的促进效应
光是影响叶绿素合成的重要条件,不同波长的光与植物体内相应光受体作用调控色素合成[24]。研究发现,蓝红绿组合光下的菊花[15]、虎雪兰[9]和碧玉兰[12]组培苗叶片叶绿素和类胡萝卜素含量最高,而蓝红组合光提高了葡萄[17]和菊花[13]的叶片叶绿素含量。王丹等[8]报道,LED复合光质促进了碧玉兰×独占春组培苗叶绿素和胡萝卜素的合成;邸秀如等[13]认为,蓝光能促进菊花组培苗色素的合成;而杨雅婷等[25]却认为,蓝红组合变化对甘薯组培苗叶片光合色素含量没有显著影响;但Jao等[14]发现,荧光灯下马蹄莲植株的叶绿素含量最高。本研究发现秋葵组培苗叶片中叶绿素和类胡萝卜素的含量在BRY处理下最高。综上所述,光质对不同植物光合色素含量产生了明显的生理反应,可能是由于光在刺激叶片扩展和叶肉细胞分化的同时, 促进原质体或黄化体向叶绿体的转化。光敏色素远红光吸收型(Pfr)在促进叶绿素前体(ALA)、原叶绿酯合成的同时, 也促进叶绿素的积累。另外,光除去促进转录加速外, 还能促进翻译的起始过程, 即在mRNA量无大的变化时, 诱导某些叶绿体蛋白的合成增加[26]。因此,本研究认为蓝红黄复合光促进了秋葵组培苗光合色素的积累。
3.3不同光质对秋葵组培苗叶片抗氧化酶活性的促进效应
不同光质同样可以调控植物的抗氧酶活性。例如,碧玉兰×独占春组培苗植株的SOD活性在蓝红绿光质培养下最高,其植株POD活性在白色荧光灯处理下最高,而植株CAT活性在蓝红白光质处理下最高[8];烟草叶片SOD活性在黄光处理下升高[27];蓝光处理的烟草叶片SOD活性较高,但POD活性均下降[28];红光和蓝光处理提高了灵芝POD的活性,绿色、黄色光质抑制了其抗氧化酶活性[29]。本研究发现,秋葵组培苗叶片中SOD、POD和CAT的活性均以BRY处理下最高。王虹等[30]认为,作为植物体内的活性氧清除酶系统的重要保护酶CAT、POD、SOD活性的增加可以有效阻止活性氧的积累,防止膜脂过氧化的产生。因此,本研究认为蓝红黄复合光处理显著提高了秋葵组培苗的SOD、POD和CAT的活性。
3.4不同光质对秋葵组培苗光合产物积累的促进效应
光质还可以调控高等植物的碳水化合物的代谢。研究发现,蓝红绿复合光下的菊花叶片可溶性糖和蔗糖含量最高[15],该复合光处理下碧玉兰组培苗的淀粉含量也最高[12];蓝红复合处理下白及组培苗可溶性糖含量最高[19];蓝光处理下的碧玉兰×独占春组培苗植株可溶性糖含量显著增加[8];甘蓝型油菜组培苗可溶性糖含量在蓝红组合光下最高,而淀粉含量在R光下最高[31];红光有利于碧玉兰组培苗可溶性糖的合成[12],也有利于菊花组培苗可溶性糖和淀粉的积累[13]。本研究发现,秋葵组培苗叶片中可溶性糖、蔗糖、淀粉和可溶性总碳含量均以BRY处理最高。Kowallik[32]认为,光谱促进碳的代谢和积累,在红光下生长的植物通常具有较高的碳水化合物含量。Saebo等[33]发现,红光通过抑制光合产物从叶片中输出,进而引起淀粉在叶片中的积累。可见,不同光质对不同植物碳水化合物代谢产生了迥异的效应,而本研究中蓝红黄复合光促进了秋葵组培苗碳水化合物的积累。
同时,光质也可以调控组培苗氮代谢。如蓝红复合光质能促进碧玉兰×独占春蛋白质的合成[3];单色蓝光处理下虎雪兰游离氨基酸和可溶性蛋白含量却是最高的,单色红光处理下游离氨基酸和可溶性蛋白含量均最低[3];蓝光有利于碧玉兰组培苗游离氨基酸和可溶性蛋白的合成[3],还能促进菊花组培苗可溶性蛋白的合成[3]。本研究发现,秋葵组培苗叶片中可溶性蛋白、游离氨基酸和可溶性总氮的含量都以BRY处理最高。可见,光质对不同组培苗氮代谢产物的影响是有差异的,本研究中蓝红黄复合光显著促进了秋葵组培苗叶片中氮代谢产物的积累。
综上所述,不同复合光质处理对秋葵组培苗的生长、根系活力、叶片光合色素含量、抗氧化酶活性和光合产物等生理指标产生了不同的影响,蓝红黄复合光(1∶3∶1)能有效促使组培苗快速、健壮生长,并且显著提高了其生长指标、根系活力、叶片光合色素含量、抗氧化酶活性和光合产物等生理指标。因此,在秋葵离体培养时,可以采用蓝红黄复合光(1∶3∶1)作为光源。本研究结果为今后黄秋葵离体培养的光调控措施提供了理论依据和技术支撑。
参考文献:
[1]刘维侠,曹振木,党选民,等. 保健蔬菜黄秋葵遗传育种研究进展[J]. 热带农业工程,2012, 36(6):26-29.
LIUWX,CAOZM,DANGXM, et al.Researchprogressongeneticsandbreedingofokra—avegetableforhealthMaintenance[J]. Tropical AgriculturalEngineering, 2012, 36(6):26-29.
[2]高玲,刘迪发,徐丽. 黄秋葵研究进展与前景[J]. 热带农业科学,2014, 34(11): 22-29.
GAOL,LIUDF,XUL.Researchprogressandprospectsofokra[J]. Chinese Journal of Tropical Agriculture, 2014, 34(11):22-29.
[3]CUIYI,HAHNEJ,KOZAIT, et al.Numberofairexchanges,sucroseconcentration,photosyntheticphotonflux,anddifferencesinphotoperiodanddarkperiodtemperaturesaffectgrowthofRehmannia glutinosaplantletsin vitro[J]. Plant Cell Tissue and Organ Culture, 2000, 62: 219-226.
[4]DEVLINPF,CHRISTIEJM,TERRYMJ.Manyhandsmakelightwork[J]. Journal of Experimental Botany, 2007, 58: 3 071-3 077.
[5]杨其长,徐志刚,陈弘达, 等.LED光源在现代农业的应用原理与技术进展 [J]. 中国农业科技导报, 2011, 13(5): 37-43.
YANGQC,XUZG,CHENHD, et al.Applicationprincipleandtechnologyprogressinusinglight-emittingdiode(LED)lightsourcesinmodernagriculture[J]. Journal of Agricultural Science and Technology, 2011, 13(5): 37-43.
[6]MASSAGD,KIMHH,WHEELERRM, et al.PlantproductivityinresponsetoLEDlighting[J]. HortScience, 2008, 43: 1 951-1 956.
[7]张欢,徐志刚,崔瑾,等. 不同光谱能量分布对菊花试管苗增殖及生根的影响[J]. 园艺学报,2010, 37(10): 1 629-1 636.
ZHANGH,XUZG,CUIJ, et al.EffectsoflightspectralenergydistributiononmultiplicationandrootingofChrysanthemumplantletsinvitro [J]. Acta Horticulturae Sinica, 2010, 37(10): 1 629-1 636.
[8]王丹,杨爱宽,李光宏,等.LED光质对碧玉兰×独占春组培苗生理生化影响[J]. 北方园艺,2014, (16): 61-66.
WANGD,YANGAK,LIGH, et al.TheeffectofLEDlightqualitiesonphysiologicalandbiochemicalCharacteristicsoftheorchidhybrid(Cymbidium lowianum×Cymbidium eburneumLindl)tissuecultureplantlets[J]. Northern Horticulture, 2014, 16: 61-66.
[9]石镇源,唐敏,杨红飞,等.LED不同光质对虎雪兰组培苗生理生化特性影响的研究[J]. 云南农业大学学报(自然科学版),2012, 27(6):863-869.
SHIZY,TANGM,YANGHF,et al.EffectofLEDdifferentlightqualitiesonphysiologicalandbiochemicalcaracteristicsofCymbidium tracyanumvar. huanghua × Cymbidium mastersiitissuecultureseedlings[J]. Journal of Yunnan Agricultural University, 2012, 27(6):863-869.
[10]徐志刚,崔瑾,邸秀茹. 不同光谱能量分布对文心兰组织培养的影响[J]. 北京林业大学学报,2009, 31(4):45-50.
XUZG,CUIJ,DIXR.EffectsofdifferentspectralenergydistributionontissuecultureofOncidium in vitro[J]. Journal of Beijing Forestry University, 2009, 31(4):45-50.
[11]陈星星,邵秀丽,何松林.LED光源不同光质比对白掌组培苗生长的影响[J]. 北方园艺,2015, (6):86-89.
CHENXX,SHAOXL,HESL.EffectofdifferentlightqualityratiosofLEDongrowthofSpathiphyllum in vitro [J]. Northern Horticulture, 2015, 6:86-89.
[12]王亚沉,包崇格,等. 光质对碧玉兰组培苗生长及若干生理指标的影响[J]. 南方农业学报,2013, 44(5):740-744.
WANGYC,BAOCG,et al.EffectsoflightqualityongrowthandseveralphysiologicalindicesofCymbidium lowianumplantlets[J]. Journal of Southern Agriculture, 2013, 44(5):740-744.
[13]邸秀茹,焦学磊,等. 新型光源LED辐射的不同光质配比光对菊花组培苗生长的影响[J]. 植物生理学通讯,2008, 44(4): 661-664.
DIXR,JIAOXL,et al.EffectsofdifferentlightqualityratiosofLEDongrowthofChrysanthemumplantletsin vitro[J]. Plant Physiology Communications, 2008, 44(4):661-664.
[14]JAORH,LAICC, et al.EffectsofredlightonthegrowthofZantedeschiaplantletsin vitroandTuberformationusinglight-emittingdiodes[J]. HortScience, 2005, 40(2): 436-438.
[15]魏星,顾清,戴艳娇,等. 不同光质对菊花组培苗生长的影响[J]. 中国农学通报,2008, 24(12): 344-349.
WEIX,GUQ,DAIYJ,et al.DifferentlightqualitiesongrowthofChrysanthemum(Dendranthemamorifolium)plantletsin virto[J]. Chinese Agricultural Science Bulletin, 2008, 24(12): 344-349.
[16]NHUTDT,HONGLTA,WATANABEH, et al.Growthofbananaplantletsculturtedin vitrounderredandbluelight-emittingdiode(LED)irradiationsource[J]. Acta Horticulturae, 2002, 575: 117-124.
[17]POUDELPR,KATAOKAI,MOCHIOKAR.Effectofredandbluelight-emittingdiodesongrowthandmorphogenesisofgrapes[J]. Plant Cell Tissue and Organ Culture, 2008, 92: 147-153.
[18]HAHNEJ,KOZAIT,PAEKKY.Blueandredlight-emittingdiodeswithorwithoutsucroseandventilationaffectsin vitrogrowthofRehmannia glutinoseplantlets[J]. Plant Biology, 2000, 43: 247-250.
[19]闻永慧,孟英,李慧敏,等.LED不同光质对白及组培苗生长及可溶性糖含量的影响[J]. 北方园艺,2014, 15:58-62.
WENYH,MENGY,LIHM,et al.EffectofLEDdifferentlightqualitiesongrowthandthecontentofsolublesugarofBletiua striatatissuecultureseedlings[J]. Northern Horticulture, 2014,15:58-62.
[20]李合生. 现代植物生理学[M]. 3版.北京: 高等教育出版社,2012, 45-46.
[21]潘瑞炽. 植物生理学[M].北京: 高等教育出版社,2008.
[22]PIAOXC.Effectsofenvironmentalfactorsongrowth,tuberizationandphotosyntheticcharacteristicsofin vitroandhydroponicallygrownpotatoes[D].ChungbukNationalUniversity,Cheongju,SouthKorea, 2002.
[23]蔡永萍. 植物生理学[M]. 北京: 中国农业大学出版社,2008.
[24]STUEFERJF,HUBERH.Differentialeffectsoflightquantityandspectrallightqualityongrowth,morphologyanddevelopmentoftwostoloniferousPotentillaspecies[J]. Oecologia, 1998, 117:1-8
[25]杨雅婷,程瑞峰,杨其长,等.LED光源不同R/B处理对甘薯组培苗品质及节能效果的影响[J]. 中国农业气象,2010, 31(4):546-550.
YANGYT,CHENGRF,YANGQC, et al.EffectsofLEDlightqualityR/Bratiotoqualityofsweetpotatoplantletsinvitroandenergysaving[J]. Chinese Journal of Agrometeorology, 2010, 31(4):546-550.
[26]童哲,赵玉锦,王台,等. 植物的光受体和光控发育研究[J]. 植物学报,2000, 42(2):111-115.
TONGZ,ZHAOYJ,WANGT, et al.Photoreceptorsandlight-regulateddevelopmentinplants[J]. Acta Botanica Sinica, 2000, 42(2):111-115.
[27]文锦芬,柯学,徐超华,等. 光质对烟草叶片生长发育过程中抗氧化系统的影响[J]. 西北植物学报,2011, 31(9):1 799-1 804.
WENJF,KEX,XUCH, et al.Effectsoflightqualityonantioxidantdefensesystemduringgrowthanddevelopmentoftobaccoleaves[J]. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(9): 1 799-1 804.
[28]苏俊,刘昳雯,杨凡,等. 不同光质对烟草组培苗生长及生理特性的影响[J]. 西北植物学报,2014, 34(6): 1 206-1 212.
SUJ,LIUYW,YANGF, et al.Effectofdifferentlightqualitiesonphysiologicalcharacteristicsandgrowthoftobaccoin vitrounderlightemittingdiodes(LEDs) [J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(6): 1 206-1 212.
[29]郝俊江,陈向东,兰进. 光质对灵芝生长及抗氧化酶系统的影响[J]. 中草药,2011, 42(12):2 529-2 534.
HAOJJ,CHENXD,LANJ.EffectoflightongrowthinGanoderma lucidumandanti-oxidativeenzymeactivities[J]. Chinese Traditional and Herbal Drugs, 2011, 42(12):2 529-2 534.
[30]王虹,姜玉萍,师恺,等. 光质对黄瓜叶片衰老与抗氧化酶系统的影响[J]. 中国农业科学,2010, 43(3):529-534.
WANGH,JIANGYP,SHIK,et al.Effectsoflightqualityonleafsenescenceandactivitiesofantioxidantenzymesincucumberplants[J]. Scientia Agricultura Sinica, 2010, 43(3):529-534.
[31]LIHM,TANGCM,XUZG.EffectoflightemittingdiodesongrowthandmorphogenesisofRapeseed(Brassica napusL)plantletsin vitro [J]. Scientia Horticulturae, 2013, 150: 117-124
[32]KOWALLIKW.Bluelighteffectsonrespiration[J]. Plant Physiology, 1982, 33: 51-72.
[33]SAEBOA,KREKLINGT,APPELGRENM.Lightqualityaffectsphotosynthesisandleafanatomyofbirchplantletsin vitro [J]. Plant Cell Tissue and Organ Culture, 1995, 41: 177-185.
(编辑:裴阿卫)
GrowthandPhysiologicalCharacteristicsofAbelmoschus esculentusPlantletsin vitrounderDifferentQualityLights
LIHuimin
(CollegeofLifeScience,AnhuiScienceandTechnologyUniversity,Fengyang,Anhui233100,China)
Abstract:Shoot apical bud cuttings of okra cultivar‘Qingfu’ in vitro (1.0 cm) were transplanted on MS basal medium supplemented with 0.05 g·L-1naphthalene acetic acid (NAA) and cultured under eight different quality lights: fluorescent lamp (CK), four mixture blue plus red light emitting diodes (BR3∶1,BR1∶1,BR1∶3,BR1∶4LEDs), blue, red plus yellow (BRY=1∶3∶1) LEDs, blue, red plus green (BRG=1∶3∶1) LEDs, blue, red plus far-red (BRFR=1∶3∶1) LEDs. The objective of present study was to determine the effects of different LEDs lights on the growth and physiological characteristics of okra (Abelmoschus esculentus) plantlets, and screen for optimal quality of okra plantlets in vitro in order to provide theoretical guidance and technical support of okra rapid propagation in vitro. The results showed that. (1) fresh mass, dry mass, root length, stem length and stem width were the greatest in plantlets cultured under BRY LEDs light; (2) root activity showed significantly higher in plantlets cultured under different lights than that of CK, and the highest was under BRY LEDs; Photosynthetic pigments were the highest in plantlets cultured under BRY LEDs, and which were also higher than that of other treatments; (3) the activities of SOD, POD and CAT were the greatest in plantlets cultured under BRY LEDs, and the lowest was that of CK; (4) the concentrations of soluble sugar, sucrose, soluble carbon and starch were the greatest in seedlings under BRY LEDs treatment, followed by BRG, and the lowest under CK; The concentrations of soluble protein, free amino acid and soluble nitrogen were the greatest in seedlings under BRY treatment, followed by BRG, and the lowest under CK. The present results indicated that larger and healthy plantlets and greater biomass of okra were produced in the presence of BRY (1∶3∶1) LEDs light. BRY light significantly promoted the root activity, photosythetic pigment content, antioxidant enzyme activities, carbon and nitrogen metabolism and accumulation of photosynthetic product of okra plantlets, which was the preferred light quality for the okra in vitro culture system.
Key words:mixture quality; okra; plantlet; physiological characteristics; in vitro
文章编号:1000-4025(2016)05-0996-08
doi:10.7606/j.issn.1000-4025.2016.05.0996
收稿日期:2016-01-09;修改稿收到日期:2016-05-17
基金项目:安徽省高校省级自然科学研究重点项目(KJ2014A053); 安徽科技学院重点学科(AKZDXK2015C05)
作者简介:李慧敏(1981-),女,博士,讲师,主要从事作物栽培生理与设施环境调控的相关研究工作。E-mail: hmli0621@163.com.
中图分类号:Q945.79
文献标志码:
