不同耐铬性青菜中Cr6+的亚细胞分布及其耐性机理
2016-07-04张海敏杨文嘉王庆亚孙建云
张海敏,杨文嘉,王庆亚,孙建云
(南京农业大学 生命科学学院,南京210095)
不同耐铬性青菜中Cr6+的亚细胞分布及其耐性机理
张海敏,杨文嘉,王庆亚,孙建云*
(南京农业大学 生命科学学院,南京210095)
摘要:为探明青菜对Cr6+的吸收及其耐性机理,选取2个不同耐铬(Cr)性青菜品种‘美加华’(Cr耐性品种)和‘三月慢’(Cr敏感品种)进行水培试验,比较0、10、50和100 μmol·L-1Cr6+处理下青菜地上部和根系Cr含量、Cr的亚细胞分布、非蛋白巯基(NPT)、植物螯合肽(PCs)和抗氧化酶活性的差异。结果表明:(1)2个青菜品种地上部Cr含量显著小于根系的含量,且‘美加华’根系Cr含量、Cr的根系滞留率、地上部和根系细胞壁中Cr含量与总Cr含量的比值均显著大于‘三月慢’,而其可溶性Cr含量与总Cr含量的比值显著小于‘三月慢’。(2)Cr6+处理显著增加了青菜地上部NPT和PCs的含量,且‘美加华’增加的幅度显著高于‘三月慢’。(3)低浓度的Cr6+(10 μmol·L-1)能够提高青菜SOD、POD和CAT的活性,且‘美加华’的增幅大于‘三月慢’;而高浓度的Cr6+(100 μmol·L-1)显著降低了SOD、POD和CAT的活性,且‘美加华’的降幅小于‘三月慢’。研究认为,在Cr6+胁迫条件下,与青菜品种‘三月慢’相比品种‘美加华’能将更多的Cr分布于根和细胞壁中,减少了跨膜进入细胞内的Cr,并且具有较高的抗氧化酶活性和PCs含量,从而表现出更强的耐Cr6+性。
关键词:青菜; Cr6+; 亚细胞分布; 非蛋白巯基; 抗氧化酶
随着电镀、印染、石油化工、油漆和涂料等工业的迅速发展,导致含有大量重金属铬(Cr)的废水、废渣排出,致使空气、土壤、水体和生物遭到不同程度的Cr污染[1]。Cr在自然条件下有多种价态,其中Cr3+和Cr6+最为稳定和最为常见。Cr6+毒性比Cr3+高100倍,是一种很强的致畸、致突变剂,因此它被国际公认为3种致癌金属物之一[2]。在自然环境中,Cr6+常以Cr2O72-和CrO42-形式存在。过量Cr能降低植物对水和营养元素的吸收,抑制植株生长,严重时可导致植株死亡,并且Cr可以通过食物链危害人类健康[3-4]。青菜(Brassica chinensisL.)又称小白菜,是中国大众化的蔬菜之一,在蔬菜周年供应中占有重要地位。因此,研究青菜对Cr的吸收以及耐性机制具有重要意义。
Cr进入植物体内后,主要富集在植物根部,被限制运输到植物茎叶,但是植物对Cr的吸收和积累在物种和品种上存在显著差异[5]。植物对Cr的束缚力决定于细胞壁对Cr的固定和液泡对Cr的钝化[6]。细胞壁是重金属进入细胞内的第一道屏障,重金属穿过细胞壁时,与细胞壁上的纤维素、半纤维素和果胶等大分子物质发生化学反应而被固定下来[7]。当重金属在植物细胞壁上达到饱和后,进入细胞内的重金属能与大量的有机配位体(螯合物、蛋白质等)结合形成稳点的螯合物,并被运送至液泡中储藏,降低细胞内的自由重金属离子的浓度,从而降低其毒性[8]。这些金属络合体主要包括有机酸、氨基酸及其衍生物、金属硫蛋白(MTs) 和植物螯合肽(PCs)等[9]。不同植物种类或品种对重金属的耐性有很大差异,其对重金属的耐性机制也有所不同。目前,Cr在其它植物中的吸收及其耐性机理研究较多,而关于青菜对Cr的吸收以及耐性机理的报道并不多见。本研究以耐Cr性不同的2个青菜品种为试材,研究Cr在青菜体内的亚细胞分布和Cr6+对非蛋白巯基含量、抗氧化酶活性的影响,旨在明确2个青菜品种对Cr的吸收及生理响应的差异,探讨植物耐Cr6+机理,为无公害蔬菜的选育及栽培提供理论依据。
1材料和方法
1.1实验材料
通过前期实验比较了Cr6+对41个青菜品种干物质重抑制的差异,筛选出2个耐Cr6+性不同的青菜品种‘美加华’(Cr6+耐性品种)和‘三月慢’(Cr6+敏感品种),并以这2个品种为试材。青菜种子均购自江苏省农业科学院。
1.2实验设计
挑选大小一致的种子经5%NaClO消毒5min,冲洗干净后将种子均匀平铺在干净湿润的纱布上,放入光照培养箱避光萌发,昼夜温度分别为24 ℃和20 ℃。露白后将种子转入装有黄沙的周转箱中继续生长,10d后挑选长势一致的幼苗移植在含5L营养液的培养钵中培养,每培养钵移苗20棵。培养液为Hoagland营养液。先用1/2Hoagland营养液培养3d,再用全Hoagland营养液培养,保持通气,每2d更换1次营养液,每天用HCl调节pH在5.1左右[10]。四叶一心时选取长势一致的幼苗进行不同浓度铬处理。Cr处理浓度 [以Cr6+计] 设置0、10、50、100μmol·L-1等4个水平,每个处理浓度设置3个重复。Cr6+以重铬酸钾(K2Cr2O7)形式添加到营养液中,自然光照。处理10d后收获,测定各项指标。
1.3测定项目与方法
1.3.1生物量每处理分别取4株,将其根系置于10%EDTA-Na2的溶液中浸泡30min,取出,用自来水和去离子水彻底清洗,将地上部和根系分开,105 ℃杀青, 70 ℃烘箱中烘干至恒重,称重。
1.3.2Cr含量将干样磨成粉,再用硝酸和双氧水(4∶1)消煮,采用火焰原子吸收光谱法测定Cr含量。
1.3.3Cr的亚细胞分布准确称取冷冻鲜样1g,加10mL提取液[0.25mol/L蔗糖+50mmol/LTris-HCl缓冲液(pH7.5)+lmmol/L赤鲜糖醇],冰浴研磨至匀浆,然后用差速离心法[11]将样品分为细胞壁(F1)、细胞器(F2)和细胞可溶部分(F3),以硝酸和双氧水(4∶1)消煮,采用火焰原子吸收光谱法测定Cr含量。
1.3.4非蛋白巯基(NPT)含量取0.5g植物鲜样,加5.0mL预冷的0.15%(W/V)抗坏血酸钠溶液,冰浴研磨至匀浆,冰浴30min,然后离心(20 000×g,4℃)20min,取上清液为样液。参照KumariBhoomika[12]方法测定非蛋白巯基(NPT)含量。
1.3.5谷胱甘肽(GSH)和植物螯合肽(PCs)含量取1g植物鲜样,加5.0mL预冷的10% (W/V) 三氯乙酸,冰浴研磨至匀浆,然后离心(15 000×g,4 ℃) 15min,取上清液为待测样液。参照HamidHassanpour[13]方法测定。
PCs含量=NPT含量-GSH含量[14]
1.3.6丙二醛含量丙二醛(MDA) 含量采用硫代巴比妥反应法[15]测定。
1.3.7抗氧化酶活性称取青菜鲜样0.5g,加入5mL0.1mmol·L-1的磷酸缓冲液(pH7.0,内含0.1mmol·L-1EDTA、1%PVP),冰浴研磨至匀浆,然后离心(15 000×g,4 ℃)15min取得酶粗液,参照陈柳君[16]方法测定SOD、POD、CAT活性。
1.3.8Cr耐受性计算根系对重金属的滞留率[17](Retentionrate,%)=(地下部分重金属含量—地上部分重金属含量)/地下部分重金属含量×100%
转移率(Translocationratio,%)=(地上部分Cr含量/根系Cr含量)×100%
1.4数据处理和作图
采用SPSS13.0和Excel软件对实验数据进行方差分析和显著性测验。采用Sigmaplot10.0 作图。
2结果与分析
2.1Cr6+处理对青幼苗菜生物量的影响
由表1可见,Cr6+处理显著降低了2个青菜品种幼苗地上部和根系的干物质重,且随着Cr6+处理浓度的增加,降低程度越来越明显(P<0.05)。与对照相比,10~100μmol·L-1Cr6+处理下,地上部和根系各处理平均抑制率,‘美加华’分别为32.6% 和35.3%,‘三月慢’分别为 56.5%和52.5%,Cr6+胁迫对‘三月慢’生长的抑制更为明显,品种间差异显著(P<0.05)。同时,从冠根比(地上部/根系)看,与对照相比,‘美加华’在100μmol·L-1Cr6+胁迫下显著增加,表明Cr6+对‘美加华’根系的抑制程度超过地上部,而‘三月慢’则在50μmol·L-1Cr6+胁迫下显著降低,表明‘三月慢’根系对Cr6+的耐性大于地上部。
2.2青菜幼苗对Cr6+的吸收和积累特征
由表2可见,2个青菜品种地上部和根系Cr含量均随着Cr6+处理浓度的增加而显著增加(P<0.05)。10~100μmol·L-1Cr6+处理下,地上部和根系中的Cr含量各处理平均值,‘美加华’分别为115.5和2 791.3mg·kg-1,‘三月慢’分别为145.2和2 261.0mg·kg-1,在相同浓度的Cr6+处理下,
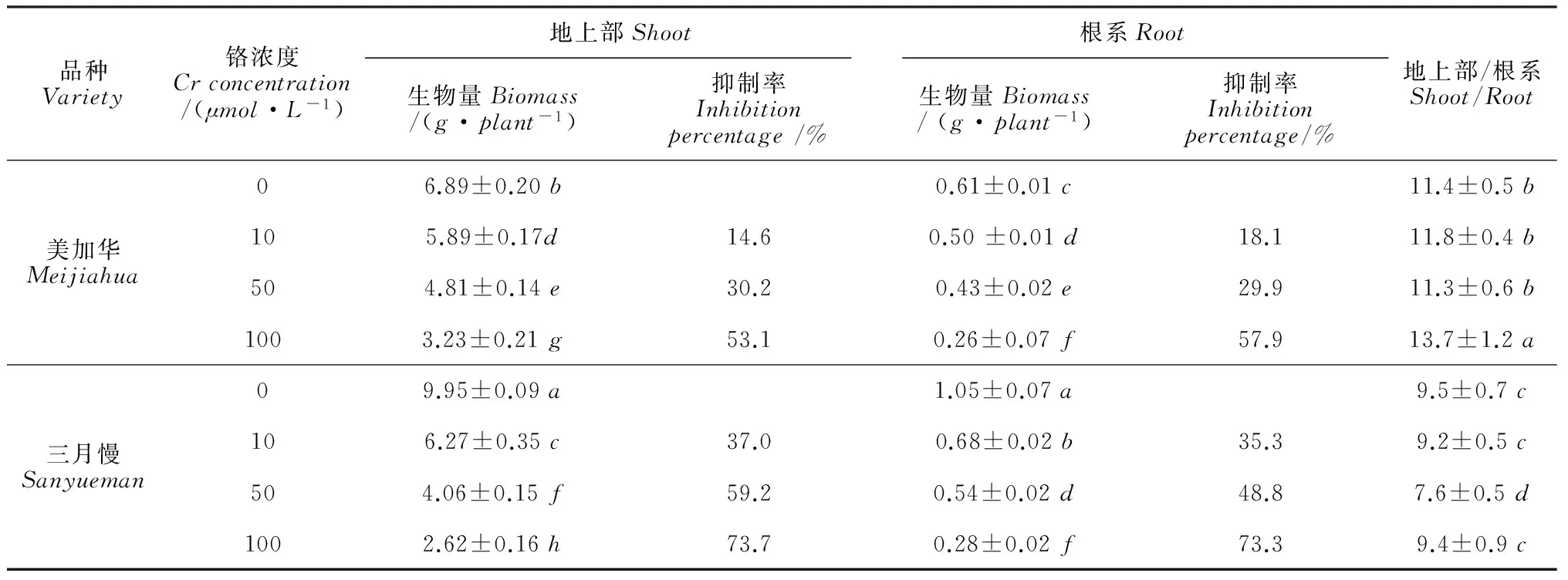
表1 Cr6+处理对青菜生物量的影响
注:同列中不同字母表示差异达显著水平(P<0.05);生物量以干重计。
Note:Differentlettersinthesamecolumnindicatesignificantdifferenceat0.05level;Thebiomassisdryweight.
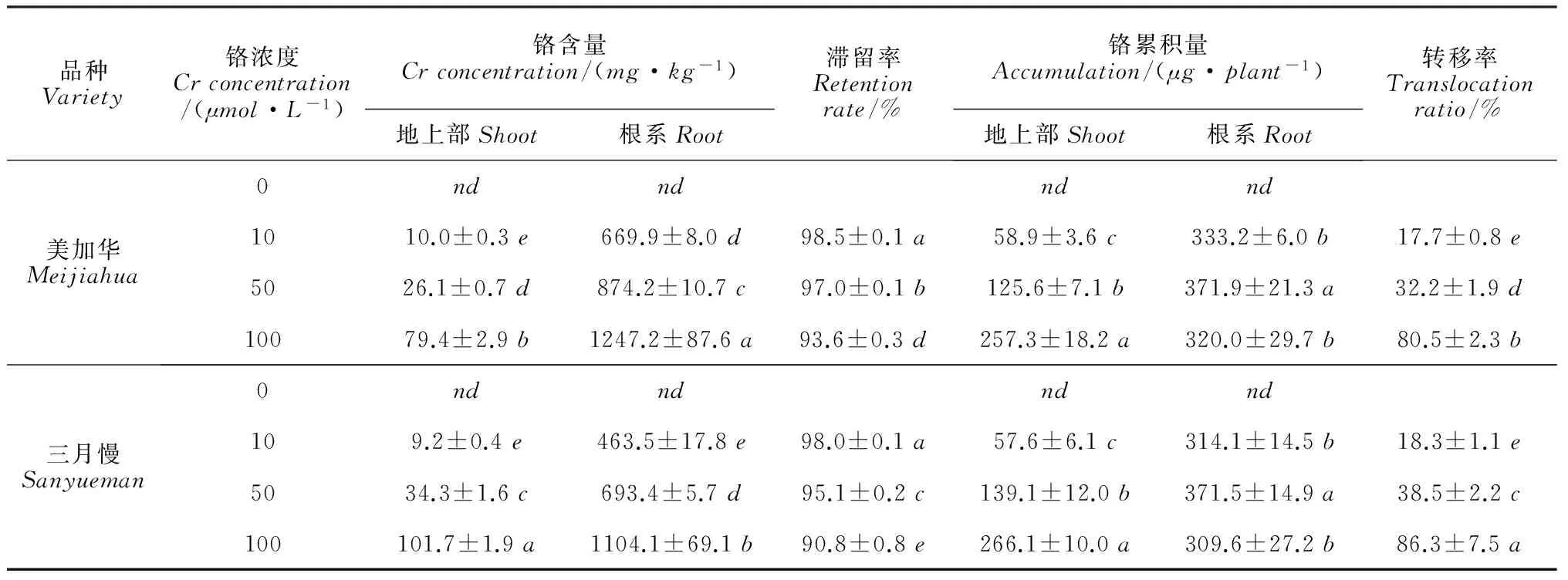
表2 青菜Cr的含量、滞留率、累积量和转移率
注:nd表示没有检测到。同列中不同字母表示差异达显著水平(P<0.05);铬含量以干重计。
Note:ndindicatesnotdetectable.Differentlettersinthesamecolumnindicatesignificantdifferenceat0.05level;TheCrcontentcalculatesbydryweight.
‘美加华’根系中的Cr含量均显著高于‘三月慢’,而地上部中的Cr含量显著低于‘三月慢’(10μmol·L-1除外;P<0.05);2个青菜品种根系Cr含量远远高于地上部(P<0.01),表明根系对Cr有较强的滞留作用。同时,2个青菜品种Cr的滞留率随着Cr6+处理浓度的增加而显著降低(P<0.05)。10~100μmol·L-1Cr6+处理下,‘美加华’和‘三月慢’滞留率各处理平均值分别为96.4%和94.6%,且在50 和100μmol·L-1Cr6+处理下,‘美加华’滞留率显著高于‘三月慢’(P<0.05)。另外,2个青菜品种Cr的转移率和地上部Cr累积量都随着Cr6+处理浓度的增加而显著增加(P<0.05)。10~100μmol·L-1Cr6+处理下,Cr的转移率各处理平均值在‘美加华’和‘三月慢’中分别为43.5%和46.8%,且在50 和100μmol·L-1Cr6+处理下,‘美加华’Cr转移率显著小于‘三月慢’(P<0.05),而两品种Cr的累积量在相同浓度Cr6+处理下差异不显著(P>0.05);两品种青菜根系Cr累积量也明显高于地上部。以上结果说明Cr被青菜吸收后,主要滞留在根系,且‘美加华’具有更强的阻遏Cr向地上部转运的能力,从而更好的保护青菜不受或减轻Cr毒害。
2.3Cr在青菜亚细胞组分中的分布特征
由表3可见,青菜亚细胞的细胞壁(F1)、细胞器(F2)和细胞可溶性(F3)组分中Cr含量(总铬含量)均随Cr6+处理浓度的升高而显著增加。在50和100μmol·L-1Cr6+处理下,‘美加华’地上部和根系细胞壁组分(F1)中的Cr含量分别是相同Cr6+处理浓度下‘三月慢’的1.56倍、1.44倍和1.48倍、1.44倍,而其细胞可溶性组分(F3)中的Cr含量分别是相同Cr6+处理浓度下‘三月慢’的0.37倍、0.83倍和0.36倍、0.82倍,品种间差异显著(P<0.05),细胞器组分(F2)中的Cr含量,‘美加华’地上部分别是相同Cr6+处理浓度下‘三月慢’的0.40倍和0.60倍,显著低于‘三月慢’,而其根系则是相同Cr6+处理浓度下‘三月慢’的1.68倍和1.86倍,显著高于‘三月慢’。Cr在青菜各亚细胞组分中分布的比例上,2个品种存在显著的差异(P<0.05)。其中,地上部分布比例在‘美加华’表现为F1>F3>F2,而在‘三月慢’则是F3>F1>F2;在2个品种根系中分布比例情况相似,均是F1中最高,F2中最低。在相同的Cr6+处理浓度下,Cr在‘美加华’地上部和根系细胞壁组分(F1)中(50μmol·L-1浓度除外)的分配比例显著高于‘三月慢’,而在可溶性组分(F3)中的分配比例显著低于‘三月慢’(P<0.05);Cr在细胞器中所占的比例,‘美加华’地上部显著低于‘三月慢’,而其根系(100μmol·L-1Cr6+处理下)中显著高于‘三月慢’(P<0.05)。以上结果说明‘美加华’的细胞壁具有更强的积累Cr的能力,减少了进入细胞内的Cr,从而表现出更强的耐Cr6+性。
2.4Cr6+处理对青菜非蛋白巯基含量的影响
如图1所示,随着Cr6+处理浓度的增加,2个青菜品种地上部非蛋白巯基含量均呈先增高后降低的趋势,并在50μmol·L-1Cr6+处理下出现最大值,随后下降,但仍显著高于对照(P<0.05);而它们根系中非蛋白巯基含量在Cr6+处理前后均没有显著变化(P>0.05)。与对照相比,10~100μmol·L-1Cr6+处理下,地上部非蛋白巯基含量增幅在‘美加华’中为51.7%~114.9%,平均为85.9%,而在‘三月慢’中增幅范围为44.6%~97.8%,平均为66.4%,‘美加华’增幅显著高于‘三月慢’,品种间差异显著(P<0.05)。相同浓度Cr6+处理下,2品种根系中非蛋白巯基含量差异不显著(P>0.05)。
同时,2个青菜品种地上部和根系中谷胱甘肽(GSH)的含量随Cr6+处理浓度的增加而逐渐降低,且处理间的差异大多达到显著水平(P<0.05)。与对照相比,10~100μmol·L-1Cr6+处理下,地上部和根系中GSH含量,‘美加华’降幅范围为16.9%~46.7%和22.9%~63.8%,平均为28.2%和46.6%,‘三月慢’降幅范围为34.4%~77.4%和37.1%~ 78.8%,平均为56.3%和59.4%,‘美加华’降幅显著低于‘三月慢’,且品种间差异显著(P<0.05)。
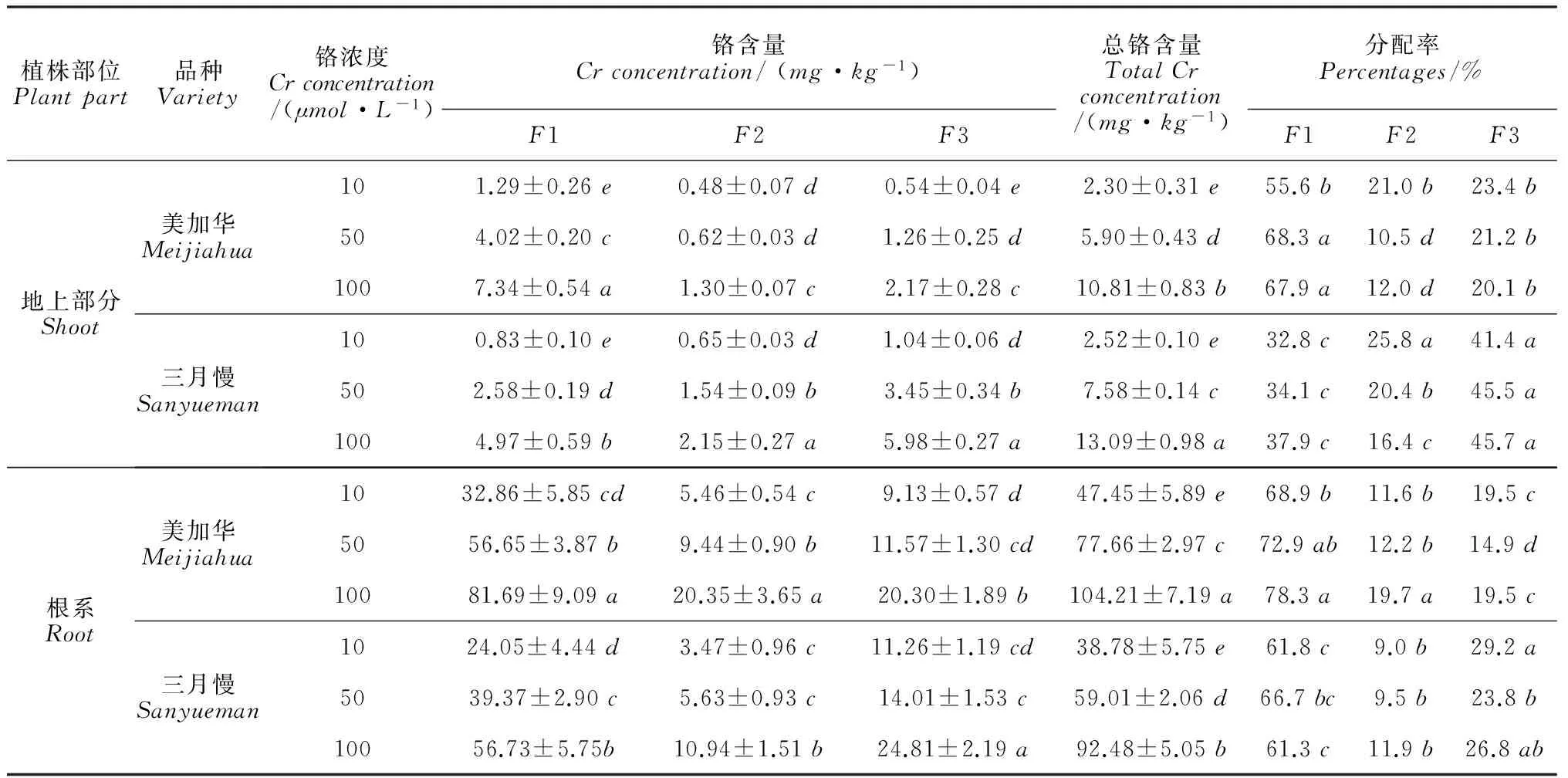
表3 Cr6+ 处理下2个青菜品种亚细胞组分中Cr含量及其分配比例
注:同列中同一植株部位不同字母表示差异达显著水平(P<0.05)。 铬含量以鲜重计。F1为细胞壁组分;F2为细胞器组分;F3为细胞可溶性组分。
Note:Differentlettersofthesameplantsiteinthesamecolumnindicateasignificantdifferenceat0.05level.TheCrcontentcalculatesbyfreshweight.Cellswereseparatedintodifferentfractions:cellwall(F1),organelle(F2),solublefraction(F3)bygradientcentrifugationtechniqueat4 ℃.
另外,与对照相比,10~100μmol·L-1Cr6+处理显著增加了2个青菜品种地上部和根系内植物螯合肽(PCs)的含量,其增幅范围分别为115.9%~267.2%和52.1%~100%。地上部的增幅显著大于根系(P<0.05)。两品种地上部中PCs的含量在50μmol·L-1Cr6+处理下达到最大值。50和100μmol·L-1Cr6+处理下,‘美加华’地上部PCs的含量分别比对照增加242.2%和219.9%,‘三月慢’分别增加267.1%和203.5%,‘美加华’的含量显著高于相同Cr6+处理浓度下‘三月慢’的含量(P<0.05);2个品种根系内PCs的含量在相同浓度Cr6+处理下无显著差异(P>0.05)。
综合以上分析可知Cr6+诱导了青菜体内PCs和NPT的合成,且‘美加华’地上部能合成更多含巯基物质与Cr螯合,这也许是其具有较强解毒能力的原因之一。
2.5Cr6+处理对青菜MDA含量和抗氧化酶活性的影响
首先,随着Cr6+处理浓度的增加,2个青菜品种地上部和根系MDA含量都呈上升趋势(图2)。两品种地上部的MDA含量在低浓度(10μmol·L-1)Cr6+处理下与对照均无显著差异,而在中、高浓度(50、100μmol·L-1)Cr6+处理下均比对照显著增加,‘美加华’和‘三月慢’增幅范围分别为12.1%~24.1%和21.9%~43.3%,‘美加华’的增幅显著低于同处理浓度下‘三月慢’的增幅(P<0.05)。2品种根系中MDA含量在Cr6+处理下均比对照显著增加,‘美加华’和‘三月慢’在10~100μmol·L-1Cr6+处理下的增幅范围分别为6.3%~47.4%和11.9%~64.8%。在相同浓度Cr6+处理下,‘三月慢’植株内(地上部和根系)MDA含量均显著高于‘美加华’的含量(P<0.05)。
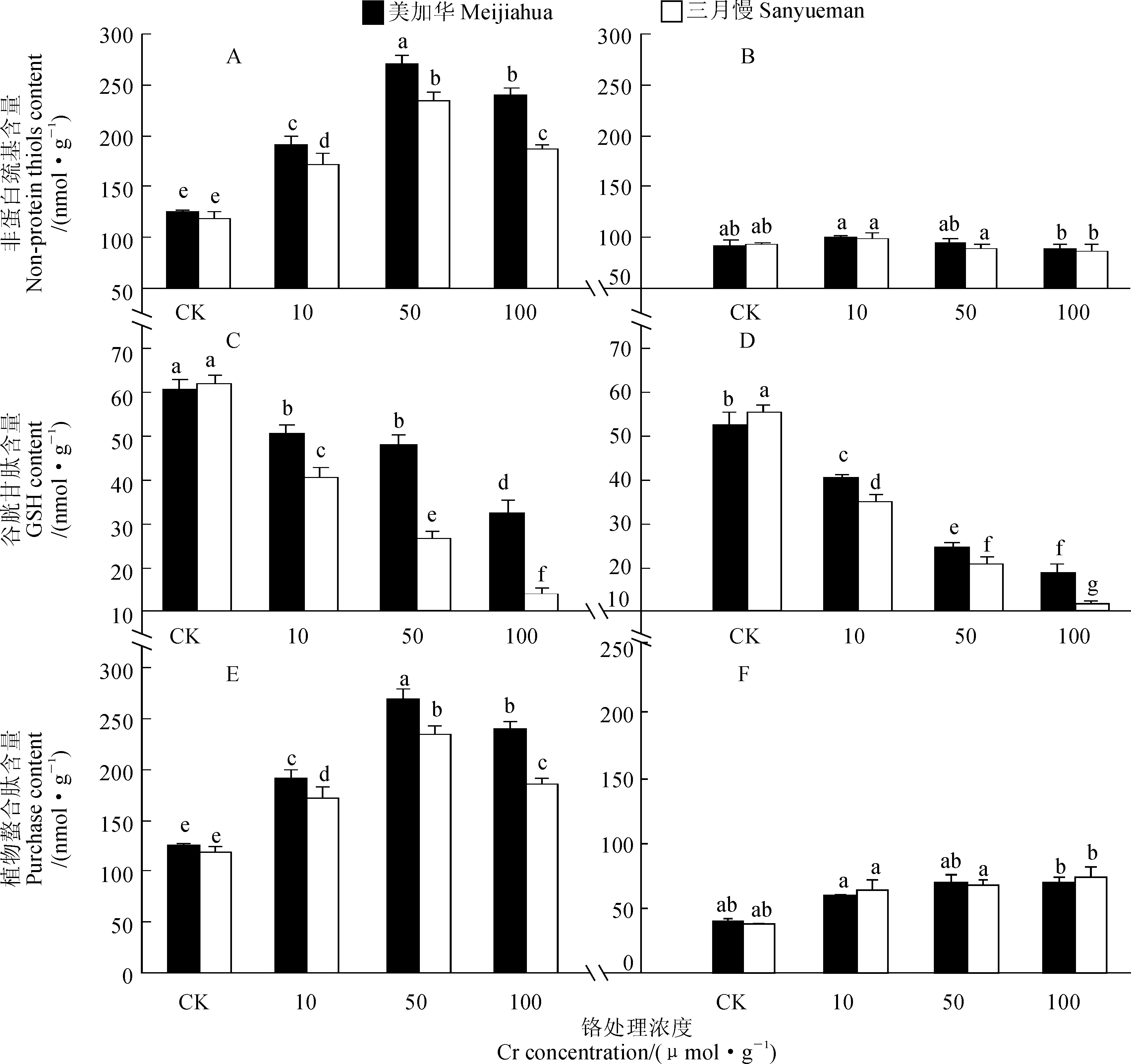
图1 Cr6+处理对青菜地上部(A、C、E)和根系(B、D、F)中非蛋白巯基、谷胱甘肽和植物螯合肽含量的影响Fig. 1 Effects of Cr treatments on non-protein thiols, GSH and PCs contents in shoots (A,C,E) and roots (B,D,F) of B. chinensis
其次,与对照相比,随着Cr6+处理浓度的增加,2个青菜品种地上部和根系SOD活性呈先增高后降低的趋势,并在50μmol·L-1(地上部)和10μmol·L-1(根系)Cr6+处理下达到最大值,此时‘美加华’增幅分别是35.7%(地上部)和7.9%(根系),‘三月慢’增幅分别是21.2%(地上部)和4.6%(根系)。随后,2个青菜品种地上部和根系SOD活性均下降,但至100μmol·L-1Cr6+处理时,地上部的SOD活性仍显著高于对照(‘美加华’增幅为28.0%,‘三月慢’增幅为9.0%),而根系则显著低于对照(‘美加华’降幅为8.8%,‘三月慢’降幅为67.8%)。在10~100μmol·L-1Cr6+胁迫处理下,‘美加华’地上部和根系(除10μmol·L-1Cr6+外)内SOD活性均显著高于相同浓度下‘三月慢’的活性(P<0.05)。
再次,与对照相比,2个青菜品种地上部和根系中POD活性随着Cr6+处理浓度的增加均呈先增高后降低的趋势,且‘三月慢’和‘美加华’地上部酶活性分别在10和50μmol·L-1Cr6+处理下达到最大值,而它们根系中酶活性均在10μmol·L-1Cr6+时达到最大值(‘三月慢’增幅为42.1%,‘美加华’增幅为56.4%);随后下降,但至100μmol·L-1Cr6+处理时,2个品种地上部和根系中酶活性仍显著高于对照(‘美加华’地上部和根系增幅分别是33.3%和 33.9%,‘三月慢’相应增幅则分别是13.2%和12.4%)。在10~100μmol·L-1Cr6+处理下,‘美加华’植株内(地上部和根系)POD活性均显著高于相同浓度下‘三月慢’的活性(P<0.05)。
另外,与对照相比,2个青菜品种地上部和根系中CAT活性均随着Cr6+处理浓度的增加也呈先增高后降低的趋势,并在50μmol·L-1(地上部)和10μmol·L-1(根系)Cr6+处理下出现最大值(‘美加华’地上部和根系增幅分别是27.4 %和138%,‘三月慢’相应增幅分别是17.7%和87.4%),随后下降,至100μmol·L-1Cr6+时,‘三月慢’地上部和根系中酶活性已显著低于对照,而‘美加华’地上部中CAT活性仍显著高于对照。在10~100μmol·L-1Cr6+处理下,‘美加华’地上部和根系内CAT活性均显著高于相同浓度下‘三月慢’的活性(P<0.05)。
以上结果说明‘美加华’植株在Cr6+胁迫条件下具有更强的清除ROS的能力,以降低Cr对植物造成的氧化胁迫,这也是其耐Cr6+较强的机理之一。
3结论与讨论
Cr是植物生长的非必需元素。进入体内的Cr6+对所有生物都有毒害[1]。Cr6+能够抑制植物根系细胞的分裂,阻碍水分吸收,从而抑制根的生长,进而导致植株叶片泛黄,植物的光合作用、呼吸作用等各种生理代谢发生紊乱,最终导致生物量降低[4]。本研究表明,与对照相比,Cr6+处理显著降低了青菜地上部和根系的生物量,表明Cr6+对青菜植株产生毒害作用;在相同浓度Cr6+处理下,‘美加华’地上部和根系生长的受抑程度均显著小于‘三月慢’,表明‘美加华’对Cr6+胁迫具有较强的抗性机制。
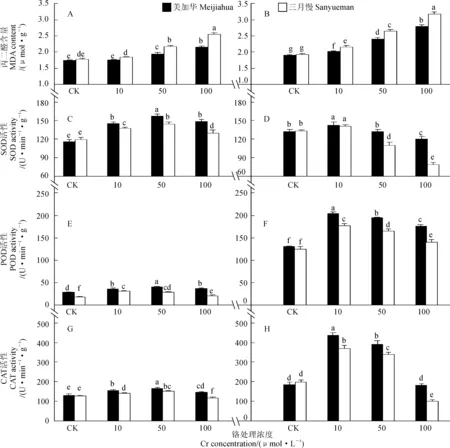
图2 Cr6+ 处理对青菜地上部(A、C、E、D)和根系(B、D、F、H)中MDA的含量及SOD、POD和CAT活性的影响Fig. 2 Effects of Cr6+ treatments on the MDA content and the activities of SOD, POD and CAT in shoots (A,C,E,D) and roots (B,D,F,H) of B. chinensis
植物对各种重金属的抗性机制不尽相同,但总体上看,一般通过两条基本途径实现:一是金属外部排斥机制,即避免过量有毒重金属被吸收进入植物细胞,或者阻碍重金属在植物体内的运输;另一途径是内部耐受机制,即重金属在植物体内以不具生物活性的解毒形式存在,如结合到细胞壁上、主动运输进入液泡、或与某些有机酸和蛋白质结合等[4]。本实验发现,Cr被青菜吸收后,主要滞留在根系,向地上部运输较少,属于典型的外部排斥机制。与‘三月慢’相比,耐性品种‘美加华’根系对Cr的滞留率更高,表明其具有更强的阻遏Cr向地上部转运的能力,从而较好地保护青菜不受或减轻Cr毒害。
除排斥机制外,植物细胞内的耐受机制在植物抗重金属胁迫中也起重要作用。其中将有毒离子区室化是细胞内重要的解毒途径之一,而细胞壁和液泡是区室化的两个主要位点[11]。本实验中,在Cr亚细胞分布上,10~100μmol·L-1Cr6+处理青菜根系和地上部(‘三月慢’除外)细胞壁组分所占的比例平均在60%以上(表3),表明细胞壁在青菜耐Cr6+毒中起重要作用。这与刘婷婷和Zhu等[18-19]研究结果一致。同时,耐性品种‘美加华’,无论根系和地上部,在相同的Cr6+处理浓度下,其细胞壁上的Cr含量均显著高于敏感品种‘三月慢’,结果暗示了‘美加华’的细胞壁具有更强的积累Cr的能力,从而减少了进入细胞内的Cr,这也许是其具有较强耐Cr6+毒害的原因之一。然而,在本实验青菜总Cr含量中,约有60%(‘三月慢’地上部)和30%(‘美加华’地上部和根系及‘三月慢’根系)的Cr通过细胞壁进入原生质内(表3)。其中,约20%(‘美加华’地上部和根系及‘三月慢’根系)和40%的(‘三月慢’地上部)Cr分布在可溶态中。可溶态主要是指液泡[20]。植物通过将细胞质中的Cr转运并储藏在液泡中,降低Cr在细胞内的离子活度,避免Cr对其它细胞器生理功能的干扰[21]。
进入到原生质内的有毒金属离子能被区室化在液泡中,细胞内的有机配体发挥了重要作用。这些有机配体包括氨基酸、有机酸和富含半胱氨酸的多肽,它们可与金属离子螯合,然后将其转运至液泡内储存。非蛋白巯基(NPT)富有半胱氨酸残基(-SH),其 -SH可与金属离子螯合。植物螯合肽(phytochelatins,PCs)属于NPT,其与重金属络合被广泛认为是植物细胞内解除重金属毒害的重要机制[22]。有研究表明,Cr6+增加了P.stratiotes 根中半胱氨酸(PCs的组成成分)的含量[23]。在本研究中,10~100μmol·L-1Cr6+浓度下,青菜地上部NPT含量和PCs含量均显著高于对照组,且‘美加华’增加的幅度更大,表明Cr6+诱导了青菜体内PCs和NPT的合成,且‘美加华’地上部能合成更多含巯基物质与Cr螯合,这也许是其具有较强解毒能力的另一原因。GSH是PCs合成的底物,由PC合成酶催化产生[24]。受到重金属胁迫后,GSH含量由于PCs的合成而下降在多种植物中都有报道[25]。本实验中,虽然我们观察到2个青菜品种根系和叶片中GSH的含量由于PCs的合成而逐渐下降,但增加的PCs的含量远高于减少的GSH,说明Cr6+能刺激新的GSH的合成。在Cr6+胁迫处理下,与对照相比,2个青菜品种GSH的含量均呈下降的趋势,但‘三月慢’下降的幅度更为明显,这可以部分解释‘三月慢’和‘美加华’的耐Cr6+性差异。GSH除了可以螯合植物体内的重金属外,它也是一种很重要的低分子抗氧化剂,与SOD、POD和CAT等抗氧化酶一起构成植物的抗氧化系统,防御活性氧的伤害,维持细胞的正常生命活动[26]。
当进入细胞内的金属离子超过了细胞内有机配体对其的螯合能力时,游离的金属离子会引起细胞内的氧化胁迫。Cr可以诱导产生过量的活性氧自由基(ROS),它们与核酸、脂膜、蛋白质、氨基酸等发生反应,引起不可逆的伤害及细胞死亡[27]。MDA是膜中不饱和脂肪酸分解的产物之一,被认为是反映植物在逆境环境下细胞膜过氧化程度的重要指标。SOD、CAT、POD是植物体内清除活性氧重要的细胞保护酶类,其活性高低可以反映植物对逆境胁迫的适应能力[28]。本实验中,与对照相比,低浓度Cr6+(10μmol·L-1)处理下,青菜地上部分SOD、POD、CAT活性显著增高,且MDA含量没有显著变化,说明在此浓度下,青菜地上部产生的ROS能被抗氧化系统清除;随着Cr处理浓度的进一步提高,地上部抗氧化酶(除‘三月慢’CAT外)活性仍显著高于对照,然而MDA含量亦显著增加,说明植物对Cr胁迫的抵御是有一定限度的,超过此限度植物就会受到伤害,这与Kale[29]和Adrees等[30]的研究结果相似;另外,在低浓度Cr6+(10μmol·L-1)处理下,青菜根系MDA含量显著升高,说明根系受到比地上部更大的氧化胁迫。在相同浓度的Cr处理(CK除外)下,耐性品种‘美加华’植株内的MDA含量低于‘三月慢’,而SOD、POD、CAT活性显著高于‘三月慢’,暗示了美加华具有更强的清除ROS的能力,以降低Cr对植物造成的氧化胁迫,这也是其耐Cr6+较强的机理之一。
综上所述,在Cr6+胁迫下,青菜生长受到显著抑制;青菜首先能通过根系固定Cr,阻遏Cr向地上部的运输,以降低植株地上部Cr含量;其次能通过细胞壁结合Cr,以减少进入原生质体的Cr;再次也许通过PCs螯合Cr离子,并将其转移到液泡内,使其生物活性钝化;另外,还通过增强植株体内抗氧化酶活性,以降低活性氧等对质膜的伤害,从而更好地维持细胞质膜的稳定性和完整性。与‘三月慢’相比,青菜品种‘美加华’具有更强的固定、螯合Cr和抗氧化的能力,这可能是其抗Cr6+性较强的重要原因。
参考文献:
[1]CHENHL,AROCENAJM,LIJB, et al.Mobilityandstoragesinksforchromiumandothermetalsinsoilsimpactedbyleathertannerywastes[J]. Journal of Environmental Monitoring, 2012, 14(12):3 240-3 248.
[2]BAGCHID,STOHSSJ,DOWNSBW, et al.Cytotoxicityandoxidativemechanismsofdifferentformsofchromium[J]. Toxicology, 2002, 180(1): 5-22.
[3]ZHANGSR,LISY,DINGXD, et al.SiliconmediatedthedetoxificationofCronpakchoi(Brassica chinensisL.)inCr-contaminatedsoil[J]. Journal of Food Agriculture & Environment, 2013, 11(2): 814-819.
[4]SINGHHP,MAHAJANP,KAURS, et al.Chromiumtoxicityandtoleranceinplants[J]. Environmental Chenmistry Letters, 2013, 11(3): 229-254.
[5]YANGY,ZHANGFS,LIHF, et al.AccumulationofcadmiumintheediblepartsofsixvegetablespeciesgrowninCd-contaminatedsoils[J]. Journal of Environmental Management, 2009, 90(2): 1 117-1 122.
[6]MARIESCHIM,GORBIG,ZANNIC, et al.IncreaseofchromiumtoleranceinScenedesmus acutusaftersulfurstarvation:ChromiumuptakeandcompartmentalizationintwostrainswithdifferentsensitivitiestoCr(VI)[J]. Aquatic Toxicology, 2015, 167: 124-133.
[7]FRANCINEMK,LOUISEWA,PYTHAGOREFS, et al.AntioxidantpropertiesofcellwallpolysaccharidesofStevia rebaudianaleaves[J]. Journal of Coastal Life Medicine, 2014, 2(12): 962-969.
[8]BRUNETTIP,ZANELLAL,DEPAOLISA, et al.Cadmium-inducibleexpressionoftheABC-typetransporterAtABCC3increasesphytochelatinmediatedcadmiumtoleranceinArabidopsis[J]. Journal of Experimental Botany, 2015, 66(13): 3 815-3 829.
[9]CHENYK,LIUYX,DINGYN, et al.OverexpressionofPtPCSenhancescadmiumtoleranceandcadmiumaccumulationintobacco[J]. Plant Cell Tissue and Organ Culture, 2015, 121(2): 389-396.
[10]ZENGFR,QIUBY,WUXJ, et al.Glutathione-mediatedalleviationofchromiumtoxicityinriceplants[J]. Biological Trace Element Research, 2012, 148(2): 255-263.
[11]LAIHY.SubcellulardistributionandchemicalformsofcadmiuminImpatiens wallerianainrelationtoitsphytoextractionpotential[J]. Chemosphere, 2015, 138: 370-376.
[12]KUMARIBHOOMIKA,SAMANTHAPYNGROPE, et al.Effectofaluminumonproteinoxidation,non-proteinthiolsandproteaseactivityinseedlingsofricecultivarsdifferinginaluminumtolerance[J]. Journal of Plant Physiology, 2014, 171(7): 497-508.
[13]HAMIDHASSANPOUR.EffectofAloe veragelcoatingonantioxidantcapacity,antioxidantenzymeactivitiesanddecayinraspberryfruit[J]. LWT - Food Science and Technology, 2015, 60(1): 495-501.
[14]高可辉, 葛滢, 张春华. 缺硫对镉胁迫下水稻幼苗非蛋白巯基物质含量和谷胱甘肽硫转移酶活性的影响[J].应用生态学报, 2011, 22(7): 1 796-1 802.
GAOKH,GEY,ZHENGCH.Effectsofsulfurstarvationonthenon-proteinthiolcontentandglutathioneS-transferaseactivityofriceseedlingsundercadmiumstress[J]. Chinese Journal of Applied Ecology,2011,22(7):1 796-1 802.
[15]徐义昆, 徐小颖, 池源, 等. 香蒲对不同浓度Pb2+胁迫的生理应答及其细胞超微结构变化[J].西北植物学报, 2015, 35(10): 2 018-2 025.
XUYK,XUXY,CHIY, et al.PhysiologicalresponsesandultrastructuralchangesofTypha orientalispreslunderPb2+stress[J]. Acta Bot.Boreal.-Occident. Sin.,2015,35(10):2 018-2 025.
[16]陈柳君, 冯海峰, 朱雪梅. 铜锌复合污染对铜富集植物大聚藻抗氧化酶活性的影响[J].西北植物学报, 2014, 34(10): 2 056-2 062.
CHENLJ,FENGHF,ZHUXM, et al.EffectofCuandZncompoundpollutiononantioxidantenzymeactivityofCu-enrichmentplantMyriophllum aquatcum[J]. Acta Bot. Boreal.-Occident. Sin.,2014, 34(10): 2 056-2 062.
[17]夏汉平, 束文圣. 香根草和百喜草对铅锌尾矿重金属的抗性与吸收差异研究[J].生态学报, 2001, 21(7): 1 121-1 129.
XIAHP,SHUWS.ResistancetoanduptakeofheavymetalsbyVetiveria zizanioidesandPaspalum notatumfromlead/zincminetailings[J]. Acta Ecologica Sinica,2001, 21(7): 1 121-1 129.
[18]刘婷婷, 彭程, 王梦, 等. 海州香薷根细胞壁对铜的吸附固定机制研究[J].环境科学学报, 2014, 34(2): 514-523.
LIUTT,PENGC,WANGM, et al.MechanismoffixationandadsorptionofcopperonrootcellwallofElsholtzia splendens[J]. Acta Scientiae Circumstantiae.2014, 34(2): 514-523.
[19]ZHUXF,WANGZW,DONGF, et al.ExogenousauxinalleviatescadmiumtoxicityinArabidopsisthalianabystimulatingsynthesisofhemicellulose1andincreasingthecadmiumfixationcapacityofrootcellwalls[J]. Journal of Hazardous Materials, 2013, 263: 398-403.
[20]LICC,DANGF,CANGL, et al.Integrationofmetalchemicalformsandsubcellularpartitioningtounderstandmetaltoxicityintwolettuce(Lactuca sativaL.)cultivars[J]. Plant and Soil, 2014, 384(1-2): 201-212.
[21]WUZP,MCGROUTHERK,CHENDL.Subcellulardistributionofmetalswithinbrassica chinensisL.inresponsetoelevatedleadandchromiumstress[J]. Jouranl of Agricultural and Food Chemistry, 2014, 61: 4 715-4 722.
[22]SPISSOAA,CERUTTIS,SILVAF, et al.CharacterizationofHg-phytochelatinscomplexesinvines(Vitis vinifera cv Malbec)asdefensemechanismagainstmetalstress[J]. Biometals, 2014, 27(3): 591-599.
[23]QIUBY,ZENGFR,CAISG, et al.Alleviationofchromiumtoxicityinriceseedlingsbyapplyingexogenousglutathione[J]. Journal of Plant Physiology, 2013, 170(8): 772-779.
[24]SHAHIDM,DUMATC,POURRUTB, et al.Roleofmetalspeciationinlead-inducedoxidativestresstoVicia fabaroots[J]. Russian Journal of Plant Physlology, 2015, 62(4): 448-454.
[25]GHNAYAT,NOUAIRII,SLAMAI, et al.Cadmiumeffectsongrowthandmineralnutritionoftwohalophytes: Sesuvium portulacastrum and Mesembryanthemum crystallinum[J]. Journal of Plant Physiology, 2005, 162(10): 1 133-1 140.
[26]TERZIH,YILDIZM.InteractiveeffectsofsulfurandchromiumonantioxidativedefensesystemsandBnMP1geneexpressionincanola(Brassica napusL.)cultivarsdifferinginCr(VI)tolerance[J]. Ecotoxicology,2015,24(5): 1 171-1 182.
[27]ALIS,BHARWANASA,RIZWANM,FARIDM, et al.Fulvicacidmediateschromium(Cr)toleranceinwheat(Triticum aestivumL.)throughloweringofCruptakeandimprovedantioxidantdefensesystem[J]. Environmental Science and Pollution Research, 2015, 22(14): 10 601-10 609.
[28]李璇, 岳红, 王升, 等. 影响植物抗氧化酶活性的因素及其研究热点和现状[J].中国中药杂志, 2013, 38(7): 973-978.
LIX,YUEH,WANGSH, et al.Researchofdifferenteffectsonactivityofplantantioxidantenzymes[J]. China Journal of Chinese Materia Medica,2013, 38(7): 973-978.
[29]KALERA,LOKHANDEVH,ADEAB.Investigationofchromiumphytoremediationandtolerancecapacityofaweed, Portulaca oleraceaL.inahydroponicsystem[J]. Water and Environment Journal, 2015, 29(2): 236-242.
[30]ADREESM,ALIS,IQBALM, et al.Mannitolalleviateschromiumtoxicityinwheatplantsinrelationtogrowth,yield,stimulationofanti-oxidativeenzymes,oxidativestressandCruptakeinsandandsoilmedia[J]. Ecotoxicology and Environmental Safety, 2015, 122:1-8.
(编辑:裴阿卫)
TheSub-cellularChromium(Cr6+)DistributionandToleranceMechanismtoChromiumStressinDifferentTolerantBrassica chinensisL.Cultivars
ZHANGHaimin,YANGWenjia,WANGQingya,SUNJianyun*
(CollegeofLifeScience,NanjingAgriculturalUniversity,Nanjing210095,China)
Abstract:In order to elucidate absorption, distribution and tolerance mechanisms of Brassica chinensis L. to chromium (Cr6+) stress, we grew two Brassica cultivars; ‘Meijiahua’(Cr6+-stress tolerant) and ‘Sanyueman’(Cr6+-stress sensitive) hydroponically in Hoagland 0, 10, 50 and 100 μmol·L-1Cr6+. The differencesin Cr absorbed contents and subcellular distribution, non-proteinthiol, phytochelatins(PCs) and antioxidant enzyme activities in shoots and roots were studied. The results were as follows: (1) the contents of Cr in shoots were significantly lower than those in the roots in both cultivars. The Cr root contents, Cr retention rate and the ratio of wall-bounded Cr to total Cr in shoots and roots of ‘Meijiahua’ were significantly higher than those in ‘Sanyueman’, but the ratio of water soluble Cr to total Cr was opposite. (2) Cr6+treatments at all concentrations significantly increased the concentrations of non-protein thiol and phytochelatins (PCs) in shoots of both cultivars, but the increment in ‘Meijiahua’ was significantly higher than that in ‘Sanyueman’. (3) Under low concentration of Cr6+(10 μmol·L-1),the activities of SOD, POD and CAT were significantly increased, but the extent of increase was significantly higher in ‘Meijiahua’ than that in ‘Sanyueman’. The activities of SOD, POD and CAT were significantly downregulated under high concentration of Cr6+(100 μmol·L-1), but the magnitude of downregulation in ‘Meijiahua’ was significantly lower than that in ‘Sanyueman’. These results indicated that under Cr6+stress, as compared to ‘Sanyueman’, more Cr was distributed in cell walls in shoot and root in ‘Meijiahua’ to inhibit the transmembrane Cr to intracellular flow. Moreover, it has higher antioxidant enzyme activities and PCs content, so it showed a stronger tolerance to Cr6+.
Key words:Brassica chinensis L.; Cr6+; subcellular distribution; non-protein thiol; antioxidant enzyme.
文章编号:1000-4025(2016)05-0954-10
doi:10.7606/j.issn.1000-4025.2016.05.0954
收稿日期:2016-02-18;修改稿收到日期:2016-05-11
基金项目:国家自然科学基金(31471443);江苏省自然科学基金(BK20140705)
作者简介:张海敏(1989-),男,硕士,主要从事植物生理研究。E-mail:zhanghaimin0514@163.com *通信作者:孙建云,副教授,主要研究方向为植物对有毒元素的吸收、缺乏或过量的适应性反应机理及其耐性机理。E-mail:sunjianyun@njau.edu.cn
中图分类号:Q945.78
文献标志码:A
