响应面法优化大肠埃希菌生产PCV2 Cap蛋白的诱导条件
2016-07-02乔绪稳郑其升吴培培王伟峰侯继波
陈 丽,乔绪稳,冯 磊,郑其升,吴培培,褚 轩,王伟峰,侯继波
(江苏省农科院 国家兽用生物制品工程技术研究中心,南京 210014)
响应面法优化大肠埃希菌生产PCV2 Cap蛋白的诱导条件
陈丽,乔绪稳,冯磊,郑其升,吴培培,褚轩,王伟峰,侯继波
(江苏省农科院 国家兽用生物制品工程技术研究中心,南京210014)
摘要为提高重组大肠埃希菌发酵生产PCV2 Cap蛋白的产量,优化宿主菌的表达条件。在单因素试验基础上,以接种量、诱导时间和诱导温度为自变量,目的蛋白产量为响应值,根据响应面法的Box-Behnken 中心组合设计原理,研究各自变量及其交互作用对PCV2 Cap蛋白产量的影响,利用Design-Expert软件和响应面分析相结合的方法对诱导条件进行优化。结果表明:发酵的最佳诱导条件为接种量φ=2.21%,诱导时间21.76 h,诱导温度 18.2 ℃。在该诱导条件下,摇瓶中获得最高蛋白产量为318.50 mg/L,发酵罐获得最高蛋白产量为1 200.00 mg/L。采用响应面分析方法能够有效地提高目的蛋白的表达量。
关键词响应面法;大肠埃希菌;表达条件;优化
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是仔猪断奶后多系统衰竭综合征(PWMS)的主要病原[1-2]。该病毒可引起断奶仔猪发生衰竭、死亡,更为严重的是PCV2的感染可造成免疫抑制,引起其他各种病原的继发感染,造成的间接损失难以估计[3-4]。目前,对PCV2致病机制仍不完全清楚,只能通过加强饲养管理、疫苗接种的方法控制猪群中该病毒的爆发,因此,研究安全、有效的PCV2疫苗具有重大意义[5]。
大肠埃希菌(Escherichiacoli)表达系统具有易构建、产量高、成本低等优点[6-8],其外源基因的高水平表达,不仅涉及宿主菌、载体和克隆基因之间的相互关系,而且与表达条件密切相关[9]。对重组蛋白表达条件优化的经典方法是单因素分析,但当影响因素较多时需要大量的试验次数,且可能导致不可靠的甚至错误的试验结论,尤其对具有交互作用的影响因素[10-11]。
响应面法(Response surface methodology,RSM) 是利用合理的试验设计,采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法。该方法可对函数的面进行分析,研究因子与响应值、因子与因子之间的相互关系,并进行优化弥补单次单因子法的缺陷[12]。目前,响应面分析法已成为降低成本、优化加工条件的一种有效方法,广泛地应用于农业、生物、食品、化学等领域[13-14]。本研究以表达PCV2 Cap蛋白的重组大肠埃希菌为研究对象,旨在利用响应面分析的Box-Benhnken (BBD)设计,建立重组蛋白最佳表达条件的数学模型,对重组蛋白表达量有重要影响的接种量、诱导时间和诱导温度条件进行优化,从而为生产PCV2基因工程疫苗奠定试验基础。
1材料与方法
1.1试验材料
1.1.1菌株和质粒 重组大肠埃希菌(含带有PCV2 Cap蛋白的质粒)由江苏省农科院国家兽用生物制品工程技术研究中心猪用新型疫苗及技术课题组构建并保存。
1.1.2主要试剂蛋白胨(Typtome)和酶母抽提物(Yeast extract)购自OXOID公司;异丙基-β-D-硫代半乳糖苷(IPTG)、丙烯酰胺、甲叉丙烯酰胺、十二烷基硫酸钠(SDS)和牛血清蛋白(BSA)均购自sigma;氨苄青霉素(Amp)和DNA Marker购自Takara公司;其余常用试剂均为国产分析纯试剂。
1.2 试验方法
1.2.1种子液的培养挑取重组大肠埃希菌单菌落到适量LB培养基(含Amp 100 μg/mL)中,37 ℃,200 r/min培养约16 h用作种子液。
1.2.2摇瓶培养将种子液按φ=2%接种到30 mL LB液体培养基(含Amp 100 μg/mL)的250 mL 摇瓶中,37 ℃,200 r/min,摇床振荡培养3 h时,18 ℃静置30 min,加入终浓度为0.1 mmol/L的异丙基硫代半乳糖苷(IPTG),18 ℃,200 r/min诱导18 h,收集菌液;然后进行SDS-PAGE检测分析。在重组大肠埃希菌培养和诱导表达过程中,其他条件控制不变的情况下,分别改变接种量、诱导时间及诱导温度进行单因子作用水平筛选试验。
1.2.3菌体密度的测定菌液稀释适当倍数后于波长600 nm处,以去离子水为对照进行比色测定,OD600=OD读数×稀释倍数。
1.2.4 目的蛋白表达量的分析 目的蛋白经SDS-PAGE得到的凝胶采用考马斯亮蓝染色液染色,脱色液脱色后,用Bio-Rad 凝胶成像系统Quantity One 软件进行光密度扫描,以测定目的重组蛋白的含量。试验中用已知浓度的BSA 作为蛋白含量测定中的参考标准品。
1.2.5试验设计与数据统计分析方法大肠埃希菌重组菌诱导表达PCV2 Cap蛋白表达条件的优化采用响应面分析方法(Response surface analysis,RSA)。综合单因子试验结果,根据Box-Behnken中心组合设计原理,采用3因素3水平进行设计,每个因素设定为中心点(0)和高、低水平(-1和+1),试验因素水平及编码见表1。
试验设计、数据分析及模型分析均由Design-Expert 8.05软件辅助完成,最终确定最优的试验点并进行验证。

表1 RSA 试验设计中定量因子的水平及编码
1.2.6发酵罐验证培养3 L发酵罐中装液量1.2 L,由于发酵罐供氧及搅拌较摇瓶好,在提高初始接种量的情况下通过连续补料仍能满足菌体的对数生长,本研究以φ=8%接种量接入种子液100 mL,同时加入Amp 100 μg/mL,通气量根据菌体密度的变化进行调节,发酵温度为37 ℃,pH 7.0。发酵分为3个阶段,第1阶段为分批培养(Batch)阶段,溶氧逐渐下降,分步提高转速,最大不超过发酵罐转速上限,控制溶氧在φ=20%以上。当基础料中葡萄糖耗尽(3~4 h),溶氧和pH上升后,进入第2阶段补料(Feeding)阶段,流加补料培养基(300 g/L葡萄糖),维持菌体生长,用氨水控制pH为7.0。当培养到对数期时,开始进入第3阶段诱导(Inducing)阶段,此时发酵温度由37 ℃降到响应面最优的诱导温度,预冷30 min后加入0.1 mmol/L IPTG过夜诱导到响应面最优时间。
2结果与分析
2.1重组大肠埃希菌诱导表达PCV2 Cap蛋白的单因素试验结果
分别考察不同接种量、诱导时间和诱导温度对目标蛋白产量的影响,由图1可知,接种量为φ=2%时,目标蛋白产量最高,接种量过低(φ=0.5%)时,培养相同时间时诱导菌浓度较低,菌体生长缓慢,但接种量过大(φ=5%)可能会引起菌体生长较快,诱导时菌体处于稳定期或者衰亡期,反而影响目标蛋白的表达;目标蛋白产量随着诱导时间的延长而提高,18 h时达到最大值,随后目标蛋白表达量增长速率缓慢,这可能是由于诱导后期菌体自身代谢速率降低或紊乱无法支持目标蛋白的持续表达而引起。目标蛋白产量随诱导温度的升高先升高后迅速降低,温度为18 ℃ 时,产量最高(312.00 mg/L)。因此,接种量、诱导时间及诱导温度的初筛值分别为φ=2%, 18 h 和18 ℃,在后续的响应面优化试验中将进一步考察。

图1 单因素对PCV2 Cap蛋白产量影响
2.2响应面优化试验设计和结果
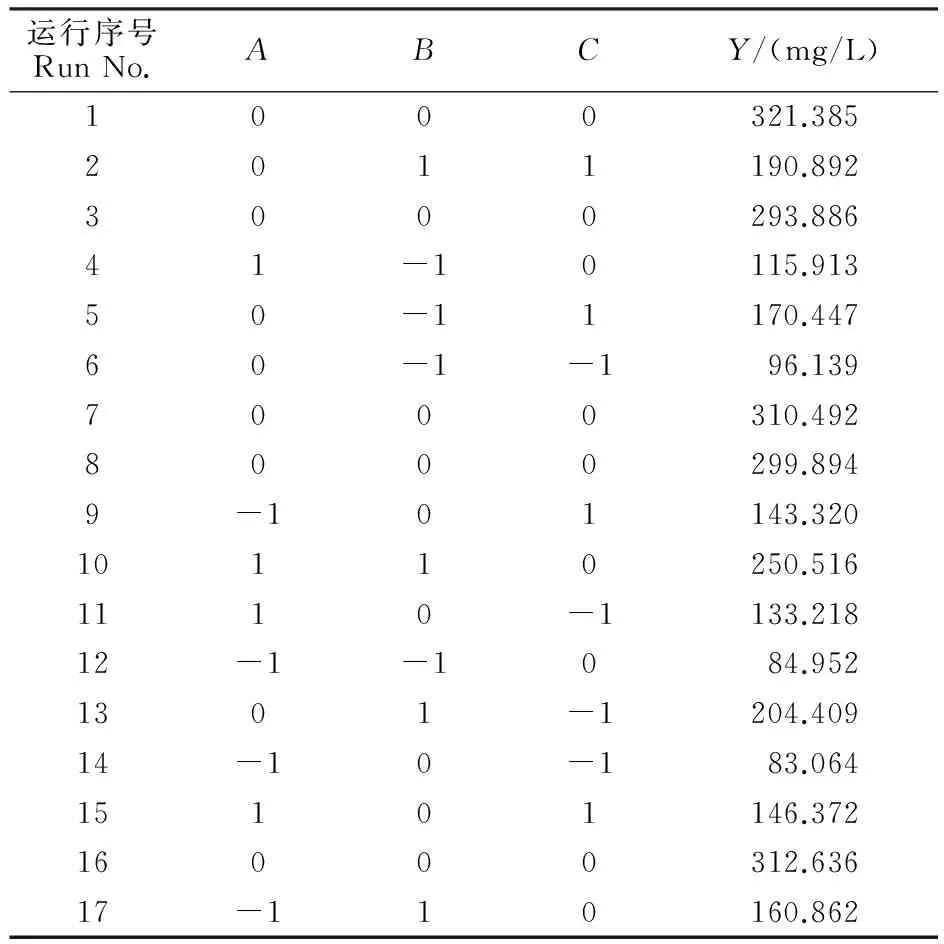
以接种量(A)、诱导时间(B)和诱导温度(C)为自变量,目的蛋白表达量(Y)为响应值,进行17组试验,用于优化大肠埃希菌表达重组PCV2 Cap的诱导条件。试验设计及结果见表2。
根据表2的试验结果,通过Design Expert软件处理得到目的蛋白表达量与各因素的回归方程为:Y=307.66+21.73A+42.40B+16.78C+14.67AB-11.78AB-21.96BC-96.79A2-57.81B2-84.38C2
Y为目的蛋白产量,A、B和C分别为自变量接种量、诱导时间和诱导温度的编码值。
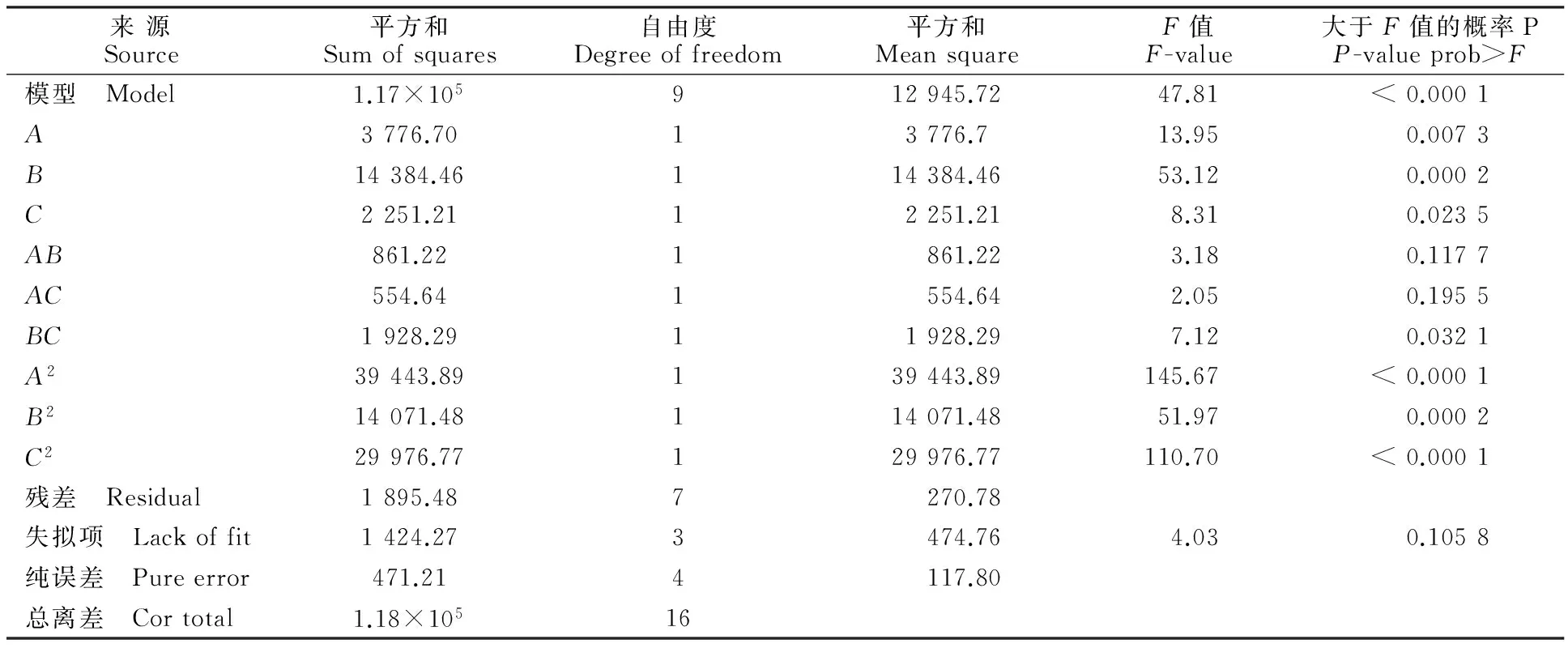
2.3回归方程的方差分析
由表3和表4可知, 回归模型的P<0.000 1, 表明回归模型极显著;失拟系数的P值为0.105 8,在统计学上分析其影响不显著(P>0.05),说明参与响应面优化的考察因素设计合理,未知因素对目的蛋白产量干扰很小。因此,不需要引入更高次数的项,模型适当[15]。此外,模型的复相关系数R2为0.984 0, 说明拟合程度良好, 试验误差小。变异系数(CV)反映模型的置信度,CV值越低模型的置信度越高,而本试验的CV值为8.430 0%,说明模型方程能很好地反映真实的试验值。因此该模型能较准确地反映目的蛋白的产量与接种量、诱导时间、诱导温度之间的关系,可以用模型分析最优发酵条件。F检验可用于判定各变量对响应值影响的显著性,P值越小显著性越高[16]。表3中由回归方程系数显著性检验可知:模型中一次项A、B极显著(P<0.01),C显著(0.01 表2 试验设计及结果 表3 回归方程各项方差分析 注:“ *”表示显著(P<0.05). Note:“*”indicates significant(P<0.05). 表4 模型置信度分析 2.4响应曲面图及其等高线 重组大肠埃希菌接种量、诱导时间、诱导温度对目的蛋白表达的交互作用响应面曲线和等高线见图2、图3和图4。 由响应面立体图可以看出,曲面均呈山丘形,在试验中所选的范围内存在最大值,即响应面的最高点,同时不同因素交互效应的强弱可通过等高线的形状进行判定,椭圆形表示两因素交互作用显著,圆形则表示两因素交互作用不显著[17],因此诱导时间与诱导温度的交互作用最为显著。 图2 接种量和诱导时间对PCV2 Cap蛋白产量影响的响应面与等高线图 图3 接种量和诱导温度对PCV2 Cap蛋白产量影响的响应面与等高线图 2.5最佳表达条件的确定 由Design Expert 8.05分析得到最大响应值,其对应的摇瓶最佳表达条件:接种量、诱导时间和诱导温度分别为φ=2.21%、21.76 h和18.2 ℃,理论最佳蛋白表达量为317.49 mg/L。为验证该模型预测的最佳条件,进行3组摇瓶平行试验,结果如图5所示,优化前后蛋白表达量如图6所示。实际最高蛋白表达量为318.50 mg/L,与理论值相当,说明该方程与实际情况具有较好的拟合度,验证了该模型的准确性。 根据响应面优化后的诱导条件,在3 L发酵罐进行发酵小试验证。由图7可知,初始培养溶氧和pH逐步下降,说明接种后菌体迅速启动生长,延迟期较短。4 h溶氧和pH迅速回升,说明分批培养阶段的糖分已耗尽,此时进行流加补料,维持细菌的快速生长状态,继续培养至OD600为20时,降低温度至18.2 ℃后维持30 min进入诱导表达阶段,该阶段大致持续21 h,最终表达如图8所示。发酵罐中的重组Cap蛋白表达量稀释4倍后与摇瓶中表达量相当,即诱导21 h最高达1 200.00 mg/L,说明PCV2病毒的重组Cap蛋白的表达条件得到进一步优化。 图4 诱导时间和诱导温度对PCV2 Cap蛋白产量影响的响应面与等高线图 图5 最优条件下PCV2 Cap蛋白产量随诱导时间的变化 M.预染蛋白分子量标准Prestained protein marker;1.优化前Before optimization;2.优化后After optimization 图6表达条件优化前后PCV2 Cap蛋白产量比较 Fig.6Comparison of PCV2 Cap yield under pre- and post-optimization of induction conditions 图7 3 L发酵罐中的发酵过程曲线图 1. 摇瓶IPTG诱导表达Induced by IPTG in shake flask;M.蛋白分子量标准Protein marker;2~5.分别为发酵罐IPTG诱导表达8、14、21、28 hInduced by IPTG at 8,14,21,28 h in 3 L fermenter;6.诱导前Before induction 图83 L发酵罐中PCV2 Cap蛋白产量随诱导时间变化的比较 Fig.8Comparison of PCV2 Cap yield during induction course in 3 L fermenter 3讨 论 猪圆环病毒2型(PCV2)是当今危害养猪业较严重的一种病毒, 其生物学特性比较特殊,能进行PCV2病毒增殖的细胞只有猪源肾细胞(PK-15)、Vero细胞等,且其在细胞上的增殖不会引起明显的细胞病变(CPE),增殖滴度非常低,培养成本高,周期长[18]。病毒样颗粒(Virus-like Particles,VLP)亚单位疫苗利用体外表达系统,大量表达病毒的主要保护性抗原蛋白,其只含有病毒的衣壳结构,因此具有很高的安全性,而且便于规模化生产,应用前景广泛[19]。大肠埃希菌表达系统,具有遗传背景清楚、可大规模发酵、繁殖快、成本低、表达量高等优点,在生产和科学研究中已得到广泛应用,但因蛋白表达量过高、速度过快从而导致蛋白来不及正确折叠而堆积形成无活性的包涵体,使其应用受到限制[20]。江苏省农科院国家兽用生物制品工程技术研究中心前期构建的CVC1102原核表达系统通过伴侣蛋白共表达,采用低温诱导方式建立了可溶性大肠埃希菌表达平台,试验证明该系统可实现大部分目的蛋白的体外可溶性表达,并且能够自我组装成病毒样颗粒[21]。 无论是原核或真核表达,经常遇到表达量较低的情况,显然不利于相关产品开发及实际应用。重组蛋白原核表达条件往往对产量有较大影响[22]。影响目的重组产物表达量的主要因素是接种量、诱导时间和诱导温度等条件[23],为高效率地实现目的蛋白表达条件优化,寻找各因素对目的蛋白表达的最佳作用参数,不能忽略各因素之间的交互作用对目的蛋白表达的影响;而响应面分析法比单次单因子法更适用于快速有效地筛选出重组蛋白在大肠埃希菌中最佳的诱导条件[24]。 本研究通过响应面分析法优化重组大肠埃希菌表达PCV2 Cap蛋白的诱导条件,建立二次多项式回归模型以表征目标产物的产量与接种量、诱导时间和诱导温度3因素的关系,并验证模型的准确性。最终得出最佳表达条件为接种量φ=2.21%,诱导时间21.76 h,诱导温度18.2 ℃,理论最佳蛋白表达量为317.49 mg/L,实际平均表达量为318.50 mg/L,两者几乎相等,3 L发酵罐验证其最高表达量达1 200.00 mg/L。研究结果表明,基于RSM的BBD法可简便、高效地对目的重组蛋白表达条件进行优化,达到明显提高表达产量的作用,同时也可为目的重组蛋白大规模发酵时获得高产量提供重要的参考依据。 参考文献Reference: [1]DULAC G C,AFSHAR A.Porcine circovirus antigens in PK-15 cell line (ATCC CCL-33) and evidence of antibodies to circovirus in Canadian pigs[J].CanadianJournalofVeterinaryResearch,1989,53(4):431-433. [2]LOPEZ-SORIA S,SIBILA M,NOFRARIAS M,etal.Effect of porcine circovirus type 2 (PCV2) load in serum on average daily weight gain during the postweaning period[J].VeterinaryMicrobiology,2014,174(3/4):296-301. [3]BAEKBO P,KRISTENSEN C S and LARSEN L E.Porcine circovirus diseases:a review of PMWS[J].TransboundaryandEmergingDiseases,2012,59(supplement 1):60-67. [4]NAINYS J,LASICKIENE R,PETRAITYTE-BURNEIKIENE R,etal.Generation in yeast of recombinant virus-like particles of porcine circovirus type 2 capsid protein and their use for a serologic assay and development of monoclonal antibodies[J].BMCBiotechnology,2014,14:100. [5]ZHU Y,LAU A,LAU J,etal.Enhanced replication of porcine circovirus type 2 (PCV2) in a homogeneous subpopulation of PK15 cell line[J].Virology,2007,369(2):423-430. [6]KIM B S,LEE S C,LEE S Y,etal.High cell density fed-batch cultivation ofEscherichiacoliusing exponential feeding combined with pH-stat[J].BioprocessandBiosystemEngineering,2004,26(3):147-150. [7]RESTAINO O F,BHASKAR U,PAUL P,etal.High cell density cultivation of a recombinantE.colistrain expressing a key enzyme in bioengineered heparin production[J].AppliedMicrobiologyandBiotechnology,2013,97(9):3893-3900. [8]HEWITT C J,ONYEAKA H,LEWIS G,etal. A comparison of high cell density fed-batch fermentations involving both induced and non-induced recombinantEscherichiacoliunder well-mixed small-scale and simulated poorly mixed large-scale conditions[J].BiotechnologyandBioengineering,2007.96(3):495-505. [9]OSADSKA M,BONKOVA H,KRAHULEC J,etal.Optimization of expression of untagged and histidine-tagged human recombinant thrombin precursors inEscherichiacoli[J].AppliedMicrobiologyandBiotechnology,2014,98(22):9259-9270. [10]ABEDI D,BEHESHTI M,NAJAFABADI A J,etal.Optimization of the expression of genes encoding poly (3-hydroxyalkanoate) synthase fromPseudomonasaeruginosaPTCC 1310 inEscherichiacoli[J].AvicennaJournalofMedicalBiotechnology,2012,4(1):47-51. [11]CONTESINI F J,DA SILVA V C,MACIEL R F,etal.Response surface analysis for the production of an enantioselective lipase fromAspergillusnigerby solid-state fermentation[J].JournalofMicrobiology,2009,47(5):563-571. [12]齐补坤,何璐,刘娜,等.响应面分析法优化苦参内生真菌BS003菌株液体发酵条件[J].西北农业学报,2012,21(9):174-178. QI B K,HE L,LIU N,etal.Fermentation condition optimization for endophytic fungi BS003 of sophora flavescens using response surface methodology[J].ActaAgriculturalBoreali-occidentalisSinica,2012,21(9):174-178(in Chinese with English abstract). [13]ZHOU W,LIU X,ZHANG P,etal.Effect analysis of mineral salt concentrations on nosiheptide production byStreptomycesactuosusZ-10 using response surface methodology[J].Molecules,2014,19(10):15507-15520. [14]SAMBROOK J.Molecular Cloning:A Laboratory Manual[M].3rd revised edition.USA.Cold Spring Harbor Laboratory Press,2000:1595-1604. [15]刘国荣,张郡莹,王成涛,等.响应面法优化弯曲乳杆菌RX-6代谢产细菌素的发酵培养基组成[J].食品科技,2013,38(3):2-8. LIU G R,ZHANG J Y,WANG CH T ,etal.Optimization of fermentation medium composition ofLactobacilluscurvatusRX-6 for bacteriocin production by response surface methodology [J].FoodScienceandTechnology,2013,38(3):2-8(in Chinese with English abstract). [16]BEIGI L,KARBALAEI-HEIDARI H R,KHARRATI-KOPAEI M.Optimization of an extracellular zinc-metalloprotease (SVP2) expression inEscherichiacoliBL21 (DE3) using response surface methodology[J].ProteinExpressionandPurification,2012,84(1):161-166. [17]高飞虎,张 玲,曾志红,等.响应面法优化超微粉碎辅助提取辣椒红素工艺研究[J].西南农业学报,2011,24(5):1928-1933. GAO F H,ZHANG L,ZENG ZH H,etal.Optimization on extraction technology of capsanthin by ultramicrofine comminution via response surface methodology [J].SouthwestChinaJournalofAgriculturalSciences,2011,24(5):1928-1933(in Chinese with English abstract). [18]YANG X,CHEN F,CAO Y,etal.Comparative analysis of different methods to enhance porcine circovirus 2 replication[J].JournalofVirologicalMethods,2013,187(2):368-371. [19]ZHANG H,QIAN P,LIU L,etal.Virus-like particles of chimeric recombinant porcine circovirus type 2 as antigen vehicle carrying foreign epitopes[J].Viruses,2014,6(12):4839-4855. [20]KHALILZADEH R,MOHAMMADIAN-MOSAABADI J,BAHRAMI A,etal.Process development for production of human granulocyte-colony stimulating factor by high cell density cultivation of recombinantEscherichiacoli[J].JournalofIndustrialMicrobiology&Biotechnology,2008,35(12):1643-1650. [21]赵晓云,乔绪稳,陈瑾,等.利用E.coli表达猪圆环病毒2型Cap蛋白生产病毒样颗粒疫苗[J].中国农业科学,2015,48(5):976-986. ZHAO X Y,QIAO X W,CHEN J,etal.PCV2 virus like particles vaccine produced with recombinant cap protein expressed inE.coli[J].ScientiaAgriculturaSinica,2015,48(5):976-986(in Chinese with English abstract). [22]VELMURUGAN N,KIM H S,JEONG K J.Enhanced production of human FcgammaRIIa receptor by high cell density cultivation ofEscherichiacoli[J].ProteinExpressionandPurification,2011,79(1):60-65. [23]ZHANG J,SUFLITA M,FIASCHETTI C M,etal.High cell density cultivation of a recombinantEscherichiacolistrain expressing a 6-O-sulfotransferase for the production of bioengineered heparin[J].JournalofAppliedMicrobiology,2015,118(1):92-98. [24]CATALKAYA E C,KARGI F.Response surface analysis of photo-Fenton oxidation of simazine[J].WaterEnvironmentResearch,2009,81(7):735-742. Received 2015-05-07Returned2015-06-30 First authorCHEN Li,female,research associate. Research area: veterinary vaccines. E-mail:chenli1128@126.com (责任编辑:史亚歌Responsible editor:SHI Yage) Optimization of Induction Conditions for Producing PCV2 Cap by Response Surface Methodology inEscherichiacoli CHEN Li,QIAO Xuwen,FENG Lei,ZHENG Qisheng,WU Peipei,CHU Xuan,WANG Weifeng and HOU Jibo (National Research Center of Veterinary Biologicals Engineering and Technology,Jiangsu Academy of Agricultural Sciences,Nanjing210014,China) AbstractTo improve the expression level of porcine circovirus type 2 (PCV2) Cap protein in recombinant E.coli,prokaryotic expression conditions were optimized. An optimized process using response surface methodology was conducted in this study on the basis of single factor screening experiments. Inoculation dose,induction time and induction temperature were served as independent variables,and the target protein production was served as the response value. Box-Behnken design method was used to study the effects of each independent variable and their interactions on target protein yield. Design-Expert software and response surface analysis were combined to optimize and confirm the best induction conditions. The results showed that the optimal induction conditions were determined as follows: inoculation dose φ=2.21%,induction time 21.76 h and induction temperature 18.2 ℃.Under the optimal induction condition,the highest target protein yield was achieved by 318.50 mg/L in shake flask and 1 200.00 mg/L in 3-liter fermenter respectively. In conclusion,RSA is an effective method to improve the expression of recombinant protein. Key wordsResponse surface methodology;Escherichia coli; Expression condition; Optimization 收稿日期:2015-05-07修回日期:2015-06-30 基金项目:农业公益性行业科研专项(201303046);江苏省农业自主创新专项[CX(14)2045-4]。 通信作者:侯继波,男,研究员,主要从事兽用生物制品研究。 E-mail:houjibo@jaas.ac.cn 中图分类号Q93-3 文献标志码A 文章编号1004-1389(2016)06-0828-08 Foundation itemSpecial Fund for Agro-scientific Research of Public Interest(No.201303046);Innovation Fund for Jiangsu Agricultural Science and Technology[No.CX(14)2045]. HOU Jibo,male,research fellow. Research area:veterinary research. E-mail:houjibo@jaas.ac.cn 网络出版日期:2016-06-01 网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0914.012.html 第一作者:陈丽,女,助理研究员,从事兽用疫苗研究。E-mail:chenli1128@126.com