抗重金属铜离子单克隆抗体的制备及其免疫学特性
2016-07-02付世杰秦保亮王亚楠姜金庆王自良
孙 勇,付世杰,秦保亮,王亚楠,姜金庆,王自良
(河南科技学院 动物科学学院, 河南新乡453003)
抗重金属铜离子单克隆抗体的制备及其免疫学特性
孙勇,付世杰,秦保亮,王亚楠,姜金庆,王自良
(河南科技学院 动物科学学院, 河南新乡453003)
摘要为制备抗Cu2+的高效价、敏感、特异的单克隆抗体,采用已合成的铜离子人工抗原Cu2+-ITCBE-BSA免疫Balb/C小鼠,通过间接ELISA和阻断ELISA筛选备用小鼠,用细胞融合技术制备抗Cu2+的单克隆抗体。结果筛选到4株特异性强、灵敏度高的杂交瘤细胞,其中杂交瘤细胞株2B8培养上清中的抗体效价采用间接ELISA检测为1∶(1.28×103),用其制备的腹水中抗体效价为1∶(5.12×105),该单克隆抗体为IgG1/κ型,对Cu2+-EDTA的半数抑制质量浓度(IC50)为29.78 μg/L,与Zn2+-EDTA的交叉反应率(CR)为26.0%,与其他金属螯合物没有交叉反应,表明获得特异性较好的抗Cu2+的单克隆抗体,可用于铜离子的免疫学检测。
关键词铜离子;单克隆抗体;免疫学特性
重金属铜通常以二价离子形式(Cu2+)存在,通过食物链的富集对人和动物产生危害,过量的铜会令动物出现恶心、呕吐、上腹疼痛、急性溶血和肾小管变形等中毒现象,严重者还可导致急性肾衰竭等[1]。由于硫酸铜能促进蛋氨酸吸收,对仔猪生长有促进作用,因此饲料中往往添加高铜添加剂,采食高铜饲料的猪粪便中所残留的铜排入环境会对土壤水源造成污染,因此,对于铜离子的检测尤为重要[2]。
检测铜离子的传统方法多为物理化学仪器检测法,如原子吸收光谱分析法(AAS)、电感耦合等离子发射光谱法(ICP-AES)、原子荧光法(AFS)、阳极溶出伏安法(ASV)和X射线荧光光谱法(XRF)等[3],这些检测方法虽然灵敏度高、精确性好,但所需仪器价格昂贵,并且需要专业培训,往往仅限于实验室人员操作而不适合大范围普及。为满足灵敏度高、特异性强而且简单快速的检测需求,免疫分析测定技术就成为人们检测重金属离子的一种重要方法。本研究旨在制备高效价、敏感、特异的抗Cu2+-EDTA 单克隆抗体,为免疫检测方法的建立奠定基础。
1材料与方法
1.1试 剂
CuSO4·5H2O,Alfa Aesar产品,纯度98.0%~102.0%;异硫氰酸苄基乙二胺四乙酸(ITCBE),上海同仁化学研究所;BSA和OVA,单克隆抗体同种型鉴定试剂盒,Pierce产品;ELISA所用洗液(PBST)为0.01 mol/L、pH 7.4φ(Tween-20)=0.05%的磷酸盐缓冲液(PBS);包被液为0.1 mol/L pH 9.6的碳酸盐缓冲液(CBS);封闭液、稀释液为φ(猪血清)=5%的PBST;酶底物为含TMB的磷酸柠檬酸缓冲液;终止液为2 mol/L的硫酸溶液;试验用水为重蒸去离子水。其他试剂均为AR级。
RPMI-1640细胞培养基,HAT、HT培养基,均为Gibco产品;二甲基亚砜(DMSO),台盼蓝,均为Sigma公司产品;PEG-1500,Roche公司产品;胎牛血清(FBS),杭州四季青生物工程材料有限公司产品;酚红,北京索莱宝科技有限公司产品。
免疫抗原Cu2+-ITCBE-BSA和包被抗原Cu2+-ITCBE-OVA由河南科技学院残留物检测实验室制备。
1.2仪 器
LDZX-30KB型立式压力蒸汽灭菌器,上海申安医疗器械厂;TS100型倒置生物显微镜,Nikon公司;Galaxy S型CO2细胞培养箱,Biotech公司;725型Thermo Forma超低温冰箱,Multiskan MK3酶标仪,Thermo公司。
1.3动物与细胞
Balb/C小鼠购自郑州大学医学院;小鼠骨髓瘤细胞株NS0由河南省动物免疫学重点实验室惠赠,河南科技学院动物科学学院动物疫病与残留防控中心实验室冻存。
1.4试验方法
1.4.1 Cu2+-EDTA mAb杂交瘤细胞株的建立细胞融合备用小鼠的免疫与选择:采用背部皮下4点注射法,用Cu2+-ITCBE-BSA免疫6周龄的雌性Balb/C小鼠,根据免疫蛋白的质量浓度,分为低剂量组每只20 μg(0.2 mL)、中剂量组每只60 μg(0.2 mL)和高剂量组每只 100 μg(0.2 mL),每组5只小鼠。首免间隔4周进行第2次免疫,共免5次,最后1次免疫后第10天断尾采血,间接ELISA检测血清抗体效价,阻断ELISA检测其抑制效价。根据耳标号选择抗体效价高、抑制效价好的小鼠脾细胞进行融合。
细胞融合与阳性杂交瘤细胞株的筛选:细胞融合参见文献[4]进行,用间接ELISA和阻断ELISA进行阳性杂交瘤细胞株的筛选。选择强阳性、抑制效果好、细胞生长旺盛的孔,用有限稀释法亚克隆后扩大培养、冻存并鉴定。
杂交瘤细胞核型鉴定:杂交瘤细胞核型鉴定采用秋水仙素阻断法[5],取对数生长期的杂交瘤细胞株传代培养48 h,用终质量浓度为0.05~0.1 mg/L 的秋水仙素处理4~6 h,收集细胞后用低渗KCl处理30 min,固定液固定,滴加细胞悬液到4 ℃预冷的载玻片上,室温自然干燥,用φ=10% 的Giemsa染色,去离子水洗脱,光学显微镜下观察,计数。每株计数5个细胞,记录染色体数目并计算平均值。
杂交瘤细胞稳定性检测:分别将冻存15、30和60 d的杂交瘤细胞复苏,培养后取上清液,间接ELISA和阻断ELISA测定抗体效价与敏感度,考察杂交瘤细胞分泌单克隆抗体的稳定性[6]。
1.4.2Cu2+-EDTA mAb的制备及免疫学特性鉴定Cu2+-EDTA mAb的制备:采用体外培养法[7]和体内诱生腹水法[8]获得抗体,用饱和硫酸铵盐析法[9]纯化后测定IgG的效价、敏感性、特异性。
同种型鉴定:按试剂盒说明操作。
效价测定:用间接ELISA测定效价。
敏感性鉴定:用阻断ELISA测定Cu2+-EDTA mAb对不同质量浓度Cu2+-EDTA的抑制率,以抑制率B/B0为纵坐标,以Cu2+-EDTA质量浓度的常用对数为横坐标,绘制标准抑制曲线,计算Cu2+-EDTA mAb对Cu2+-EDTA的IC50。
特异性鉴定:采用交叉反应试验,选择锌、铬、铅、镉、钴、钼、钙等金属离子与EDTA的螯合物为抑制剂,用阻断ELISA测定Cu2+-EDTA mAb对各抑制物的IC50,以Cu2+-EDTA mAb对Cu2+-EDTA的IC50和Cu2+-EDTA mAb对各抑制剂的IC50之比的百分数为其交叉反应率(CR)。
2结果与分析
2.1细胞融合备用小鼠的血清效价和血清敏感性测定结果
由图1可知,免疫小鼠血清抗体效价均达到1∶104,说明获得较好的免疫效果,其中3号小鼠血清抑制效果最好,3号小鼠血清的抑制曲线回归方程为y=-37.08x+106.71,R2为0.963 5,IC50为33.8 ng/mL。

图1 3号小鼠多抗血清对Cu2+-EDTA
2.2Cu2+-EDTA mAb杂交瘤细胞株的建立
杂交瘤细胞株的筛选:细胞融合10 d后观察融合效果,4块细胞培养板384孔中,有杂交瘤细胞克隆形成的有352孔,融合率为91.7%;采用间接ELISA和阻断ELISA检测,阳性52孔,阳性率为14.8%;3次亚克隆后筛选出4株杂交瘤细胞,分别命名为1F7、2B8、3G5、3D10。
杂交瘤细胞核型鉴定结果:小鼠脾细胞染色体数目为40,NS0染色体数目为62~68,获得的4株杂交瘤染色体数目平均分别为97.2、98.5、98.8和101,平均为98.8。
单克隆抗体同种型鉴定结果:用mAb同种型试剂盒鉴定,1F7、2B8、3G5、3D10同种型分别为IgG1/κ、IgG1/κ、IgG1/λ、IgG2a/κ。
杂交瘤细胞的稳定性测定结果:4株杂交瘤细胞冻存前细胞培养上清效价与冻存15、30和60 d复苏培养后上清效价基本一致,说明4株杂交瘤细胞分泌抗体的稳定性良好。
2.3Cu2+-EDTA mAb的免疫学特性鉴定
2.3.1效价测定由表1可知,杂交瘤细胞分泌的Cu2+-EDTA mAb具有较高的效价,2B8株的最高,其细胞培养液上清和腹水中抗体效价分别达到1∶(1.28×103)和1∶(5.12×105)。

表1 Cu2+-EDTA mAb的抗体效价检测结果
2.3.2敏感性测定由表2可知,4株单抗均有较好的敏感性。由图2可知,2B8株的敏感性最好,曲线回归方程为y=-36.916x+104.43,IC50为29.78 μg/L。

表2 Cu2+-EDTA mAb阻断ELISA抑制曲线的
2.3.3特异性鉴定由表3可知,2B8株mAb对Cu2+-EDTA的IC50为29.78 μg/L,对Zn2+-EDTA的IC50为114.56 μg/L,交叉反应率为26.0%,与EDTA及其他金属离子螯合物无交叉反应。
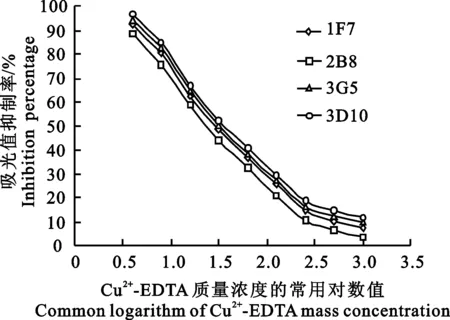
图2 Cu2+-EDTA mAb对Cu2+-EDTA
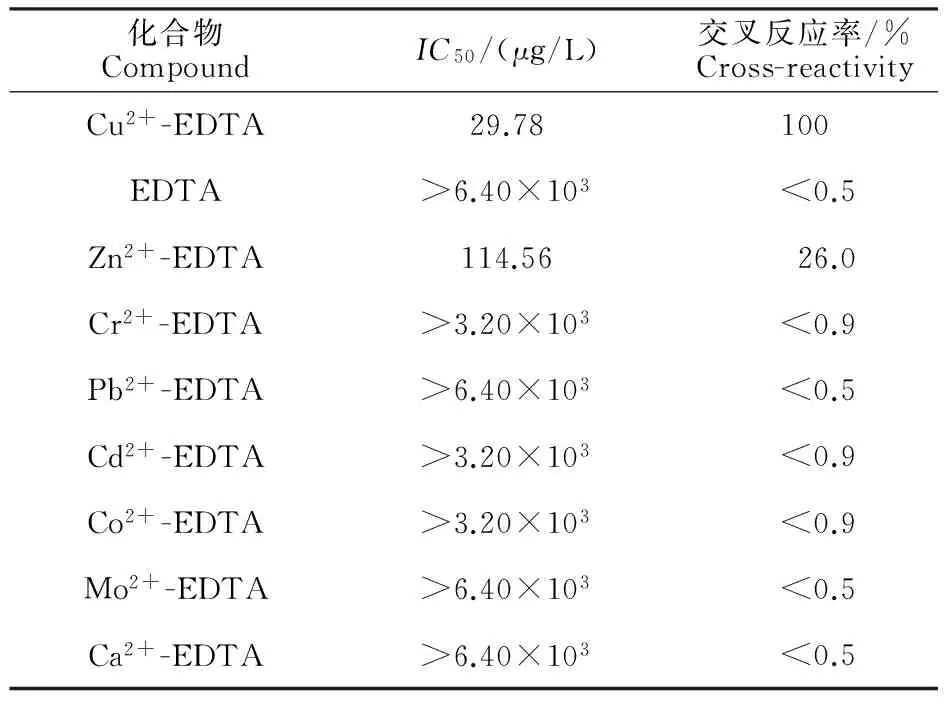
化合物CompoundIC50/(μg/L)交叉反应率/%Cross-reactivityCu2+-EDTA29.78100EDTA>6.40×103<0.5Zn2+-EDTA114.5626.0Cr2+-EDTA>3.20×103<0.9Pb2+-EDTA>6.40×103<0.5Cd2+-EDTA>3.20×103<0.9Co2+-EDTA>3.20×103<0.9Mo2+-EDTA>6.40×103<0.5Ca2+-EDTA>6.40×103<0.5
3讨 论
3.1细胞融合备用小鼠的选择
对于抗铜离子的人工抗原,不同的免疫剂量对小鼠的免疫效果有不同的影响,剂量过小无法刺激机体产生免疫反应,剂量过大会引起小鼠的应激反应,甚至产生肿瘤。本试验分别选择低剂量每只20 μg、中剂量每只60 μg、高剂量每只100 μg免疫小鼠,结果表明,低剂量免疫组的免疫效果最好,而高剂量免疫组中,5只小鼠有2只出现肿瘤。李俊锁等[10]和Cooper等[11]的研究也表明,小剂量、长间隔是免疫首选方案。本试验选择每只20 μg的免疫剂量、4周的免疫间隔,得到很好的免疫效果。
3.2杂交瘤细胞株的筛选
可靠的杂交瘤细胞筛选体系一般有3个要求,一是能准确测定上清效价,二是避免桥抗体的影响,三是能确定mAb的敏感性[12]。本试验采用间接ELISA和阻断ELISA同时筛选阳性杂交瘤细胞,以Cu2+-ITCBE-OVA作为包被原,间接ELISA测定上清效价,以Cu2+-EDTA为标准品,采用阻断ELISA确定阳性杂交瘤,可以简便地筛选出效价高、无桥抗体、敏感性强的目的杂交瘤细胞株。
3.3交叉反应
Love等[13]认为,螯合剂通过化学键与金属离子螯合,不同的金属离子使螯合剂构型发生不同的改变,这是决定抗原抗体识别的重要因素。Jones等[14]采用距离矩阵法发现Cd2+-EDTA与Hg2+-EDTA的三维结构差异最小,认为这是产生交叉反应的主要原因。郭常伟等[15]制备的抗Cu2+单克隆抗体,也与Zn2+出现较强的交叉反应。本试验中Cu2+-EDTA mAb与Zn2+-EDTA交叉反应率为26.0%,可能是因为铜与锌分子质量接近,离子半径接近,价态一样所致。
参考文献Reference:
[1]张振玉,刘燕.猪铜过多症的症状与防治[J].畜禽业,2012(1):92.
ZHANG ZH Y,LIU Y.The symptoms and prevention of excessive copper disease in pigs[J].LivestockandPoultryIndustry,2012(1):92(in Chinese).
[2]徐梅珍.猪铜中毒的探讨[J].当代畜牧,2014(2):71-72.
XU M ZH.Discussion of pig copper poisoning[J].ModernAnimalHusbandryandVeterinaryMedicine,2014(2):71-72(in Chinese).
[3]王磊,胡骁飞,张改平,等.食品中重金属检测方法研究进展[J].中国公共卫生,2012,28(10):1390-1392.
WANG L,HU X F,ZHANG G P,etal.The research progress of heavy metal detection in food[J].ChineseJournalofPublicHealth,2012,28(10):1390-1392(in Chinese).
[4]姜金庆,张海棠,范国英,等.19-去甲睾酮单克隆抗体的筛选及icELISA方法的建立[J].科学通报,2011,56(20):1622-1628.
JIANG J Q,ZHANG H T,FAN G Y,etal.Establishment of screening nortestosterone monoclonal antibody 19-methyltestosterone and icELISA method[J].ChineseScienceBulletin,2011,56(20):1622-1628(in Chinese with English abstract).
[5]李佩珊,张春燕,李时君,等.用多糖-破伤风类毒素结合苗制备抗流行性脑膜炎球菌多糖单克隆抗体[J].医药导报,2011,30(6):709-712.
LI P SH,ZHANG CH Y,LI SH J,etal.Preparation of monoclonal antibody against neisseria meningococcal serogroup a polysaccharide(gamp) by using the conjugate vaccine of both gamp and tetanus toxoid[J].HeraldofMedicine,2011,30(6):709-712(in Chinese with English abstract).
[6]范国英,王自良,姜金庆,等.重金属钼离子单抗的制备及其免疫学特性研究[J].西北农业学报,2015,24(4):1-5.
FAN G Y,WANG Z L,JIANG J Q,etal.Preparation and immunology character of monoclonal antibody of heavy metal ion molybdenum[J].ActaAgricultureBoreali-occidentalisSinica,2015,24(4):1-5(in Chinese with English abstract).
[7]DELEHANTY J B,JONES R M,BISHOP T C,etal.Identification of important residues in metal-chelate recognition by monoclonal antibodies[J].Biochemistry,2003,42(48):4173-4183.
[8]唐佳佳,李小兵,刘国文,等.跗关节免疫法抗镉单克隆抗体的制备[J].中国兽医科学,2011,41(9):936-940.
TANG J J,LI X B,LIU G W,etal.Production of two anti-cadmium monoclonal antibodies by hock immunizaton[J].ChineseVeterinaryScience,2011,41(9):936-940(in Chinese with English abstract).
[9]肖增鸿,黄昭亮,林月霞,等.腹水型单克隆抗体纯化方法的研究[J].中国医药生物技术,2013,8(6):425-428.
XIAO Z H,HUANG ZH L,LIN Y X,etal.Study on purification methods of monoclonal antibody from mouse ascites fluid[J].ChineseMedicineBiotechnology,2013,8(6):425-428(in Chinese with English abstract).
[10]李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002:43-47.
LI J S,QIU Y M,WANG CH.Veterinary Dug Residiues[M].Shanghai:Shanghai Science and Technology Press,2002:43-47(in Chinese).
[11]COOPER K M,CADDELL A,ELLIOTT C T,etal.Production and characterisation of polyclonal antibodies to a derivative of 3-amino-2-oxazolidinone,A-metabolite of the nitrofuran furazolidone[J].AnalyticalChemicalActa,2004,520(1):79-86.
[12]王自良,张改平,杨艳艳,等.抗苯巴比妥单克隆抗体杂交瘤细胞株的建立及其免疫学特性鉴定[J].核农学报,2006,20(4):336-340.
WANG Z L,ZHANG G P,YANG Y Y,etal.Generation and immunological traits of monoclonal antibody for phenobarbital[J].JournalofNuclearAgricultureScience,2006,20(4):336-340(in Chinese with English abstract).
[13]LOVE R A,VILLAFRANCA J E,AUST R M,etal.How the anti-(metal chelate) antibody CHA255 is specific for the metal ion of its antigen: X-ray structures for two Fab′/hapten complexes with different metal in the chelate[J].Biochemistry,1993,32(41):1095-1099.
[14]JONES R B,YU H,DELEHANTY J B,etal.Monoclonal antibodies that recognize minimal differences in the three-dimensional structures of metal-chelate complexes[J].BioconjugateChemistry,2002,13(3):408-415.
[15]郭常伟,唐勇,向军俭,等.重金属铜离子单克隆抗体的制备及其间接竞争ELISA检测方法的建立[J].中国生物制品学杂志,2011,24(6):720-723.
GUO CH W,TANG Y,XIANG J J,etal.Preparation of monoclonal antibody against heavy metal cupper ion and development of indirect competitive ELISA method[J].ChineseJournalofBiologicals,2011,24(6):720-723(in Chinese with English abstract).
Received 2016-01-15Returned2016-03-07
First authorSUN Yong, male, master student. Research area: the food safety of animal biotechnology.E-mail:412061790@qq.com
(责任编辑:顾玉兰Responsible editor:GU Yulan)
Preparation and Immunology Character of Monoclonal Antibody of Heavy Metal Ion Copper
SUN Yong, FU Shijie, QIN Baoliang, WANG Yanan,JIANG Jinqing and WANG Ziliang
(College of Animal Science, Henan Institute of Science and Technology, Xinxiang Henan453003, China)
AbstractTo produce efficient, sensitive and specific monoclonal antibody, the experimental mouse was selected from the composited Cu2+-ITCBE-BSA to immunize Balb/C mouse by the means of indirect ELISA and blocking ELISA, and monoclonal antibody was prepared by cell fusion technology. The results showed that four hybridoma cell lines characterized as powerful specificity and high sensitivity were obtained. The indirect ELISA titers of 2B8 were 1∶(1.28×103) in supernatant and 1∶(5.12×105) in ascites. The isotype of the 2B8 mAb was IgG1/κ. The Cu2+-EDTA-mAb showed that the IC50of mAb to Cu2+-EDTA was 29.78 μg/L, 26.0% cross-reactivity to Zn2+-EDTA and little or no cross-reactivity with other compounds. The prepared monoclonal antibody of Cu2+-EDTA can be used for immunoassay of Cu2+.
Key wordsCopper ion;Monoclonal antibody;Immunological properties
收稿日期:2016-01-15修回日期:2016-03-07
基金项目:“十二五”国家科技支撑计划(2011BAK10B01)。
通信作者:王自良,男,教授,研究方向为动物性食品安全生物技术。E-mail:wangziliang1966@163.com
中图分类号TS2071.3;S859.84
文献标志码A
文章编号1004-1389(2016)06-0836-05
Foundation itemThe “12th Five-year Plan” National Science and Technology Support Program(No.2011BAK10B01). WANG Ziliang, male, professor. Research area: the food safety of animal biotechnology. E-mail:wangziliang1966@163.com
网络出版日期:2016-06-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0914.014.html
第一作者:孙勇,男,硕士研究生,研究方向为动物性食品安全生物技术。E-mail:412061790@qq.com
