虾-贝-红树林耦合循环水养殖系统中微生物群落分析
2016-06-29翔闫茂仓肖国强柴雪良谢起浪浙江省海洋水产养殖研究所温州325005浙江省近岸水域生物资源开发与保护重点实验室温州325005
张 翔闫茂仓肖国强柴雪良谢起浪(1.浙江省海洋水产养殖研究所,温州 325005; 2.浙江省近岸水域生物资源开发与保护重点实验室,温州 325005)
虾-贝-红树林耦合循环水养殖系统中微生物群落分析
张 翔1,2闫茂仓1,2肖国强1,2柴雪良1,2谢起浪1,2
(1.浙江省海洋水产养殖研究所,温州 325005; 2.浙江省近岸水域生物资源开发与保护重点实验室,温州 325005)
摘要:海水循环水养殖系统是重要的生态养殖模式发展趋势之一,为了深入了解循环水养殖生态系统,通过对系统各功能区水体中细菌16S rDNA基因V4—V5区进行高通量测序和生物信息学分析,从微生物生态学角度分析了循环水养殖系统不同功能区的细菌群落结构动态。测序分析结果显示,海水循环水养殖系统中优势细菌种群分别属于变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)。红树林湿地水体中变形菌门和厚壁菌门丰度较高,而对虾养殖池的拟杆菌门和浮霉菌门丰度较高。在不同优势类群中,变形菌门多样性指数平均值最高,其次是拟杆菌门,厚壁菌门最低。在各功能区中,红树林细菌多样性最高,虾池最低。MDS分析结果显示虾池、贝池和红树林湿地水体中细菌群落结构有明显差异,虾池与其他功能区差异最大。研究表明,高密度对虾养殖对虾池水体中细菌群落有显著影响,但其影响在循环水养殖系统后续功能区中逐渐减弱。
关键词:浮游细菌; 循环水系统; 红树林人工湿地; 高通量测序; 16S rDNA
海水对虾养殖通常是在临近海岸线的池塘中进行,以方便换水,保持池塘水质清新,然而,进入池塘的海水也会含有病毒和细菌性病原体,这将给海水养殖带来潜在风险。此外,养殖尾水的直接排放将破坏周边水体生态环境,同时导致近海海域水体富营养化程度进一步加深,所以海水养殖池塘的尾水排放一直是海水养殖业与海洋环境和谐发展的关键问题[1,2]。循环水养殖系统(Recirculating Aquaculture System,RAS)提供了解决以上两个问题的方法,能通过最大化减少水需求,从而将病原输入和污染输出最小化[3]。海水循环水养殖系统是利用生态学原理,将若干个功能区,例如人工湿地、排水沟、养殖池塘、生态净化池等有机地结合在一起,从而构建成尾水零排放的新型生态安全养殖系统。
在循环水养殖系统中,为了养殖对象的健康生长,除了日常监测和管理溶解氧和氮磷水平外,对于定植于其中的微生物种群进行管理同样十分重要。微生物作为海水循环水养殖系统的关键部分,在人工湿地和养殖池塘中执行着重要功能,包括有机碎屑的分解和矿化、氮磷等营养元素的转化、直接作为饵料提供给养殖对象等等[4,5]。同时,病原性微生物的数量和种类又与水产动物的疾病发生率和死亡率相关,直接影响着海水养殖的收益。特别是异养细菌在溶解氧消耗、代谢副产物释放方面有着重要影响,并最终与自养细菌竞争溶解氧和生存空间[6,7]。因此,虽然我们知道循环水系统中水质好坏依赖于微生物群落,但对于其中大部分微生物尚未有详细研究[8]。先前的环境微生物多样性研究多基于DNA指纹图谱(例如DGGE)和16S rDNA基因克隆文库技术[8,9],但受技术本身所限,难以全面深入地解析细菌群落结构。随着高通量测序技术的发展,基于16S rDNA基因片段的高通量测序逐渐成为微生物群落组成研究的主要手段,其最大的优势在于能够全面的解析微生物群落中的细菌种类和丰度。
本文以红树林人工湿地-海水养殖耦合系统为研究对象,通过对养殖水体中细菌16S rDNA V4—V5区的高通量测序,分析了该系统中微生物群落组成,揭示了不同功能区微生物群落的差异,为循环水养殖系统的运行管理及改良提供了科学依据。
1 材料与方法
1.1 采样站点
浙江温州某养殖基地构建了一套海水多生态位耦合设施化循环水养殖系统。该循环水养殖系统主要由高位精养池、循环水渠、贝类养殖池、红树林人工湿地、生态净化池和砂滤池等组成,通过循环水渠、管道、水泵等设施实现养殖尾水的净化和再利用。高位池为全封闭式,使用循环水养殖系统砂滤水作为进水,养殖对象为南美白对虾,养殖期间全天进行底增氧曝气。贝类养殖池养殖对象为文蛤和泥蚶,露天开放式养殖,除接收虾池尾水外,不再进行肥水。红树林湿地种植秋茄,秋茄平均株高1.5 m左右。采样站点设置于各个功能区,包括对虾养殖池(S1)、贝类养殖池A(S2)和B(S3)、红树林湿地进水口(S4)和出水口(S5)、生态净化池(S6)。采集各个功能区中上层水样,每个水样100 mL用2片无菌滤膜(Millipore,0.22 μm)进行抽滤,然后将滤膜封装于自封袋中,冻存于-80℃超低温冰箱,保存至DNA提取。
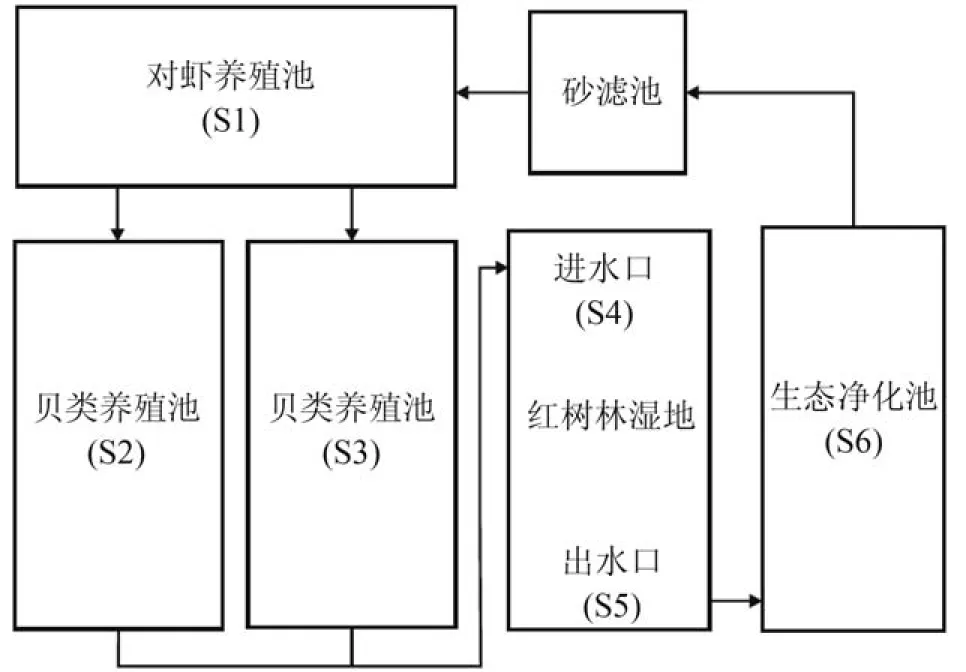
图 1 循环水养殖系统排水流程示意图
1.2 DNA提取和MiSeq高通量测序
将滤膜用灭菌手术剪剪碎,放入50 mL无菌离心管中,利用水体环境基因组提取试剂盒Water DNA kit(Omega)提取滤膜中环境基因组DNA,1.5%琼脂糖凝胶电泳进行质量检测。
PCR在ABI GeneAmp 9700 型热循环仪中进行,引物为515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′),每个样品3个重复。PCR反应采用TransGen 20 μL体系,其组分为:5×FastPfu buffer,4 μL; 2.5 mmol/L dNTPs,2 μL; 5 μmol/L 正反向引物各0.8 μL;FastPfu DNA聚合酶(10 U/μL),0.4 μL; 模板DNA 10 ng; 加灭菌ddH2O补足至20 μL。PCR反应参数如下:95℃预变性3min,然后95℃变性30s; 55℃退火30s; 72℃延伸30s,共计28个循环,最后72℃延伸10min。将同一样品的PCR 产物混合后用2%琼脂糖凝胶电泳检测。使用AxyPrepDNA凝胶回收试剂盒(AXYGEN)切胶回收PCR产物,TE洗脱液洗脱,2%琼脂糖电泳进行检测。PCR产物定量后利用Illumina Miseq PE250平台进行高通量测序。
1.3 数据统计分析
根据Barcode序列将下机数据拆分为不同样品数据,并截去Barcode序列和PCR扩增引物序列。使用FLASH Version 1.2.7对各样品reads进行拼接并进行处理得到高质量Tags数据,并利用Qiime Version 1.7.0检测并去除嵌合体序列。之后将Tags序列与数据库(Gold database)进行比对(UCHIME algorithm)。利用Uparse Version 7.0.1001 对所有样品重采样的有效序列进行聚类,默认将具有97%一致性的序列聚类成为操作分类单元(Operational taxonomic unit,OTU)。将Uparse构建OTU时选取的代表性序列与Silva 119库比对,得到每个OTU的分类学信息,每个OTU在数据分析中被视为一种细菌。
使用R语言(R version 3.1.3)中的vegan程序包计算各个采样站点间细菌群落OTU的布雷柯蒂斯(Bray-Curtis)距离矩阵,然后通过生物统计软件XLSTAT 2014进行多维尺度分析(MultiDimensional Scaling,MDS)并作图。选取各个站点中OTU数量所占比例超过总数1%的细菌,利用R语言(R version 3.1.3)作热图。细菌类群多样性采用Shannon-Wiener 指数(H′)表示,H′可反映细菌种群物种多样性的差异。
2 结果
2.1 高通量测序质量分析
对各样品中Miseq高通量测序结果进行统计分析,结果表明所有样品的测序覆盖率全部达到99%以上,测序结果能较好地反映不同采样站点浮游细菌的群落组成。海水循环水养殖系统不同功能区的有效OTU 数量平均值为425.17,其中虾贝养殖池(S1—S3)的OTU数量低于平均值,而经过红树林人工湿地处理后的水样(S4—S6)高于平均值(表 1)。
通过随机抽取的序列数及其所含的OTU 数量构建高通量测序的稀释曲线(图 2),结果显示,所有样品的稀释曲线均随有效序列数量的增加而趋于平缓,这表明测序获得的有效OTU数量较好地反映浮游细菌的物种多样性。
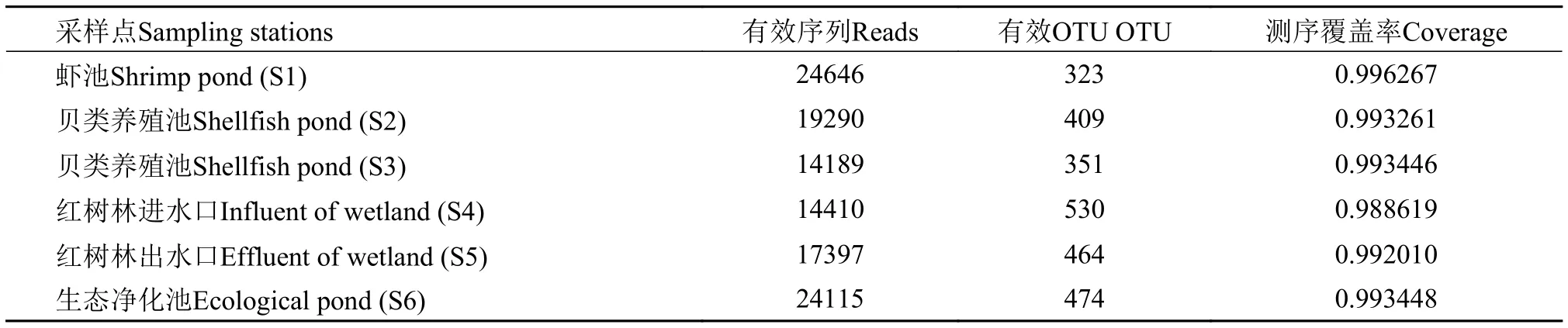
表 1 各样品高通量测序结果分析Tab.1 The analysis of the high-through sequencing results
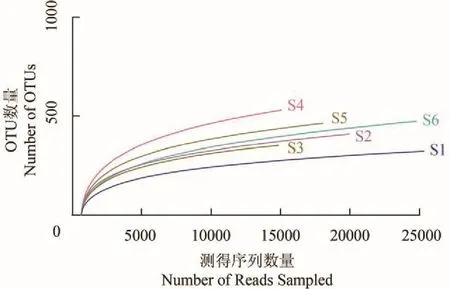
图 2 各样点高通量测序结果的稀释曲线
2.2 各功能区微生物群落组成分析
细菌分类学信息显示,海水循环水养殖系统中的优势细菌种群分别属于变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)(图3)。如表 2所示,不同采样站点中6个优势细菌类群共占细菌OTU总数的97%—99%,同时不同站点间细菌种群相对丰度变化明显,结果显示:对虾养殖池(S1)拟杆菌和浮霉菌丰度明显高于其他站点; 贝类养殖池(S2—S3)变形菌和厚壁菌平均丰度低于经红树林湿地处理后的各个站点(S4—S6),而蓝藻丰度则较高。对测序结果进行相似性聚类(图 3)和MDS分析(图 4),结果显示红树林进水(S4)、出水(S5)和生态净化池(S6)较为相似,其次是两个贝类养殖池(S2、S3),而对虾养殖池(S1)与其他站点相似性较低。
选取所有样品中占1%以上的优势细菌种群构建热图。结果显示,占细菌总数比例超过1%的O T U共4 4种,在各站点所占总比例分别为84%(S1)、77%(S2)、78%(S3)、67%(S4)、73%(S5)和80%(S6)(图 5)。虾池中丰度较高的OTU分别属于芽孢杆菌属、蓝藻、黄杆菌目、腐螺旋菌科、浮霉菌、鞘脂杆菌目、红细菌科; 红树林湿地与虾池差异明显,丰度较高的OTU分别属于芽孢杆菌属、聚球藻属、酸微菌科、乳球菌属、微杆菌科和变形菌SAR11演化枝。
2.3 各功能区细菌类群分析
计算了各个采样站点优势门类细菌的Shannon-Wiener多样性指数(H'),结果显示(图 6)变形菌门多样性指数平均值最高,其次是拟杆菌门,最低为厚壁菌门。同时,对虾养殖池(S1)各个门类细菌多样性均低于其他站点,厚壁菌门除外。而红树林进水处(S4)各个门类细菌多样性均高于其他站点,放线菌除外。
通过MDS分析了各个优势类群的采样点间群落组成差异(图 7),结果显示不同优势菌群的空间变化规律并不一致,其中除厚壁菌门,其他优势细菌类群空间分布模式与总细菌类似,均显示S1明显与其他站点不同。而厚壁菌MDS分析仅将贝类养殖池(S2、S3)与其他站点区分开,S1与其他站点聚为一类。

图 3 循环水养殖系统浮游细菌群落结构组成
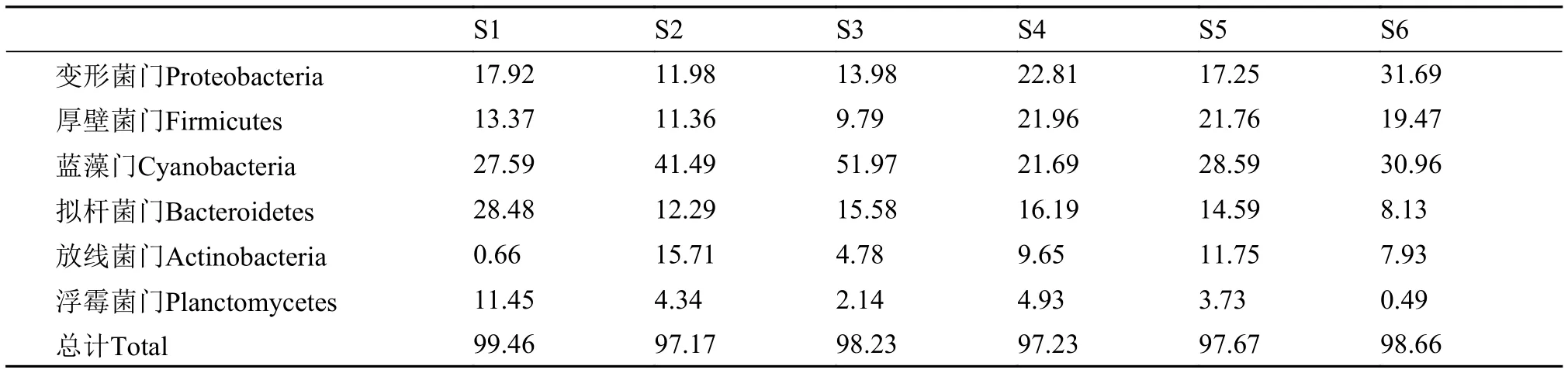
表 2 优势细菌类群在不同站点细菌OTU中所占比例Tab.2 OTU ratio of dominant bacterial subgroups in different stations(%)
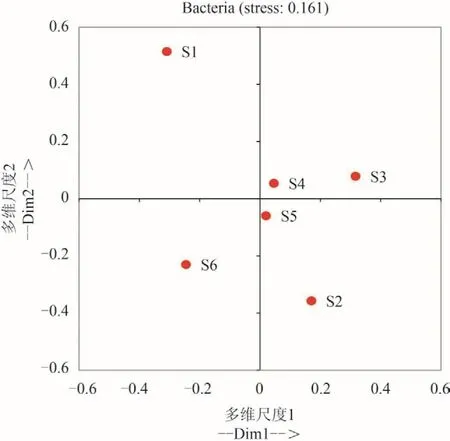
图 4 环水养殖系统浮游细菌群落多维尺度分析
3 讨论
红树林人工湿地-虾贝养殖耦合系统作为海水循环水养殖系统,通过循环水渠、管道、水泵等设施将对虾高位池、贝类养殖池、红树林人工湿地和生态净化池串联成一个有机整体,利用红树林人工湿地去除水体中的氮磷和颗粒悬浮物,不但能有效地增加海水利用率,减少尾水排放,而且能明显改善水质,提高水产品质量。为了揭示整个循环水养殖系统中浮游细菌动态,为系统管理提供依据,本文通过高通量测序技术研究了各个站点的细菌群落结构和空间差异。
南美白对虾进行高密度养殖时,由于饲料供给充足导致对虾产生排泄物的过程十分迅速,有研究表明其肠道通过时间会缩短30%—60%[10,11],这意味着高密度养殖模式下养殖水体与对虾肠道的微生物交换更加频繁,水体中细菌群落对南美白对虾健康影响也更大。在本研究中,对虾养殖池中拟杆菌和浮霉菌在总细菌中所占比例明显高于循环水养殖系统其他功能区,在虾池排水进入贝类养殖池塘后,拟杆菌和浮霉菌所占比例已明显下降。之前的研究报道海水中拟杆菌大量存在于水中悬浮颗粒物上,而自由生活的拟杆菌相对较少[12],这可能暗示了拟杆菌在虾池水体有机悬浮颗粒(虾粪和残饵)上丰度较大,而在后续功能区有机颗粒物减少,从而引起拟杆菌丰度降低。同时有研究发现浮霉菌参与反硝化作用[13],在高污染的膜上丰度相对较大[14],这表明虾池水体中较高的污染物含量可能导致浮霉菌丰度进一步提高,而后续功能区中浮霉菌丰度随污染物浓度降低。
Zhang等[15]研究了湖泊中不同细菌类群组成的空间动态,结果表明厚壁菌空间异质性与其他细菌类群明显不同,不同站点间群落结构相似度高。在本研究中同样发现由于厚壁菌群落多样性较低(0.5 图 6 采样站点优势细菌类群Shannon-Wiener多样性指数 人工湿地技术建设成本、运行费用低,并且管理方便,在污水处理技术中环境和生态效益兼而有之。人工湿地是通过植物根系-基质-微生物的共同作用去除水体中的污染物[17,18]。由于海水养殖中海洋废水的盐度效应,在人工湿地技术中针对海水养殖废水处理的可选择植物较少,而红树植物是海水人工湿地技术中重要组成部分。红树植物对于海水环境中污染物去除起着重要作用,李飞等[19]研究表明,种植红树的池塘中牡蛎石油烃含量显著低于未种植红树的对照塘(P < 0.05)。在本研究中,人工湿地采用盐生红树植物秋茄作为湿地植物,建设了表面流人工湿地,与虾贝养殖池塘(S1-S3)相比,红树林水体环境(S4、S5)微生物OTU数量明显增加(表1),红树林出水所带的细菌有可能增强了生态净化池的净化作用。Lexonard等[20]研究发现循环水养殖系统中生物滤膜表层细菌会脱离滤膜进入水中,导致过滤后水中细菌总数较过滤前提高25%。本研究同样发现红树林湿地使得后续生态净化池中细菌OTU数量高于虾贝养殖池。孙静等[21]研究发现红树林土壤中变形菌和厚壁菌是优势菌群,分别占66%和19%。在本研究中红树林湿地水体中变形菌和厚壁菌所占比例高于贝类养殖池,这可能是由于红树林湿地土壤中的大量变形菌和厚壁菌在水流作用下,从土壤逸出进入水体所致。 图 7 各采样站点在细菌门水平的多维尺度分析 综上所述,海水循环水养殖系统中优势细菌种群分别属于变形菌门、蓝藻门、拟杆菌门、厚壁菌门、放线菌门和浮霉菌门。在各个功能区水体中,红树林湿地变形菌和厚壁菌丰度较高,贝类养殖池蓝藻丰度较高,而对虾养殖池的拟杆菌和浮霉菌丰度较高。在不同优势类群中,变形菌门多样性指数平均值最高,其次是拟杆菌门,厚壁菌门最低。同时,对虾养殖池细菌类群多样性均低于其他站点,厚壁菌门除外。而红树林进水处各个门类细菌多样性均高于其他站点,放线菌除外。MDS分析结果显示对虾池、贝池和红树林湿地细菌群落有明显差异,其中对虾池与其他功能区的差异最大。 参 考 文 献: [1]Lotz J M.Disease control and pathogen status assurance in an SPF-based shrimp aquaculture industry,with particular reference to the United States[A].In:Flegel T W,MacRae I H(Eds.),Diseases in Asian Aquaculture Ⅲ,Fish Health Section[C].Manila,Philippines,Asian Fisheries Society.1997,243—254 [2]Naylor R,Burke M.Aquaculture and ocean resources:raising tigers of the sea[J].Annual Review of Environment and Resources,2005,30:185—218 [3]Moss S M.Dietary importance of microbes and detritus in penaeid shrimp aquaculture[A].In:Lee C S,O'Bryen P(Eds.),Microbial Approaches to Aquatic Nutrition within Environmentally Sound Aquaculture Production Systems[C].Baton Rouge,Louisiana,World Aquaculture Society.2002,1—9 [4]Balcxazar J L,de Blas I,Ruiz-Zarzuela I,et al.The role of probiotics in aquaculture[J].Veterinary Microbiology,2006,114(3—4):173—186 [5]Itoi S,Niki A,Sugita H.Changes in microbial communities associated with the conditioning of filter material in recirculating aquaculture systems of the pufferfish Takifugu rubripes[J].Aquaculture,2006,256(1—4):287—295 [6]Lexonard N,Guiraud J P,Gasset E,et al.Bacteria and nutrients-nitrogen and carbon- in a recirculating system for sea bass production[J].Aquacultural Engineering,2002,26(2):111—127 [7]Michaud L,Blancheton J P,Bruni V,et al.Effect of particulate organic carbon on heterotrophic bacterial populations and nitrification efficiency in biological filters[J].Aquacultural Engineering,2006,34(3):224—233 [8]Sugita H,Nakamura H,Shimada T.Microbial communities associated with filter materials in recirculating aquaculture systems of freshwater fish[J].Aquaculture,2005,243(1—4):403—409 [9]Zhu P,Ye Y,Pei F,et al.Characterizing the structural diversity of a bacterial community associated with filter materials in recirculating aquaculture systems of Scortum barcoo[J].Canadian Journal of Microbiology,2012,58(3):303—310 [10]Beseres J J,Lawrence A L,Feller R J.Practical equivalence of laboratory and field measurements of gut passage time in two penaeid shrimp species[J].Marine Ecology Progress Series,2006,309:221—231 [11]Beardsley C,Moss S,Malfatti F,et al.Quantitative role of shrimp fecal bacteria in organic matter fluxes in a recirculating shrimp aquaculture system[J].FEMS Microbiology Ecology,2011,77(1):134—145 [12]Mohita V,Archambaultb P,Toupointb N,et al.Phylogenetic differences in attached and free-living bacterial communities in a temperate coastal lagoon during summer,revealed via high-throughput 16S rDNA gene sequencing[J].Applied and Environmental Microbiology,2014,80(7):2071—2083 [13]Qian Z S,Fu L,Ding J,et al.Enrichment of denitrifying anaerobic methane oxidation microbes in a hollow fiber membrane bioreactor[J].Journal of University of Science and Technology of China,2014,44(11):887—892[钱祝胜,付亮,丁静,等,中空纤维膜生物反应器富集反硝化厌氧甲烷氧化菌群的研究.中国科学技术大学学报,2014,44(11):887—892] [14]Tang J X,Wang Z W,Ma J X,et al.Identifying predominant strains causing membrane biofouling by using 454 high-throughput pyrosequencing[J].Microbiology China,2014,41(2):391—398[唐霁旭,王志伟,马金星,等.454高通量焦磷酸测序法鉴定膜生物反应器膜污染优势菌种.微生物学通报,2014,41(2):391—398] [15]Zhang X,Yan Q Y,Yu Y H,et al.Spatiotemporal pattern of bacterioplankton in Donghu Lake[J].Chinese Journal of Oceanology and Limnology,2014,32(3):554—564 [16]Yao Y D,Li G,Tao L,et al.Bacterial diversity investigation on an integrated system of constructed wetland and pond aquaculture[J].Environmental Science & Technology,2011,34(7):50—55[姚延丹,李谷,陶玲,等.复合人工湿地-池塘养殖生态系统细菌多样性研究.环境科学与技术,2011,34(7):50—55] [17]Xiong J,Guo G,Mahmood Q,et al.Nitrogen removal from secondary effluent by using integrated constructed wetland system[J].Ecological Engineering,2011,37(4):659—662 [18]Maltais-Landry G,Maranger R,Brisson J,et al.Nitrogen transformations and retention in planted and artificially aerated constructed wetlands[J].Water Research,2009,43(2):535—545 [19]Li F,Liu Y,Chen G Q,et al.Petroleum Hydrocarbon content in oyster and purifying effect of mangrove in mangrove plantation-aquaculture coupling systems[J].Chinese Journal of Applied and Environmental Biology,2012,18(3):432—437[李飞,刘玉,陈冠秋,等.红树种植-养殖耦合系统牡蛎石油烃含量及红树净化效果.应用与环境生物学报,2012,18(3):432—437] [20]Le′onard N,Blancheton J P,Guiraud J P.Populations of heterotrophic bacteria in an experimental recirculating aquaculture system[J].Aquacultural Engineering,2000,22(1—2):109—120 [21]Sun J,Wang S Y,Zhang D C.Diversity of culturable bacteria from the soil of root system of mangrove forest of Beigang island in Hainan Province[J].Marine Sciences,2014,38(7):27—33[孙静,王素英,张德超.海南红树林根系土壤中可培养细菌的多样性分析.海洋科学,2014,38(7):27—33] ANALYSIS OF MICROBIAL COMMUNITY STRUCTURE IN MANGROVE CONSTRUCTED WETLAND-MARICULTURE COUPLING SYSTEM ZHANG Xiang1,2,YAN Mao-Cang1,2,XIAO Guo-Qiang1,2,CHAI Xue-Liang1,2and XIE Qi-Lang1,2 Abstract:Bacteria play a key role in the biological geochemical cycle and degradation of organic contamination in pond ecosystem.It is important to understand the dynamics of bacterial community structure in recirculating aquaculture system during shrimp and shellfish rearing.In this study,bacterioplankton community structure in mangrove constructed wetland-mariculture coupling system was investigated by using high-throughput sequencing with 16S rDNA.High-throughput sequencing analysis indicated that the dominant OTUs were Proteobacteria,Cyanobacteria,Bacteroidetes,Firmicutes,Actinobacteria and Planctomycetes.Proteobacteria and firmicutes were the most dominant phyla in mangrove wetland,while bacteroidetes and planctomycetes were the most abundant in shrimp pond.The analysis of Shannon-Wiener indices inferred that proteobacteria communities were the highest,whereas firmicutes were the lowest.The diversity of bacterial phyla in shrimp pond was lower than that of the other station(except firmicutes),whereas the diversity of bacterial phyla in mangrove wetland was higher than that of the other station(except actinobacteria).Multidimensional scaling revealed the changes in the microbial community structure of different stations.The microbial community structure in shrimp pond was markedly different from other stations in recirculating mariculture system,suggesting that shrimp farming has a great influence on bacterioplankton community structure. Key words:Bacterioplankton; Recirculating aquaculture system; Mangrove constructed wetland; High-throughput sequencing; 16S rDNA 中图分类号:Q145+.2 文献标识码:A 文章编号:1000-3207(2016)03-0557-08 doi:10.7541/2016.75 收稿日期:2015-07-10; 修订日期:2015-12-14 基金项目:浙江省重大科技专项(2012C12017-3); 国家贝类产业技术体系(CARS-48); 国家虾产业技术体系温州综合试验站(CARS-47); 浙江省科技计划项目(2012F20029,2014F30025); 温州市科技计划项目(2011N0006,S20130008)资助[Supported by the Major Science and Technology Projects of Zhejiang Province(2012C12017-3); Zhejiang Mollusk Experiment Station,CARS(CARS-48);Wenzhou Shrimp Experiment Station,CARS(CARS-47); Zhejiang Science and Technology Project(2012F20029,2014F30025);Wenzhou Science and Technology Project(2011N0006,S20130008)] 作者简介:张翔(1982—),男,湖北黄石人; 博士; 主要研究方向为海水养殖微生物分子生态学。E-mail:jhon618@sohu.com 通信作者:闫茂仓,副研究员; E-mail:yanmaocang@126.com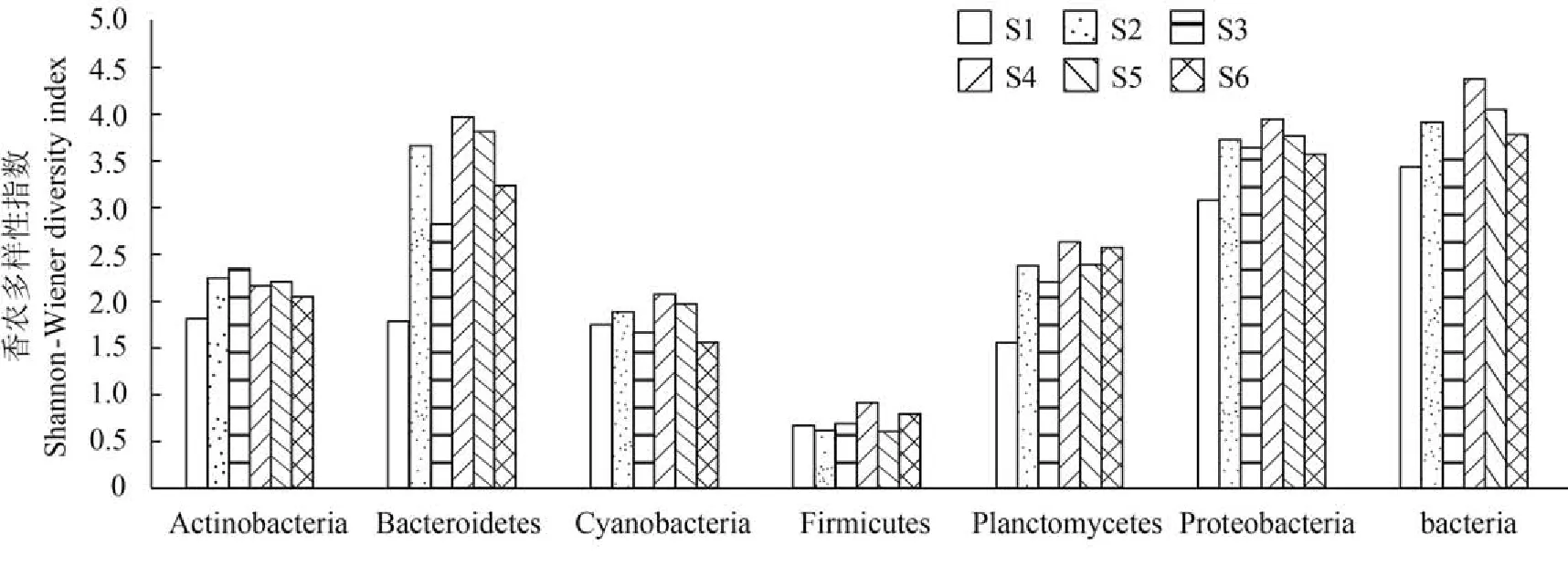

(1.Zhejiang Mariculture Research Institute,Wenzhou 325005,China; 2.Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bioresource,Wenzhou 325005,China)
