叶绿素荧光动力学检测塑化剂对尖细栅藻的毒性效应
2016-06-29刘常青谢慕赵剑周香君付陶然陈兰洲武汉大学资源与环境学院武汉430072孝感市中心医院孝感432000
刘常青谢 慕赵 剑周香君付陶然陈兰洲(.武汉大学资源与环境学院,武汉 430072; 2.孝感市中心医院,孝感 432000)
叶绿素荧光动力学检测塑化剂对尖细栅藻的毒性效应
刘常青1,2谢 慕1赵 剑1周香君1付陶然1陈兰洲1
(1.武汉大学资源与环境学院,武汉 430072; 2.孝感市中心医院,孝感 432000)
摘要:以汉江水华藻类尖细栅藻Scenedesmus acuminatus为材料,研究了塑化剂(邻苯二甲酸二异辛酯,DEHP)对其光合系统的毒性效应。以不同浓度的DEHP处理S.acuminatus,分析其光合系统电子传递特征及相关参数,以及快速叶绿素荧光诱导动力曲线,发现低浓度的DEHP(10 mg/L)对S.acuminatus活性反应中心的电子传递链中�的还原有促进作用,而高浓度(50—100 mg/L)则显著抑制; 光合活性则与DEHP浓度呈效应-剂量关系,最大光化学效率降低; 同时DEHP显著降低SOD活性,增加MDA含量,而且随DEHP浓度升高,处理时间的延长,效果越明显。研究结果表明,DEHP处理对S.acuminatus的光合系统传递链和抗氧化系统有一定的影响,说明快速荧光动力方法能够应用于DEHP毒性效应的快速检测。
关键词:尖细栅藻; 塑化剂; 毒性效应; 快速荧光动力曲线; 光合系统
邻苯二甲酸二异辛酯(di-2-ethylhexylphthalate,DEHP)作为增塑剂,应用于塑料薄膜(特别是聚氯乙烯PVC)的生产加工过程中[1]。DEHP在PVC中用量为30%,其主要作用为可使塑料软化。DEHP在环境中比较稳定且难以降解,如室温条件下进入土壤的DEHP在6个月后仍有75%—90%的残留[2,3]。DEHP在动物体内,首先是在脂肪酶作用下水解为水溶性代谢产物,而MEHP及其他代谢产物在细胞内发挥毒性作用[4]。研究发现,将血液保存于含DEHP的塑料血袋内后,因红细胞膜发生脂质过氧化反应导致血细胞溶血加剧。小鼠和藻细胞中DEHP诱导活性氧(ROS)以及氧化应激反应的发生,可能是造成毒性作用的主要原因[5—7]。
随着经济社会发展加快,DEHP的使用量逐年上升,导致水体和土壤中塑化剂污染也日益增强。作为在众多水体中均存在的典型污染物,邻苯二甲酸酯(PAEs)在汉江中检出多达53种[8]。作为水生生态系统第一营养级的藻类,汉江水华藻类尖细栅藻(Scenedesmus acuminatus)往往直接暴露在水体中塑化剂的毒性作用下。由于其细胞结构简单,对毒性作用敏感,研究其生理效应对水体中塑化剂浓度的响应,特别是藻体叶绿素荧光诱导动力(OJIP-test)及电子传递链等快速变化反应[9],对于评估塑化剂的毒害作用,有重要参考意义。
1 材料与方法
1.1 藻类培养及DEHP处理
尖细栅藻(Scenedesmus acuminatus)为汉江水华优势藻类,由中国科学院水生生物研究所淡水藻类典型培养物保藏中心(编号:FACHB-1221)提供。采用BG-11培养基,于光照培养箱中恒温(25±1)℃,24h持续光照,光强50 μE/(m2·s),通气培养。取50 mL对数期尖细栅藻的藻液,4500 r/min的速度下离心10min,离心后藻培养物待用。
取4个盛有50 mL灭菌BG-11培养液的三角烧瓶,分别加入0、10、50和100 mg/L邻苯二甲酸二异辛酯(DEHP,98%+)及25 μL二甲亚砜(DMSO),然后于25℃、100 W功率进行超声振荡,并快速摇匀,直至培养基呈乳化状并无油状DEHP漂浮在液体表面。随后将离心后的藻培养物加入DEHP培养基中,充分混匀,震荡培养,分别处理1—4d。
1.2 叶绿素荧光动力学参数测定
取不同浓度塑化剂处理藻液,以变携式植物效率分析仪(PEA,Hansatech,U.K.)测定叶绿素a荧光。激发光强为最大光强的50%[约1500 μE/(m2·s)],暗适应时间不少于10min,记录时间为5s。连续激发式荧光仪(PEA)主要是通过短时间照光后荧光信号的瞬时变化反映暗反应活化前PSⅡ的光化学变化,记录从10μs 最长到300s(Handy-PEA)内不同时间的荧光信号,并根据等方法计算光合电子传递参数变化[9]。
1.3 叶绿素含量、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性的测定
取不同浓度塑化剂处理后藻液,7000 r/min离心10min,弃去上清液,加入80%的丙酮充分研磨,在4℃下黑暗抽提24h,7000r/min离心10min,测定750、663、645和630 nm处的吸光度值,以傅若农等[10]方法计算叶绿素a、b含量。
另取2 mL藻液,以硫代巴比妥酸法测定丙二醛含量[11]; 取藻液10 mL,以氮蓝四唑(NBT)法测定其超氧化物歧化酶(SOD)活性[11]。
1.4 数据分析
用origin 8.0进行数据处理,数据分析采用 oneway analysis of variance(ANOVA),结果为多次实验结果的平均值(n≥3)。
2 结果
2.1 DEHP胁迫下快速叶绿素荧光动力曲线
如图 1所示,以0、10、50和100 mg/L DEHP处理1d后,尖细栅藻荧光强度随浓度O、J、I、P相变化正常,但低浓度的DEHP(10 mg/L)对S.acuminatus活性反应中心的电子传递链中的还原有促进作用,而高浓度(100 mg/L)则变化不显著; 处理2d后,不同浓度DEHP处理的荧光强度值均低于对照组,但O、J、I、P相形状保持正常; 处理3d后,各浓度荧光动力学曲线的荧光强度显著低于对照组,并随浓度继续增加荧光产量下降; 处理4d后,荧光强度均显著低于对照组,并随浓度增加荧光产量显著下降,J相变化显著,表明反应中心的荧光产量有显著影响。
2.2 DEHP胁迫下电子传递链参数变化
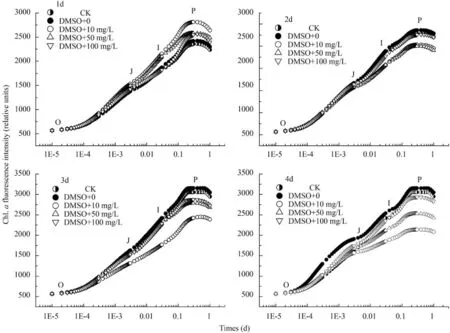
图 1 不同浓度DEHP处理下尖细栅藻的快速叶绿素荧光诱导动力学曲线变化
根据不同浓度的DEHP胁迫下尖细栅藻的叶绿素荧光诱导动力学曲线的参数变化情况(表 1),单位面积内反应中心数量(RC-CSM)减小,但100 mg/L处理4d时差别显著(P<0.05); 而单位反应中心吸收的光能(ABS/RC)随处理时间而增加,但高浓度在3—4d差别显著(P<0.05),而单位反应中心捕获的用于电子传递的能量(ET0/RC)变化不大,对藻细胞吸收的光能无明显变化,同时也增加了用于氧化态接受电子被还原的能量。

表 1 不同浓度DEHP胁迫下尖细栅藻的快速叶绿素荧光诱导动力学参数变化Tab.1 The parameters of chlorophyll fluorescence induction kinetics under different levels of DEHP concentrations in S.acuminatus.
由图 2可发现,DEHP对于尖细栅藻光合作用效率的影响,随时间的增加,其最大光化学效率逐渐降低,且DEHP浓度越大,降低速率越快,在处理3d后,100 mg/L处理组的Fv/Fm下降明显(P<0.05)。表明DEHP与光合效率在一定范围内存在剂量-效应关系。
2.3 DEHP胁迫对叶绿素含量的影响

图 2 不同浓度DEHP对尖细栅藻最大光化学效率(Fv/Fm)的影响
如图 3所示,处理1d后,各浓度下细胞叶绿素a和b含量均增加,10 mg/L处理组增加值最高; 随处理时间的延长,叶绿素含量逐渐下降,但仍高于对照组; 50 mg/L处理2d时,叶绿素a含量基本恢复到原有水平,3d时有显著回升,较对照组增加;100 mg/L处理组在最初受到DEHP时小幅度增加,但随后随时间增加,叶绿素a和b含量显著减少。总体上,叶绿素b对DEHP的敏感程度要强于叶绿素a,变化更明显; 浓度越大,DEHP胁迫对尖细栅藻叶绿素含量的影响越大,但破坏作用不明显。
2.4 丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性变化
丙二醛是细胞膜脂质发生过氧化反应的产物。如图 4所示,在加入DEHP后MDA含量明显高于对照组,随时间累积,MDA含量增加; 并且DEHP浓度越大,其增加速率越快,100 mg/L 处理4d后MDA含量已为对照组的4.3倍,证明藻细胞内发生了严重的膜脂质过氧化。
如图 5所示,在加入DEHP后,藻细胞内SOD的活性均下降。总体来说,其浓度越大,SOD的下降幅度也越大,且这种变化随时间的增加而持续进行。10 mg/L 处理组在3d后SOD酶仅为对照组的85.6%,而100 mg/L处理组在3d后SOD值下降到对照组的62%。
3 讨论
藻类在遭遇外源污染物处理时,其光合系统PSII往往首先受到影响。而单细胞藻类由于细胞结构简单,对外源污染物导致的胁迫往往很灵敏,其叶绿素荧光产量及电子传递链速率等参数也很容易发生变化,因而快速叶绿素荧光(OJIP-test)作为光合作用能量转换的天然探针,含有极其丰富的光合作用信息,被广泛应用于研究和探测逆境对植物光合作用生理的影响[9,12]。在遭受DEHP胁迫后,通过快速叶绿素荧光诱导动力曲线及获得的参数可知,低浓度的DEHP(10 mg/L)对尖细栅藻,活性反应中心的电子传递链中的还原有促进作用,而高浓度(100 mg/L)则相反; 对栅藻最大光化学效率(Fv/Fm)有显著影响,与DEHP浓度呈效应-剂量关系;此外,DEHP还会提高吸收光能后热耗散部分的能量占吸收能量的消耗比例。因此,DEHP对尖细栅藻的影响主要在于对QA氧化还原过程的干扰,而对具活性反应中心的其他机能未见明显作用。说明能够快速荧光动力法能够灵敏的检测DEHP造成的伤害。

图 3 不同浓度DEHP对尖细栅藻叶绿素a(A)和b(B)含量的影响
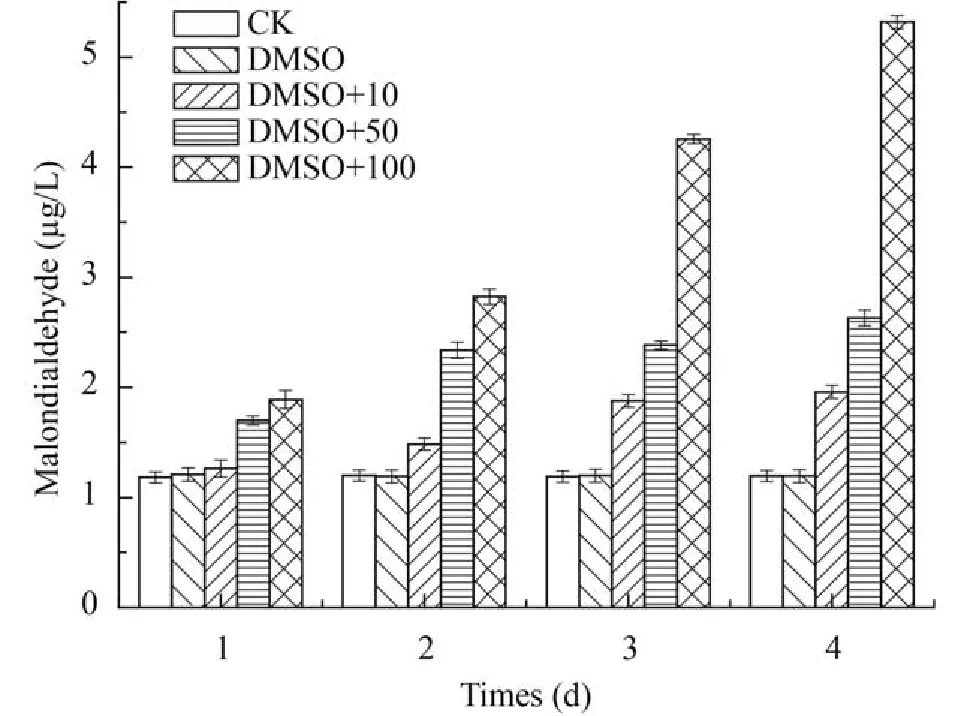
图 4 各浓度DEHP胁迫下尖细栅藻的MDA变化情况
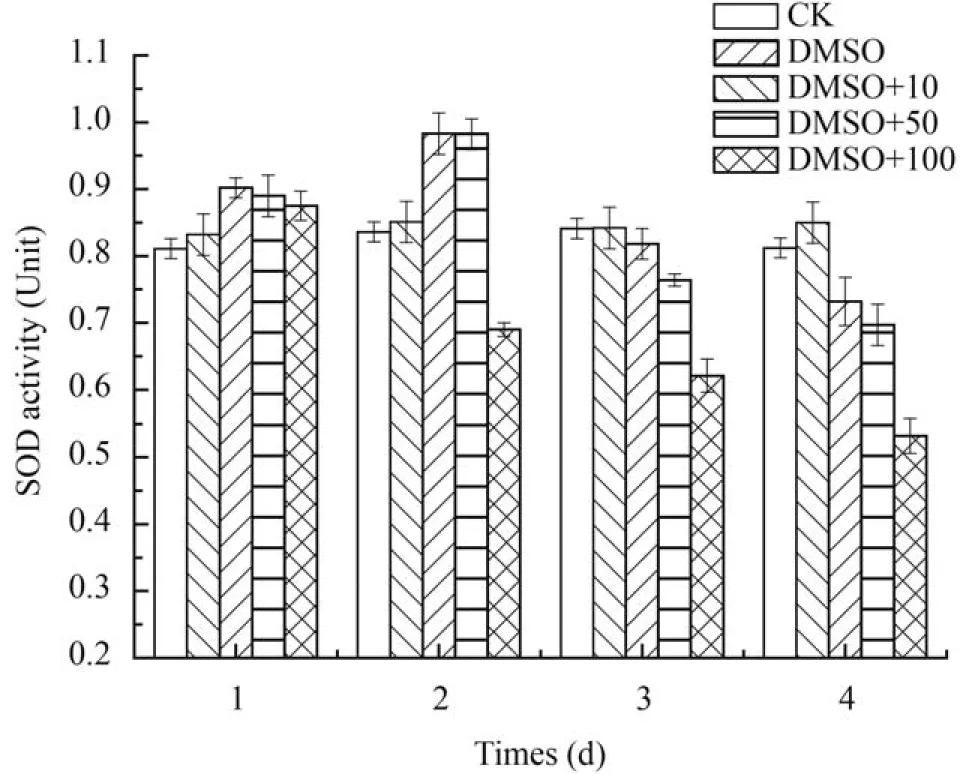
图 5 各浓度DEHP胁迫下尖细栅藻SOD活性变化
藻细胞易受到胁迫时易产生活性氧类物质。对裸短甲藻的毒性效应研究中发现,DBP诱导ROS的积累,随其浓度增加,·OH、H2O2积累[5]。因此藻细胞中DEHP诱导活性氧(ROS)以及氧化应激反应的发生,可能是造成毒性作用的主要原因[6]。DEHP对尖细栅藻细胞的处理显著降低了SOD活性,所产生的MDA含量随时间和DEHP的浓度增加而增大,证明DEHP促进了细胞内ROS的生成,增加了胞内各组分的氧化压力。由于SOD是清除藻细胞内超氧化物的酶,它的活性降低,一方面可能是短时间产生了大量的ROS(活性氧),为了清除由ROS导致的超氧化物而消耗,另一方面也可能是藻细胞受到DEHP的损伤,使SOD的合成或者活性受阻[14]。并且SOD活性降低的幅度与加入DEHP的浓度有明显的剂量-效应关系。因此,DEHP对藻类造成的是活性氧伤害,其毒性效应,通过快速叶绿素荧光动力学方法可快速检测出来。
参 考 文 献:
[1]Baun S J A.Toxicity of mono- and diesters of o-phthalic esters to a crustacean,a green alga,and a bacterium[J].Environmental Toxicology and Chemistry,2003,22(12):3037—3043
[2]Jiang P P,Zhang S Y,Qi D G,et al.Plasticizer storm andthe countermeasures of plasticizer industry[J].Plastics Additives,2011,88(4):1—5[蒋平平,张书源,祁丹耿,等.塑化剂风波与增塑剂行业对策.塑料助剂,2011,88(4):1—5]
[3]Abdel-Kawi S H,Hashem K S,Abd-Allah S,et al.Mechanism of diethylhexylphthalate(DEHP)induced testicular damage and of grape seed extract-induced protection in the rat[J].Food and Chemical Toxicology,2016,90:64—75
[4]Mu X,Liao X,Chen X,et al.DEHP exposure impairs mouse oocyte cyst breakdown and primordial follicle assembly through estrogen receptor-dependent and independent mechanisms[J].Journal of Hazardous Materials,2015,298:232—240
[5]Venturelli A C,Fischer S V,de Morais R N,et al.Effects of exposure to Di-(2-ethylhexyl)phthalate(DEHP)during lactation and puberty on sexual maturation and glycemic homeostasis in males rats[J].Clinical Nutrition ESPEN,2015,10:5—12
[6]Hu Q Q,Xiong L,Tian P X Z,et al.Toxic effects of Dibutyl Phthalate(DBP)on Scenedesmus obliquus[J].Asian Journal of Ecotoxicology,2008,3(1):87—92[胡芹芹,熊丽,田裴秀子等.邻苯二甲酸二丁酯(DBP)对斜生栅藻的致毒效应研究.生态毒理学报,2008,3(1):87—92]
[7]Sui H X,Zhang L,Wu P G,et al.Concentration of di(2-ethylhexyl)phthalate(DEHP)in foods and its dietary exposure in China[J].International Journal of Hygiene and Environmental Health,2014,217:695—701
[8]Peng X L.Detection of organics in Hanjiang tap water and research on the combined effect of their nonpolar Components with Microcystins[D].Huazhong University of Science & Technology,Master Dissertation.2008[彭晓琳.汉江水源末梢水中有机物检测及其非极性成分与藻毒素联合作用的研究.华中科技大学,硕士论文.2008]
[9]Chen L Z,Xie M,Bi Y H,et al.The combined effects of UV-B radiation and herbicides on photosynthesis,antioxidant enzymes and DNA damage in two bloom-forming cyanobacteria[J].Ecotoxicology and Environmental Safety,2012,80:224—230
[10]Fu R N,Dai R J,Huang C,et al.Determination of algal chlorophylls and their degradation products[J].Journal of the CUN(Natural Sciences Edition),2004,13(1):75—80[傅若农,戴继荣,黄春,等.藻类叶绿素及其降解产物的测定方法.中央民族大学学报(自然科学版),2004,13(1):75—80]
[11]Chen L,Deng S,De Philippis R,et al.UV-B resistance as a criterion for the selection of desert microalgae to be utilized for inoculating desert soils[J].Journal of applied Phycology,2013,25:1009—1015
[12]Martínez-Peñalver A,Reigosa M J,Sánchez-Moreiras A M.Imaging chlorophyll a fluorescence reveals specific spatial distributions under different stress conditions[J].Flora,2011,206:836—844
[13]Wang Z Y,Bie C C,Li F M,et al.Effects of allelochemical dibutyl phthalate on Gymnodinium breve reactive oxygen species[J].Environmental Science,33(2):442—447[王震宇,别聪聪,李峰民,等.邻苯二甲酸二丁酯对短裸甲藻活性氧自由基的影响.环境科学,2012,33(2):44—447]
[14]Yang X L,Deng S Q,De Philippis R,et al.Chemical composition of volatile oil from Artemisia ordosica and its allelopathic effects on desert soil microalgae,Palmellococcus miniatus[J].Plant Physiology and Biochemistry,2012,51:153—158
USE OF CHLOROPHYLL FLUORESCENCE TRANSITS TO ANALYSIS DEHP ON THE TOXICOLOGICAL EFFECTS OF SCENEDESMUS ACUMINATUS
LIU Chang-Qing1,2,XIE Mu1,ZHAO Jian1,ZHOU Xiang-Jun1,FU Tao-Ran1and CHEN Lan-Zhou1
(1.School of Resource & Environmental Science,Wuhan University,Wuhan 430072,China; 2.The Central Hospital of Xiaogan,Xiaogan 432000,China)
Abstract:To investigate the toxicological effects of DEHP on Scenedesmus acuminatus,a green algae isolated from Han River,chlorophyll fluorescence induction kinetics curve and the parameters and antioxidatant system were utilized.The results indicated that DEHP significantly decreased SOD activity but increased MDA content in a concentration and treatment time-dependent pattern,and that DEHP increased Chlorophyll contents at low concentration.Chlorophyll fluorescence induction kinetics curve and the parameters analysis showed that 10 mg/L DEHP promoted deoxidation ofin the electron transport chain,and 100 mg/L DEHP reduced the deoxidation of.DEHP decreased Fv/Fmwith the increased concentration and the duration time.The results revealed that DEHP has an obvious damage on the photosynthetic system and antioxidant system of S.acuminatus,and fast chlorophyll fluorescence induction kinetics(OJIP-test)can be effectively used to detect detrimental damage.
Key words:Scenedesmus acuminatus; DEHP; Toxicological effects; Fast chlorophyll fluorescence induction kinetics;Photosynthetic activity
中图分类号:Q949.25
文献标识码:A
文章编号:1000-3207(2016)03-0552-05
doi:10.7541/2016.74
收稿日期:2015-05-20;
修订日期:2015-12-04
基金项目:国家重大水专项(2013ZX07503001); 国家基础科学人才培养基金《武汉大学地理科学理科基地》科研能力训练项目(J1103409)资助[Supported by the National Water Pollution Control and Treatment Science and Technology Major Project(2013ZX07503001);the Project for National Basic Science Personnel Training Fund(J1103409)]
作者简介:刘常青(1974—),女,湖北大悟人,本科,主要从事于生态毒理学研究。E-mail:lcq201010@126.com
通信作者:陈兰洲,教授,E-mail:chenlzwhu@163.com
