梅氏新贝尼登虫膜联蛋白B1基因序列分析及应激表达分析
2016-06-29马文静史雨红
马文静, 史雨红, 陈 炯
(宁波大学 生物与海洋科学系, 宁波 315211)
梅氏新贝尼登虫膜联蛋白B1基因序列分析及应激表达分析
马文静, 史雨红, 陈炯
(宁波大学 生物与海洋科学系, 宁波 315211)
摘要膜联蛋白(Annexins, ANX)是一类Ca2+依赖性磷脂结合蛋白多基因家族,参与生物膜修复、Ca2+调节、信号传导、膜泡运输以及细胞增殖等过程,部分成员其mRNA和蛋白表达与发育和环境变化紧密相关。研究采用生物信息学方法鉴定了梅氏新贝尼登虫anxb1(Neobenedenia melleni anxb1,nmanxb1)的序列特征,随后采用RT-qPCR技术确定其mRNA表达与发育和环境(温度和盐度)变化相关性。研究结果表明,NmANXB1具有4个由α-螺旋组成的重复单元,其中3个典型II型Ca2+结合位点、6个III型Ca2+结合位点,以及1个KGD基序。氨基酸序列的系统进化树分析揭示,nmanxb1与其他B族蠕虫类寄生虫anx共成一簇。RT-qPCR结果显示,nmanxb1 mRNA主要在虫卵中表达。低温和高温应激下虫卵nmanxb1 mRNA表达量显著上调;高温和低盐应激时成虫中的表达量也显著上升。以上结果揭示,NmANXB1可能参与梅氏新贝尼登虫的发育和环境应激适应过程。
关键词nmanxb1;序列特征;基因表达;梅氏新贝尼登虫
膜联蛋白(Annexins, ANX)是一类Ca2+依赖性磷脂结合蛋白,广泛地分布于单细胞生物、动物和植物中,约占细胞总蛋白质的2%以上,存在于细胞质膜内侧、储Ca2+细胞器附近以及在核内或细胞外基质中[1]。除酸性磷脂外,ANX可结合含EF指结构蛋白和细胞骨架蛋白[2],广泛参与生物膜修复、离子通道调节、膜泡运输、信号传导、细胞增殖、分化和凋亡、抗炎以及抗凝血等过程[2-5]。据文献报道,anxmRNA表达不仅与发育紧密相关,且其表达、丰度以及细胞定位受温度和盐度调控[6]。因此,anx基因家族可能参与机体发育过程对环境胁迫的适应性应答过程[2]。
ANX家族是多基因家族,可分成5族: A族为脊椎动物, B族为非脊椎动物, C族为真菌和部分真核单细胞生物, D族为植物, E族为原生动物,此外还有40多种还未分类[7]。蠕虫类寄生虫ANX基因属于B族。近年来,由于高通量测序及组学技术的发展,越来越多的蠕虫类寄生虫anx序列逐步被鉴定[8-10]。其中研究对象多为体内蠕虫类寄生虫,如曼氏吸血虫(Schistosomamansoni)[7]、猪肉绦虫(Taeniasolium)[11]和华支睾吸虫(Clonorchissinensis)[12]等。相对于上述寄生体内的蠕虫,体表蠕虫anx鲜少报道,仅有微杯虫(Microcotylesebastis)anx[13]。由于体内蠕虫类寄生虫anx表达受环境变化影响较小,因此,其与环境应激相关研究未曾报道。anxmRNA表达与温度和盐度应激相关性报道来自于脊椎动物或植物。
梅氏新贝尼登虫(Neobenedeniamelleni)隶属扁形动物门、吸虫纲、单殖目、分室科、新贝尼登虫属。该虫在世界范围内分布较为广泛,是近年来我国沿海和日本养殖鱼类暴发急性寄生虫流行病的主要病原之一,造成海水养殖业巨大经济损失[14]。梅氏新贝尼登虫广泛寄生于多种海水养殖鱼类体表,如褐牙鲆、高体鰤和大黄鱼等,对环境条件(如温度和盐度)变化敏感[15]。因此,研究梅氏新贝尼登虫anxb1(Neobenedeniamellenianxb1,nmanxb1)参与寄生虫适应环境变化的分子机制,可为梅氏新贝尼登虫病害防治提供理论依据。
本研究采用文库随机测序方法鉴定了nmanxb1序列,运用生物信息学方法分析了nmanxb1分子序列特征,研究其与温度和盐度应激相关性,为该基因的深入研究奠定基础。
1材料与方法
1.1实验材料
寄生虫采集方法参考文献[16],大黄鱼病样采集于浙江省宁波市象山黄避岙港湾。首先从病样体表分离梅氏新贝尼登虫成虫;再将收集的成虫放入盛有过滤海水的培养皿中,置于室温下让其自然产卵,数小时后收集形状完好和颜色为黄褐色的虫卵;最后将收集的虫卵放入盛有过滤海水的培养皿中室温培养,培养皿中海水每天更换,收集逸出的钩毛蚴。应激实验如下:成虫和虫卵分别置于18 ℃、25 ℃及32 ℃的过滤海水(盐度24)中,2h后收集并液氮速冻保存。取成虫与虫卵分别置于盐度18、24及30的过滤海水(25℃)中,5 h后收集,液氮速冻后-70℃保存。上述实验生物学重复3次。
SMART RACE cDNA amplification kit、RNAiso试剂、AMV 逆转录酶、ExTaq DNA聚合酶、DNA Ligation Kit Ver.2.0及SYBR Premix ExTaq试剂盒均购自TaKaRa公司;引物合成及序列测定由上海英骏生物工程公司完成。
1.2方法
1.2.1cDNA序列获得及分析 根据NCBI数据库中已有的anx序列设计ANX兼并引物上游序列ANX(+):5′-ATGAAAGGWHBHGGCACNGATGA-3′,W=A,T,H=A,C或T,B=C,G或T,N=A,C,G或T;下游引物ANX(-):5′-GGTAWTCWCCAGADGTATCA-3′,D=A,G或T。ANX(+)与ANX(-)配对从梅氏新贝尼登虫各发育阶段混合cDNA文库中扩增获得中间序列,再根据中间序列测序结果设计5′-RACE引物NmANXB1-5t(-)(5′-GAAGCAATCT CTATTCTCTG-3′)和Nested Universal Primer A配对扩增5′-末端片段,最后根据中间序列设计特异引物NmANXB1-3t(+)(5′-GGTTTGGGTACCTGCGATGT-3′),采用RACE技术从上述cDNA文库中获得nmanxb1 3′-末端序列。序列拼接获得nmanxb1 cDNA,用BLASTX (http://www.ncbi.nlm. nih.gov/BLAST/)分析,信号肽序列预测采用SignalP 4.0程序[17]。多重序列比对采用Bioedit软件,系统进化树分析采用MEGA 5.0软件[18]。1.2.2nmanxb1 mRNA表达分析 根据已知的nmanxb1 cDNA序列设计的RT-qPCR引物为NmANXB1F:5′-GTTGGACGCCTACTCCATGT-3′和NmANXB1R:5′-TTTCTCATGCCTTGCAACAG-3′,扩增234 bp片段;内参为β-actin基因,RT-qPCR引物为Nm-actinF:5′-CTTTAGATTT CAACCAGGAG-3′和Nm-actinR:5′-TGCCACAGTATTCCCTTT-3′,预期扩增162 bp片段。
样品处理和RT-qPCR反应体系等同文献[16]。简述如下:首先用RNAiso试剂分别提取不同发育阶段样品和应激处理样品的总RNA;DNase I (RNase-free)处理后,在AMV逆转录酶作用下以总RNA为模板合成cDNA第一链;RT-qPCR反应体系25 μL。采用2-ΔΔCt法[19]计算nmanxb1 mRNA的相对表达量。统计分析采用单因素方差分析法(One-way ANOVA),P<0.05为显著性差异。
2结果
2.1nmanxb1 cDNA序列分析

图1 部分蠕虫寄生虫ANX氨基酸序列比对
ANX具有5个部分:N末端(N-terminus)和4个重复单元(Repeat I-IV),分别用划线表示;重复单元中II型Ca2+结合位点“G-X-G-T-(38residues)-D/E”基序用“▲”表示,III型Ca2+结合位点“G-X-G-T-D/E”用“↓”表示;“KGD”基序用“▽”表示;α螺旋(1A-4E)用圆角矩形表示;NmANXB1:梅氏新贝尼登虫N.melleniANXB1(KT314071),EmANX:多房棘球绦虫EchinococcusmultilocularisANX(CBLO010001671),TsANXB3:猪带绦虫T.soliumANXB3(DQ010543),TsANXB1:猪带绦虫T.soliumANXB1(AF147955),MsANX:微杯虫M.sebastisANX(EU719209),SbANX:牛血吸虫S.bovisANX (EU595758),SmANXB22:曼氏血吸虫S.mansoniANXB22(AF065599)
nmanxb1 cDNA序列长为1 286 bp(不计polyA尾)。开放阅读框共1 050 bp (31 nts~1 080 nts),编码一个由350个氨基酸组成的蛋白,该蛋白无信号肽序列,编码蛋白分子质量约38.6 ku,其等电点pI为4.46。NmANXB1氨基酸序列分成N末端(N-terminus)和C端序列。N末端包含25 aa,与其他蠕虫类寄生虫ANX氨基酸序列相比,NmANXB1蛋白N端适中(图1)。C端序列包含4个重复单元(Repeat I:aa 27~98;Repeat II:aa 99~176;Repeat III:aa 177~286;Repeat IV:aa 287~350);4个重复单元各由5个α-螺旋组成,分别用A-E命名(图1)。4个重复单元各具有一个典型的II型Ca2+结合位点“G-X-G-T-(38 residues)-D/E”基序(图1),氨基酸残基“G-X-G-T”位于α-螺旋A和B之间,氨基酸残基D/E位于α-螺旋D和E之间。Ca2+可与此基序中带负电荷的残基结合,ANX可通过Ca2+再结合膜上带有负电的磷脂。此外,C端共存在6个III型Ca2+结合位点“G-X-G-T-D/E”(图1)。重复单元IV末端存在“K342G343D344”基序,该基序与ANX结合膜有关(图1)。根据多重序列比对结果,ANX基因N端属于可变区,C端氨基酸序列保守性较高(图1)。氨基酸序列同源性比较揭示,NmANXB1与华支睾吸虫ANXB7同源性最高(42.2%)。氨基酸序列的系统进化树分析揭示,NmANXB1与其他B族蠕虫类寄生虫ANX共成一簇,A族中ANXA13另成一簇(图2)。目前仅A族内部各个异构体命名较明确,B族内部anx命名混乱[7],通常无法从蠕虫类寄生虫anx命名的数字编号将其归类。

图2 基于ANX氨基酸序列的系统发生树
分叉处数值表示1 000次重复抽样所得到的置信度百分比, 只显示置信度60 %以上的数值; 标尺长度表明每个位点发生0.1次置换;所用序列登录号:人HomosapiensANXA13(BC125158),牛BostaurusANXA13(BC133570),猪SusscrofaANXA13(XM_005662867),非洲爪蟾XenopuslaevisANXA13(NM_131774),斑马鱼DaniorerioANXA13(NM_131774),大西洋鲑SalmosalarANXA13(BT045040),猪带绦虫T.soliumANXB3(Q4ZGZ6),多房棘球绦虫E.multilocularisANX(CBLO010001671),梅氏新贝尼登虫N.melleniANXB1(KT314071),日本血吸虫S.japonicumANX(FN320195),华支睾吸虫C.sinensisANXB7(DF142903),曼氏血吸虫SchistosomamansoniANXB22(AF065599),牛血吸虫SchistosomabovisANX(EU595758),微杯虫M.sebastisANXB34(EU719209),猪带绦虫T.soliumANXB2(Q52MU2),曼氏血吸虫S.mansoniANXB2(FJ860253),华支睾吸虫C.sinensisANXB30(DF142920)
2.2不同发育阶段中nmanxb1 mRNA表达变化
取梅氏新贝尼登虫3个发育阶段虫体:卵、钩毛蚴、成虫,进行RT-qPCR分析。结果表明,nmanxb1 mRNA在卵中表达量最大且显著高于其他两个发育阶段,其表达量约为钩毛蚴的19.1倍,为成虫的3.97倍。成虫中次之,钩毛蚴中表达量最少(图3)。
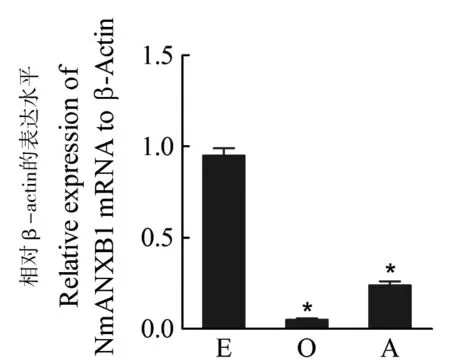
图3 nmanxb1 mRNA在3个发育阶段表达
E:虫卵(Egg);O:钩毛蚴(Oncomiracidium);A:成虫(Adult)。*P<0.05 (n=3)
2.3温度和盐度应激后nmanxb1 mRNA表达变化
本研究以梅氏新贝尼登虫病爆发时水温25℃为对照温度,对虫卵和成虫分别进行低温(18℃)和高温(32℃)应激处理。RT-qPCR结果表明,在低温和高温应激下虫卵nmanxb1 mRNA表达量分别为对照温度时表达量的2.19倍和1.86倍;在低温应激下成虫nmanxb1 mRNA表达量无显著变化,在高温应激时其表达量为对照温度时表达量的1.77倍(图4A)。
虫病爆发期海水盐度约为24。本研究以盐度24为对照,对虫卵和成虫分别进行低盐(盐度18)和高盐(盐度30)应激。RT-qPCR结果显示,低盐和高盐应激后虫卵nmanxb1 mRNA表达量均无显著变化;低盐应激成虫后其表达量上调为对照盐度的1.72倍;高盐应激其表达量无显著变化(图4B)。
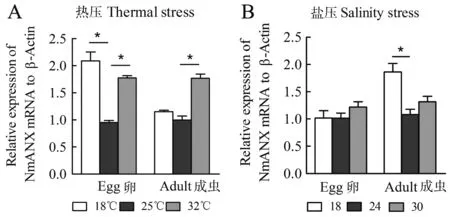
图4 温度和盐度应激后虫卵和成虫nmanxb1 mRNA表达
A:温度应激;B:盐度应激。*P<0.05 (n=3)
3讨论
ANX是Ca2+依赖性磷脂结合蛋白,典型结构各由4组α螺旋组成为环形α螺旋束,其凸面为Ca2+依赖的膜结合区[20]。Ca2+结合位点存在3种形式:II型、III型和K/R/HGD基序。K/R/HGD基序取代II型Ca2+结合位点成为ANX结合膜的新形式,这种现象在无脊椎动物B族中较为常见[21]。氨基酸序列分析表明,NmANXB1也具有α螺旋形成的4组重复单元,符合典型ANX结构特征。同时具有4个典型II型Ca2+结合位点,6个III型Ca2+结合位点,重复单元IV中α螺旋4D和4E之间存在一个KGD基序,表明NmANXB1是典型的Ca2+依赖性蛋白。此外,系统进化分析表明NmANXB1与其他B族蠕虫类寄生虫ANX共成一簇。
anx家族部分成员mRNA和蛋白表达受生长发育调控[2]。牛血吸虫ANX是童虫和成虫体被表膜蛋白[20]。华支睾吸虫虫卵、后囊蚴和成虫中后囊蚴anxb30 mRNA表达量最高[12]。复殖类曼氏血吸虫anxb22(又名Sm1)在卵和幼虫中表达量较少,在童虫和成虫中表达量较高[9]。梅氏新贝尼登虫生活史可简单划分为 3 个典型的生理发育时期,带壳虫卵需5~7 d孵化成钩毛蚴;钩毛蚴逸出6 h后感染性大幅降低,寄生于鱼体表后钩毛蚴发育为成虫;成虫存活周期一般为 14~16 d[22, 23]。在生活史3个阶段中,虫卵nmanxb1 mRNA表达量最高。anx为多基因家族,不同的anx可能在不同阶段发挥功能。
文献报道,anx家族可能参与机体对环境胁迫的适应性应答过程[2]。人ANXA1体外具有分子伴侣活性,可防止柠檬酸合酶和谷氨酸脱氢酶热失活[24]。低温应激导致白杨树anxmRNA表达增加[25]。大麦ANX p39和p22.5蛋白量上调,通过插入质膜感应或转导Ca2+信号,或调节细胞内Ca2+浓度,参与信号调控和适应环境变化[26]。anxmRNA的表达、丰度以及细胞定位都与盐度变化相关[6]。ANX在盐度应激时可暂时性插入质膜中,可能通过信号转导或通过调节其他膜蛋白,以应对恶劣环境[6]。高盐应激后苜蓿anxms2 mRNA表达量显著上调[27]。梅氏新贝尼登虫寄生于海水鱼类体表,其虫卵孵化率、发病率等都受环境条件影响。据报道,虫卵在25℃时发育正常且孵化率最高,低温(18 ℃)和高温(32 ℃)时发育停滞以及孵化率骤减[28],从而导致发病率显著下降。此外,梅氏新贝尼登虫在水温为19 ℃[29]和30 ℃[24]时均有报道,但迄今为止在寒带海域未有发现,因此,本研究选择18 ℃和32 ℃进行温度应激实验。研究表明低温及高温下虫卵nmanxb1 mRNA均显著上升,而成虫nmanxb1 mRNA在高温应激时显著上调,在低温应激时无显著变化。虫卵卵壳对海水盐度变化有较强的保护作用,因此盐度17.6~56.9对虫卵基本无影响[29]。但成虫对盐度的变化敏感, 暴雨等造成的盐度暂时性改变能导致成虫从宿主体表脱落[15,29]。无论低盐还是高盐应激处理时,虫卵nmanxb1 mRNA表达无显著变化,低盐时成虫nmanxb1 mRNA表达上升,高盐应激下其表达无显著变化。ANX具有维持细胞膜完整性和膜修复的功能,参与Ca2+转运和信号调控等过程,从而在梅氏新贝尼登虫应对环境应激中发挥作用。
综上所述,本研究分析了梅氏新贝尼登虫nmanxb1序列特征,并探讨了其表达与生长发育以及环境温度和盐度应激的相关性,为后续蛋白功能的研究奠定了基础。
参考文献:
[1]MOSS S E, MORGAN R O. The annexins[J]. Genome Biol, 2004, 5 (4): 219.
[2]GERKE V, MOSS S E. Annexins: from structure to function[J]. Physiol Rev, 2002, 82(2): 331-371.
[3]DRAEGER A, MONASTYRSKAYA K , BABIYCHUK E B. Plasma membrane repair and cellular damage control: the annexin survival kit[J]. Biochem Pharmacol, 2011, 81(6): 703-712.
[4]DUBOIS T, OUDINET J, MIRA J P, et al. Annexins and protein kinases C[J]. Biochim Biophys Acta, 1996, 1313(3): 290-294.
[5]TURNAY J, LECONA E, FERNNDEZ-LIZARBE S, et al. Structure-function relationship in annexin A13, the founder member of the vertebrate family of annexins[J]. Biochem J, 2005, 389(3): 899-911.
[6]LEE S, LEE E J, YANG E J,et al. Proteomic identification of annexins, calcium-dependent membrane binding proteins that mediate osmotic stress and abscisic acid signal transduction in Arabidopsis[J]. Plant Cell, 2004, 16(6): 1378-1391.
[7]CANTACESSI C, SEDDON J M, MILLER T L,et al. A genome-wide analysis of annexins from parasitic organisms and their vectors[J]. Sci Rep, 2013(3): 2893.
[8]CASTRO-BORGES W, SIMPSON D M, DOWLE A, et al. Abundance of tegument surface proteins in the human blood flukeSchistosomamansonidetermined by QconCAT proteomics[J]. J Proteomics, 2011, 74(9): 1519-1533.
[9]LEOW C Y, WILLIS C, OSMAN A, et al. Crystal structure and immunological properties of the first annexin fromSchistosomamansoni: insights into the structural integrity of the schistosomal tegument[J]. FEBS J, 2014, 281(4): 1209-1225.
[10]MULVENNA J, MOERTEL L, JONES M K, et al. Exposed proteins of theSchistosomajaponicumtegument[J]. Int J Parasitol, 2010, 40(5): 543-554.
[11]YAN H, XUE G, MEI Q, et al. Calcium-dependent proapoptotic effect ofTaeniasoliummetacestodes annexin B1 on human eosinophils: a novel strategy to prevent host immune response[J]. Int J Biochem Cell Biol, 2008, 40(10): 2151-2163.
[12]HE L, REN M, CHEN X, et al. Biochemical and immunological characterization of annexin B30 fromClonorchissinensisexcretory/secretory products[J]. Parasitol Res, 2014, 113(7): 2743-2755.
[13]CHOI S H, KWON S R, LEE, et al. Molecular cloning, functional characterization and localization of an annexin from a fish gill flukeMicrocotylesebastis(Platyhelminthes: Monogenea)[J]. Mol Biochem Parasitol, 2009, 163(1): 48-53.
[14]杨文川, 李立伟, 石磊, 等. 魢新本尼登虫(单殖目:多室科)的发育[J]. 动物学报, 2002, 48(1): 75-79.
[15]杨文川, 李立伟, 王彦海. 福建海水养殖鱼类本尼登虫病研究[J]. 海洋科学, 2004, 28(7): 36-39.
[16]王芳, 陈炯, 史雨红, 等. 梅氏新贝尼登虫热休克蛋白60基因的克隆、序列分析及应激表达分析[J]. 动物学研究, 2012, 33(6): 603-608.
[17]PETERSEN T N, BRUNAK S, VON HEIJNE G, et al. SignalP 4.0: discriminating signal peptides from transmembrane regions[J]. Nat Methods, 2011, 8(10): 785-786.
[18]TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol[J]. 2011, 28(10): 2731-2739.
[19]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408.
[20]DE LA TORRE-ESCUDERO E, MANZANO-ROMN R, SILES-LUCAS M, et al. Molecular and functional characterization of aSchistosomabovisannexin: fibrinolytic and anticoagulant activity[J]. Vet Parasitol, 2012, 184(1): 25-36.
[21]MORGAN R O, MARTIN-ALMEDINA S, IGLESIAS J M, et al. Evolutionary perspective on annexin calcium-binding domains[J]. Biochim Biophys Acta, 2004, 1742(1-3): 133-140.
[22]JAHN T L, KUHN L R. The life history ofEpibdellamelleniMacCallum, a monogenetic trematode parasitic on marine fishes [J]. Biol Bull, 1932, 62(1): 89-111.
[23]李立伟, 杨文川. 梅氏新贝尼登虫钩毛蚴及成虫活力(单殖吸虫目:多室科)[J]. 厦门大学学报( 自然科学版), 2002, 41(1): 99-102.
[24]KIM G Y, LEE H B, LEE S O, et al. Chaperone-like function of lipocortin 1[J]. Biochem Mol Biol Int, 1997, 43(3): 521-528.
[25]RENAUT J, HAUSMAN J F, WISNIEWSKI M E. Proteomics and low-temperature studies: bridging the gap between gene expression and metabolism[J]. Physiologia Plantarum, 2006, 126(1): 97-109.
[26]BRETON G, VAZQUEZ-TELLO A, DANYLUK J, et al. Two novel intrinsic annexins accumulate in wheat membranes in response to low temperature[J]. Plant Cell Physiol, 2000, 41(2): 177-184.
[28]林克冰, 何丽斌, 周宸. 几种理化因子对梅氏新本尼登虫卵发育的影响[J]. 海洋科学, 2008, 32(2): 1-4.
[29]DEVENEY M R, CHISHOLM L A, WHITTINGTON I D. First published record of the pathogenic monogenean parasiteNeobenedeniamelleni(Capsalidae) from Australia[J]. Dis Aquat Org, 2001, 46(1): 79-82.
Sequence analysis and stress-related changes of the annexin B1 gene in Neobenedenia melleni
MA Wen-jing, SHI Yu-hong, CHEN Jiong
(Department of Biology and Marine Science, Ningbo University, Ningbo 315211, China)
AbstractAnnexins (ANX) are a multigene family of Ca2+-dependent phospholipid binding proteins, which are involved in the processes, such as membrane repair, ion channel regulation, signal transduction, vesicular transport and cell proliferation. Some anxs are expressed in the growth and environment (thermal and salinity)-dependent manner. In this study, bioinformatic approaches were used for sequence analysis of Neobenedenia melleni anxb1 (nmanxb1). And RT-qPCR was used to detect the mRNA expressions of nmanxb1 responding to the developmental and environmental changes. The results revealed that NmANXB1 was consist of 4 similar repeats made up of α helices, which contained 3 type II Ca2+binding sites, 6 type III Ca2+binding sites, and a KGD motif. Phylogenetic analysis of the amino acid sequences of some anxs showed that nmanxb1 grouped with other the parasitic helminth anxs belonging to group B. The results of RT-qPCR suggested that nmanxb1 mRNA was mainly expressed in the egg. Thermal stress (cold or hyperthermal stress) caused obviously increased nmanxb1 mRNA expressions in the egg, and hyperthermal and low salinity strss elevated significantly its expressions in the adult. It suggests that nmanxb1 may be involved in development and adaptation to adverse environmental conditions.
Key wordsnmanxb1; sequence anlysis; gene expression; Neobenedenia melleni
收稿日期:2015-09-16;修回日期:2015-09-30
基金项目:国家高技术研究发展计划(863计划)(2012AA10A403);“水产”浙江省重中之重开放基金(xkzsc1417)
作者简介:马文静,研究方向为水产分子生物学,E-mail: mawenjing0802@163.com; 通信作者:史雨红,副教授,研究方向为水产分子生物学,E-mail: shiyuhong0517@163.com。
中图分类号Q51;Q78
文献标识码A
文章编号2095-1736(2016)03-0005-05
doi∶10.3969/j.issn.2095-1736.2016.03.005
