植物病毒侵染诱导寄主内质网应激反应
2016-06-29李方方申莉莉
李方方,申莉莉
(中国农业科学院烟草研究所,青岛266101)
植物病毒侵染诱导寄主内质网应激反应
李方方,申莉莉*
(中国农业科学院烟草研究所,青岛266101)
病毒侵染产生的大量病毒蛋白阻碍细胞转运功能,未折叠或错折叠蛋白在内质网腔蓄积导致内质网应激(ERs),诱发细胞保护信号未折叠蛋白应答(UPR),或导致细胞程序性死亡(PCD)。在明确了动物病毒诱导的ERs相关的UPR信号通路基础上,从非生物因素诱导的拟南芥ERs应答信号和植物病毒侵染引起ERs两方面,对近年的研究成果进行了概述。归纳出植物病毒侵染诱导寄主ERs,包括改变ER膜形态和激活UPR基因。分析了ERs应答信号在病毒侵染过程中的重要作用,指出病毒调控UPR通路完成侵染复制,寄主则通过PCD通路以主动消亡的方式抵御病毒。但UPR和PCD的关系尚不明晰,不同的病毒调控UPR信号的机制及信号强弱尚不明确,寻找病毒诱发寄主UPR和逃避寄主PCD建立侵染关系的关键调节子,是抗病毒研究的发展方向。
植物病毒;内质网应激;未折叠蛋白应答;细胞程序性死亡
内质网(ER)是植物细胞的膜管道系统,是分泌蛋白和膜蛋白合成、修饰的场所。ER含有免疫球蛋白结合蛋白(BiP)和蛋白二硫键异构酶(PDI),可以促进蛋白质正确折叠,不能正确折叠的蛋白主要通过泛素降解途径被蛋白酶体所降解。
ER具极强的内稳态,但仍然有很多因素(高温、干旱、盐害、病毒和细菌侵入)导致内稳态失衡,未/错折叠蛋白蓄积,引起内质网应激(ERs),即蛋白质加工运输障碍、生理功能发生紊乱的一种亚细胞器的病理过程。细胞首先启动未折叠蛋白应答(UPR),调节下游基因的表达,来终止新蛋白合成、降解错折叠蛋白、促进蛋白折叠,重建细胞内稳态。若内环境紊乱无法纠正,细胞则转向程序性死亡(PCD),调节下游凋亡基因表达,以凋亡或自噬的自我消化方式免受病原物侵染[1-3]。
动物病毒诱导的ERs相关的UPR信号有3条;拟南芥中已发现非生物因素诱导的两条UPR信号和1条PCD信号。研究表明植物单链RNA病毒也诱导寄主ERs相关的UPR信号。
1 动物病毒诱导的寄主ERs相关的UPR信号通路
UPR是一条综合的细胞内保护信号,细胞能检测到ER中的错误折叠蛋白,并反馈给细胞核采取保护措施,激活可以修改这些错误的基因。Kazutoshi Mori和Peter Waler因发现UPR获得2014年“拉斯克医学奖”。
RNA病毒利用ER膜复制,蓄积的病毒蛋白使ER腔Ca2+失衡,且病毒释放损耗ER膜,由此造成ER功能障碍,产生ERs。信号因子BiP感知到应激时,与ER膜上的前体蛋白:蛋白激酶类内质网激酶(PERK)、需肌醇酶(IRE1)和转录激活因子(ATF6)解偶联,激活三条UPR信号通路(图1)[1,4-5]。
1.1 PERK—eIF2α 控制蛋白合成
ERs时,与BiP解偶联的PERK相互寡聚发生自身磷酸化而被激活,进而使真核细胞蛋白质翻译起始复合体(eIF2)的α亚基磷酸化,由此抑制β亚基的能量交换而使eIF2不能被重复利用。此外,由双链RNA激活的蛋白激酶(PKR)也促使eIF2磷酸化。最终抑制大部分mRNAs的翻译,关闭蛋白质合成。
但转录激活因子(ATF4)的mRNA则能利用磷酸化的eIF2翻译出ATF4蛋白,进入核激活下游基因的转录,如内质网源性转录因子(CHOP)、X盒-结合蛋白(XBP1)、生长抑制DNA损伤基因(GADD34)及其它参与氧化应激和细胞凋亡的基因。GADD34可作为蛋白磷酸酶(PR1)的调节亚基,使eIF2脱磷酸化恢复功能,抑制PERK信号。
但长时间关闭蛋白质合成不利于病毒复制,研究表明病毒能调控PERK通路,完成复制。如巨细胞病毒(CMV)能通过提高ATF4的表达,结束PERK信号。疱疹病毒(HSV1)和非洲猪瘟病毒(ASFV)能产生寄主GADD34的同源物,恢复eIF2功能。丙肝病毒(HCV)则会编码PERK的底物类似物,抑制PERK的活性。淋巴细胞脉络丛脑膜炎病毒(LCMV)能选择性地激活UPR支路以利于病毒复制[1]。
1.2 IRE1—XBP1降解错折叠蛋白
ERs时,与BiP解偶联的IRE1相互寡聚发生自身磷酸化而被激活,剪接XBP1的mRNA,表达具转录激活活性的蛋白XBP1S,进入核调节UPR基因,促进内质网相关的降解(ERAD)和蛋白再折叠。而非剪接的XBP1 mRNA则表达UPR的抑制子XBP1U。研究表明HCV能降低XBP1S的转录,抑制IRE1通路,避免病毒蛋白被降解[1,5]。
1.3 ATF6上调ER伴侣蛋白表达
ERs时,前体蛋白ATF6被转运至高尔基体,经其腔内蛋白酶S1P和膜内蛋白酶S2P两次剪切,释放出活性蛋白ATF6f,进入核上调与蛋白折叠相关的UPR基因,促进蛋白折叠。研究表明ASFV能选择性的激活ATF6信号,利于病毒复制[1,5]。
近年研究表明,UPR信号与自噬相关,ERs能激活c-Jun氨基末端激酶(JNK),XBP1,ATF4和CHOP的表达,促进细胞自噬,表现为DNA片断化和凋亡小体增多,以自杀的方式抵御病毒侵染[4-5]。
显然,病毒侵染引起ERs,诱发细胞保护信号UPR,与病毒做斗争,决定细胞生死。不同的病毒则能以各自的调节子调控UPR,利于病毒复制,逃避寄主的免疫反应,建立侵染关系。但UPR和PCD两个通路相互独立还是相互作用,尚不清楚。
2 非生物因素诱导的拟南芥ERs应答信号
高温、盐害或ERs诱导剂衣霉素等非生物因素均诱导拟南芥ERs应答信号,由3个ER膜转录因子调控:UPR信号分子bZIP28和bZIP60,PCD信号分子NAC089。尚未发现PERK路径[6-8]图2)。
2.1 IRE1—bZIP60—NAC103
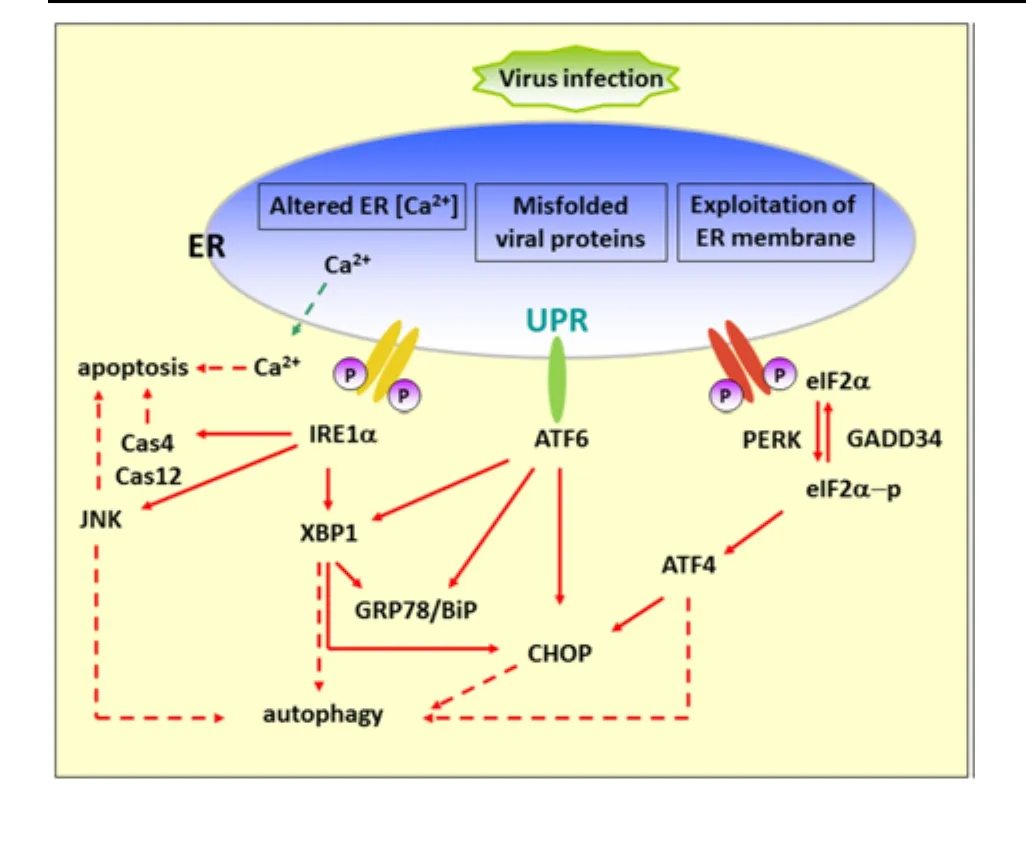
图1 三条UPR通路及其相关联的PCD[5]Fig. 1 Diagram of the UPR arms and their connections to autophagy
拟南芥和烟草均存在IRE1的同源物[9],bZIP60mRNA是IRE1的底物。ERs时,磷酸化的IRE1,选择性剪接bZIP60 mRNA,表达活性蛋白 bZIP60S,进入核激活UPR伴侣基因BiP和ER相关的降解(ERAD)原件[3,10]。bZIP60S还能诱导自身及转录因子(NAC103)的转录,放大存活信号[11]。同时,IRE1还可降解特定的mRNA(RIDD),减少分泌蛋白进入ER腔。
与动物的XBP1U不同,植物的bZIP60P作为前体蛋白跨ER膜,正常状态下低水平合成,是UPR的抑制子,感知到ER腔的未折叠蛋白,水解释放出bZIP60S[12]。
2.2 IRE1—bZIP28—NF-YC2
bZIP17P/bZIP28P作为前体蛋白跨ER膜,正常状态下低水平合成,是UPR的抑制子。类似于动物细胞的ATF6,高温或衣霉素诱导时,转运至高尔基体,经其腔内的S1P蛋白酶和膜内的S2P蛋白酶两次剪切后,释放活性蛋白bZIP17D/bZIP28D,进入核激活UPR伴侣基因BiP及核转录因子NF-YC2的表达,NF-YC2转回胞质参与调控UPR[6-7,12]。其中bZIP17是盐害胁迫的信号蛋白[8]。
2.3 NAC089
若ERs长时间持续,ER膜上的前体蛋白NAC089P水解,释放活性蛋白NAC089D,进入核激活UPR下游的PCD基因,如转录因子(NAC094)、类半胱天冬蛋白酶(MC5)、Bcl-2相关抗凋亡基因(BAG6)和自噬控制基因(WRKY33),最终表现为细胞凋亡[13]。
研究发现,拟南芥ERs时,bZIP60突变导致PDI基因表达下调,而IRE1-2突变则未导致其下调,说明还有其他的UPR信号补充bZIP60活性,维持PDI的表达[13]。过表达NAC103影响植株正常生长发育[3]。转bZIP28ΔC(去跨膜区的bZIP28)基因植株在无衣霉素诱导时也上调ERs基因,延缓生长[14]。NAC089沉默植株则耐ERs诱导剂衣霉素,长势健壮[14]。上述试验说明细胞存活和死亡信号均由bZIP28和bZIP60调控。bZIP28启动反应信号,而bZIP60持续这种信号反应,两者共同调节NAC089的表达,其产量平衡可能决定细胞的存亡[10,12]。bZIP28、bZIP60和NAC089在信号激活、功能和反馈调节等方面密不可分。
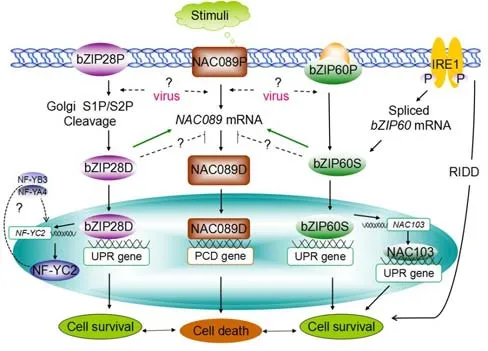
图2 植物UPR的细胞存/亡通路1,7,11,14]Fig. 2 Hypothetical working model of cell survival and cell death pathways in plant UPR
此外,水稻、玉米、烟草均存在拟南芥AtbZIP60的同源基因,是ERs的重要因子,调控寄主的抗性反应[15-19]。其中,烟草NtbZIP60是精胺信号原件,参与UPR,调节天然免疫反应。本氏烟接种菊莴假单胞菌6 h,NtbZIP60表达上调,接种烟草野火病菌,其表达不受影响,NtbZIP60沉默利于假单胞菌增殖[19]。此外,烟草中已发现与拟南芥脱水诱导早期应答基因(ERD2)同源的蛋白ERD2a和ERD2b,其作为ER腔滞留蛋白受体,能减轻ERs。沉默EDR2a和EDR2b导致BiP逃离ER,加剧了过敏性坏死反应(HR)和PCD[20]。
3 植物病毒侵染引起ERs应答信号
采用绿色荧光蛋白(GFP)标记植物单链RNA病毒和GFP或红色荧光蛋白(RFP)标记ER的技术,荧光显微镜下观察到病毒诱导ER膜形成病毒的复制结构。
3.1 病毒蛋白诱发ER形态变化
烟草普通花叶病毒(TMV MP:GFP)侵染本氏烟早期,MP和复制酶(RdRp)均在皮层ER上停泊,聚集成小点状结构,随后ER微管转变成大的聚集体,特别是皮层ER上,形成大的不规则形状。ER和微管形成的衍生结构是病毒复制场所。侵染后期,聚集体又转变成微管。这些变化与MP的积累和降解同步[21]。细胞骨架和ER膜系统参与了病毒转运,MP修饰胞间连丝(PD),扩大排阻分子限度,完成胞间转运[22-26]。
马铃薯Y病毒(PVY)的6K2蛋白能诱导ER形成包含6K2在内的病毒复制的膜囊泡结构。在肌动球蛋白运动系统的参与下,膜囊泡从ER转运至叶绿体上聚集,诱导叶绿体膜内陷,包裹病毒RNA、双链RNA和RdRp[27]。水稻黑条矮缩病毒(RBSDV)的外壳蛋白P10能定位于ER膜上,诱导ER形成多孔结构[28]。烟草饰纹病毒(TEV)和马铃薯X病毒(PVX)都是在ER内陷的膜结构上复制,但其诱导的膜形成机制尚不清楚[29]。此外,雀麦花叶病毒(BMV)的RNA1编码的复制酶1a蛋白可单独结合在ER外膜上,诱发ER外膜内陷形成内质网小球[30-31]。
3.2 病毒侵染诱发UPR信号通路
新近研究表明,植物病毒侵染不仅改变ER膜形态,也诱导ERs相关的UPR信号。如PVX和 RBSDV侵染本氏烟,ERs伴侣基因BiP和UPR基因bZIP60表达上调。
PVX侵染本氏烟3 d,寄主UPR基因转录水平提高3倍以上,尤其是BiP、bZIP60和S期激酶相关蛋白(SKP1)在接种2 d后显著提高。是其运动蛋白TGBp3(ORF3编码的8 kD的膜结合蛋白)触发了UPR信号。TGBp3过表达导致的坏死斑能经TGBp3和BiP同时过表达解除,说明UPR能缓解ERs相关的细胞死亡。bZIP60沉默抑制BiP和SKP1的转录,降低PVX积累;而SKP1沉默则促进PVX积累,说明bZIP60为UPR的上游信号[32]。
在TMV的基因组中插入TGBp3,接种本氏烟,产生非TMV或PVX症状的枯斑,且活性氧上升、DNA碎裂和SKP1上调,即TGBp3诱发了PCD。此外,TGBp3诱导UPR基因在8 h内表达上调15-35倍,在出现PCD前下降;过表达BiP抑制PCD,说明UPR是居前的生存机制。SKP1沉默使TGBp3诱发的PCD下降,说明此PCD依赖于SKP1[33]。
RBSDV侵染本氏烟和水稻原生质体2 d,其外壳蛋白P10触发ERs标记基因BiP及UPR基因bZIP60、PDI、钙调蛋白(CAM)表达上调2.5~3.5倍[30]。
此外,在TMV侵染NN烟草产生的枯斑及其临近健康细胞的胞质和液泡中,观察到包裹胞质和细胞器的双层膜自噬泡,及自噬小体与液泡逐渐融合的过程,说明N基因介导的抗TMV的HR诱发了细胞自噬[34]。
在TMV侵染人类海拉细胞的体外模型中,TMV-RNA也诱导细胞自噬,病毒蛋白在自噬小泡膜上积累。不仅细胞中有疑似TMV的病毒粒子,且TMV-RNA在ER膜上被翻译成MP,+RNA从细胞质转移到细胞核,同时BiP表达上调;形成的自噬小泡与ER膜扩大密切相关。这显示海拉细胞用ERs及自噬来抵御TMV-RNA[35]。
4 问题与展望
单链RNA病毒诱发ER形成复制的“布袋”类结构,复制产生的大量病毒蛋白势必引起ERs,诱发UPR信号。病毒侵染诱导的植物UPR信号通路研究刚开始,病毒调控bZIP60信号利于自身复制的机制;烟草与拟南芥同源的ERs关键因子bZIP28和NAC089的鉴定及其在病毒侵染过程中的作用,均不明确。
此外,不在ER膜上复制的病毒是否诱导ERs相关的UPR?如黄瓜花叶病毒(CMV)侵染导致ER膜增生,产生较大的膜状体和髓鞘样结构。同时液泡增多,液泡膜边缘凹陷,包裹一些内含纤细丝状物质的圆形或卵圆形小泡;免疫胶体金电镜检测到病毒的复制酶1a和2a主要位于液泡膜,证明液泡是病毒复制的场所,通过胞间连丝(PD)胞间转运[36-38]。在CMV系统侵染的三生NN烟病变细胞中,作者也观察到液泡内陷形成双层膜囊泡,内中包裹双层膜的小泡;UPR基因在6~12 h上调1.0~3.3倍,PCD相关基因NAC089在12~24 h上调(待发表)。此外,在CMV(Y/GM2)tr株系侵染心叶烟产生的枯斑细胞中有液泡增生的膜状结构和核凋亡现象[39]。这说明CMV虽然在液泡膜上复制,但其侵染也与ER密不可分。
为此,作者通过构建ER标签,在接种TMV和CMV的本氏烟表皮细胞中,观察到TMV诱导ER膜形成逐渐长大的点状小体,ER的微管发生重排,CMV诱导ER膜明显增生。通过RACE和同源克隆已获得烟草的NbbZIP28和NbNAC089全序列;bZIP28和NAC089为ER膜蛋白,在病毒侵染初期被显著诱导;NAC089沉默株对病毒的敏感性上升(待发表)。
综上所述,ERs应答信号在病毒侵染过程中发挥着重要的作用。病毒侵染导致ERs,调控细胞存活信号UPR,维持细胞内的稳态,完成病毒侵染复制,表现为系统花叶症状;若刺激过强,寄主启动PCD途径,以细胞凋亡或自噬的主动消亡方式抵御病毒侵染,表现为坏死症状。
虽然,已知拟南芥非生物刺激触发的ERs相关的2条UPR通路和1条PCD通路,研究也表明植物病毒侵染或特定的病毒蛋白能激活UPR信号。但病毒是如何调控细胞UPR信号,逃避PCD,完成复制,建立侵染关系的尚不明确。
此外,病毒、寄主和环境三要素中每一因素的改变都呈现不同的抗感症状,说明不同的病毒在不同抗感寄主和不同环境条件下触发的UPR信号通路及信号强弱不同。阐明病毒与UPR的互作机制,寻找特定的诱导子或抑制子是抗病毒研究的重要方向。
[1] Zhang L R, Wang A M. Virus-induced ER stress and the unfolded protein Response[J]. Front Plant Sci, 2012, 3: 1-16.
[2] 宋泽婷,孙乐,刘建祥. 环境胁迫诱导的植物内质网胁迫应答信号转导与基因调节[C]//全国植物生物学研讨会论文摘要集,2010.
[3] 孙玲. 拟南芥内质网胁迫应答中转录因子NAC103的功能分析[D]. 上海:复旦大学,2013.
[4] Hetz C. The unfolded protein response: controlling cell fate decisions under ER stress and beyond[J]. Nat Rev Mol Cell Bio, 2012, 13(2): 89-102.
[5] Jheng J R, Ho J Y, Horng J T. ER stress, autophagy, and RNA viruses[J]. Front Microbiol, 2014, 5: 1-13.
[6] Liu J X, Srivastava R, Che P, et al. An ER stress response in Arabidopsis is mediated by proteolytic processing and nuclear relocation of a membrane-associated transcription factor AtbZIP28[J]. Plant Cell, 2007, 19(12): 4111-4119.
[7] Liu J X, Howell S H. bZIP28 and NF-Y transcription factors are activated by ER stress and assemble into a transcriptional complex to regulate stress response genes in Arabidopsis[J]. Plant Cell, 2010, 22 (3): 782-796.
[8] Liu J X, Srivastava R, Che P, et al. Salt stress responses in Arabidopsis utilize a signal transduction pathway related to ER stress signaling[J]. The Plant Journal, 2007, 51(5): 897-909.
[9] Koizumi N,Martinez I M, Kimata Y, et al. Molecular characterization of two Arabidopsis Ire1 homologs, endoplasmic reticulum-located transmembrane protein kinases[J]. Plant Physiol, 2001, 127(3): 949-962.
[10] Deng Y,Humbert S,Liu J X,et al. Heat induces the splicing by IRE1 of a mRNA encoding a transcription factor involved in the unfolded protein response in Arabidopsis[J]. Proc Natl Acad Sci, 2011, 108(17): 7247-7252.
[11] Sun L, Yang Z T, Song Z T, et al. The plant-specific transcription factor gene NAC103 is induced by bZIP60 through a new cis-regulatory element to modulate the unfolded protein response in Arabidopsis[J]. The Plant Journal, 2013, 76 (2): 274-286.
[12] Iwata Y, Koizumi N. An Arabidopsis transcription factor,AtbZIP60, regulates the endoplasmic reticulum stress response in a manner unique to plants[J]. Proc Natl Acad Sci, 2005, 102(14): 5280-5285.
[13] Lu D, Christopher D A. Endoplasmic reticulum stress activates the expression of a subgroup of protein disulfide isomerase genes and AtbZIP60 modulates the response in Arabidopsis thaliana[J]. Mol Genet Genomics, 2008, 280: 199-210.
[14] Yang Z T, Wang M J, Sun L, et al. The membraneassociated transcription factor NAC089 controls ER-stress-induced programmed cell death in plants[J]. PLoS Genet, 2014, 10(3): 1-15.
[15] Takahashi H, Kawakatsu T, Wakasa Y, et al. A rice transmembrane bZIP transcription factor, OsbZIP39, regulates the endoplasmic reticulum stress response[J]. Plant Cell Physiol, 2011, 53(1): 144-153.
[16] Hayashi S, Wakasa Y, Takahashi H, et al. Signal transduction by IRE1-mediated splicing of bZIP50 and other stress sensors in the endoplasmic reticulum stress response of rice[J]. The Plant Journal, 2011, 69(6): 946-956.
[17] Lu S J, Yang Z T, Sun L, et al. Conservation of IRE1-regulated bZIP74 mRNA unconventional splicing in rice (Oryza sativa L.) involved in ER stress responses [J]. Molecular Plant, 2012, 5(2): 504-514.
[18] Wang B, Zheng J, liu Y J, Wang J H, et al. Cloning and characterization of the stress-induced bZIP gene ZmbZIP60 from maize[J]. Mol Biol Rep, 2012, 39(5): 6319-6327.
[19] Tateda C, Ozaki R, Onodera Y, et al. NtbZIP60,an endoplasmic reticulum-localized transcription factor, plays a role in the defense response against bacterial pathogens in Nicotiana tabacum[J]. J Plant Res, 2008, 121: 603-611.
[20] Xu G Y, Li S Z, Xie K, et al. Plant ERD2-like proteins function as endoplasmic reticulum luminal protein receptors and participate in programmed cell death during innate immunity[J]. The Plant Journal, 2012, 72(1): 57-69.
[21] Heinlein M, Padgett H S, Gens J S, et al. Changing patterns of localization of the tobacco mosaic virus movement protein and replicase to the endoplasmic reticulum and microtubules during infection[J]. Plant Cell, 1998, 10: 1107-1120.
[22] Reichel C, Beachy R N. Tobacco mosaic virus infection induces severe morphological changes of the endoplasmic reticulum[J]. Proc Natl Acad Sci, 1998, 95(19): 11169-11174.
[23] 刘成科,洪健,周雪平. 内质网和细胞骨架在植物病毒细胞内转运中的作用[J]. 细胞生物学杂志,2008(5):617-621.
[24] Liu C K , Nelson R S. The cell biology of Tobacco mosaic virus replication and movement[J]. Plant Sci, 2013, 4: 1-10.
[25] 胡帆,雷荣,廖晓兰. 植物病毒在细胞间转运的机理探讨[J]. 生物学杂志,2013,30(6):81-85.
[26] Schwartz M, Chen J, Lee W M, et al. Alternate, virusinduced membrane rearrangements support positive – strand RNA virus genome replication[J]. Proc Natl Acad Sci, 2004, 101(31): 11263-11268.
[27] Wei T, Huang Y S, McNeil J, et al. Sequential Recruitment of the endoplasmic reticulum and chloroplasts for plant potyvirus replication[J]. Virology, 2010, 84(2): 799-809.
[28] Sun Z T, Yang D, Xie L, et al. Rice black-streaked dwarf virus P10 induces membranous structures at the ER and elicits the unfolded protein response in Nicotiana benthamiana[J]. Virology, 2013, 447(1-2): 131-139.
[29] Turner K A, Sit T L, Callaway A S, et al. Red clover necrotic mosaic virus replication proteins accumulate at the endoplasmic reticulum[J]. Virology, 2004, 320: 276-290.
[30] Restrepo-Hartwig M, Ahlquist P. Brome mosaic virus RNA replication proteins 1a and 2a colocalize and 1a independently localizes on the yeast endoplasmic reticulum[J]. Virology, 1999, 73(12): 10303-10309.
[31] Den Boon J A, Chen J B, Ahlquist P. Identification of sequences in Brome mosaic virus replicase protein 1a that mediate association with endoplasmic reticulum membranes[J]. Virology, 2001, 75(24): 12370-12381.
[32] Ye C, Dickman M B, Whitham S A, et al. The unfolded protein response is triggered by a plant viral movement protein[J]. Plant Physiol, 2011, 156(2): 741-755.
[33] Ye C M, Chen S, Payton M, et al. TGBp3 triggers the unfolded protein response and SKP1-dependent programmed cell death[J]. Mol Plant Pathol, 2013, 14(3): 241-255.
[34] Liu Y L, Schiff M, Czymmek K, et al. Autophagy regulates programmed cell death during the plant innate immune response[J]. Cell, 2005, 121: 567-577.
[35] Li L, W L, Xiao R J, Zhu G G, et al. The invasion of tobacco mosaic virus RNA induces endoplasmic reticulum stress-related autophagy in HeLa cells[J]. Bioscience Rep, 2012, 32(2): 171-184.
[36] 洪健,陈集双,李德葆. 不同CMV分离物侵染寄主的超微结构变化[J]. 中国病毒学,2000,15(1):66-72.
[37] Cillo F, Roberts I M, Palukaitis P. In situ localization and tissue distribution of the replication-associated proteins of Cucumber mosaic virus in tobacco and cucumber[J]. J Virol, 2002, 76 (21): 10654-10664.
[38] 刘朝辉. 黄瓜花叶病毒运动蛋白与微丝作用关系及胞间连丝通透性调节机制的研究[D]. 北京:中国农业大学,2005.
[39] Ishihara T, Takahashi H, Hase S, et al. Ultrastructure of necrotic lesions in Nicotiana glutinosa leaves locally infected with a variant of Cucumber mosaic virus[J]. Phytopathology, 2002, (150): 553-556.
Endoplasmic Reticulum Stress Induced by Plant Viral Infection
LI Fangfang, SHEN Lili*
(Tobacco Research Institute, Chinese Academy of Agricultural Science, Qingdao, 266101, China)
The cellular translation machinery is hijacked by large amounts of viral proteins upon viral infection. As a result, the unfolded or misfolded proteins accumulated in the lumen of the endoplasmic reticulum leads to ER stress (ERs), which triggers the unfolded protein response (UPR) or programmed cell death (PCD). On the basis of the ERs-related UPR signaling induced by animal viruses, this review summarizes recent understanding of the ERs signaling induced by abiotic factors in Arabidopsis and triggered by plant viral infection, reviews the ERs induced in plant virus infected cell , including the morphological changes of ER membranes and the activation of UPR genes, analyzes the vital role of ERs signaling in viral infection, and points out that the viruses manipulate UPR in favor of their replication and the host initiates PCD of apoptosis to resist viruses. Little is known about the crosstalk between different UPR arms and PCD, and signal strength of UPR regulated by different viruses. Searching for the key regulators of virus induced host UPR and escaped from host PCD is the developing direction of antiviral research.
plant virus; endoplasmic reticulum stress; unfolded protein response; programmed cell death
S435.72
1007-5119(2016)06-0095-06
10.13496/j.issn.1007-5119.2016.06.017
中国农业科学院科技创新工程(ASTIP-TRIC04)
李方方,女,硕士,主要从事病毒与寄主互作研究。E-mail:156845354@qq.com。*通信作者,E-mail:sdrzsll@tom.com
2016-04-07
2016-07-11
