烟草赤星病菌嘧菌酯抗性突变体的诱导及其生物学特性
2016-06-29汪汉成薛娟娟黄艳飞王茂胜张长青
汪汉成,薛娟娟,黄艳飞,王茂胜,张长青
(1.贵州省烟草科学研究院,贵阳 550081;2.长江大学农学院,湖北 荆州 434025)
烟草赤星病菌嘧菌酯抗性突变体的诱导及其生物学特性
汪汉成1,薛娟娟2,黄艳飞2,王茂胜1,张长青2
(1.贵州省烟草科学研究院,贵阳 550081;2.长江大学农学院,湖北 荆州 434025)
为探究烟草赤星病菌对嘧菌酯的抗药性风险水平,通过对烟草赤星病菌在室内含药平板上的菌丝药剂驯服和分生孢子紫外诱变,进行突变体的生物学特性的研究,并对突变体靶标基因细胞色素b进行了测序分析。获得了4株嘧菌酯抗药性突变体。其中,菌丝药剂驯服未获得突变体;孢子紫外诱变获得4株突变体,突变率约为0.004%,突变体抗性倍数分别为42.50、282.50、515和107.50。4株突变体均降低了对嘧菌酯的敏感性。适合度研究表明,抗药性突变体具有同敏感菌株同样的分生孢子萌发能力和致病能力;菌丝生长速率较敏感菌株有所降低,3株突变体的分生孢子产量较敏感菌株增强,1株突变体较敏感菌株减弱。抗药性靶基因细胞色素b基因部分序列分析表明,突变体在129位和143位的碱基与敏感菌株完全相同,未发生任何突变。初步认为烟草赤星病菌对嘧菌酯的抗性风险水平较低。
嘧菌酯;抗药性;烟草赤星病菌;甲氧基丙烯酸酯;突变体
烤烟(Nicotiana tabacum L.)是我国重要的经济作物,其在我国的产量和消费量均占全球约40% 左右[1-2]。由Alternaria alternata(Frises)Keissler引起的烟草赤星病是烟草生长中后期发生最为严重的叶部病害之一,导致烟叶品质下降,烘烤价值降低[3-5]。该病害具有间歇性和爆发性的特点,严重时烟叶发病率可高达90%,重病区减产、减收达50%以上[6-7]。长期以来,烟草赤星病严重威胁我国烟草的生产。目前,我国主要采用菌核净(dimetachlone)来防治烟草赤星病,长期高频率的应用已使病原菌群体出现了严重的抗药性[8],亟待寻找新的替代防治药剂,并对新药剂的抗药性风险进行评估。近年来,甲氧基丙烯酸酯类杀菌剂陆续在我国登记,用于多种链格孢属真菌病害的防治[9-12]。
嘧菌酯(azoxystrobin)是甲氧基丙烯酸酯类杀菌剂的典型代表。它由瑞士先正达公司研制开发,并于2001开始在中国登记。它通过与细胞色素bcl复合物中Qo位点结合,切断呼吸链中的电子传递,抑制真菌细胞能量产生,干扰呼吸,从而抑制菌丝生长和孢子萌发[13-15]。嘧菌酯在开发和研究早期,被认为具有中等抗药性风险[16];但实际上,在它应用2年后,就出现了防治效果下降的现象。目前,被报道对甲氧基丙烯酸酯类杀菌剂产生抗药性的链格孢属病原菌有链格孢菌(A.alternata),极细链格孢菌(Alternaria tenuissima),茄链格孢(Alternaria solani)和苹果褐斑病菌(Alternaria mali)[9,11,17]。嘧菌酯在欧美被用于赤星病的防治,目前还没有发现烟草赤星病菌对它产生抗药性的报道。烟草赤星病菌是否对嘧菌酯存在抗药性风险目前仍不清楚。
药剂高选择压下病原菌突变体的诱导和其生物学习性的研究是评价病原菌抗药性风险的重要方法。为了更好地防治病害,就必须进行病原菌对其防治药剂产生抗药性的风险评估。本文以烟草赤星病菌敏感性菌株为对象,进行嘧菌酯抗药性突变体的诱导及突变体的生物学习性的研究,旨在评价烟草赤星病菌对嘧菌酯产生抗药性的风险水平。
1 材料与方法
1.1 病原菌及培养条件
野生敏感烟草赤星病菌菌株C2-1,由贵州省烟草科学研究院微生物实验室分离和鉴定,用于嘧菌酯抗药性突变体诱导。马铃薯培养基(PDA)用于病原菌的培养及保存。AEA培养基:5 g酵母、6 g NaNO3、6 g KH2PO4、0.5 g KCl、0.25 g MgSO4、20 mL甘油及15 g琼脂,加去离子水定容至1 L,灭菌,用于敏感性测定及分生孢子的诱导。
1.2 供试药剂
93%嘧菌酯由先正达(中国)有限公司提供,溶于甲醇配成10 000 mg/L的母液。旁路氧化途径抑制剂水杨肟酸(SHAM,99%)由美国Acros Organics公司生产,溶于甲醇配成1.0×105mg/L的母液。用无菌水将上述母液稀释成系列浓度的药液,于4 ℃黑暗条件下保存、备用。药液中甲醇的含量小于待测溶液体积的0.5%,此浓度的甲醇不影响烟草赤星病菌分生孢子的萌发(数据略)。以加入相同体积的甲醇处理作为空白对照。
1.3 抗药性突变体的诱导
紫外诱变:将敏感菌株C2-1于PDA平板上预培养4 d,在菌落边缘制备菌碟(5 mm),将菌碟置于AEA平板上,25 ℃培养7 d后,无菌水洗涤孢子,获得分生孢子悬液,并将孢子浓度调至1.0×105个/mL,备用。制备嘧菌酯100 mg/L的含药平板,吸取100 µL的分生孢子悬液涂布于平板上,预培养2 h后,将平板置于紫外灯下(40 W,垂直距离15 cm)照射20 min,照射后的平板置于25 ℃的恒温培养箱中黑暗培养7 d。从长出的菌落边缘挑取少量菌丝继续培养,直至产孢,收集分生孢子并将其涂布于嘧菌酯100 mg/L的含药平板进行验证,能够正常生长的即为抗药性突变体。
药剂驯服诱导:在预培养菌落边缘用打孔器制备直径5 mm的菌饼,将菌饼接种于含嘧菌酯500 mg/L的AEA平板上,25 ℃恒温培养,直至扇形突变菌落出现。共处理200个菌饼,将获得的突变体在含嘧菌酯500 mg/L的平板上进行再次生长验证。
1.4 室内敏感性测定
采用孢子萌发法[18]测定烟草赤星病菌敏感和抗性菌株对嘧菌酯的敏感性。分别将0.50 mL各浓度药液与0.50 mL孢子悬浮液混合均匀,取100 μL该混合液滴于载玻片上,置于保湿培养皿中,28 ℃黑暗条件下培养12 h。嘧菌酯单独作用时的最终供试浓度为0、0.5、1、10和40 mg/L;在100 mg/L水杨肟酸协同下,嘧菌酯最终供试浓度为0、0.5、1、10和40 mg/L。当空白对照孢子萌发率达到90%以上时,检查各处理孢子萌发情况。以孢子芽管长度大于孢子的短半径时视为萌发。每处理重复3次,随机观察3个视野,调查孢子总数不少于200个,记录孢子萌发数及孢子总数,计算孢子萌发抑制率。
1.5 适合度的测定
以敏感菌株为对照,测定抗性突变体的菌丝生长、离体平板上的分生孢子产量、分子孢子的萌发及烟草叶片上的致病力。
1.5.1 菌丝生长 将从预培养菌落边缘制取的5 mm菌饼置于无药AEA平板中央,25 ℃黑暗条件下培养,6天后“十字交叉法”量取菌落直径。每个菌株3次重复。
1.5.2 分生孢子产量与萌发 参照Caten等[19]孢子产量的测定方法,测定各抗性突变体平板上分生孢子的产量。在同一平板内,用5 mm直径打孔器分别在距菌落边缘2 mm的地方和距接菌饼2 mm的地方制取菌饼;从两处各随机挑取3个菌饼,共6个于2 mL离心管中。向离心管中加入1 mL无菌水,在涡旋仪上涡旋20秒洗下分生孢子,置于显微镜下检查孢子的数量,计算单位面积上孢子的产量。各菌株3次重复。分子孢子的萌发在上述1.4敏感性测定的过程中进行检测。
1.5.3 致病力 在烟草叶片上测定各抗药性突变体的致病力。每菌株选取3片无病成熟烟草叶片,用无菌水冲洗干净,吸干叶片上的水分。每叶片同一部位刺上相同的伤口,在伤口处接种直径5 mm的菌饼(菌丝面朝上)。然后置于28 ℃、空气相对湿度RH>80%、每天12 h光照/12 h黑暗的条件下培养,9 d后观察各抗药性突变体的致病情况。
1.6 抗药性突变体cyt b基因的测序与分析
将敏感菌株和突变体于PDA平板上活化,挑取少量菌丝于装有50 µL Lysis Buffer for Microorganism to Direct PCR[宝生物工程(大连有限公司),TaKaRa货号D304]的无菌PCR中,80 ℃水浴15 min后,低速离心,取上清液作为PCR反应的模板。采用特异性引物对敏感菌株和突变体的部分细胞色素b基因(cyt b)进行PCR扩增。利用特异性引物cytb-3 (5′-CAGAGCACCTAGAACTCT AGTATGAA-3′)和cytb-4(5′-AACAACTCAAGT AAACTCCTCC-3′)对细胞色素b基因129位和143位附近的序列进行PCR扩增[12]。扩增条件为:95 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72℃ 延伸1 min,共40个循环;最终72 ℃延伸10 min。PCR产物经纯化后,参照质粒pMD19-T(TaKaRa:D102A)的方法将其连接至载体上,将验证后的转化子送生工生物工程上海(股份)有限公司测序,分析突变体cyt b的碱基变化情况。
1.7 数据分析
采用Microsoft Excel 2010软件进行处理,以药剂的浓度对数为横坐标,以对病菌分生孢子萌发抑制率的对数值为纵坐标,建立线形回归方程,并进行相关性分析。根据方程计算嘧菌酯抑制孢子萌发的EC50值。通过DPS(7.05)软件进行统计分析。根据下列公式计算抗药性突变体的抗性倍数:RF=EC50X/EC50WT,其中EC50X为被测菌株X的EC50值,EC50WT为敏感菌株的EC50值。
2 结 果
2.1 烟草赤星病菌嘧菌酯抗性突变体的诱导
室内平板上药剂驯服未获得烟草赤星病菌嘧菌酯抗药性突变体;而含药平板上的紫外诱导获得了烟草赤星病菌嘧菌酯抗药性突变体4株,分别命名为CX-y1、CX-y2、CX-y3、CX-y4,诱导率为0.004%。表明该病菌具有在田间产生嘧菌酯抗药性的遗传和生化基础,但在室内通过紫外诱变来获得烟草赤星病菌嘧菌酯抗性突变体的几率很低。
2.2 室内敏感性测定
由表1看出,在嘧菌酯0~40 mg/L测试范围内,随着处理浓度的增加,所测菌株分生孢子萌发的抑制均逐渐增强。嘧菌酯1 mg/L单独作用时,敏感菌株C2-1不能萌发;而突变体CX-y1、CX-y2、CX-y3和CX-y4在最高测试浓度40 mg/L时仍均有萌发,其萌发率分别为80%、72.80%、70.80%和68.31%。在100 mg/L水杨肟酸协同下,敏感菌株C2在0.5 mg/L嘧菌酯作用下不能萌发;而突变体CX-y1、CX-y2、CX-y3和CX-y4在最高测试浓度40 mg/L时的萌发率分别为9.70%、9.80%、7.60%和9.60%。
所有抗药性突变体均降低了对嘧菌酯的敏感性。嘧菌酯单独作用下,敏感菌株孢子萌发的EC50值为0.05 mg/L,突变体的EC50值均>10 mg/L;在100 mg/L的水杨肟酸协同下,敏感菌株孢子萌发的EC50值为0.004 mg/L,突变体CX-y1、CX-y2、CX-y3及CX-y4的EC50值分别为0.17、1.13、2.06及0.43 mg/L,突变体的抗性倍数分别为42.50、282.50、515和107.50(表2)。
2.3 适合度
以敏感菌株为对照,测定了烟草赤星病菌嘧菌酯抗药性菌株4个方面的适合度。结果表明,在适合度的4个方面,各突变体间存在着较大的差异。
在菌丝生长速率上,4株突变体的菌丝生长速度均较敏感菌株慢,其中最快的为CX-y2,其次为CX-y3和CX-y4,CX-y1最慢;在产孢量上,突变体CX-y1和CX-y2的产孢量较敏感菌株多,CX-y3与敏感菌株相当,CX-y4产孢量最少,低于敏感菌株;在分生孢子萌发率上,所有突变体的萌发率与敏感菌株相当;在致病力上,所有突变体均能顺利侵染烟草叶片,并使其发病(表3)。
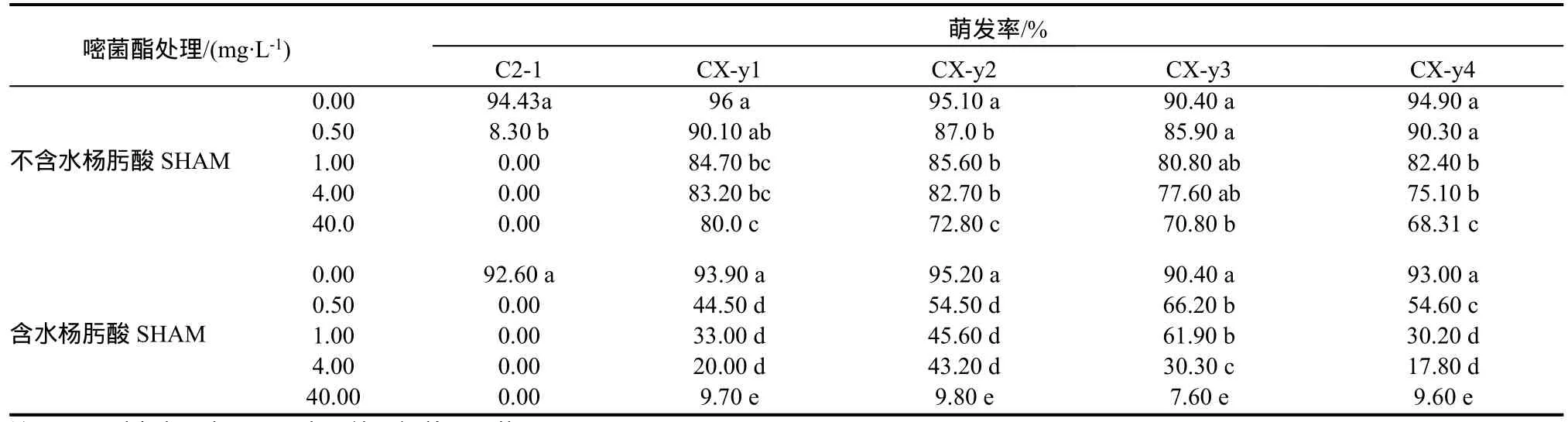
表1 嘧菌酯及其协同SHAM对烟草赤星病菌敏感和抗药性突变体孢子萌发的影响Table 1 Conidia germination sensitivity of Alternaria alternata to azoxystrobin among sensitive and resistant isolates with the synergism of salicylhydroxamic acid

表2 嘧菌酯及其协同SHAM对烟草赤星病菌敏感菌和抗药性突变体的毒力Table 2 Toxicity of azoxystrobin with salicylhydroxamic acid to Alternaria alternata among the sensitive and resistant isolates

表3 烟草赤星病菌嘧菌酯抗性突变体的适合度Table 3 Fitness components of the resistant and sensitive isolates of Alternaria alternata to azoxystrobin
2.4 抗药性突变体cyt b基因的测序与分析
cyt b基因129位和143位碱基发生的点突变是病原菌对嘧菌酯产生抗药性的主要分子机理。以敏感菌株和突变体的DNA作为模版,利用特异性引物cytb-3/cytb-4对各菌株的cyt b基因进行PCR扩增,其扩增片段长度均在150 bp左右。PCR产物经纯化、链接pMD19-T载体及测序,成功获得了敏感菌株和突变体的cyt b基因的部分序列。测序结果与GenBank中的已有序列DQ209283.1进行比对,结果表明4种突变菌株所测cyt b部分基因与敏感菌株的相同,基因的129位和143位碱基均未发生突变(图1)。

图1 烟草赤星病菌嘧菌酯敏感菌株和抗药性突变体 cyt b基因部分序列比对结果Fig. 1 Sequence comparison of partial cyt b gene from both the azoxystrobin resistant mutants and the sensitive isolate of Alternaria alternate
3 讨 论
烟草赤星病菌在一个生产季节可以造成多次再侵染,同时产生大量的分生孢子,这些孢子可以通过风、雨水等很容易地结合而进行遗传物质的交换与重组。因此,可以初步将它划分为“中-高”等风险的病原菌。目前,杀菌剂抗性委员会还未对烟草赤星病菌进行抗药性风险评价。本文诱导了烟草赤星病菌嘧菌酯抗药性的突变体,研究了突变体的生物学性状,并对突变体突变潜在的分子机理进行了探索。研究结果对评价烟草赤星病菌对嘧菌酯的抗药性风险具有重要的意义。
对病原菌进行杀菌剂抗药性风险评估的方法有很多,如:室内对病原菌孢子的紫外线诱变、对孢子的N-亚硝基甲脲诱变、以及在田间高剂量的药剂驯服等。然而,不同方法获得的抗药性突变体会表现出不同的适合度。病原菌抗药性菌株适合度的强弱对指导病害的防治具有重要的指导意义。同烟草赤星病菌敏感菌株相比,嘧菌酯抗性突变体或菌丝生长速率减小而产孢量变大,或菌丝生长速率和产孢量均减小。因此本文室内诱得的烟草赤星病菌嘧菌酯抗性菌株的田间适合能力可能比较弱;其在田间环境条件下的适应能力及其与敏感菌株在田间的竞争能力还有待于进一步研究。据报道,甲氧基丙烯酸酯类药剂抗性是由细胞色素b的基因发生点突变引起的,包括氨基酸143位的丙氨酸突变为甘氨酸(即G143A)[12],氨基酸129位的亮氨酸突变为苯丙氨酸(F129L)[20],及氨基酸137位的精氨酸突变为甘氨酸(G137R)[21]。G143A突变的抗性倍数一般在100倍以上,F129L和G137R突变的抗性倍数一般在5~15倍之间,少数会大于50倍[22]。本文通过紫外诱变获得了4株烟草赤星病菌嘧菌酯抗性突变体,突变几率低,抗药性倍数>100的3株、<100的1株,突变体的适合度均低于敏感菌株。低频率突变体的获得可能与诱变所采用的方法和材料有关,同时紫外诱变具有很大的随机性,以致可能出现cyt b基因靶位点以外的突变体。本文检测突变体的cyt b基因潜在位点均未有发生突变,说明烟草赤星病菌对嘧菌酯可能存在其他的潜在突变基因或者突变位点,有必要进一步深入研究以探寻其产生抗药性的分子机理。
烟草赤星病通常在烟草采烤期发生,危害时间约2个月。虽然条件适宜时病原菌能够迅速流行与传播;但同蔬菜灰霉病、白粉病等相比,赤星病菌的再侵染次数较少,病原菌群体在药剂压力下的接触时间相对较少。因而,可把烟草赤星病菌初步视为低等风险病原菌。本文通过药剂驯服和紫外诱变均没有获得嘧菌酯靶基因的突变体。结合烟草赤星病菌的生物学特性,该病原菌对嘧菌酯的抗药性风险应该属于低等水平。
参考文献
[1] Wang H C, Huang Y F, Tang X G, et al. Leaf and stem rot of tobacco (Nicotiana tabacum) caused by Rhizopus oryzae in closed curing barns in Guizhou province of China [J]. Plant Disease, 2016, 100(2): 536.
[2] Wang H C, Wang M S, Xia H Q, et al. First report of Fusarium wilt of tobacco caused by Fusarium kyushuense in China [J]. Plant Disease, 2013, 97(3): 424.
[3] 刘学敏,李大壮,常稳. 烟草赤星病研究现状及存在问题[J]. 东北农业大学学报,2000,31(1):80-85.
[4] Stavely J R, Main C E. Influence of temperature and other factors on initiation of tobacco brown spot [J]. Phytopathology, 1970, 60: 1591-1596.
[5] Lucas G B. Alternaria alternata (Fries) Keissler, the correct name for A. tenuis and A. longipes[J]. Tobacco Science, 1971 (15): 37-42.
[6] Stavely J R. Relationship of post inoculation leaf wetness to initiation of tobacco brown spot [J]. Phytopathology, 1975, 65: 897-901.
[7] 彭希文,刘光珍,杨永柱,等. 云南省烟草赤星病(Tobacco brown spot)病原研究及其防治药剂的筛选[J]. 西南农业大学学报,2000,22(2):153-156.
[8] 孟建玉,曹毅,陆宁,等. 贵州省烟草赤星病菌对菌核净的抗药性[J]. 植物保护学报,2013,40(5):497-480.
[9] Pasche J S, Wharam C M, Gudmestad N C. Shift in sensitivity of Alternaria solani (potato early blight) to strobilurin fungicides [J]. Proceedings of the BCPC Conference Pests & Disease, 2002, 33(8), 841-846.
[10] Arreaza J M, Hernández L. Evaluation of azoxystrobin on the early blight control (Alternaria solani) in tomatoes [J]. Revista De La Facultad De Agronomia De La Universidad Del Zulia, 2001, 18(2): 106-116.
[11] Ma Z, Felts D, Michailides T J. Resistance to azoxystrobin in Alternaria isolates from pistachio in California [J]. Pesticide Biochemistry and Physiology, 2003, 77(2): 66-74.
[12] Ma Z, Michailides T J. An allel-specific PCR assay for detecting azoxystrobin-resistant Alternaria isolates from pistachio in California[J]. Journal of Phytopathology, 2004, 152(2): 118-121.
[13] Brandt U, Schagger H, von Jagow G. Characterization of binding of the methoxyacrylate inhibitors mitochondrial cytochrome c reductase[J]. European Journal of Biochemistry, 1988, 173(3): 499-506.
[14] Hellwig V, Dasenbrock J, Klostermeyer D. New benzodioxepin type strobilurins from basidiomycetes structural revision and determination of the absolute configuration of strobilurin D and related methoxyacrylate antibiotics[J]. Tetrahedron, 1999, 55(33): 10101-10118.
[15] Becker W F, Jagow G V, Anke T. Oudemansi, strobilurin A, strobilurin B and myxothiazol: new inhibitors of the Bcl segment of the respiratory chain with an E-βmethoxyacrylate system as common structural element[J]. FEBS Lett, 1981, 132(2): 329-333.
[16] Brent K J, Hollomon D W. Fungicide resistance: the assessment of risk[M]. FRAC Monograph No. 2, Global Crop Protection Federation, Brussels, 1998: 48.
[17] Lu Y L, Sutton T B, Ypema, H. Sensitivity of Alternaria mali from North Carolina apple orchards to pyraclostrobin and boscalid [J]. Phytopathology, 2003, 93: S54.
[18] 黄艳飞,陈庆园,王进,等. 线粒体旁路氧化途径抑制剂水杨肟酸(SHAM)协同下烟草赤星病菌对嘧菌酯的敏感性[J]. 中国烟草学报,2015,21(6):65-70.
[19] Caten C E, Jinks J L. Spontaneous variability of single isolates of Phytophthora infestans. I. Cultural variations[J]. Can J Bot, 1968, 46: 329-348.
[20] Pasche J S, Piche L M, Gudmestad N C. Effect of the F129L mutation in Alternaria solani on fungicides affecting mitochondrial respiration[J]. Plant Disease, 89(3): 269-278.
[21] Sierotzki H, Frey R, Wullschleger J, et al. Cytochrome b gene sequence an structure of Pyrenophora teres and P. tritici-repentis and implications for QoI resistance [J]. Pest Mangement Science, 2007, 63(3): 225-233.
[22] Leadbeater A, Sierotzki H, Varney P. Mutations associated with QoI-resistance [R]. FRAC QoI Working Group, 2006.
Induction and Characterization of Laboratory Mutants of Alternaria alternata Resistant to Azoxystrobin
WANG Hancheng1, XUE Juanjuan2, HUANG Yanfei2, WANG Maosheng1, ZHANG Changqing2
(1. Guizhou Academy of Tobacco Science, Guiyang 550081, China; 2. College of Agriculture, Yangtze University, Jingzhou, Hubei 434025, China)
This study was conducted to analyze the risk of resistance of Alternaria alternata to azoxystrobin. Resistant mutants were induced by incubating mycelial plugs and mutating conidia on poisoned agar plates. Mutant characterization and mechanism of resistance were also studied and the target gene cyt b was analyzed using partial sequence analysis. Four mutants of A. alternata with resistance to azoxystrobin were isolated. No mutant was obtained through mycelial plug incubation while four mutants were isolated through conidia mutation, with a frequency of around 0.004%. The resistance factors for the four mutants were 42.50, 282.50, 515 and 107.50, respectively. All resistant strains displayed a highly reduced sensitivity to azoxystrobin. Studies of fitness parameters in the wild-type and mutant strains of A. alternata showed that all resistant isolates had equal abilities on conidia germination and virulence, and less ability in mycelial growth. Three mutants showed enhanced ability of conidia production, while the other one decreased its’ conidia production. Sequence analysis of the target gene cyt b showed that there was no point mutation at position 129 or 143 on neither the four mutants or the sensitive isolate of A. alternata. This is believed to be the first report of different levels of azoxystrobin resistance in A. alternata. These studies suggested that the risk of resistance development in A. alternata was low for azoxystrobin.
azoxystrobin; fungicide resistance; Alternaria alternata; strobilurin fungicide; mutant
S435.72
1007-5119(2016)06-0066-06
10.13496/j.issn.1007-5119.2016.06.012
国家自然科学基金项目“基于表型组学的嘧菌酯对烟草赤星病菌的作用机理及其抗性机理研究”(31360448)
汪汉成,男,博士,研究员,主要从事植物保护及烟草微生物研究。E-mail:xiaobaiyang126@hotmail.com
2016-05-10
2016-09-13
