浅水湖泊沉积物中水生植物残体降解过程及微生物群落变化
2016-06-28刘新黄庆慧江和龙宋娜
刘新,黄庆慧, ,江和龙,宋娜*
1. 南京林业大学生物与环境学院,江苏省环境工程重点实验室,江苏 南京 210037;2. 中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008
浅水湖泊沉积物中水生植物残体降解过程及微生物群落变化
刘新1,黄庆慧1, 2,江和龙2,宋娜2*
1. 南京林业大学生物与环境学院,江苏省环境工程重点实验室,江苏 南京 210037;2. 中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008
摘要:通过长期(700 d)的室内模拟实验,研究太湖优势沉水植物——马来眼子菜(Potamogeton malaianus)在不同深度沉积物中的分解过程,并通过454焦磷酸高通量测序方法研究了此过程中微生物群落结构的变化。结果表明:有机质在0~8、8~18和18~28 cm的沉积物中的降解率分别为49.6%、40.7%和38.7%,降解率随着深度增加而降低;沉积物腐殖化程度加强,腐殖质(包括HA和FA)含量均随着沉积物深度增加而增加,并且18~28 cm处的腐殖质含量均极显著高于其他深度的含量(P<0.01);经过长时间的分解,沉积物中的有机碳库从易降解有机质(LP)转化为难降解有机质(RP),植物残体中的木质素难以被微生物降解,大部分仍残留在沉积物中。从门的分类水平来看,初始沉积物和驯化后沉积物中的优势细菌相同,均为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、螺旋菌门(Spirochaetes)、厚壁菌门(Firmicutes);从属的分类水平来看,与初始沉积物相比,驯化后的表层沉积物中的细菌群落并未发生明显改变,优势细菌为Flavobacterium、GOUTA19、LCP-6、Crenothrix,但是驯化后深层沉积物中细菌群落结构发生明显改变,主要以厌氧细菌为主,如属于螺旋菌门中的密螺旋体属Treponema,在8~18和18~28 cm的沉积物中的含量分别为7.4%和8.8%。本研究旨在为水生植物残体在沉积物中的归属以及湖泊富营养化提供科学的理论指导和依据。
关键词:湖泊;沉积物;水生植物残体;分解;微生物
引用格式:刘新, 黄庆慧, 江和龙, 宋娜. 浅水湖泊沉积物中水生植物残体降解过程及微生物群落变化[J]. 生态环境学报,2016, 25(3): 489-495.
LIU Xin, HUANG Qinghui, JIANG Helong SONG Na. The Decomposition Processes of Aquatic Plant Residue and the Change of Microbial Community Structure in A Shallow Lake Sediment [J]. Ecology and Environmental Sciences, 2016, 25(3): 489-495.
在中国湖泊中,70%的湖泊是浅水湖泊,尤其是长江中下游地区,平均水深仅2 m左右(秦伯强,2002)。与深水湖泊相比,浅水湖泊单位水体具有更大的水-沉积物接触面积,更高的透光层深度,更强烈和频繁的水土界面物质交换,更复杂的生态类型(Nixdorf et al.,1997)。另外,湖泊中的水生植物是湖泊生态系统的重要组成部分,除了净化水体外(任文君等,2011),其自身储存了大量营养物质(Holmroos et al.,2015),这些水生植物死亡后,大部分的植物残体将沉积到表层沉积物中。因此研究浅水湖泊沉积物中植物残体的分解转化过程对认识湖泊内营养归转与富营养化过程、生物沉积与全球环境变化有着重要意义(Li et al.,2013)。
水生植物细胞壁主要由多糖类物质组成,包括纤维素、半纤维素和木质素。其中,木质素与纤维素和半纤维素以共价和非共价键形式结合,以嵌合体的形式包围或黏合纤维素,形成了坚固的天然屏障(Pettolino et al.,2012)。水生植物的结构导致了其残体难以被分解,并且分解过程复杂,主要包括其组织衰老和死亡后所有的物理和化学变化,该过程分为植物组织的水解、矿质成分及可溶性有机物的浸出或自溶、微小颗粒的逸散、各类有机成分的酶解(植物细胞内的酶)以及有机质的形成及转化(Brinson et al.,1981)等。
沉积物中水生植物残体的降解受许多因素影响,比如残体本身性质(碳氮的含量、结晶度、聚合度、取向度等)(Cornwell et al.,2008;Li et al.,2012)、自然气候条件(温度、pH、溶解氧、水中营养盐浓度、降水等)(Li et al.,2013)以及微生物群落结构(Gudasz et al.,2012)等,其中微生物对植物残体的降解过程呈现降解酶种类的多样性和酶解反应过程的复杂性。目前发现的降解植物残体的微生物有上千种,主要包括细菌、真菌、放线菌,甚至古菌中也有一部分具有分解植物纤维素能力,在湿地系统中细菌控制植物残体的降解速率,这些微生物能够通过同化作用将植物细胞壁中的多糖物质转化为单糖(Buesing et al.,2006)。事实上,目前对水生植物腐败分解已有大量研究,但是这些研究多集中于在湿地腐败水生植物上,并且多数是从腐败水生植物释放营养盐对水体造成二次污染的角度入手(Li et al.,2012;王博等,2012),而关于其在沉积物中的转化过程及微生物群落结构方面的研究较少。
本研究选取浅水湖泊——太湖的沉积物污染严重区域梅梁湾为研究对象,通过室内微宇宙实验模拟植物残体在沉积物中的腐烂分解,研究此过程中有机质转化及微生物群落结构的变化情况。
1 材料与方法
1.1 研究区域概况
太湖是中国长江中下游地区著名的大型浅水湖泊,是仅次于鄱阳湖和洞庭湖的全国第三大淡水湖泊,面积约为2338 km2,平均水深1.9 m,最大水深约为3.4 m。太湖包括东太湖、胥口湾、贡湖湾、梅梁湾、竺山湾五大湖湾,其中梅梁湾和竺山湾因换水周期相对较长,水浅及盛行风的作用,多次爆发蓝藻水华,目前成为太湖富营养化较严重的湖区(Song et al.,2013;赵兴青等,2007)。
1.2 样品采集及试验设计
分别采集太湖北部湖区梅梁湾区域(N31°22.651′,E120°14.924′)的水样和表层沉积物样品,其中水样过0.45 μm滤膜以去除悬浮物;沉积物样品混匀,去除石块、贝壳类等杂质。湖水和沉积物样品放入4 ℃冰箱待用。另外采集太湖优势沉水植物——马来眼子菜(Potamogeton malaianus),风干,粉碎,过100目筛待用。
实验装置采用自制的有机玻璃反应器,直径12 cm,高35 cm,容积约为4 L。每个反应器中加入1600 g湿沉积物和48 g处理后的马来眼子菜,从而使植物残体/沉积物的比例为3%(干重/干重)。沉积物和植物残体充分混匀后加入1 L原位采回的湖水做上覆水,将实验组串联,用蠕动泵和流动泵带动上覆水流动,以模拟原位湖水小风浪。本实验组共有3个重复反应器。试验中,反应器均用铝箔纸避光,实验装置置于25 ℃温室运行。实验运行两年,并且每隔3个月分层取样,从沉积物表层往下依次为8 cm、10 cm和10 cm。
1.3 沉积物样品的测定
1.3.1 总有机碳(TOC)的测定
TOC的含量采用重铬酸钾-油浴法测定(Song et al.,2013)。
1.3.2 腐殖质的测定
本实验主要测定腐殖质中的胡敏酸(HA)和富里酸(FA)两种组分,测定方法参照腐殖质协会(IHSS)的标准方法(Hong et al.,2010),具体测定如下:称取风干过筛的沉积物样品2.5 g,加入1 mol·L-1HCl使pH达到1~2,再加入0.1 mol·L-1HCl至液体体积为25 mL,室温下振荡1 h,离心,上清液分出FA(a)。在残留物中加入1 mol·L-1NaOH 25 mL,在氮气下混合、振荡4 h,静置过夜,离心,除去残渣,用6 mol·L-1HCl将提取液pH调到1.0,静置12 h,离心,上清液分出FA(b)。在氮气下将沉淀出来的HA用尽量少的0.1 mol·L-1KOH重新溶解,高速离心,加6 mol·L-1HCl调节pH至1.0,沉淀12~16 h,离心,弃去上清液,残留的HA用0.1 mol·L-1HCl+0.3 mol·L-1HF混合液,室温下振荡过夜,离心,反复用HCl+HF处理,使HA残余小于1.0%。再通过透析膜或透析管,直至AgNO3检测不出Cl-,冷冻干燥,用元素分析仪测定有机碳含量。合并(a)、(b)两份FA溶液,用XAD-8树脂吸附FA,弃去残留液,依次用0.1 mol·L-1NaOH和水洗脱,流出液立即用6 mol·L-1HCl调节pH至1.0,使FA仍留在溶液中。然后将溶液通过H+饱和的离子交换树脂,冷冻干燥得H+饱和的FA,用元素分析仪测定有机碳含量。
1.3.3 易降解有机质(LP)和难降解有机质(RP)的测定(Rovira et al.,2002)
(1)易降解有机质Ⅰ(LPⅠ,主要为非纤维素多糖类物质):称取0.5 g风干过筛的沉积物样品放入50 mL离心管中,加入20 mL 2.5 mol·L-1H2SO4,105 ℃静置30 min,4000 r·00m-1离心15 min,上清液倒出保存,残留物用20 mL蒸馏水清洗,离心。合并两次离心得到的上清液,采用元素分析仪测定碳含量。
(2)易降解有机质Ⅱ(LPⅡ,主要为纤维素类物质):在(1)中的残留物中加入2 mL 13 mol·L-1H2SO4室温过夜,持续振荡水解,然后用蒸馏水稀释酸度至1 mol·L-1,105 ℃水解3 h,每隔0.5 h摇晃一次。4000 r·min-1离心15 min,上清液倒出保存,残留物用20 mL蒸馏水清洗,离心。合并两次离心得到的上清液,采用元素分析仪测定碳含量。
(3)难降解有机质(RP):将(2)中的残留物用蒸馏水清洗两次,60 ℃烘干,采用元素分析仪测定有机碳含量。
本试验将LPⅠ和LPⅡ含量统称为易降解有机质(LP)。
1.3.4 微生物群落结构分析
分别测定初始沉积物和试验后沉积物中的微生物群落结构。首先用土壤基因组试剂盒(MO BIO,CA)提取样品中基因组总DNA。DNA的浓度通过Nanodrop 2000测定,确保A260/280≈1.8。随后将DNA样品送至上海美吉生物医药科技有限公司进行454焦磷酸测序。
细菌16S rRNA采用341F和907R作为PCR扩增引物。PCR反应采用ABI GeneAmp® 9700型PCR仪,反应体系如下(20 μL):5×FastPfu缓冲液,4 μL;2.5 mmol dNTPs,2 μL;Forward Primer(5 μmol),0.8 μL;Reverse Primer(5 μmol),0.8 μL;FastPfu聚合酶,0.4 μL;DNA模板10 ng,最后加灭菌的Milli-Q水至体积为20 μL。PCR反应过程为:95 ℃变性2 min,然后95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环25次,然后在72 ℃保持5 min,最后10 ℃保温至终止(Zhou et al.,2015)。
454测序数据结果用Qiime软件进行去噪、嵌合体检测和序列的质量分析,用Mothur软件进行菌群丰度和多样性分析。
1.3.5 数据分析与处理
本试验用沉积物中TOC的去除率来表征植物残体在沉积物中的降解率,此过程符合一级动力学方程(Olson,1963):

其中,C0为添加植物残体的初始沉积物中TOC含量;C为t天时沉积物中TOC含量;k为分解速率常数;t为分解进行的时间(d)。半反应时间(t1/2)计算公式为:

采用Origin 8.0软件对数据进行处理和绘图,并用SPSS 17.0统计软件对数据进行统计分析(P<0.05,显著性差异;P<0.01,极显著性差异)。
2 结果与分析
2.1 植物残体分解对沉积物有机质含量的影响
2.1.1 沉积物中植物残体降解速率及降解动力学变化
700 d的驯化试验期间,不同深度沉积物中TOC的降解率见图1。0~8、8~18和18~28 cm沉积物中TOC的降解率与时间均呈显著正相关关系(r2=0.86,0.94,0.91,P<0.05)。实验结束后,沉积物中TOC的降解率分别达到56.4%、52.5%和48.6%,随深度增加降解率降低。并且,在整个试验期间,49.6%、40.7%和38.7%的TOC降解率在前180 d进行,而在180~700 d之间,植物残体呈缓慢降解趋势。这与史学军等研究植物凋落物在土壤中的分解有相似的规律,凋落物有机碳在土壤中的分解有快速分解和缓慢分解两个过程,快速分解量大且持续时间相对较短,而缓慢分解则持续时间较长(史学军等,2009)。

图1 沉积物中TOC降解率随培养时间变化Fig. 1 Removal efficiencies of TOC in sediments with culture time
根据TOC降解率计算得到的降解动力学变化更直接地反应了植物残体在沉积物中的降解趋势(表1)。植物残体在表层沉积物中的降解速率最快(k=0.0019 d-1),半反应时间最短(t1/2=586.2 d),并且随着深度增加,降解速率和半反应时间均降低。
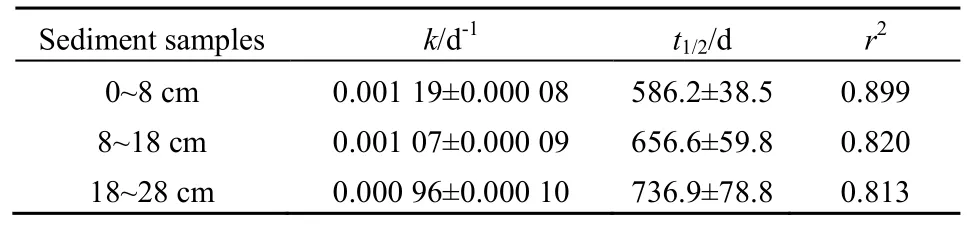
表1 沉积物中TOC的降解速率常数及半反应时间Table 1 The first-order rate constantof TOC degradation and half-livesin sediments
2.1.2 沉积物腐殖化程度的变化
实验结束后测定了沉积物中腐殖质(HA和FA)的含量(图2)。未添加植物残体的初始沉积物中HA和FA的质量分数分别为1.13和1.01 mg·g-1。添加植物残体并经过700 d的驯化后,0~8、8~18 和18~28 cm沉积物中HA的质量分数分别增至3.20、3.92和5.35 mg·g-1,FA的质量分数分别增至3.6、4.0和4.4 mg·g-1,其中18~28 cm沉积物中的HA和FA含量均极显著高于其他深度的含量(P<0.01)。试验结果表明,植物残体在沉积物中的长期分解转化过程,促进了沉积物的腐殖化,并且腐殖化程度随着沉积物深度的增加而增大。
2.1.3 沉积物中有机质组分的变化
实验结束后,测定了沉积物中有机质组分的变化,主要分为易降解有机质(LP)和难降解有机质(RP)(图3)。添加植物残体后的初始沉积物中LP 和RP质量分数分别为13.1和3.8 mg·g-1,LP的质量分数约为RP的3.4倍,这说明植物残体中大部分物质为LP,主要为多糖和纤维类物质。但是经过700 d的驯化后,大部分的LP物质被分解,0~8、8~18和18~28 cm的沉积物中的LP的质量分数分别为3.4、4.1和4.0 mg·g-1。被分解的LP一部分继续被微生物利用,转化为RP类物质,从而使得驯化后的沉积物中的RP显著增加,尤其是18~28 cm处的沉积物。表层沉积物和深层沉积物中的LP和RP含量并无显著性差异(P>0.05)。
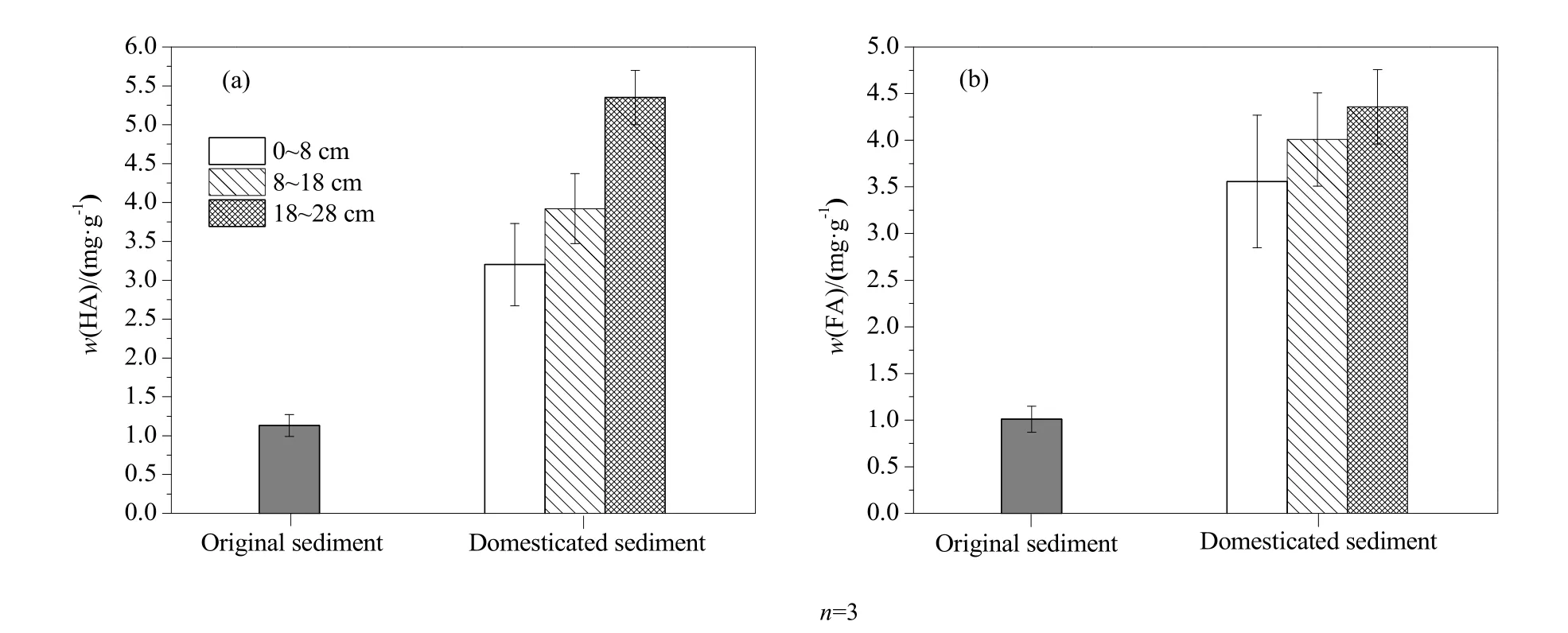
图2 初始沉积物和驯化后沉积物中HA(a)和FA(b)的含量Fig. 2 Contents of HA (a) and FA (b) in the initial and culture sediments

图3 添加马来眼子菜的初始沉积物和驯化后沉积物中LP(a)和RP(b)的含量Fig. 3 Contents of LP (a) and RP (b) in the initial sediment which added Potamogeton malaianus and in the culture sediments
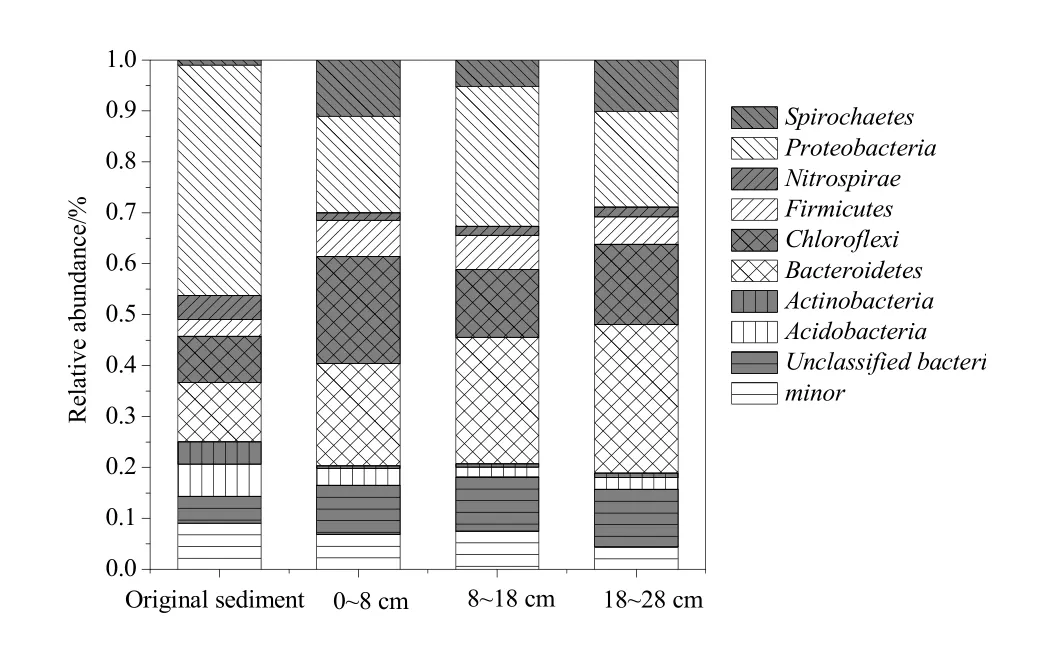
图4 初始沉积物和驯化后沉积物中细菌门的丰度Fig. 4 Abundance of microbial phylum in the initial and culture sediments
2.2 植物残体分解对沉积物中微生物群落结构的影响
将4个测序样品共10512条细菌序列进行比对(检测结果几乎没有古菌),在生物分类学水平上从门和属进行分类。部分序列在生物学上为未知类(unclassified)。通过对微生物进行分类学上的归类,可以更全面地掌握微生物群落结构的变化特征。图4是细菌群落在门水平上的分类,结果表明主要由5个门构成:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、螺旋菌门(Spirochaetes)、厚壁菌门(Firmicutes)。从相对含量分布可以看出,驯化前后沉积物样品中微生物群落间存在差异。初始沉积物中变形菌门含量最高(45.3%),其次为拟杆菌门(11.6%)、绿弯菌门(9.1%)、酸杆菌门(6.3%)。但是植物残体在沉积物中经过长时间的分解后,沉积物中变形菌门含量降低,在0~8、8~18和18~28 cm沉积物中的含量依次为19.0%、27.5%,18.8%。但是厚壁菌门、绿弯菌门和拟杆菌门在不同深度沉积物中含量均增加,其中拟杆菌门随沉积物深度增加而增加,依次为20.1%、24.8%、29.1%。这与郑九文(2013)研究马来眼子菜、芦苇等分解过程中群落结构变化有相似的结论:表层沉积物中,优势菌群是变形菌门、拟杆菌门、绿弯菌门,酸杆菌门。
从属的分类水平看(图5),初始沉积物中细菌在黄杆菌属Flavobacterium(2.5%)、GOUTA19 (3.5%)、LCP-6(2.7%)中含量最高,经过长时间的植物残体降解后,表层沉积物(0~8 cm)与深层沉积物(8~18、18~28 cm)中细菌群落结构发生显著改变。其中,0~8 cm沉积物中的优势细菌除了Flavobacterium(2.1%)、GOUTA19(4.4%)和泉发菌属Crenothrix(2.1%)含量明显增加。8~18和18~28 cm沉积物中螺旋菌门中的密螺旋体属Treponema(7.4%和8.8%)为优势菌属。

图5 沉积物样品中前100个属中已被确定的属的热图Fig. 5 The heat map at relative abundances of classified bacterial genera in the top 100 genera in sediments
3 讨论
水生植物残体的腐烂分解过程十分复杂。目前国内外的相关研究多集中于植物残体死亡后在湖泊水体中的分解。经过700 d的长期微宇宙实验,结果表明,植物残体沉降到沉积物中后的分解也分为植物体内易溶有机颗粒和无机盐类淋溶过程的快速分解期和难降解有机物的缓慢分解期。水生植物死亡进入沉积物后,一方面由于溶出、微生物的作用使得易分解有机物溶出,另一方面,外源营养物质的输入刺激沉积物微生物的生长繁殖,使得植物残体的分解迅速(杨秀虹等,2013)。与在水体中分解不同的是(Li et al.,2013;曹勋等,2015),沉积物中植物残体的分解更为缓慢,前180 d为快速分解阶段,180~700 d为缓慢分解阶段。这可能是由于水体和沉积物中的分解环境以及微生物群落的不同造成的(Longhi et al.,2008)。
沉积物中的植物残体经生物酶分解、氧化以及微生物合成等过程有一部分形成了高分子芳香族醌类聚合物,即腐殖质(楼涛等,2014)。腐殖质本身不易被微生物分解,矿化率很低,因此能够在沉积物中逐渐累积。另外,由于参与腐殖化过程的微生物大部分为厌氧微生物,从而造成了沉积物腐殖化程度随深度增加而增加。另一方面我们发现,与添加植物残体的初始沉积物相比,沉积物中LP含量降低,伴随着RP含量的增加,沉积物中的有机碳库从LP转变为RP。RP主要包括木质素和腐殖质,因此试验结束沉积物中HA和FA含量较低,但是较高的RP含量表明沉积物中保留了较多的难以被分解的木质素物质。
在湖泊沉积物中,植物残体的降解受微生物群落结构和活性影响,而微生物的多样性及微生物群落相互作用比较复杂(Ylla et al.,2013)。虽然有研究(Marano et al.,2011)表明,湖泊生态系统中真菌在植物残体降解的早期过程中所起的作用大于细菌,但是真菌降解主要通过好氧降解(Schneider et al.,2012;Su et al.,2015)。而湖泊中的大型植物死亡后,挺水和浮叶类植物残体首先沉降到湖水的好氧区,由湖水中的好氧细菌和真菌参与降解,随后植物残体沉降到沉积物-水界面的缺氧区,最终进入到沉积物的厌氧区,因此沉积物中参与植物降解的微生物主要为厌氧细菌(De Boer et al.,2005)。本试验所采的初始沉积物为表层沉积物样品,细菌的多样性高(可用Shannon多样性指数和Pielou均匀度指数等来评价)(沈烁等,2015),其中多数为为参与有机质降解的细菌属,如黄杆菌属、GOUTA19、LCP-6,通常附着于植物碎屑或其他有机体上,能将高分子有机物分解(Mann et al.,2013)。经过700 d的驯化后,表层沉积物中的细菌种类并未发生明显变化,这可能是由于表层沉积物仍处于缺氧环境,以发酵微生物为主;而深层沉积物中微生物群落发生明显改变,主要以厌氧微生物为主,其中螺旋菌门主要存在于白蚁的肠道中(Lilburn et al.,1999),驯化后深层沉积物中密螺旋体属(Treponema)含量显著增加。
4 结论
综上所述,水生植物残体——马来眼子菜在不同深度沉积物中的降解速率不同,总体呈现随深度增加降解速率加快的趋势。植物残体的降解增加了沉积物的腐殖化程度,且腐殖化程度随着深度增加而增加。植物残体在降解的过程中,容易被分解的部分有机质逐渐被矿化同时产生难分解的有机质而储存在沉积物中,并且植物残体中的木质素大部分仍被留在沉积物中。添加植物残体的沉积物经过长时间的驯化后,微生物群落结构发生不同的变化。表层沉积物中的细菌群落仍以发酵菌为主,细菌多样性丰富,但深层沉积物中的细菌以厌氧发酵菌为主,如密螺旋体属(Treponema)。
参考文献:
BRINSON M M, LUGO A E, BROWN S. 1981. Primary productivity,decomposition and consumer activity in freshwater wetlands [J]. Annual Review of Ecology and Systematics, 12: 123-161.
BUESING N, GESSNER M O. 2006. Benthic bacterial and fungal productivity and carbon turnover in a freshwater marsh [J]. Applied and environmental microbiology, 72(1): 596-605.
CORNWELL W K, CORNELISSEN J H C, AMATANGELO K,et al. 2008. Plant species traits are the predominant control on litter decomposition rates within biomes worldwide [J]. Ecology Letters, 11(10): 1065-1071.
DE BOER W, FOLMAN L B, SUMMERBELL R C, et al. 2005. Living in a fungal world: impact of fungi on soil bacterial niche development [J]. FEMS Microbiology Reviews, 29(4): 795-811.
GUDASZ C, BASTVIKEN D, PREMKE K, et al. 2012. Constrained microbial processing of allochthonous organic carbon in boreal lake sediments [J]. Limnology and Oceanography, 57(1): 163-175.
HOLMROOS H, HORPPILA J, NIEMISTO J, et al. 2015. Dynamics of dissolved nutrients among different macrophyte stands in a shallow lake [J]. Limnology, 16(1): 31-39.
HONG S W, KIM H S, CHUNG T H. 2010. Alteration of sediment organic matter in sediment microbial fuel cells [J]. Environmental Pollution,158(1): 185-191.
LI X, CUI B S, YANG Q C, et al. 2012. Detritus Quality Controls Macrophyte Decomposition under Different Nutrient Concentrations in a Eutrophic Shallow Lake, North China [J]. Plos One, 7(7): e42042.
LI X, CUI B S, YANG Q C, et al. 2013. Effects of plant species on macrophyte decomposition under three nutrient conditions in a eutrophic shallow lake, North China [J]. Ecological Modelling, 252: 121-128.
LILBURN T G, SCHMIDT T M, BREZNAK J A. 1999. Phylogenetic diversity of termite gut spirochaetes [J]. Environmental Microbiology,1(4): 331-345.
LONGHI D, BARTOLI M, VIAROLI P. 2008. Decomposition of four macrophytes in wetland sediments: Organic matter and nutrient decay and associated benthic processes [J]. Aquatic Botany, 89(3): 303-310.
MANN A J, HAHNKE R L, HUANG S X, et al. 2013. The Genome of the Alga-Associated Marine Flavobacterium Formosa agariphila KMM 3901(T) Reveals a Broad Potential for Degradation of Algal Polysaccharides [J]. Applied and Environmental Microbiology, 79(21): 6813-6822.
MARANO A V, PIRES-ZOTTARELLI C L A, BARRERA M D, et al. 2011. Diversity, role in decomposition, and succession of zoosporic fungi and straminipiles on submerged decaying leaves in a woodland stream [J]. Hydrobiologia, 659(1): 93-109.
NIXDORF B, DENEKE R. 1997. Why 'very shallow' lakes are more successful opposing reduced nutrient loads [J]. Hydrobiologia, 342: 269-284.
OLSON J S. 1963. Energy Storage and the Balance of Producers and Decomposers in Ecological Systems [J]. Ecology, 44(2): 322-331.
PETTOLINO F A, WALSH C, FINCHER G B, et al. 2012. Determining the polysaccharide composition of plant cell walls [J]. Nature Protocols,7(9): 1590-1607.
ROVIRA P, VALLEJO V R. 2002. Labile and recalcitrant pools of carbon and nitrogen in organic matter decomposing at different depths in soil: an acid hydrolysis approach [J]. Geoderma, 107(1-2): 109-141.
SCHNEIDER T, KEIBLINGER K M, SCHMID E, et al. 2012. Who is who in litter decomposition? Metaproteomics reveals major microbial players and their biogeochemical functions [J]. Isme Journal, 6(9): 1749-1762.
SONG N, YAN Z S, CAI H Y, et al. 2013. Effect of temperature on submerged macrophyte litter decomposition within sediments from a large shallow and subtropical freshwater lake [J]. Hydrobiologia,714(1): 131-144.
SU R, KUEHN K A, PHIPPS S W. 2015. Fungal contributions to carbon flow and nutrient cycling during decomposition of standing Typha domingensis leaves in a subtropical freshwater marsh [J]. Freshwater Biology, 60(10): 2100-2112.
YLLA I, PETER H, ROMANI A M, et al. 2013. Different diversity-functioning relationship in lake and stream bacterial communities [J]. FEMS Microbiol Ecol, 85(1): 95-103.
ZHOU Y L, JIANG H L, CAI H Y. 2015. To prevent the occurrence of black water agglomerate through delaying decomposition of cyanobacterial bloom biomass by sediment microbial fuel cell [J]. Journal of Hazardous Materials, 287: 7-15.
曹勋, 韩睿明, 章婷曦, 等. 2015. 冬季水生植物分解过程及其对水质的影响研究[J]. 农业环境科学学报, 34(2): 361-369.
楼涛, 汪学军, 何昆鹏, 等. 2014. 腐殖质的光化学降解及其对环境污染物环境行为的影响[J]. 生态环境学报, 23(4): 716-720.
秦伯强. 2002. 长江中下游浅水湖泊富营养化发生机制与控制途径初探[J]. 湖泊科学, 14(3), 193-202.
任文君, 田在锋, 宁国辉, 等. 2011. 4种沉水植物对白洋淀富营养化水体净化效果的研究[J]. 生态环境学报, 20(2): 345-352.
沈烁, 杨长明, 成水平. 2015. PCR-DGGE 分析合肥市塘西河表层沉积物细菌群落结构空间分布特征[J]. 应用与环境生物学报, 21(1): 80-87.
史学军, 潘剑君, 陈锦盈, 等. 2009. 不同类型凋落物对土壤有机碳矿化的影响[J]. 环境科学, 30(6): 1832-1837.
王博, 叶春, 李春华, 等. 2012. 初春苦草腐解过程中营养盐释放过程及规律[J]. 生态与农村环境学报, 28(2): 171-175.
杨秀虹, 彭琳婧, 李适宇, 等. 2013. 红树植物凋落叶分解对土壤可溶性有机质的影响[J]. 生态环境学报, 22(6): 924-930.
赵兴青, 杨柳燕, 于振洋, 等. 2007. 太湖沉积物理化性质及营养盐的时空变化[J]. 湖泊科学, 19(6): 698-704.
郑九文. 2013. 水生植物分解过程中微生物群落多样性研究[D]. 南京:南京师范大学.
The Decomposition Processes of Aquatic Plant Residue and the Change of Microbial Community Structure in A Shallow Lake Sediment
LIU Xin1, HUANG Qinghui1, 2, JIANG Helong2, SONG Na2*
1. Nanjing Forestry University, College of Biology and the Environment, Key Laboratory of Environmental engineering of Jiangsu Province, Nanjing 210037,China; 2. Nanjing Institute of Geography and Limnology, State Key Laboratory of Lake Science and Environment, Nanjing 210008, China
Abstract:In this study, a long-term (700 days) laboratory incubation test was carried out to investigate the decomposition processes of aquatic plant residue based on Potamogeton malaianus, a typical submerged plant in Lake Taihu. The driving mechanisms related to microbial community structure for the residue decomposition were also determined by using 454 pyrophosphate high-throughput sequencing method. The results showed that the organic matter removal efficiencies decreased as sediment depth increased, which were 49.6%, 40.7%, and 38.7% in the 0~8, 8~18 and 18~28 cm sediments, respectively. Humification degree and the contents of humus (including HA and FA) in the sediment increased as the depth increased; in particular, the humus contents in the 18~28 cm sediment were significantly (P<0.01) higher than those in other depths. After the incubation test, the transformation of organic matter from labile to refractory fractions were observed, and most of lignin-like compounds in the plant residue were retained in the sediment. Further analysis indicated that the dominant bacteria at the phylum level were the same in the initial and incubated sediments, which were Proteobacteria, Bacteroidetes, Chloroflexi, Spirochaetes, and Firmicutes. The dominant bacteria at the genus level also had little difference between the initial sediment and the incubated surface sediment, which were Flavobacterium,GOUTA19, LCP-6, and Crenothrix. However, substantial changes of the dominant bacteria at the genus level were found in the deeper sediment after incubation, and microorganisms in the sediment were dominant by anaerobic bacteria, such as Treponema in spirochete phylum, with the relative abundances of 7.4% and 8.8% in the 8~18 and 18~28 cm sediments, respectively. The results of this study will enrich the knowledge about the decomposition characteristics of aquatic plant residue in lake sediment and provide theoretical supports for eutrophication control.
Key words:lake; sediment; aquatic plant residues; decomposition; microorganism
DOI:10.16258/j.cnki.1674-5906.2016.03.018
中图分类号:X17
文献标志码:A
文章编号:1674-5906(2016)03-0489-07
基金项目:国家自然科学基金青年基金项目(41501528);江苏省自然科学基金项目(BK20151058);中国科学院引进人才启动项目(Y4SL011036);江苏省高校优势学科建设工程资助项目(PAPD);南京市科委项目“东屏湖水源地保护湿地研究”
作者简介:刘新(1968年生),男,副教授,主要从事水污染控制与修复、农林固废资源化利用方面的研究。E-mail: xin126mail@126.com
*通信作者,E-mail: nsong@niglas.ac.cn
收稿日期:2015-12-14
