血管生成素-2及其受体在子宫内膜异位症中的表达及临床意义
2016-06-28高静
高静
(辽宁中医药大学附属第四医院妇产科,沈阳 110101)
血管生成素-2及其受体在子宫内膜异位症中的表达及临床意义
高静
(辽宁中医药大学附属第四医院妇产科,沈阳110101)
【摘要】目的观察血管生成素-2(Ang-2)与酪氨酸激酶受体-2(Tie-2)在子宫内膜异位症(EMs)患者子宫内膜中的表达,探讨其在EMs的发生发展过程中的具体作用。方法选取本院2012年1月至2013年12月收治的70例EMs患者为研究组,选取同期70例非EMs患者为对照组,分别取材两组的内膜组织,应用免疫组织化学染色法测定Ang-2、Tie-2的表达状况。结果(1) Ang-2主要定位在细胞质中,主要表达于腺上皮细胞与血管内皮细胞,间质细胞中可见少量表达。Tie-2主要定位在腺上皮细胞胞浆中,少数定位在间质细胞与血管内皮细胞中。(2)研究组患者中Ang-2、Tie-2阳性表达率分别为75.7%和72.9%,显著高于对照组(分别为42.9%和38.6%)(P<0.05)。Ang-2在EMs患者增殖期的阳性表达率(67.5%)显著低于分泌期(86.7%)(P<0.05);Tie-2在EMs患者增殖期的阳性表达率(87.5%)显著高于分泌期(53.3%)(P<0.05)。结论Ang-2、Tie-2在EMs患者内膜组织中均有较高表达,提示其参与EMs的发生发展。
【关键词】子宫内膜异位症;血管生成素-2;酪氨酸激酶受体-2;表达
Methods: Seventy patients with endometriosis (study group) and 70 patients without endometriosis (control group) were selected in our hospital from Jan 2012 to Dec. 2013. The endometrial tissues were collected for detecting the expression of Ang-2 and Tie-2 by immunohistochemical method.
Results: Ang-2 was mainly localized in the cytoplasm and expressed mainly in epithelial cells and vascular endothelial cells,and slightly expressed in stromal cells. Tie-2 is mainly located in the cytoplasm of epithelial cells,and a few located in the interstitial cells and vascular endothelial cells. The expression rate of Ang-2 and Tie-2 in the study group (75.7% and 72.9% respectively) were significantly higher than those in control group (42.9%,38.6%,respectively) (P<0.05). In the patients with endometriosis,Ang-2 expression rate in proliferative phase (67.5%) was significantly lower than that in secretory phase (86.7%)(P<0.05),but Tie-2 expression rate in proliferative phase (87.5%) was significantly higher than that in the secretory phase (53.3%)(P<0.05).
Conclusions: Ang-2 and Tie-2 are highly expressed in endometrial tissues of the patients with endometriosis,which suggests that Ang-2 and Tie-2 may be involved in the development of endometriosis.
(JReprodMed2016,25(6):545-549)
子宫内膜异位症(EMs)是临床中常见的妇科疾病,具有较高的发病率,临床表现主要为盆腔疼痛、不孕以及月经异常等,严重影响患者的健康和生活。EMs的发病机制目前尚不明确,但有研究证实EMs的发生发展与血管生成密切相关,异位内膜病灶中的微血管密度明显高于在位子宫内膜[1]。血管生成素-2(Ang-2)参与血管生成的过程,其通过与内皮细胞特异性酪氨酸激酶受体-2(Tie-2)的结合,促进血管的发生与生长[2]。本研究重点分析Ang-2与Tie-2在EMs患者异位内膜与在位内膜中的表达,并与非EMs患者正常子宫内膜中的表达情况进行比较,进一步了解二者在EMs发生发展过程中作用,以期为该病的诊断与治疗提供一定参考。
资料与方法
一、研究对象
选取本院2012年1月至2013年12月收治的70例EMs患者为研究组,选取同期因不孕不育、卵巢囊肿、子宫肌瘤等来我院就诊的70例非EMs患者为对照组。
研究组纳入标准:符合美国生殖学会制定的EMs诊断标准[3],且经病理检查证实。排除标准:合并有基础内分泌疾病、生殖道炎症和妇科恶性肿瘤以及放置宫内节育器的患者,手术治疗前半年服用过甾体类激素药物的患者,不同意参与本研究的患者。
本次研究经医院伦理委员会批准,且患者均知情同意,签署知情同意书。
二、研究方法
研究组患者腹腔镜手术或开腹手术后经病理检查确诊,术中选取子宫异位内膜病灶组织进行取材,并刮宫取材部分在位内膜新鲜组织。对照组患者则是在子宫肌瘤切除术、不孕及卵巢囊肿等手术探查或治疗过程中取材正常子宫内膜组织。两组患者子宫内膜组织取材后,浸泡在10.0%的中性缓冲福尔马林液中进行固定,固定24 h后进行常规石蜡包埋和切片处理,制成4.0 μm的石蜡切片,行HE染色。由两名病理科医师在显微下观察组织染色情况,依据美国生殖学会分期标准[3]进行EMs内膜分期(Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期),并对子宫内膜形态进行分期[4]:(1)增殖期:月经周期第5~14天,卵泡发育成熟阶段,卵泡刺激素作用下子宫内膜及间质细胞呈增生状态;(2)分泌期:月经周期第15~28天,黄体形成后,在孕激素作用下子宫内膜呈分泌 反应,血管管腔扩张、内膜增厚,分泌糖原。
确定分期后的蜡块重新切片、贴片,行免疫组织化学染色。Ang-2和Tie-2的免疫组化染色均采用北京中杉金桥生物技术有限公司生产的试剂盒,严格按照试剂盒说明书进行操作[5],并做好详细的记录。
三、结果判断
由两位经验丰富的病理医师进行双盲阅片。免疫组化染色阳性信号为:光学显微镜下观察到黄色或者棕色染色。并依据阳性细胞所占的百分比和染色情况进行分级。
依据内膜组织显色程度进行评分:0分:无任何显色;1分:显示为浅黄色或者黄色;2分:显示为棕黄色;3分:显示为棕褐色。依据内膜组织显色面积比例评分:0分:阳性细胞染色面积在细胞总面积中所占比例<10.0%;1分:阳性细胞面积所占比例为10.1%~25.0%;2分:阳性细胞面积25.1%~50.0%;3分:阳性细胞面积50.1%~75.0%;4分:阳性细胞面积>75.0%。将两者的乘积作为最终评分[6],评价其阳性强度:阴性(-):评分为0分;弱阳性(+):评分在1~4分之间;阳性(++):评分为5~8分;强阳性(+++):评分为9~12分。
各组患者中的阳性表达率=弱阳性+阳性+强阳性患者数/各组例数。
四、统计学处理
采用SPSS 19.0统计学软件进行数据分析与处理,计数资料以%表示,组间比较采用χ2检验,P<0.05为差异具有统计学意义。
结果
一、两组患者一般资料比较
研究组患者年龄21~44岁,平均年龄(34.3±4.2)岁;内膜临床分期:Ⅰ期18例,Ⅱ期24例,Ⅲ期18例,Ⅳ期10例;增殖期40例,分泌期30例;孕次1~4次,平均(1.5±0.2)次。对照组患者年龄20~42岁,平均年龄(33.9±4.7)岁;增殖期38例,分泌期32例;孕次1~5次,平均(1.4±0.2)次。两组患者的一般资料比较无显著性差异(P>0.05),具有可比性。
二、Ang-2和Tie-2在内膜组织中的表达
Ang-2主要定位在细胞质中,主要表达于腺上皮细胞与血管内皮细胞,少数表达在间质细胞(图1、2)。Tie-2主要定位在腺上皮细胞胞浆中,少数定位在间质细胞与血管内皮细胞中(图3、4)。
研究组患者中Ang-2、Tie-2阳性表达率分别为75.7%、72.9%,显著高于对照组(分别为42.9%、38.6%)(P<0.05)(表1)。

A:异位内膜;B:在位内膜图1 Ang-2在EMs患者内膜组织中的阳性表达 (免疫组化 ×400)
图2 Ang-2在对照组内膜组织中的阳性表达 (免疫组化 ×200)

A:异位内膜;B:在位内膜图3 Tie-2在EMs患者内膜组织中的阳性表达 (免疫组化 ×400)

图4 Tie-2在对照组内膜组织中的阳性表达 (免疫组化 ×200)
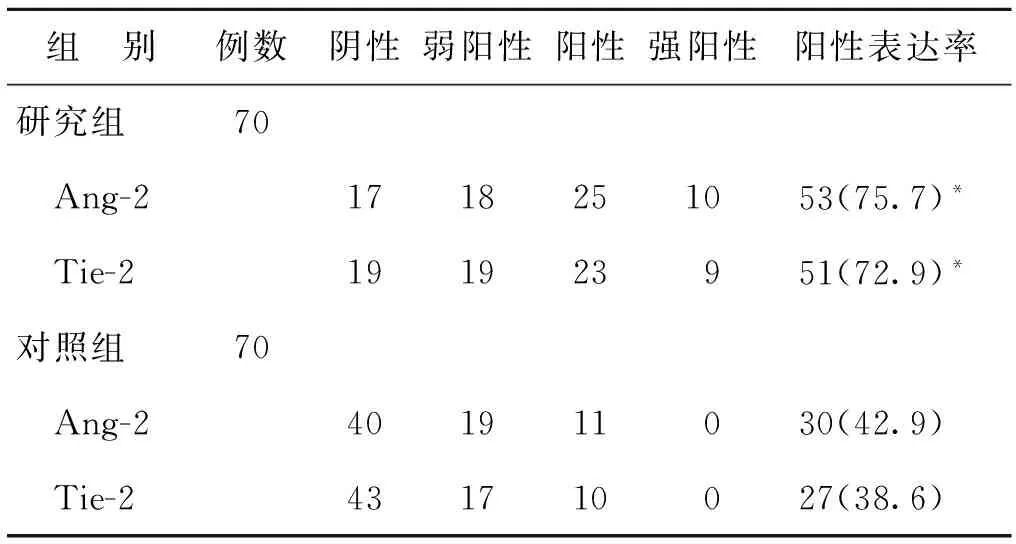
组 别例数阴性弱阳性阳性强阳性阳性表达率研究组70 Ang-21718251053(75.7)* Tie-2191923951(72.9)*对照组70 Ang-2401911030(42.9) Tie-2431710027(38.6)
注:与对照组比较,*P<0.05
三、Ang-2和Tie-2在两组患者内膜增殖期与分泌期的表达
Ang-2在研究组患者增殖期的阳性表达率(67.5%)显著低于其在分泌期的阳性表达率(86.7%)(P<0.05);Tie-2在研究组患者增殖期的阳性表达率(87.5%)则显著高于其在分泌期的阳性表达率(53.3%)(P<0.05)。Ang-2在对照组患者增殖期的阳性表达率(60.5%)显著高于分泌期(15.6%)(P<0.05);Tie-2在对照组患者增殖期的阳性表达率(57.9%)亦显著高于分泌期(18.8%)(P<0.05)(表2)。

表2 Ang-2和Tie-2在两组患者内膜增殖期
注:与同组分泌期比较,*P<0.05
讨论
EMs一般发生在育龄女性中,且发病率呈现逐年增长的趋势。其病因学说认为异位内膜本身和周围组织新血管的建立与维持,是子宫内膜异位种植成活和EMs发生的重要条件,其中,新生血管的形成是EMs发生的重要环节[7-8]。因此,在EMs发病机制的探讨中,血管生成的多种促进因子引起了高度关注。
Ang-2及其受体Tie-2均在血管生成中起到关键性的作用,Ang-2在一定的病理环境下刺激毛细血管增生,并提高其血管通透性,为异位生长的腺上皮细胞提供更好的物质生存基础,导致血管生成[9-10]。Tie-2主要是维持成熟血管的稳定性,并且在整个内皮细胞新生血管化过程中起到重要作用,有研究证实Tie-2的缺乏很容易导致血管生成受阻[11-14]。
本研究结果显示,Ang-2和Tie-2在EMs患者的子宫内膜组织中异常表达,显著高于其在非EMs妇女内膜组织中的表达量,提示Ang-2、Tie-2参与了EMs的发生发展。由于体内多种因素的影响,Ang-2、Tie-2的表达明显增加,促进了血管生成的不稳定性,使得患者更容易受到其他促血管生成因子的影响,进一步引起病灶组织中的血管生成[15-16]。本研究还对EMs患者内膜增殖期与分泌期Ang-2、Tie-2的阳性表达率进行分析,结果显示增殖期的Ang-2阳性表达率显著低于分泌期,而增殖期的Tie-2阳性表达率显著高于分泌期;对照组患者内膜组织中Ang-2、Tie-2的阳性表达率均是增殖期显著高于分泌期,提示Ang-2在EMs患者中主要表达于分泌期,Tie-2则主要表达于增殖期,而在非EMs患者女性中Ang-2、Tie-2均主要表达于增殖期。Ang-2主要表达在腺上皮细胞与血管内皮细胞,随着分泌期子宫内膜明显增厚,其表达呈现增加的趋势;Tie-2作为Ang-2的受体,主要表达在腺上皮细胞胞浆中,血管内皮细胞中有少量表达,增殖期子宫内膜组织的血管生成较分泌期更为活跃,因此Tie-2在增殖期表达相对增加。二者可能在体内多种因素的刺激下,Ang-2在分泌期内膜组织中异常高表达,Tie-2则在增殖期异常高表达,从而减少了血管的稳定性,导致血管重构,引起EMs的发生[17-18]。
综上所述,Ang-2、Tie-2在EMs患者子宫内膜中均有较高表达,提示二者参与EMs的发生发展,并可能起到重要作用。但其具体的作用机制和表达通路,尚需要后续进一步研究探讨。
【参考文献】
[1]黄丹丹. VEGF、Ang-2、Tie-2在子宫内膜异位症不同临床分期中的表达及意义[J]. 中国冶金工业医学杂志,2015,32:211-213.
[3]Ludwin A,Ludwin I. Comparison of the ESHRE-ESGE and ASRM classifications of Müllerian duct anomalies in everyday practice[J]. Hum Reprod,2015,30:569-580.
[4]乐杰 主编. 妇产科学. 第五版. 北京:人民卫生出版社,2002:29.
[5]凌艳,刘阳. 子宫内膜异位症中血管内皮生长因子、血管生成素-2与微血管密度的表达及临床意义[J]. 中国妇幼保健,2014,29:191-193.
[6]王瑞华,谢建国,陈华,等. 促血管生成素-2和血管内皮生长因子在结直肠癌组织中的表达[J]. 南方医科大学学报,2013,33:1236-1239.
[7]冯艳,卢秀琴. VEGF、Ang-2和IL-1β在子宫内膜异位症中的表达[J]. 山西医科大学学报,2014,45:961-963.
[8]何勤径. 血管生成素-2、血管内皮生长因子与微血管密度在子宫内膜异位症中的表达及临床意义[J]. 河北医药,2014,36:1025-1027.
[9]黄彩彩,康佳丽,张佳立,等. 血管生成素-2及其受体Tie-2在子宫内膜异位症中的表达[J]. 中国妇幼保健,2012,27:1540-1543.
[10]杜彦博,孙兆贵,王健. 转化生长因子-β1在子宫内膜异位症中的作用[J]. 生殖医学杂志,2010,19:538-544.
[11]宋洁,尹利荣,马洪达,等. 内皮抑素基因治疗裸鼠子宫内膜异位症对Ang-2/Tie-2的影响[J]. 天津医药,2010,38:124-126.
[12]王爽,张晓玲. Ang-2、VEGF在卵巢子宫内膜异位症中表达及相关性研究[J]. 实用妇产科杂志,2010,26:594-597.
[13]Fang Y,Li C,Shao R,et al. Prognostic significance of the angiopoietin-2/angiopoietin-1 and angiopoietin-1/Tie-2 ratios for early sepsis in an emergency department[J]. Crit Care,2015,19:367.
[14]刘淑艳. 子宫内膜异位症患者外周血和腹腔液中血管生成素-2和血管内皮细胞生长因子水平的检测及临床意义[J]. 海南医学,2010,21:86-87.
[15]Ng TK. Letter to the editor regarding “Virtual screening of natural and synthetic ligands against diabetic retinopathy by molecular interaction with angiopoietin-2”[J]. Asia Pac J Ophthalmol (Phila),2014,3:395-396.
[16]Zhang B,Khalaf H,Sirsjö A,et al. Gingipains from the periodontal pathogen porphyromonas gingivalis play a significant role in regulation of angiopoietin 1 and angiopoietin 2 in human aortic smooth muscle cells[J]. Infect Immun,2015,83:4256-4265.
[17]张晓玲,王爽,朱清仙. 血管生成素-2在卵巢子宫内膜异位症中的表达及其临床意义[J]. 中国综合临床,2009,25:1311-1313.
[18]宋娟,马洪达,尹利荣,等. Ang-2、Tie-2与ER-α在子宫内膜异位症中的表达及意义[J]. 天津医药,2009,37:734-736.
[编辑:肖晓辉]
Expression of angiopoietin-2 and its receptor in endometriosis
GAO Jing
DepartmentofObstetrics&Gynecology,theFourthAffiliatedHospitalofLiaoningUniversityofTCM,Shenyang110101
【Abstract】Objective: To investigate the expression of angiopoietin-2 (Ang-2) and tyrosine kinase receptor-2 (Tie-2) in endometriosis,and explore its specific role in development of endometriosis.
Key words:Endometriosis;Angiopoiethin-2;Tyrosine kinase receptor-2;Expression
DOI:10.3969/j.issn.1004-3845.2016.06.011
【收稿日期】2015-10-08;【修回日期】2015-11-19
【作者简介】高静,女,辽宁人,本科,副主任医师,妇科内分泌专业.
