福辛普利联合非诺贝特对糖尿病小鼠视网膜病变干预作用的研究
2016-06-28旷劲松赵玉蓉赵玉岩李若溪辛彩虹
旷劲松,赵玉蓉,赵玉岩,李若溪,辛彩虹
福辛普利联合非诺贝特对糖尿病小鼠视网膜病变干预作用的研究
旷劲松1,赵玉蓉1,赵玉岩2,李若溪1,辛彩虹1
摘要:目的探讨福辛普利联合非诺贝特对糖尿病(DM)小鼠视网膜病变(DR)的治疗作用及机制。方法ICR小鼠随机分为5组,每组30只:A组(假造模)、B组(DM模型)、C组[福辛普利干预,20 mg/(kg·d)]、D组[非诺贝特干预,400 mg/(kg·d)]、E组[福辛普利20 mg/(kg·d)+非诺贝特400 mg/(kg·d)干预]。RT-PCR法测定Bax与Bcl-2基因mRNA的表达水平。TUNEL染色法检测视网膜组织细胞凋亡情况。测定并比较各组谷胱甘肽过氧化物酶(GSHPX)、超氧化物歧化酶(SOD)活性、丙二醛(MDA)、活性氧类物质(ROS)及血管内皮生长因子(VEGF)水平。结果A 组Bcl-2 mRNA、B组Bax mRNA水平高于其他4组;E组Bcl-2 mRNA水平高于C、D组,而Bax mRNA水平低于C、D组(均P<0.05)。B组TUNEL指数最高,E组<D组<C组<B组(均P<0.05),但E组与A组差异无统计学意义。B组GSH-PX、SOD活性均低于其他4组,而ROS、MDA、VEGF均高于其他4组;E组GSH-PX、SOD水平均高于C、D组,而ROS、MDA、VEGF均低于C、D组(均P<0.05)。结论福辛普利和非诺贝特均能通过抑制凋亡与抗氧化对DM小鼠视网膜起到一定的保护作用,两药联合应用效果更佳。
关键词:糖尿病视网膜病变;糖尿病并发症;氧化性应激;细胞凋亡;疾病模型,动物;福辛普利;非诺贝特;血管内皮生长因子
作者单位:1沈阳市第四人民医院内分泌科(邮编110032);2沈阳,中国医科大学附属第一医院内分泌科
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者最普遍的微血管并发症,也是目前眼科4大致盲性眼病之一[1]。临床DR一旦发生,即呈进行性进展趋势,如在DR早期能有效干预,患者预后可明显改善。福辛普利是一种临床中常用的血管紧张素转化酶抑制剂(ACEI)。研究证实,肾素血管紧张素醛固酮系统(RAAS)阻断剂能很好地抑制糖尿病肾病(diabetic nephrosis,DN)的进展[2];同时RAAS阻断剂也可抑制糖尿病神经病变(diabetic neuropa⁃thy,DPN)和DR的进展[3]。此外,非诺贝特作为一种降脂药,还能降低机体的氧化应激反应[4]。DR发生、发展的病理机制之一是视网膜组织细胞的凋亡增多。目前,有研究显示,早期DR进展过程中氧化应激能导致细胞发生凋亡[5]。上述2种药物均已被证实对DR有明确的治疗作用,而两者联合是否能增强对DR的作用尚少见相关报道。本研究旨在探讨福辛普利联合非诺贝特对糖尿病(DM)小鼠早期DR进展的抑制作用及其可能的作用机制。
1 材料与方法
1.1一般材料(1)实验动物。150只SPF级ICR小鼠购自北京维通利华实验动物技术有限公司。合格证号SCXK-(京)2007-0001,周龄6~8周,体质量26~30 g(雌鼠),28~32 g(雄鼠)。(2)主要仪器和试剂。PCR仪(德国Biometra公司);RM2135型石蜡切片机、生物组织包埋机(德国Leica公司)。福新普利钠片(蒙诺,中美上海施贵宝制药有限公司,规格10 mg/片);非诺贝特(力平之,法国利博福尼制药公司,规格200 mg/片);RT-PCR试剂盒(日本TaKaRa公司);ASD-310S型低温离心机、链脲佐菌素(STZ)、视网膜组织匀浆血管内皮生长因子(VEGF)浓度酶联免疫吸附试验(ELISA)检测试剂盒(Sigma公司);谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)、丙二醛(MDA)及活性氧类物质(ROS)检测试剂盒(南京建成生物科技公司);Trizol试剂盒(美国Introgen公司);TUNEL免疫组织化学检测试剂盒(中杉金桥公司)。One ToucuⅡ型血糖仪(LifeScan公司)。
1.2方法
1.2.1动物分组及模型制作将150只小鼠随机分为5组,每组30只,雌、雄鼠分开饲养,人工控温20~26℃,12 h光照,12 h黑暗,颗粒饲料喂养,自由饮水取食。假造模(A)组给予普通饲料喂养,其余4组(B、C、D及E组)均给予高脂饲料(脂肪含量36%)连续喂养4周。禁食、水12 h后,A组腹腔注射0.1 mmol/L、pH 4.4的枸橼酸钠,其余4组腹腔注射STZ100 mg/kg(用新配制的0.1 mmol/L、pH 4.4的枸橼酸钠缓冲液配制),2周后尾缘静脉抽血测非空腹血糖(BG)>11.1 mmol/L为成功制作糖尿病小鼠模型[6]。B、C、D及E组分别成功造模24、25、27及27只。模型制作成功后各组依以下方法干预处理8周:A组普通饲料喂养并且灌胃理盐水;模型(B)组继续高脂饲料喂养并给予生理盐水灌胃;福辛普利干预(C)组高脂饲料喂养并按20 mg/(kg·d)剂量给予福辛普利溶液灌胃;非诺贝特干预(D)组高脂饲料喂养并按400 mg/ (kg·d)剂量给予非诺贝特溶液灌胃;福辛普利+非诺贝特联合干预(E)组高脂饲料喂养并给予福辛普利20 mg/(kg·d)+非诺贝特400 mg/(kg·d)溶液灌胃,非诺贝特与福辛普利用0.9%氯化钠制成混悬液,现用现配。各组干预8周后禁食12 h,静脉抽血测BG,用10%水合氯醛腹腔注射麻醉后,用4℃预冷的4%多聚甲醛-磷酸盐缓冲液(PBS,pH 7.5)200 mL进行心脏灌流,摘除左侧眼球,取部分小鼠(14只)制备视网膜组织匀浆待用。其余立即置入4%多聚甲醛固定液,放入4℃冰箱过夜。次日以60%、70%、80%、90%、95%、100%梯度乙醇脱水,常规石蜡包埋,连续4 μm切片后续待用。摘除大鼠右眼眼球,在冰台上显微镜下快速分离视网膜组织,提取DNA,行RT-PCR检测。
1.2.2 RT-PCR法测定Bax与Bcl-2基因mRNA的表达水平称取10 mg视网膜组织并按Trizol试剂盒说明书提取总RNA。鉴定RNA纯度与完整性后按试剂盒说明以(oligo) dT为引物逆转录合成cDNA第一链,以2 μL的cDNA为模板,按试剂盒说明进行PCR扩增,GAPDH为内参照。各引物均由日本TaKaRa公司合成,聚丙烯酰胺凝胶电泳(PCGE)级纯化,序列见表1。反应条件:94℃变性1 min,依表1相应退火温度分别退火50 s,72℃延伸1 min 30 s,33个循环。扩增产物以20 μL琼脂糖凝胶电泳40 min,紫外灯(260 nm)下进行检测。用quantity one软件分析各目的基因的条带密度,以GAPDH为内参照计算各个样本的基因条带密度的相对值。

Tab. 1 Sequence of oligoneucleotide primers表1 Bax、Bcl-2及GAPDH基因序列及产物长度
1.2.3 TUNEL染色法检测视网膜组织细胞凋亡情况取每组小鼠10只左侧眼球视网膜石蜡包埋切片,按免疫组织化学试剂盒说明书进行操作,封片后在显微镜下(×400)进行观察。对照文献[7],细胞核染成棕黄色者为阳性细胞,即凋亡细胞,显微镜下观察并拍照,随机取7个高倍视野(×400),记数200个细胞中的阳性细胞数,细胞凋亡情况采用末端标记技术TUNEL法检测,以TUNEL指数表示。
1.2.4 GSH-PX、SOD、ROS酶活性与MDA、VEGF浓度测定取视网膜组织匀浆上清,用ELISA法测定VEGF浓度。视网膜组织匀浆以5 000~10 000 r/min离心5 min,取上清,温度4℃,按试剂盒说明书测定GSH-PX、SOD与ROS活性,并检测MDA含量。所取标本均在1周内测定。
1.3统计学方法采用SPSS 13.0软件进行统计学分析。符合正态分布的计量资料以x ±s表示。多组间均数比较采用单因素方差分析,组间多重比较用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1视网膜细胞Bax、Bcl-2基因mRNA水平检测结果A~E组中,A组Bax mRNA水平最低,B~E组依次降低,但E组仍高于A组;A组Bcl-2 mRNA水平最高,B~E依次增高,但E组仍低于A组;Bax/ Bcl-2趋势与Bax相同(均P<0.05),见图1、表2。
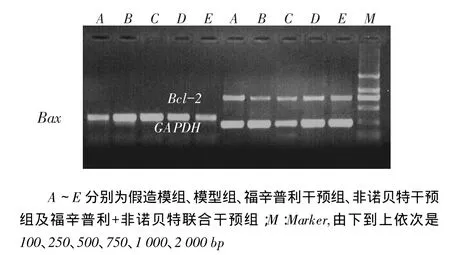
Fig. 1 The relative expressions of Bax and Bcl-2 in the level of mRNA图1 Bax、Bcl-2 mRNA相对表达水平
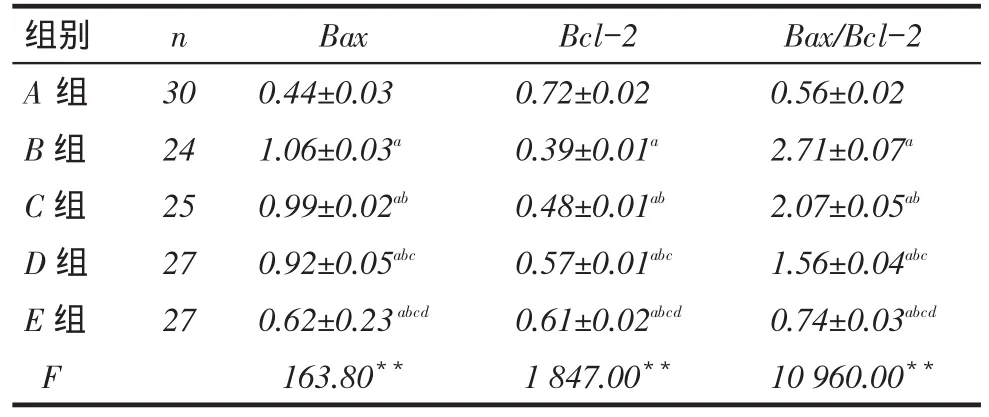
Tab. 2 The expressions of Bax and Bcl-2 in the level of mRNA表2 Bax、Bcl-2 mRNA相对表达水平(x ±s)
2.2视网膜组织细胞凋亡检测结果A~E组大鼠TUNEL指数(%)分别为0.98±0.14、4.32±0.67、3.54± 0.43、3.13±0.62及1.23±0.36(F=256.20,P<0.01)。其中,B组最高,E组<D组<C组<B组(均P<0.05),但E组与A组差异无统计学意义,见图2。
2.3各组GSH-PX、SOD、MDA、ROS及VEGF结果比较A~E组中,A组GSH-PX、SOD表达水平最高,B~E依次增高,但E组仍低于A组;A组MDA、ROS表达水平最低,B~E依次降低,但E组仍高于A组;A组VEGF最低,但C组和D组间差异无统计学意义,见表3。
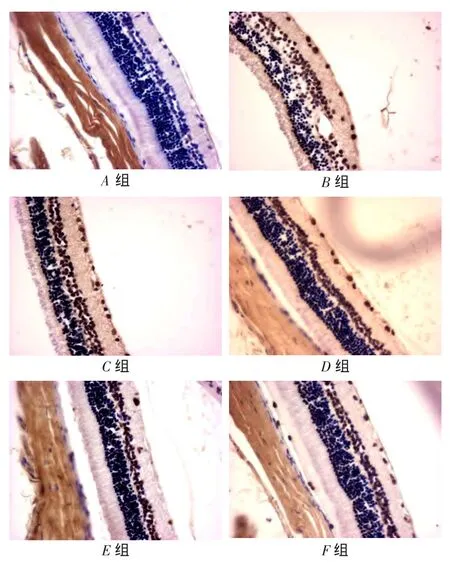
Fig. 2 TUNEL stainingin retinal tissue in each group (TUNEL staining,×400)图2各组视网膜组织TUNEL染色表达情况(TUNEL染色,×400)
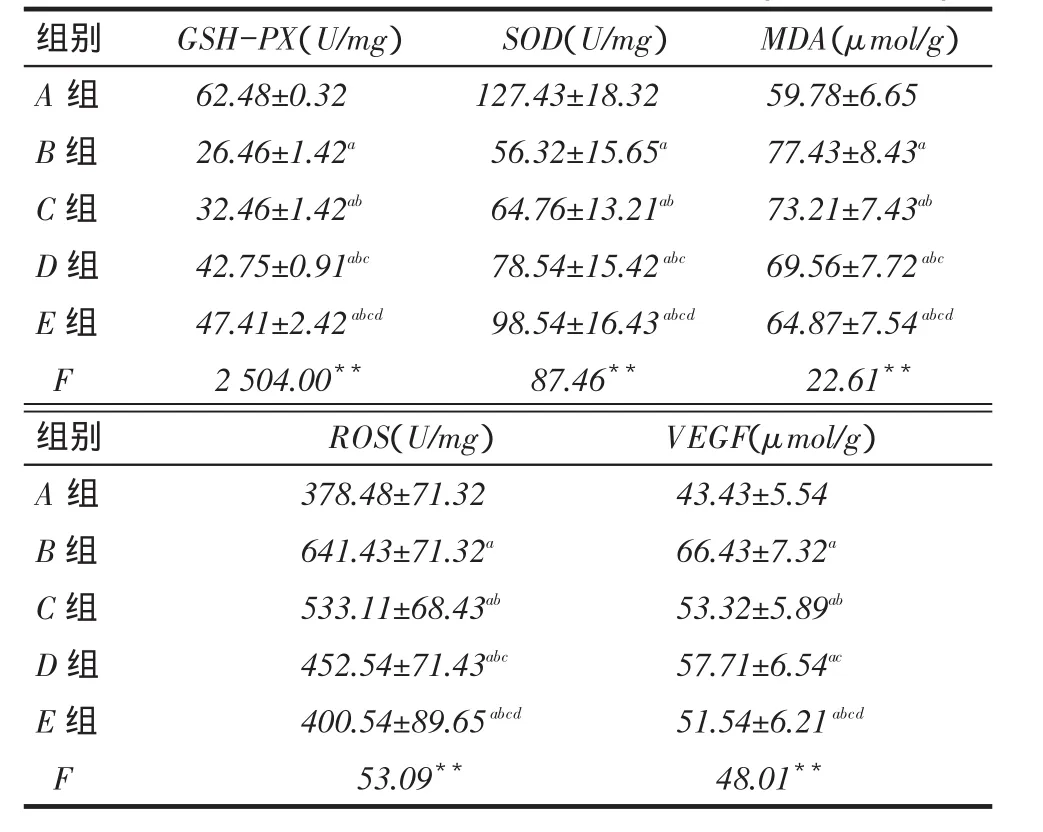
Tab. 3 The activity levels of GSH-PX, SOD, MDA, ROS and VEGFin diabetic retinopathy of diabetic mice表3视网膜组织GSH-PX、SOD、MDA、ROS、VEGFs水平(n=14,x ±s)
3 讨论
DR的临床诊断依据是眼底出现微血管瘤或有出血、渗出等血管形态学改变,但是在未出现上述血管形态学异常之前,糖尿病患者已发生不同程度的视功能异常。研究表明,此时眼底的病理改变主要在视网膜神经细胞、视网膜毛细血管周细胞及内皮细胞,可有明显的细胞超微结构改变和凋亡,且糖尿病所致的视网膜神经细胞凋亡远早于微血管病变[8]。Huang等[9]研究表明,高糖状态下牛视网膜细胞发生凋亡,TUNEL指数升高。另有研究显示,6个月时DM鼠模型眼底改变可等同于人DR的增殖期改变,2~3个月时为早期改变[10]。此外,有研究显示,3个月的DM大鼠的视网膜神经节细胞凋亡数目较正常大鼠明显增加,电镜示大鼠视网膜感光细胞外节排列紊乱,műller细胞突起消失,神经节细胞有核染色质固缩等细胞凋亡特征,但微血管内皮细胞、周细胞未见超微结构改变,此可作为大鼠早期视网膜病变模型[11]。
细胞在发生凋亡时,会激活一些DNA内切酶,这些内切酶会切断核小体间的基因组DNA,利用这一原理常常采用TUNEL染色法检测凋亡细胞。本研究采用高脂饲料连续喂养4周后,腹腔注射STZ 100 mg/kg,2周后尾缘静脉抽血测非空腹BG>11.1 mmol/L,表明成功制作了糖尿病小鼠模型,各组成功率均在80%以上。笔者认为此种方法简便,成功率较高,值得借鉴。模型制作成功后8周时TUNEL检测发现,B、C、D组DM小鼠视网膜组织细胞凋亡数量均较A组正常小鼠明显增多,表明早期DR模型建立成功。既往有研究证实,非诺贝特、福辛普利均能抑制心肌肥厚细胞发生凋亡[12]。本研究结果示,E 组Bcl-2 mRNA水平高于C、D组,而Bax mRNA水平低于C、D组,同时TUNEL指数E组<D组<C组<B组,E组与A组无差别,表明非诺贝特、福辛普利均能不同程度抑制DM小鼠视网膜组织细胞的凋亡,且两药联合疗效更好。
目前,关于DR视网膜细胞凋亡机制的研究主要集中在氧化应激损伤方面。研究证实,视网膜组织氧化应激可导致神经细胞发生凋亡[13]。GSH-PX是机体内重要的抗氧化酶,能清除自由基,提高SOD的抗氧化活力,从而阻断超氧离子诱导的自由基连锁反应,这两种酶的活性反映了组织氧化与抗氧化之间的平衡[14]。DR患者的视网膜组织存在过氧化反应,可导致ROS与MDA浓度升高[15]。目前,临床通常认为氧化应激可导致凋亡相关基因Bax和Bcl-2的不同表达。Bax基因本身发挥促进凋亡的效应需要与其家族中Bcl-2基因相互协调并形成一个调控体系,当Bax同源二聚体形成时,可诱导细胞凋亡,而Bcl-2蛋白表达量升高时,Bax二聚体可逐渐分开,与Bcl-2蛋白形成更稳定的Bax-Bcl-2异源二聚体,从而抑制细胞凋亡[16]。本研究结果显示,A组Bcl-2 mRNA、B组Bax mRNA水平高于其他4组;E组Bcl-2 mRNA水平高于C、D组,表明DM小鼠的Bax基因表达明显高于正常小鼠,而药物干预后可抑制Bax表达,增强Bcl-2的表达,发挥抑制凋亡作用,且联合使用效果更好。
VEGF是导致DR发生发展最重要的分子标志。近期已有研究证实,在DR动物模型的早期即可检测到血清和视网膜组织中VEGF表达呈明显的增高[1]。Nebbioso等[17]研究示3个月糖尿病大鼠视网膜műller细胞有VEGF表达。福辛普利为一种ACEI,抑制VEGF的作用与其有效抑制了视网膜组织局部RAAS激活和血管紧张素Ⅱ(ATⅡ)的生成有关,而RASS系统的激活和ATⅡ的生成可诱导VEGF产生。目前研究已证实,视网膜组织存在局部RAAS系统,DM时高血糖、氧化应激等因素可诱导视网膜局部RASS激活[18]。本研究结果显示,B 组GSH-PX、SOD活性均低于其他4组,而ROS、MDA、VEGF水平均高于其他4组,表明DM可造成视网膜组织氧化应激增强和抗氧化平衡的破坏。D 组GSH-PX、SOD活性高于C组,而ROS、MDA均低于C组,C组VEGF低于D组,表明非诺贝特通过其抗氧化作用一方面减少了调亡,另一方面也可抑制视网膜局部RASS,进而降低VEGF的产生,但抑制VEGF作用似乎不如ACEI。E组GSH-PX、SOD活性均高于C、D组,而ROS、MDA、VEGF均低于C、D组,表明两种药抑制视网膜细胞凋亡作用机制都是与拮抗氧化应激相关的。因此,单药比较,福辛普利抑制VEGF效果较非诺贝特好,但两药联合效果更明显。
参考文献
[1] Moradi A, Sepah YJ, Sadiq MA, et al. Vascular endothelial growth factor trap-eye (Aflibercept) for the management of diabetic macu⁃lar edema[J]. World J Diabetes, 2013, 4(6):303-309. doi: 10.4239/ wjd.v4.i6.303. Review.
[2] Mavrakanas TA, Gariani K, Martin PY. Mineralocorticoid receptor blockade in addition to angiotensin converting enzyme inhibitor or angiotensinⅡreceptor blocker treatment: an emerging paradigm in diabetic nephropathy:a systematic review[J]. Eur J Intern Med, 2014, 25(2):173-176. doi: 10.1016/j.ejim.2013.11.007.
[3] Chew EY, Ambrosius WT, Davis MD, et al. Effects of medical thera⁃pies on retinopathy progression in type 2 diabetes[J]. N Engl J Med, 2010, 363(3): 233-244.doi: 10.1056/NEJMoa1001288.
[4] Zhou WF, Shen XR, Wang LY, et al. Influences of fenofibrate on ox⁃idative stress and endoplasmic reticulum stress in livers of hyperlip⁃idemic rats[J]. The Journal of Practical Medicine, 2014, 30(17): 2718-2721. [周卫凤,沈馨如,汪凌云,等.非诺贝特对高脂血症大鼠肝脏氧化应激和内质网应激的影响[J].实用医学杂志,2014, 30(17): 2718-2721].
[5] Role AP, Palmeira CM. Diabetes and mitochondrial function: role of hyperglycemia and oxidative stress[J]. Toxicol Appl Pharmacol, 2006, 212(2): 167-178.
[6] Chen ZY, Wen Y, Zhang SH, et al. Renal protection effect of gastric bypass and its mechanism in type 2 diabetes mellitus rats [J]. Med J Chin PLA, 2014, 39(6):454-458. [陈振宇,文艺,张少华,等.胃转流术对2型糖尿病大鼠肾脏的保护作用及其机制探讨[J].解放军医学杂志, 2014, 39(6):454-458]. doi: 10.11855/j.issn.0577-7402.2014.06.06.
[7] Chen YM, Zhang YF, Li L, et al. Neuroprotective effect of geniposide on Parkinson′s disease model mice[J]. Chin J Contemp Neurol Neu⁃rosurg, 2015, 15 (6): 481-487. [陈毅美,张彦芳,李琳.京尼平苷对帕金森病小鼠模型神经保护作用[J].中国现代神经疾病杂志, 2015, 15 (6): 481-487]. doi: 10.3969/j.issn.1672-6731.2015.06.012.
[8] Barber AJ, Gardner TW, Abcouwer SF, et al. The significance of vascular and neural apoptosis to the pathology of diabetic retino⁃pathe[J]. Invest Ophthalmol Vis Sci, 2011, 52(2): 1156-1163.doi: 10.1167/iovs.10-6293.
[9] Huang C, Zhang P, Wang W, et al. Longterm blue light exposure in⁃duces RGC-5 cell death in vitro:in volvement of mitochondria de⁃pendent apoptosis,oxidative stress,and MAPK signaling pathways[J]. Apoptosis, 2014, 19(6):922-932. doi:10.1007/s10495-014-0983-2. [10] Ding WZ, Yao HP, Liu Y, et al. Establishing diabetic rat model and early changes of the visual function [J]. Journal of Clinical Ophtal⁃mology,2014,22(1):80-82. [丁慰祖,姚慧萍,刘嫣,等.大鼠糖尿病模型的建立及其视网膜功能早期改变的研究[J].临床眼科杂志, 2014,22(1):80-82].
[11] Hattori T, Matsubara A, Taniguchi K, et al. Aldose reductase inhibi⁃tor fidarestat attenuates leukocyte-endothelial interactions in exper⁃ imental diabetic rat retina in vivo[J]. Curr Eye Res,2010,35(2) : 146-154.doi: 10.3109/02713680903447918.
[12] Liu GQ, Jia ZK, Xue R, et al. Role of high mobility group protein B-1 in the protective effect of fenofibrate against cardiac hypertrophy [J]. Chin J Exp Surg, 2014, 34(12): 2782-2785. [刘刚琼,贾占奎,薛瑞,等.高迁移率蛋白B-1在非诺贝特特治心肌肥厚过程中的作用[J].中华实验外科杂志, 2014, 34(12): 2782-2785].
[13] Xin X, Xue MM. The effects of fosinopril on bcl-2 and bax genes of myocardial hypertrophy rat with pressure verload[J]. Journal Of Inner Mongolia Medical University,2014, 36(5): 408-411.[辛雪,薛明明.福辛普利对压力超负荷性心肌肥厚大鼠左心室心肌细胞bcl-2及bax基因表达的影响[J].内蒙古医科大学学报, 2014, 36(5): 408-411].
[14] Raunig JM, Yamauchi Y, Ward MA, et al. Placental inflammation and oxidative stress in the mouse model of assisted reproduction[J]. Placenta, 2011, 32(11): 852-858.
[15] Wang Q, Pfister F, Dorn-Beineke A, et al. Low-dose erythropoietin inhibits oxidative stress and early vascular changes in the experi⁃mental diabetic retina[J]. Diabetologia, 2010, 53(6): 1227- 1238. doi: 10.1007/s00125-010-1727-7.
[16] Karnabi E, Boutjdir M. Role of calcium ch ann els in congenit al⁃heart block[J]. Scand JIm munol, 2010, 72(3):226-234.
[17] Nebbioso M, Pranno F, Pescosolido N. Lipoic acid in animal models and clinical use in diabetic retinopathy[J]. Expert Opin Pharmacoth⁃er, 2013, 14(13): 1829-1838.
[18] Wang N, Zheng Z, Jin HY, et al. Treatment effects of captopril on nonproliferative diabetic retinopathy[J]. Chin Med J(Engl), 2012, 125(2): 287-292.
(2015-10-08收稿2015-11-22修回)
(本文编辑陆荣展)
读者·作者·编者
《天津医药》协作办刊单位(排名不分先后)
天津市胸科医院
天津市第三中心医院
天津医科大学总医院
天津市中医药研究院附属医院
天津港口医院
天津医科大学代谢病医院
天津市天津医院
天津市宁河县医院
天津市滨海新区大港医院
武警后勤学院附属医院
天津市儿童医院
天津市第一中心医院
天津医科大学第二医院
天津市第二人民医院
天津市安定医院
天津市人民医院
天津市公安医院
天津华立达生物工程有限公司
天津中新药业集团股份有限公司
天津金耀集团有限公司
天津市第五中心医院
海洋石油总医院
天津海滨人民医院
天津医学高等专科学校
天津市口腔医院
天津市第四中心医院
天津医科大学口腔医院
权健集团有限公司
The studying of fosinopril combined with fenofibrate on the preventing of diabetic retinopathy in diabetic mice
KUANG Jinsong1, ZHAO Yurong1, ZHAO Yuyan2, Li Ruoxi1, Xin Caihong1
1 Department of Endocrinology, The Fourth People′s Hospital of Shenyang, Shenyang 110032, China; 2 Department of Endocrinology,The First Hospital of China Medical University Corresponding Author E-mail:www.sysylrx@126.com
Abstract:Objective To study the effect and mechanism of the Fosinopril combined with Fenofibrate on the prevent⁃ing of diabetic retinopathy. Methods A total of 150 viripotent ICR mice(100 male mice, 50 female mice) were randomly di⁃vided into five groups(n=30), including A group (Sham group), B group (Model group), C group [Fosinopril prevented group, 20 mg/(kg·d)], D group [Fenofibrate prevented group, 400 mg/(kg·d)] and E group (Fosinopril combined with Fenofibrate pre⁃vented group). The expression levels of Bax and Bcl-2 gene mRNA were determined by RT-PCR method. TUNEL staining method was used to detect the apoptosisi of retinal cells. Results The Bcl-2 mRNA of A group, Bax mRNA of B group were higher than those of other four groups. Bcl-2 mRNA of E group was higher than that of C group and D group, while the Bax mRNA was lower than those of two groups(all P<0.05). The TUNEL index of B group was the highest than other groups, which of E group<D group<C group<B group(all P<0.05), and which of A and E groups were similar. The activi⁃ties of GSH-PX and SOD of B group were lower than those of other four groups, while the levels of ROS, MDA, VEGF were higher than those of them, the activity of GSH-PX and SOD of E group were higher than those of C and D groups, while the levels of ROS, MDA, VEGF were lower than them(all P<0.05). Conclusion Fosinopril and Fenofibrate can improve dia⁃betic retinopathy through inhibitingthe apoptosis and antioxidation. The combination of them can get even better effect.
Key words:diabetic retinopathy;diabetes complications;oxidative stress;apoptosis;disease models, animal;Fosino⁃pril;Fenofibrate;vascular endothelial growth factor
中图分类号:R587.26,R453
文献标志码:A
DOI:10.11958/59086
基金项目:国家自然科学基金资助项目(81470998);辽宁省科学计划项目基金(2011225014);沈阳市科技计划项目基金(F11-262-9-25)
作者简介:旷劲松(1965),女,博士研究生,主任医师,教授,硕士生导师,主要从事糖尿病并发症相关研究
通讯作者E-mail:www.sysylrx@126.com
