中等强度静磁场对THP-1细胞分泌炎症因子的影响
2016-06-28郭志霞毛立斌王会琴张蕊张同存
郭志霞,毛立斌,王会琴,张蕊,张同存
中等强度静磁场对THP-1细胞分泌炎症因子的影响
郭志霞1,毛立斌1,王会琴2,张蕊2,张同存1
摘要:目的观察中等强度静磁场对人单核细胞白血病细胞THP-1增殖和炎症因子肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-8分泌的影响。方法取对数生长期THP-1细胞,分为对照组和磁场处理组,利用60 mT、200 mT、400 mT的静磁场分别作用细胞18 h、24 h,、48 h后,CCK-8法检测细胞增殖情况。另取细胞分为对照组、磁场处理组、脂多糖(LPS)活化组、LPS+磁场组。利用60 mT、200 mT、400 mT的静磁场分别作用磁场处理组和LPS+磁场组18 h、24 h、48 h后,酶联免疫吸附试验(ELISA)检测各组TNF-α、IL-6、IL-8的水平。结果(1)与对照组相比,3种强度磁场处理组对THP-1细胞增殖无明显影响(P>0.05)。(2)各组24 h时TNF-α、IL-6水平较18 h升高,IL-8则无明显变化。而48 h与24 h相比较,TNF-α出现下降,IL-6无明显变化,IL-8出现升高。3个时点LPS活化组TNF-α、IL-6、IL-8水平较对照组及磁场处理组升高,经过磁场处理后,LPS+磁场组IL-6、IL-8、TNF-α水平均较LPS活化组下降(P<0.05)。结论静磁场对THP-1细胞释放炎症因子有一定抑制作用,可为类风湿关节炎的治疗提供理论依据。
关键词:类风湿关节炎;静磁场;THP-1细胞;炎症因子;脂多糖;酶联免疫吸附试验;肿瘤坏死因子-α;白细胞介素-6;白细胞介素-8
作者单位:1天津科技大学生物工程学院分子药理学和分子生物学研究室(邮编300457),2工业发酵微生物教育部重点实验室
类风湿关节炎(rheumatoid arthritis, RA)是以关节滑膜慢性炎症为特点的自身免疫性疾病,巨噬细胞在RA的发病过程中起重要作用[1-2]。目前临床上主要使用抗炎药物控制炎症发展,但长期用药存在不良反应[3]。近年来,磁疗法因具有费用低、简便易行、安全无创等优点,被初步用于RA临床治疗。但是由于磁场规格不尽相同,其作用机制尚不明确,限制了磁场的应用[4]。THP-1细胞株来源于急性单核细胞白血病患者,具有典型单核细胞特征,在佛波酯(PMA)的作用下成熟为巨噬细胞。多项研究证实THP-1细胞可作为RA的发病机制研究的体外模型[5-7]。本文旨在探究不同强度的静磁场对THP-1细胞的作用,为磁疗法在临床上治疗关节炎提供理论基础。
1 材料与方法
1.1试剂与磁场设备
1.1.1试剂PMA购自Sigma,脂多糖(LPS)购自碧云天,人肿瘤坏死因子(TNF)-α、人白细胞介素(IL)-6、IL-8、酶联免疫吸附试验(ELISA)试剂盒均购自贝茵莱公司,CCK-8细胞增殖检测试剂盒购自奕源生物,RPMI-1640培养基购自GIBCO,胎牛血清购自四季青。
1.1.2磁场设备60 mT、200 mT、400 mT静磁场由德中利德(天津)生物技术有限公司提供,静磁体规格:Φ35 mm×20 mm×10 mm,见图1。

Fig. 1 Schematic diagram of static magnetic field图1静磁体规格示意图
1.2方法
1.2.1细胞培养THP-1(购自上海中国科学院细胞库)在37℃,5%CO2条件下培养于含10%胎牛血清,100 U/mL青
霉素和100 mg/L链霉素的RPMI-1640培养基。取对数生长期的细胞进行实验,实验前用台盼蓝拒染法检测细胞活力>95%。
1.2.2静磁场处理以及细胞增殖情况检测细胞以1×105个/mL每孔100 μL接种于96孔板中,分为对照组和磁场处理组,每组设4个复孔。磁场处理组分别置于60 mT、200 mT、400 mT静磁场上曝磁18 h、24 h、48 h,对照组在未充磁静磁场上放置18 h、24 h、48 h。静磁场处理后每孔加入10 μL CCK-8溶液,37℃避光孵育2 h,酶标仪于490 nm处测定光密度(OD)值,实验重复3次。
1.2.3 THP-1细胞活化及炎症因子测定THP-1细胞分为对照组、磁场处理组、LPS活化组[细胞经PMA(150 μg/L)诱导24 h,分化为成熟巨噬细胞。饥饿处理12 h后,加入LPS (1 mg/L)活化24 h;更换含血清培养基正常培养,即为活化后的THP-1细胞]、LPS+磁场组,每组设3个复孔。磁场处理组和LPS+磁场组分别置于60 mT、200 mT、400 mT静磁场上作用18 h、24 h、48 h,对照组及LPS活化组在未充磁静磁场上放置相应时间。曝磁结束后收集各组上清,按照ELISA试剂盒说明书操作测定各组IL-6、IL-8、TNF-α水平,在450 nm波长处测定OD值。根据标准曲线计算出待测炎症因子的浓度。
1.3统计学方法应用SPSS 13.0软件进行统计分析,计量资料以均数±标准差(x ±s)表示,2组间均数的比较采用t检验,多组比较采用单因素方差分析,组间多重比较采用Tukey法,P<0.05为差异有统计学意义。
2 结果
2.1静磁场对THP-1细胞生长情况的影响与对照组相比,60 mT、200 mT、400 mT静磁场对细胞生长情况无明显影响(P>0.05),且随着磁暴时间的延长,细胞生长情况差异无统计学意义(P>0.05),见表1。
2.2静磁场对THP-1细胞分泌炎症因子的影响
2.2.1 TNF-α组内不同时间比较:3种磁场强度下,24 h时各组内TNF-α水平较18 h升高,而到48 h时则出现下降(P<0.05)。组间比较:LPS活化组THP-1细胞TNF-α表达水平较对照组和磁场处理组升高(P<0.05),经过磁场干预后,LPS+磁场组较LPS活化组TNF-α水平均有所降低(P<0.05),见表2。

Tab. 1 Effects of static magnetic field on THP-1 cell growth表1静磁场对THP-1细胞增殖情况的影响 (n=4,OD,x ±s)

Tab. 2 Effects of different inte nsity static magnetic field on secretion of TNF-α表2不同强度静磁场对细胞释放TNF-α的影响(n=3,ng/L,x ±s)
2.2.2 IL-6组内不同时间比较:3种磁场强度下,24 h时IL-6的释放量高于18 h(P<0.05),48 h与24 h IL-6的释放水平差异无统计学意义。组间比较:3种磁场强度处理后,LPS活化组IL-6水平较对照组和磁场处理组升高(P<0.05),而LPS+磁场组较LPS活化组IL-6水平均有所下降(P<0.05),见表3。
2.2.3 IL-8组内比较:3种磁场强度下,各组内24 h与18 h IL-8水平差异无统计学意义(P>0.05),48 h时IL-8水平明显升高(P<0.05)。组间比较:3种磁场强度处理后,LPS活化组IL-8水平较对照组和磁场处理组升高(P<0.05),而LPS+磁场组较LPS活化组IL-8水平有所下降,见表4。
3 讨论
THP-1细胞经LPS活化后,LPS可结合到细胞膜的TOLL样受体上并激活丝裂原活化蛋白激酶(MAPK)或核转录因子(NF)-κB信号通路,引起IL-6、IL-8、TNF-α的释放[8-9]。TNF-α主要由单核细胞、巨噬细胞分泌产生,在调控细胞凋亡、炎症和免疫的过程中起重要的作用,活化的TNF-α又可有效激活NF-κB通路。IL-6可刺激软骨下骨囊性变及硬化,导致关节软骨活动时应力分布不均,加速矿化的骨关节炎(OA)关节软骨的退变[10-11]。IL-8在一定程度上趋化炎症细胞进入关节其他组织(滑膜、滑液、韧带等),合成、释放多种炎症介质,加重关节内炎症反应。
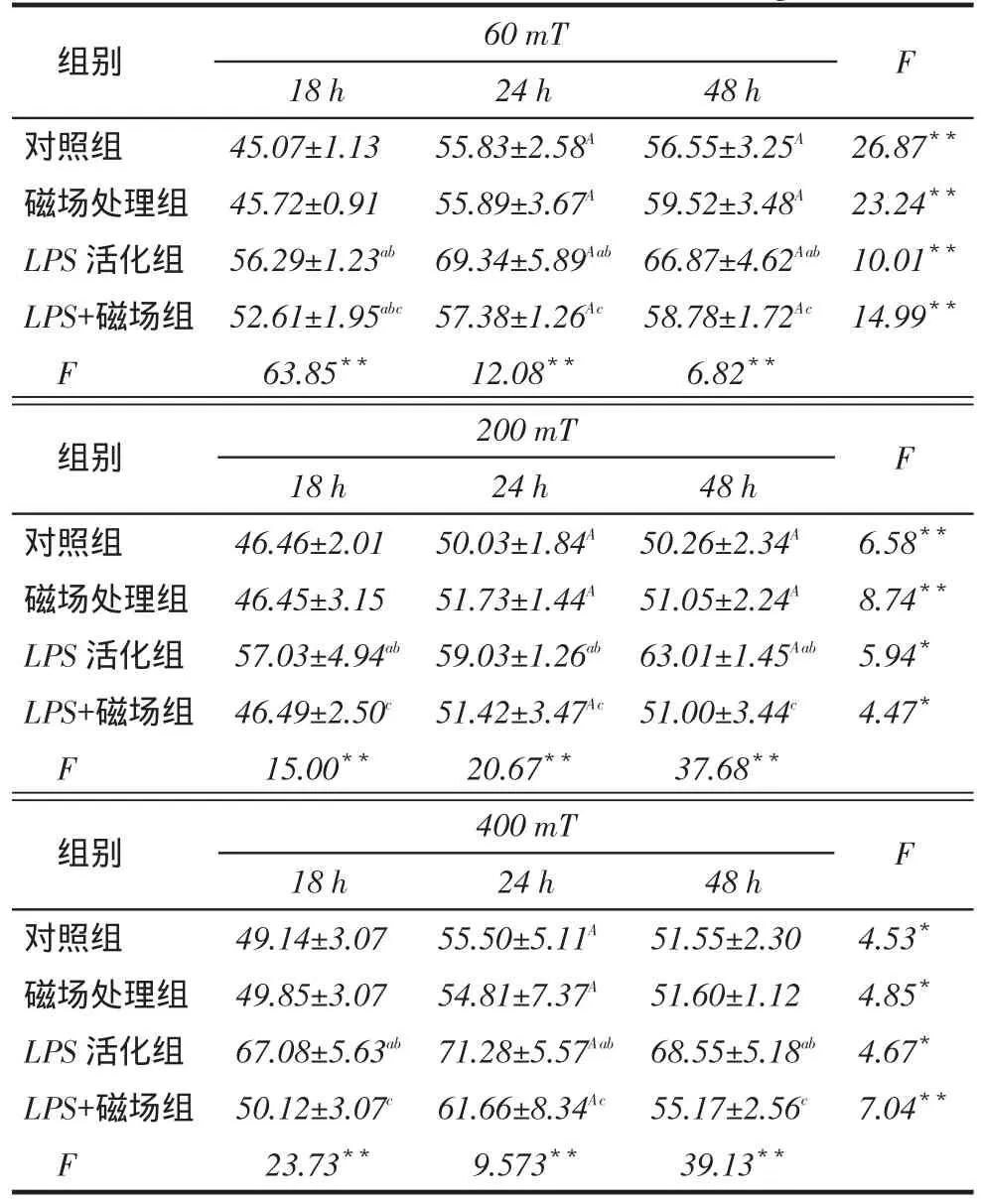
Tab. 3 Effects of different intensity static magnetic field on secretion of IL-6表3不同强度静磁场对细胞释放IL-6的影响(n=3,ng/L,x ±s)
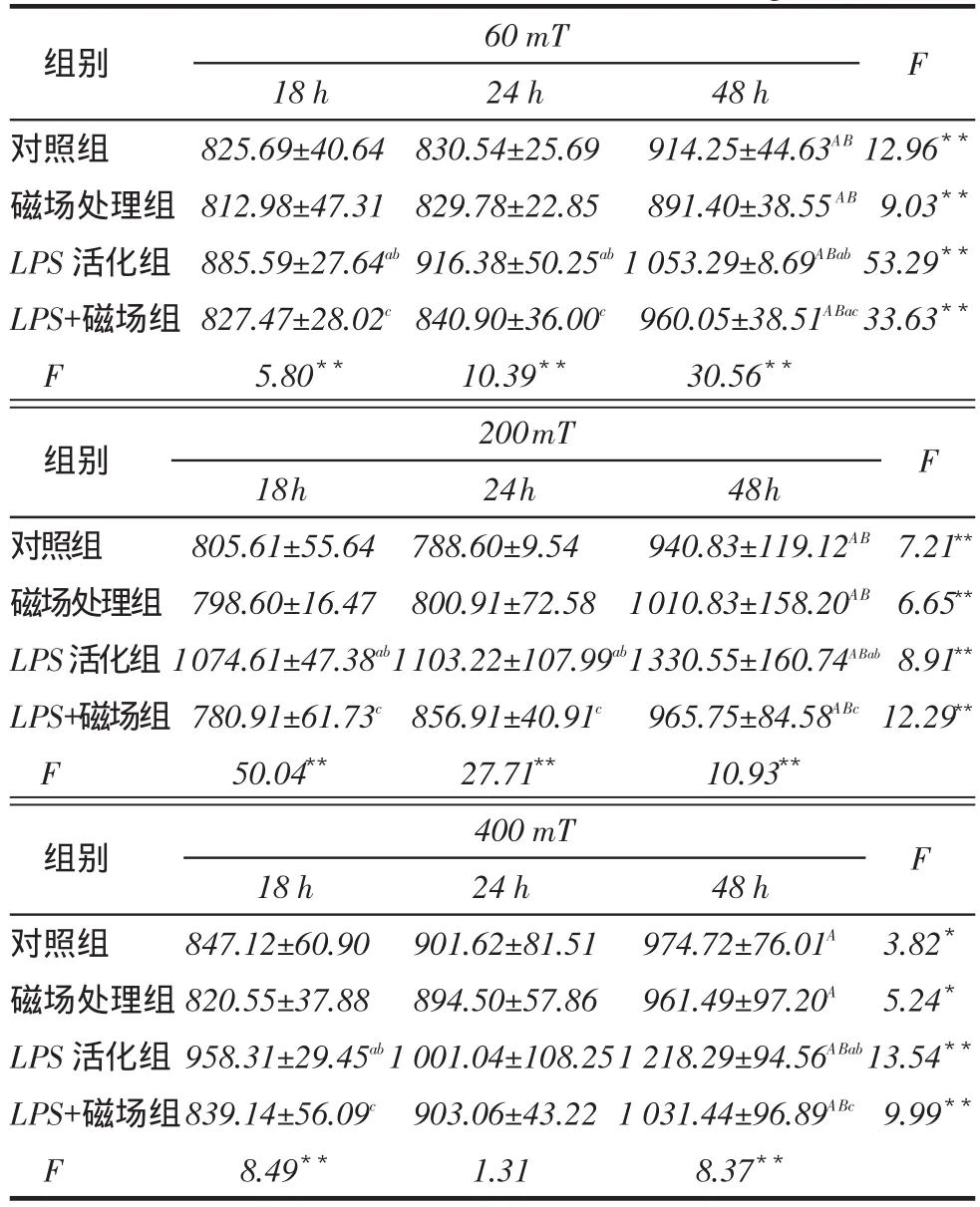
Tab. 4 Effects of different intensity static magnetic field on secretion of IL-8表4不同强度静磁场对细胞释放IL-8的影响(n=3,ng/L,x ±s)
磁场对于生物体的作用机制存在很多假说,其中被广泛接受的是磁场通过影响细胞内外钙离子浓度从而影响细胞的生物学效应[12-14]。此外,细胞内的大分子如蛋白质、酶等或带不同电荷的基团,或含有过渡族金属离子。这些部分往往是酶的活性中心,在稳恒磁场作用下这些金属离子和基团的电荷受力方向及回旋半径都不相同,导致整个酶分子的构象发生变形或扭曲,将活性中心外露或内包,从而改变了酶的活性,进而影响到细胞的正常生理活动。而炎症细胞信号是一个复杂的信号系统,可以管理基本细胞活动,协调细胞行为。目前关于静磁场对炎症细胞的报道较少,且结论不一。Dini等[15]发现6 mT的静磁场可抑制PMA引起的前单核细胞(U937细胞)分化,但并不影响细胞的增殖、,与本研究的结果基本一致。另有研究显示静磁场可使THP-1细胞和U937细胞吞噬指数和吞噬率下降,其作用在巨噬细胞的分化晚期明显增强[12]。Aldinucci等[13]发现4.75 T强静磁场可以有效促进外周血淋巴细胞的增殖能力,而淋巴细胞的活化程度无明显变化,且血清中IL-1β、IL-6、干扰素(IFN)和TNF-α的含量无明显改变。Vergallo等[16]采用2~754 mT不均一静磁场作用于人外周血巨噬细胞和淋巴细胞,可以有效抑制巨噬细胞释放TNF-α、IL-6、IL-8,及淋巴细胞释放IL-6。本研究发现,3种强度的静磁场对THP-1细胞的增殖并无影响。且LPS活化后的THP-1细胞释放的炎症因子水平升高,而经过磁场干预后,炎症因子释放减少,提示磁场对抑制炎症因子的释放有一定作用。另外3种炎症因子随时间的消长变化并不一致,这可能是由于TNF-α在炎症反应中的特殊地位所致。TNF-α是一种重要的前炎性细胞因子,被认为是引发炎症反应的起始者,其释放较早,合成后可经TNF受体激活NF-κB信号通路,诱导其他炎症因子的释放,因而导致IL-6和IL-8释放的峰值较晚。
静磁场对细胞的生物效应是从多方位、多层次同时作用而表现出来的综合效应,并不是某一因素单独作用的结果。目前研究中大多实验条件并不相同,得到的结论也各有侧重。本研究提示静磁场可能通过抑制IL-6、IL-8、TNF-α的释放来辅助治疗RA。
参考文献
[1] Tesch AM, MacDonald MH, Kollas-Baker C, et al. Endogenously produced adenosine regulates articular cartilage matrix homeosta⁃sis: enzymatic depletion of adenosine stimulates matrix degradation [J]. Osteoarthritis Cartilage, 2004, 12(5): 349-359. doi: 10.1016/j. joca.2004.01.002.
[2] Vincenzi F, Targa M, Corciulo C, et al. Pulsed electromagnetic fields increased the anti-Inflammatory effect of A2A and A3adenosine re⁃ceptors in human T/C-28a2 chondrocytes and hFOB 1.19 osteoblasts [J]. PLoS One, 2013, 8(5): e65561. doi: 10.1371/journal.pone.0065561. [3] Romão VC, Canhão H, Fonseca JE. Old drugs, old problems: where do we stand in prediction of rheumatoid arthritis responsiveness to methotrexate and other synthetic DMARDs[J]? BMC Med, 2013, 11: 17. doi: 10.1186/1741-7015-11-17.
[4] Xu ZJ, Weng LH, Cao JR, et al. The bio-effects of magnetic fields and the latest progress[J]. Progress in Modern Biomedicine, 2012, 12(6): 1187-1190. [徐贞俊,翁磊华,曹炯睿,等.磁场的生物学效应及最新进展[J].现代生物医学进展, 2012, 12(6):1187-1190].
[5] Yang Y. Cyclophilin A′s function to monocytes/macrophages in rheumatoid arthritis via CD147 signalingpathway[D]. Xi′an: Depart⁃ment of Clinical Immunology, Xijing Hospital, Fourth Military Medi⁃cal University, 2007. [杨勇. Cyp A通过CD147分子在类风湿关节炎中对单核/巨噬细胞作用的初步研究[D].西安:第四军医大学西京医院临床免疫科, 2007].
[6] Zhou J, Zhu P, Jiang JL, et al. The relationship between MMP-9 and MMP-2 expression and cell erosiveness in the process of THP-1 cells differentiation induced by PMA[J]. Chinese Journal of Cellu⁃lar and Molecular Immunology, 2005, 21(2):256-260. [周筠,朱平,蒋建利,等. PMA诱导的THP-1细胞分化过程中MMP-9及MMP-2的表达与细胞侵蚀性的关系[J].细胞与分子免疫学杂志, 2005, 21(2):256-260].
[7] Xie JM, Wang HW, Lu CS, et al. Association of TNF-α upregula⁃tion of MMP-9 activation in monocyte-derived macrophages with progression of joint damage in patients with rheumatoid arthritis[J]. Chinese Journal of Pathophysiology, 2009, 25(6): 1181-1185. [谢建民,王好问,陆才生,等. TNF-α上调单核巨噬细胞MMP-9的活性与类风湿关节炎关节破坏的关系[J].中国病理生理杂志, 2009, 25(6): 1181-1185].
[8] Ross CL, Harrison BS. Effect of pulsed electromagnetic field on in⁃flammatory pathway markers in RAW 264.7 murine macrophages[J]. Journal of Inflammation Research, 2013, 6: 45-51. doi: 10.2147/JIR. S40269.
[9] Diks SH, Richel DJ, Peppelenbosch MP. LPS signal transduction: the picture is becoming more complex[J]. Curr Top Med Chem, 2004, 4(11): 1115-1126. doi:10.2174/1568026043388141.
[10] Kwan TS, Padrines M, Théoleyre S, et al. IL-6, RANKL, TNF-al⁃pha/IL-1: interrelations in bone resorption pathophysiology[J]. Cyto⁃kine Growth Factor Rev, 2004, 15(1): 49-60. doi: 10.1016/j.cytog⁃fr.2003.10.005.
[11] Rosenthal AK, Gohr CM, Uzuki M, et al. Osteopontin promotespathologic mineralization in articular cartilage[J]. Matrix Biol, 2007, 26(2): 96-105. doi: 10.1016/j.matbio.2006.10.004.
[12] Dini L, Panzarini E. The influence of a 6 mT static magnetic field on apoptotic cell phagocytosis depends on monocyte/macrophage differentiation[J]. Exp Biol Med (May wood), 2010, 235(12): 1432-1441. doi: 10.1258/ebm.2010.010122.
[13] Aldinucci C, Garcia JB, Palmi M, et al. The effect of strong static magnetic field on lymphocytes[J]. Bioelectromagnetics, 2003, 24(2): 109-117. doi: 10.1002/bem.10071.
[14] Wang Z, Sarje A, Che PL, et al. Moderate strength (0.23-0.28 T) static magnetic fields (SMF) modulate signaling and differentiation in human embryonic cells[J]. BMC Genomics, 2009, 10: 356. doi: 10.1186/1471-2164-10-356.
[15] Dini L, Dwikat M, Panzarini E, et al. Morphofunctional study of 12-O-tetradecanoyl-13-phorbol acetate (TPA)-induced differentiation of U937 cells under exposure to a 6 mT static magnetic field[J]. Bio⁃electromagnetics, 2009, 30(5): 352-364. doi: 10.1002/bem.20474.
[16] Vergallo C, Dini L, Szamosvölgyi Z, et al. In vitro analysis of the an⁃ti-inflammatory effect of inhomogeneous static magnetic field-expo⁃sure on human macrophages and lymphocytes[J]. PLoS One, 2013, 8(8):e72374. doi: 10.1371/journal.pone.0072374.
(
2015-07-30收稿2015-11-20修回)
(本文编辑胡小宁)
The effect of moderate static magnetic fields on secretion of pro-inflammatory factors in THP-1 cells
GUO Zhixia1, MAO Libin1, WANG Huiqin2, ZHANG Rui2, ZHANG Tongcun1
1 Molecular Pharmacology and Molecular Biology Research Laboratory, College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457,China; 2 Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education
Corresponding Author E-mail: tony@tust.edu.cn
Abstract:Objective To investigate the effect of moderate static magnetic fields (SMF) on secretion of inflammato⁃ry factors tumor necrosis factor-α(TNF-α), interleukin-6 (IL-6) and interleukin-8 (IL-8) in human monocytic leukemic cell line THP-1. Methods THP-1 cells at logarithmic phase were divided into control group and magnetic treatment group. CCK-8 method was used to detect cell proliferation after THP-1 cells were exposed to 60 mT, 200 mT and 400 mT static magnetic fields at 18, 24 and 48 h. Then THP-1 cells were divided into control group, magnetic treatment group, LPS activation group and LPS+SMF treatment group. When magnetic treatment group and LPS+SMF treatment group were ex⁃posed to SMFat 18, 24 and 48 h, the levels of the cytokines TNF-α, IL-6 and IL-8 were determined by ELISA. Results (1) 60 mT, 200 mT and 400 mT SMF had no significant effects on cell proliferation in THP-1 cells (P>0.05). (2)THP-1 cells secreted more TNF-α and IL-6 in 24 h than 18 h in every group, while IL-8 didn′t change. Compared with 24 h, the secre⁃tion of TNF-α decreased and IL-6 didn′t change, while IL-8 increased in 48 h. At three sampled time THP-1 cells of LPS activation group secreted more TNF-α, IL-6, IL-8 than those of control group and magnetic treatment group. After magnetic treatment THP-1 cells of LPS+SMF treatment group secreted less TNF-α, IL-6, IL-8 than those of LPS activation group (P<0.05). Conclusion Static magnetic field may have some inhibitory effects on release of TNF-α, IL-6, IL-8 from THP-1 cells, which can provide basic datafor the treatment of rheumatoid arthritis.
Key words:rheumatoid arthritis; static magnetic field; THP-1 cells; inflammatory factors; LPS; ELISA; TNF-α; IL-6; IL-8
中图分类号:R684.3
文献标志码:A
DOI:10.11958/20150055
基金项目:国家自然科学基金资助项目(31171303,31270837);教育部长江学者和创新团队发展计划(IRT1166)
作者简介:郭志霞(1989),女,硕士在读,主要从事关节炎和骨质疏松研究
通讯作者E-mail: tony@tust.edu.cn
