以c-Met为靶点的抗肿瘤系列化合物体内外药效筛选
2016-06-28王莹张玉花陈占法刘玉刚
王莹,张玉花,陈占法,刘玉刚
以c-Met为靶点的抗肿瘤系列化合物体内外药效筛选
王莹1,张玉花2,陈占法3,刘玉刚3
摘要:目的从8个LY系列肝细胞生长因子受体(c-Met)酪氨酸激酶抑制剂中筛选具有抗肿瘤活性的化合物,并进一步评价其体内外抗肿瘤作用。方法首先采用均相时间分辨荧光技术(HTRF)对LY系列化合物进行初步筛选,观察它们对c-Met酪氨酸激酶的抑制作用;采用CCK-8法观察筛选出的活性化合物在体外对人胃癌MKN-45、人神经胶质瘤U87MG、人肾癌Caki-1、人前列腺癌PC-3细胞株的增殖抑制作用。建立人恶性胶质母细胞瘤U87MG裸小鼠移植瘤模型,考察活性化合物的抑瘤效果。结果HTRF结果显示有4个活性较好的化合物(LY22、LY25、LY28、LY32),其中LY28对c-Met抑制作用优于阳性对照药克唑替尼(Crizotinib)。CCK-8结果显示这些活性化合物对选用的4种靶细胞均有不同程度的抑制作用,其中LY28对肿瘤细胞增殖抑制作用最明显。裸小鼠移植瘤实验显示,LY28可显著抑制U87MG裸小鼠移植瘤的增殖,40 mg/kg LY28抑瘤率达到78.13%。结论化合物LY28具有较好的抗肿瘤活性,具有进一步研发的价值。
关键词:药物筛选试验,抗肿瘤;受体蛋白质酪氨酸激酶类;原癌基因蛋白质c-met;肝细胞生长因子受体;克唑替尼
作者单位:1河北工程大学医学院药理教研室(邮编056002);2河北工程大学图书馆;3河北工程大学附属医院骨科
肝细胞生长因子受体(hepatocyte growth factor receptor,c-Met)是原癌基因c-Met编码的蛋白,属于肝细胞生长因子(hepatocyte growth factor,HGF)特异性细胞膜受体。被HGF激活的c-Met对多种细胞的增殖、分化、形态发生和浸润运动等均有调节作用,因而与人类多种肿瘤的发生、发展有关[1-2]。现己证实,人的许多肿瘤组织中有c-Met表达,且明显高于其对应的正常组织,如肝细胞癌、胃癌、结肠癌、胰腺癌、肺癌、甲状腺癌、乳腺癌、白血病和淋巴瘤等[3-5]。目前,已有2个以c-Met为靶点的小分子抑制剂上市,另外还有多个化合物处于Ⅰ~Ⅲ期临床试验阶段。克唑替尼(Crizotinib)是由Pfizer公司研发的ATP竞争性c-Met及间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)双重抑制剂,于2011年8月经美国食品药品管理局(FDA)批准上市,用于治疗ALK阳性的局部晚期或转移的非小细胞肺癌[6-7]。常见的不良反应包括视力障碍、恶心、腹泻等,严重的不良反应为肺炎、呼吸困难等[8-9]。
为研发具有自主知识产权的安全有效的c-Met酪氨酸激酶抑制剂,本课题组以Crizotinib为母核进行结构改造,合成了LY系列化合物。本研究通过对该系列化合物进行体内外筛选,期望发现具有较强抗肿瘤活性的化合物。
1 材料与方法
1.1材料
1.1.1细胞株人胃癌MKN-45、人神经胶质瘤U87MG、人肾癌Caki-1、人前列腺癌PC-3细胞株,均购自中科院细胞库。MKN-45细胞株用RPMI1640培养基培养,U87MG细胞株用EMEM培养基培养,Caki-1细胞株用McCoy′s培养基培养,PC-3细胞株用Ham′s F12培养基培养。均置于5% CO2、37℃培养箱中培养,每隔2~3 d传代1次,取对数生长期细胞用于实验。
1.1.2实验动物BALB/c裸鼠(SPF级)购于北京维通利华实验动物技术有限公司,合格证号SCXK(京)2012-0001。
1.1.3试药与试剂LY系列化合物共8个样品和阳性对照药Crizotinib,均由邯郸市隆仁堂医药有限公司提供,纯度为97%以上,呈类白色粉末状,用二甲基亚砜(DMSO)溶解,配制成2×104μmol/L的储备液,-80℃保存备用,使用前用培养基稀释至所需浓度。HTRF®KinEASETM-TK试剂盒为Cisbio公司产品;RPMI1640培养基、EMEM培养基、McCoy′s培养基、Ham′s F12培养基、胎牛血清(FBS)及胰蛋白酶均为Gibco公司产品;ATP为Sigma公司产品;c-Met激酶购自Carna Biosciences;CCK-8试剂盒为碧云天生物技术研究所产品。
1.2方法
1.2.1均相时间分辨荧光技术(HTRF)检测LY系列化合物对c-Met激酶活性的影响采用HTRF检测LY系列化合物对c-Met激酶的抑制活性。实验除待测化合物外,另设3个对照组:阳性对照组(Crizotinib)、空白对照组和Cryptate对照组。将酶缓冲液、MgCl2、DTT、ddH2O按体积比794∶1∶5∶200配制激酶缓冲液。用该激酶缓冲液分别稀释TK-Substratebiotin、ATP和c-Met。稀释后将TK-Substrate-biotin、ATP按体积比1∶1混合,混合液按5 μL/孔加入至EP管中。按2 μL/孔加入待测化合物,空白对照孔用2 μL激酶缓冲液补齐,混匀。最后加入3 μL/孔c-Met稀释液,无酶孔用3 μL激酶缓冲液补齐,混匀。TK-Substrate-biotin、ATP、c-Met的终浓度分别为1 μmol/L、2.93 μmol/L、0.1 mg/L。实验设置3个复孔。将反应液转移至384孔板中,37℃孵育30 min。孵育结束后,将SA-XL665和TK Antibody-Cryptate按体积比1∶1混匀,按10 μL/孔加至反应体系中,充分混匀以终止反应,此时SA-XL665的终浓度为62.5 nmol/L。室温放置60 min后,于酶标仪314 nm激发检测665、620 nm荧光,计算激酶的抑制率。采用GraphPad Prism 5.0软件计算半数抑制浓度(IC50)值。抑制率= (F665/620对照孔-F665/620给药孔)/F665/620对照孔。
1.2.2 LY系列化合物对肿瘤细胞的增殖抑制实验将MKN-45、U87MG、Caki-1、PC-3细胞株按照常规方法传代,取对数生长期细胞,用0.25%胰蛋白酶消化后配成单细胞悬液,调整细胞密度至3×104个/mL,接种于96孔板,每孔100 μL,置于37℃、5%CO2培养箱中培养。24 h后弃上清液,分为溶媒对照组和待测化合物组。溶媒对照组为含0.04% DMSO的培养基,待测化合物组添加含不同浓度待测药物的培养基,100 μL/孔。每一个浓度设置3个复孔。37℃、5% CO2培养箱中孵育,药物浓度梯度为100、80、40、20、10、1 μmol/L。72 h后,每孔加入CCK-8溶液10 μL。培养箱中孵育2 h,在酶标仪450 nm波长处检测各孔光密度(OD)值。细胞增殖抑制率=(1-各浓度平均OD值/空白组平均OD值)×100%,采用Graphpad Prism5软件计算IC50值。
1.2.3动物分组、给药及瘤体积的测量50只6周龄裸鼠于皮下接种U87MG细胞,每只5×106细胞。细胞接种后10 d左右,进行肿瘤体积测量。挑选肿瘤体积在100~200 mm3的裸鼠,分组,进行实验。肿瘤体积(V)=1/2×a×b2,其中a、b分别表示长(mm)、宽(mm)。根据裸鼠的肿瘤体积按随机区组法分为模型组(给予溶媒)、LY28 10 mg/kg组、20 mg/kg组、40 mg/kg组及Crizotinib 30 mg/kg组,每组8只。分组当天即开始给药,每天单次灌胃给药,给药体积为0.01 mL/g,周期21 d。每3 d称体质量并测量肿瘤体积。末次给药结束后处死裸鼠,剥离肿瘤组织,称瘤质量并储存备用。抑瘤率(%)= (1-给药组平均瘤质量/模型组平均瘤质量)×100%。根据体积绘制肿瘤生长曲线。
1.3统计学方法采用SPSS 16.0软件进行统计分析。所有实验数据用均数±标准差(±s)表示。组间比较采用单因素方差分析(one-way ANOVA),多重比较采用LSD-t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 LY系列化合物对c-Met激酶活性的影响筛选中发现,LY系列化合物对c-Met激酶均表现出不同的抑制作用。LY14、LY19、LY22、LY25、LY28、LY31、LY32、LY45对c-Met激酶的IC50值分别为(25.36±0.02)、(59.14±0.09)、(11.64±0.22)、(27.47± 0.05)、(7.03±0.04)、(162.28±0.91)、(15.31±0.07)和(71.95±0.23)nmol/L。Crizotinib的IC50为(17.25± 0.03)nmol/L,组间差异有统计学意义(F=27.251,P<0.01)。化合物LY22、LY28、LY32的c-Met激酶抑制活性高于Crizotinib(均P<0.05)。化合物LY14、LY25的c-Met激酶抑制活性与Crizotinib较为接近。由于LY14的药学性质欠佳,因此后续选择LY22、LY25、LY28、LY32进行体外细胞筛选实验。2.2 LY系列化合物对肿瘤细胞增殖的影响LY系列化合物对MKN-45、U87MG、Caki-1、PC-3细胞株均表现出了不同程度的抑制作用。其中,LY28的抑制作用最强,且优于阳性对照药Crizotinib。各化合物的IC50值见表1。
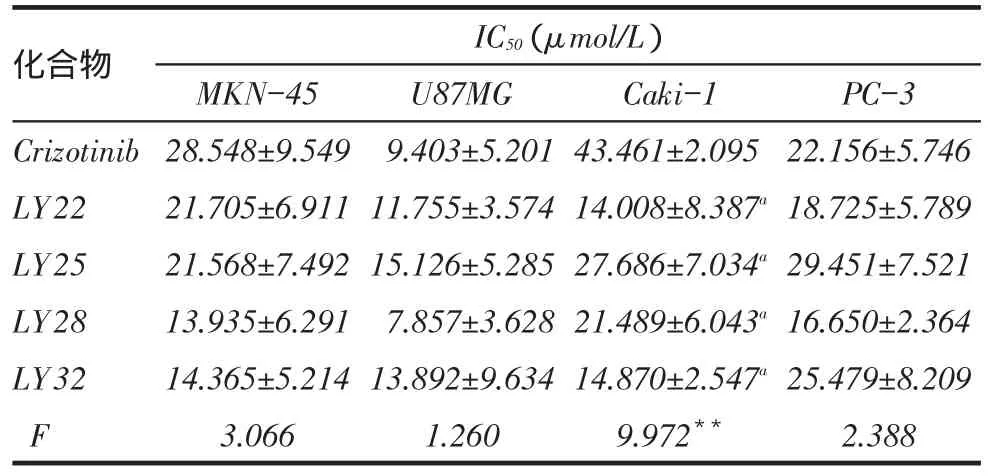
Tab. 1 The inhibitory effect of LY compounds on proliferation of tumor cells表1 LY系列化合物对肿瘤细胞的增殖抑制作用(n=3,x ±s)
2.3 LY28对U87MG细胞裸鼠移植瘤增殖抑制作用分析以上4个化合物对不同肿瘤细胞的IC50值,U87MG细胞对该系列化合物最为敏感。选定化合物LY28进行U87MG裸鼠移植瘤增殖抑制实验。结果显示,LY28可显著抑制人恶性胶质母细胞瘤U87MG裸鼠移植瘤的生长,抑制作用具有明显的剂量依赖性,高剂量(40 mg/kg)组和中剂量(20 mg/kg)组的抑制率分别为78.13%和64.06%。荷瘤鼠对LY28能够较好的耐受,没有发生严重的体质量减轻等症状。阳性药Crizotinib显著抑制人恶性胶质母细胞瘤U87MG裸鼠移植瘤的生长,30 mg/kg的抑瘤率达到80.47%。实验过程中无裸鼠死亡,各组裸鼠的体质量、瘤体积、瘤质量见表2、图1。

Fig.1 Growth curves of tumor volume in different treatment groups图1治疗后各组瘤体积增殖曲线
3 讨论
3.1 c-Met信号通路与肿瘤活化的c-Met可以通过多种机制造成肿瘤的增殖及转移。包括:(1)诱导多种底物蛋白的酪氨酸磷酸化,如PLCr、ras、Src、Gab1、Grb2等。经瀑布式的磷酸化反应,将信号逐级放大,最终转入细胞核内的转录机构,导致细胞的增殖、分化[10]。(2)通过激活PI3K通路生成肌醇磷脂,作用于细胞骨架的肌动蛋白,增强细胞的运动能力[11]。(3)影响肿瘤细胞间的黏附。HGF/c-Met信号通路使连环蛋白的酪氨酸残基磷酸化,破坏了E钙黏蛋白和细胞骨架的连接作用,最终导致细胞间的黏附作用降低,造成肿瘤的侵袭转移[12]。(4)诱发肿瘤血管生成。HGF经自分泌或旁分泌形式与c-Met受体相互作用,激活酪氨酸激酶,直接刺激内皮细胞的增殖、迁移、形成血管样结构[13]。因此,针对c-Met激活的不同途径开发抑制剂,对于阻断肿瘤的增殖及转移有着十分重要的意义。
3.2 LY系列化合物药效评价及后续研究方向LY系列化合物为自主设计合成的以c-Met为靶点的小分子化合物。本实验对LY系列化合物进行了抗肿瘤活性的体内外筛选,选择Crizotinib为阳性对照药。首先采用HTRF法进行激酶筛选,得到化合物LY14、LY22、LY25、LY28、LY32的c-Met抑制活性优于或接近Crizotinib。由于LY14的药学性质欠佳,因此后续选择LY22、LY25、LY28、LY32进行体外细胞筛选。4个化合物对所选的肿瘤细胞均有不同程度的抑制作用。综合两者结果,得到有潜力的活性化合物LY28。接下来考察了其对裸小鼠移植瘤模型的疗效。由于人癌裸小鼠移植瘤模型缺乏裸小鼠自身间充质细胞分泌的HGF,难以激活人源细胞中的c-Met。因此本研究选择了共同表达HGF、c-Met(两者组成一个自分泌环)的人胶质瘤模型U87MG[14]。结果表明,LY28可剂量依赖性地抑制U87MG裸小鼠移植瘤的增殖,高、中、低剂量(40、20、10 mg/kg)组的抑瘤率分别达到了78.13%、64.06%、30.47%,说明LY28对U87MG人恶性胶质母细胞瘤有效。LY28高剂量(40 mg/kg)对肿瘤的增殖抑制率与Crizotinib(30 mg/kg)80.47%的抑制率近似。由于激酶实验中LY28对c-Met的IC50值优于Crizotinib,有可能LY28在灌胃给药时,溶解度较差,影响体内吸收,进而影响药效发挥。因此,接下来本课题组将优化LY28的配制方法,改善其在体内的吸收。实验中荷瘤鼠对LY28能够较好的耐受,没有体质量减轻等症状发生。Crizotinib的体内外实验数据与文献报道相近[15],证实了实验过程的可靠性。本实验仅选择了一种人癌移植瘤U87MG模型,考虑到LY28对Caki-1细胞的抑制作用优于Crizotinib,差异具有统计学意义,后续将继续考察LY28对Caki-1等多种人癌裸鼠移植瘤的疗效,深入了解其抑瘤效果及作用机制,为新型小分子酪氨酸激酶抑制剂的研发提供依据。

Tab. 2 The inhibitory effect of LY28 on transplanted tumor of U87MG cells in nude mice表2 LY28对人恶性胶质母细胞瘤U87MG裸鼠移植瘤的抑制作用 (n=8,x ±s)
参考文献
[1] Jung KH, Park BH, Hong SS. Progress in cancer therapy targeting c-Met signaling pathway[J]. Arch Pharm Res, 2012, 35(4): 595-604. doi: 10.1007/s12272-012-0402-6.
[2] Organ SL, Tsao MS. An overview of the c-Met signaling pathway[J]. Ther Adv Med Oncol, 2011, 3(1 Suppl): S7- S19. doi:10.1177/ 1758834011422556.
[3] De Oliveira AT, Matos D, Logullo AF, et al. MET is highly expressed in advanced stages of colorectal cancer and indicates worse prognosis and mortality[J]. Anticancer Res, 2009, 29(11): 4807-4811.
[4] Wang J, Gui Z, Deng L, et al. c-Met upregulates aquaporin 3 ex⁃pression in human gastric carcinoma cells via the ERK signalling pathway[J]. Cancer Lett, 2012, 319(1):109-117. doi: 10.1016/j.can⁃ let.2011.12.040.
[5] Lutterbach B, Zeng Q, Davis LJ, et al. Lung cancer cell lines harbor⁃ing MET gene amplification are dependent on Met for growth and survival[J]. Cancer Res, 2007, 67(5):2081- 2088. doi: 10.1158/ 0008-5472.CAN-06-3495.
[6] Cui JJ, Tran-Dube M, Shen H, et al. Structure Based drug design of crizotinib (PF-02341066), a potent and selective dual inhibitor of mesenchymal-epithelial transition factor (c-MET) kinase and ana⁃plastic lymphoma kinase (ALK) [J]. J Med Chem, 2011, 54(18): 6342-6363. doi: 10.1021/jm2007613.
[7] Food and Drug Administration. Prescribing information for XALKO⁃RI[EB/OL].(2011-08-01)[2015-07-28]. http://www.accessdata.fda. gov/drugsatfda_docs/label/2011/202570s000lbl.pdf.
[8] Besse B, Salgia R, Solomon B, et al. Visual disturbances in patients with anaplastic lymphoma kinase-positive advanced non-small cell lung cancer treated with crizotinib[J]. Ann Oncol, 2012, 23(9 Sup⁃pl): S416-S416. doi: 10.1093/annonc/mds409.
[9] Costa DB, Shaw AT, Ou SH, et al. Clinical experience with crizo⁃tinib in patients with advanced ALK-rearranged non-small-cell lung cancer and brain metastases[J]. J Clin Oncol, 2015, 33(7): 1881-1888. doi: 10.1200/JCO.2014.59.0539.
[10] Mizuno S, Nakamura T. HGF-MET cascade, a key target for inhibit⁃ing cancer metastasis: the impact of NK4 discovery on cancer biolo⁃gy and therapeutics[J]. Int J Mol Sci, 2013, 14(1): 888-919. doi: 10.3390/ijms14010888.
[11] Gherardi E, Birchmeier W, Birchmeier C, et al. Targeting MET in cancer: rationale and progress[J]. Nat Rev Cancer, 2012, 12(2): 89-103. doi: 10.1038/nrc3205.
[12] Murai M, Shen X, Huang L, et al. Overexpression of c-met in oral SCC promotes hepatocyte growth factor-induced disruption of cad⁃herin junctions and invasion[J]. Int J Oncol, 2004, 25(4):831-840. doi: 10.3892/ijo.25.4.831.
[13] Zhang YW, Su Y, Volpert OV, et al. Hepatocyte growth factor/scat⁃ter factor mediates angiogenesis through positive VEGF and nega⁃tive thrombospondin 1 regulation[J]. Proc Natl Acad Sci USA, 2003, 100(22): 12718-12723. doi: 10.1073/pnas.2135113100.
[14] Hu B, Guo P, Bar-Joseph I, et al. Neuropilin-1 promotes human gli⁃oma progression through potentiating the activity of the HGF/SF au⁃tocrine pathway[J]. Oncogene, 2007, 26(38): 5577- 5586. doi: 10.1038/sj.onc.1210348.
[15] Yamazaki S, Skaptason J, Romero D, et al. Pharmacokinetic-phar⁃macodynamic modeling of biomarker response and tumor growth in⁃hibition to an orally available cMet kinase inhibitor in human tumor xenograft mouse models[J]. Drug Metab Dispos, 2008, 36(7): 1267-1274. doi: 10.1124/dmd.107.019711.
(2015-08-03收稿2015-11-25修回)
(本文编辑李鹏)
Pharmacodynamic screening of anticancer agents used as c-Met inhibitor in vitro and in vivo
WANG Ying1, ZHANG Yuhua2, CHEN Zhanfa3, LIU Yugang3
1 Department of Pharmacology, Medical College of Hebei University of Engineering, Handan 056002, China;2 Hebei University of Engineering Library; 3 Department of Orthopedics of the Affiliated Hospital of Hebei University of Engineering Corresponding Author E-mail: liuyugang1983@yeah.net
Abstract:Objective To screen 8 series of LY compounds, c-Met tyrosine kinase inhibitors, and evaluate their antitumor effects in vitro and in vivo. Methods Preliminary screening was carried out by detecting the c-Met kinase phosphor⁃ylation inhibition activity of the compounds. CCK-8 assay was adopted for secondary anti-tumor screen of the selected com⁃pounds using MKN-45, U87MG, Caki-1 and PC-3 cell lines in vitro. The transplanted tumor model of U87MG cells in nude mice was established to evaluate the antitumor activity in vivo. Results Four compounds (LY22, LY25, LY28 and LY32) with better activities were selected by HTRF method, in which LY28 had better inhibitory effect on c-Met than that of Crizo⁃tinib. The above active compounds showed different degrees of inhibition on the four kinds of target cells (MKN-45, U87MG, Caki-1 and PC-3) detected by CCK-8 method, and the inhibitory effect of LY28 showed the most obvious. Antitumor activi⁃ty in vivo showed that LY28 can significantly inhibited tumor growth in a dose-dependent manner. The tumor inhibitory rate in high-dose of LY28 was 78.13%. Conclusion The compound LY28 has good antitumor activity in vitro and in vivo, which will be anew tyrosine kinase inhibitor.
Key words:drug screening assays, antitumor;receptor protein-tyrosine kinases;proto-oncogene proteins c-met;c-Met;Crizotinib
中图分类号:R965.1
文献标志码:A
DOI:10.11958/20150078
基金项目:邯郸市科学技术研究与发展计划项目(1423108064-7)
作者简介:王莹(1984),女,博士在读,主要从事肿瘤药理学研究
通讯作者E-mail:liuyugang1983@yeah.net
