弥可保对糖尿病神经病理性疼痛大鼠背根神经节Nav1.7表达的影响
2016-06-28张春玲任幼红通讯作者
张春玲 任幼红(通讯作者)
1)山东平度市人民医院内分泌科 平度 266700 2)郑州大学第一附属医院康复科 郑州 450052
弥可保对糖尿病神经病理性疼痛大鼠背根神经节Nav1.7表达的影响
张春玲1)任幼红2)(通讯作者)
1)山东平度市人民医院内分泌科平度2667002)郑州大学第一附属医院康复科郑州450052
【摘要】目的探讨弥可保对链脲佐菌素(STZ)致糖尿病模型大鼠痛阈及背根神经节(DRG)中电压门控性钠离子通道亚型1.7(Nav1.7)表达的影响。方法健康雄性SD大鼠75只,体质量200~250 g,随机分为空白对照组(C组)、模型组(DNP组)和弥可保组(DNP+M组),每组25只,其中模型组和弥可保组皮下注射STZ 75 mg/kg制作糖尿病大鼠模型,剔除血糖低于16.7 mmol/L的大鼠,14 d后给予安慰剂和弥可保(600 μg/kg)腹腔注射,1次/d,观察STZ注射前1 d及注射后3、7、14、21、28 d机械缩足反射阈值(mechanical withdrwal threshold,MWT),行为学测试完成后,采集大鼠背根神经节(DRG)标本,用免疫组化和Western blot方法分别检测其钠离子通道Nav1.7蛋白表达水平。结果与对照组比较,模型组大鼠MWT降低,DRG中Nav1.7 的表达上调,差异有统计学意义(P<0.05);与模型组比较,弥可保组大鼠MWT升高,DRG中Nav1.7 的表达下调,差异有统计学意义(P<0.05)。结论弥可保通过抑制糖尿病大鼠DRG中 Nav1.7 表达,从而缓解大鼠神经病理性疼痛。
【关键词】弥可保;糖尿病神经病理性疼痛;背根神经节;Nav1.7
研究表明,糖尿病患者高血糖诱发微循环障碍,最终可导致痛性糖尿病神经病变的发生,其中以糖尿病神经病理性疼痛(diabetic neuropathic pain,DNP)最为常见[1]。患者可出现自发痛、痛觉过敏、触诱发痛及感觉异常,严重影响生活质量[2],其中疼痛过敏由神经元兴奋性升高引起,而神经元兴奋性与电压门控钠离子通道息息相关。研究指出,背根神经节(dorsal root ganglion,DRG)中高表达的Nav1.7与人类遗传性疼痛疾病密切相关[3],编码Nav1.7的SCN9A基因错义突变导致原发性红斑肢痛症[4]和阵发性剧痛症[5],而SCN9A基因碱基缺失则引起先天性无痛症[6]。弥可保(甲钴胺)早期应用能改善糖尿病患者的神经症状和感觉传导速度[7]。本实验旨在观察弥可保对糖尿病神经病理性疼痛大鼠痛阈及DRG中Nav1.7蛋白表达的影响,为治疗糖尿病神经病理性疼痛提供理论基础。
1对象与方法
1.1实验对象健康雄性SD大鼠75只,体质量200~250 g,由河南省实验动物中心提供,采用随机数字表法将其分为3组:对照组(C 组)、模型组(DNP组)和弥可保组(DNP+M组),每组25只。
1.2试剂与设备弥可保注射液(卫材中国药业有限公司),链脲佐菌素(streptozocin,美国Sigma公司),Nav1.7 兔单克隆一抗(abcam公司,美国),碱性磷酸酶标记的山羊抗兔抗体(南通碧云天公司),血糖仪(中国欧姆龙公司),von Frey Hairs(美国Stoelting公司)。
1.3DNP模型制备参照文献[8]制备DNP模型,测大鼠基础痛阈后皮下注射STZ 75 mg/kg,给药后7 d测量尾静脉血糖稳定>16.7 mmol/L为糖尿病模型制备成功,给药后14 d痛阈降低幅度>基础痛阈的15%为DNP模型制备成功。14 d后分别给予安慰剂和弥可保600 μg/(kg·d)腹腔注射,1次/d,连续28 d,测量STZ注射前1 d、STZ注射后3、7、14、21、28 d时间点MWT。
1.4机械缩足反射阈值(mechanical withdrwal threshold,MWT)的检测参照文献[9],采用“up and down”方法测定50%缩足阈值。将大鼠置于金属筛网上的有机玻璃箱中适应30 min后,用特制的von Frey纤维丝(0.4、0.6、1、2、4、6、8、15 g)垂直刺激大鼠后肢足底掌部皮肤,持续时间≤4 s,若大鼠出现缩足或舔足,即记为阳性反应。测定首先从中等强度(2.0 g)开始,不能引起阳性反应时,则增大1级力度刺激;如出现阳性反应,则减小1级力度刺激,检测出现第1次阳性或阴性反应时记录表上后移记录,再测定4次。为避免前一刺激的影响,一般2次检测之间相隔30 s。阳性反应用“×”表示,阴性反应用“○”表示,计算出大鼠50%机械缩足阈值。
1.5组织学观察大鼠用10%水合氯醛(3 mL/kg)麻醉后,打开胸腔,暴露心脏,经左心室灌注冰冷生理盐水300 mL,接着使用4%多聚甲醛400 mL灌注。取L3-5DRG置于4%多聚甲醛(pH 7.2)固定2 h,后放入30%蔗糖溶液,待其在蔗糖溶液沉底后冰冻切片,晾片过夜,0.01 mol/L的PBS漂洗3次。5% 胎牛血清封闭 2 h 后,入一抗Anti-Nav1.7(1∶200) 孵育。一抗 4 ℃孵育 24 h。PBS漂洗3 次,入二抗Alexa Fluor 488(donkey anti-rabbit IgG,1∶200),室温孵育2 h。PBS漂洗3次后封片剂封片。德国Leica显微镜照相,图像采用Biosens Digitl Imaging System v1.6软件分析处理。
1.6Western blot冰上操作取L3-5DRG,放入-80 ℃冰箱保存备用。提取蛋白,在SDS-PAGE凝胶系统中上样电泳,半干转法将目的蛋白转移至NC膜上,5%脱脂奶粉/TBST 20 mL,水平摇床室温封闭1 h,分别 Anti-Nav1.7 一抗(1∶200),Anti-β-actin(1∶1 000),4 ℃孵育过夜,碱性磷酸酶标记兔二抗(1∶1 000),室温摇床孵育2 h,发光曝光后所得条带光密度分析,统计分析数据。
1.7统计学分析采用 SPSS 17.0软件进行统计学分析,实验结果均以均数±标准误表示,行为学分析结果采用双因素方差分析(two-way ANOVA),Western blot和免疫荧光结果使用单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2结果
2.1行为学结果为探讨弥可保对DNP大鼠糖尿病神经病理痛的影响,我们给模型组和弥可保组皮下注射STZ 75 mg/kg制作糖尿病大鼠模型,14 d后分别给予安慰剂和弥可保(600 μg/kg)腹腔注射,1次/d,连续28 d,测定STZ注射前1 d及注射后3、7、14、21、28 d MWT。结果显示,与对照组比较,DNP组和M组随着时程的延长,MWT逐渐降低,至14、21、28 d差异有统计学意义(P<0.05)。与DNP组比较,M组MWT 14、28 d升高差异有统计学意义(P<0.05)。见图1。
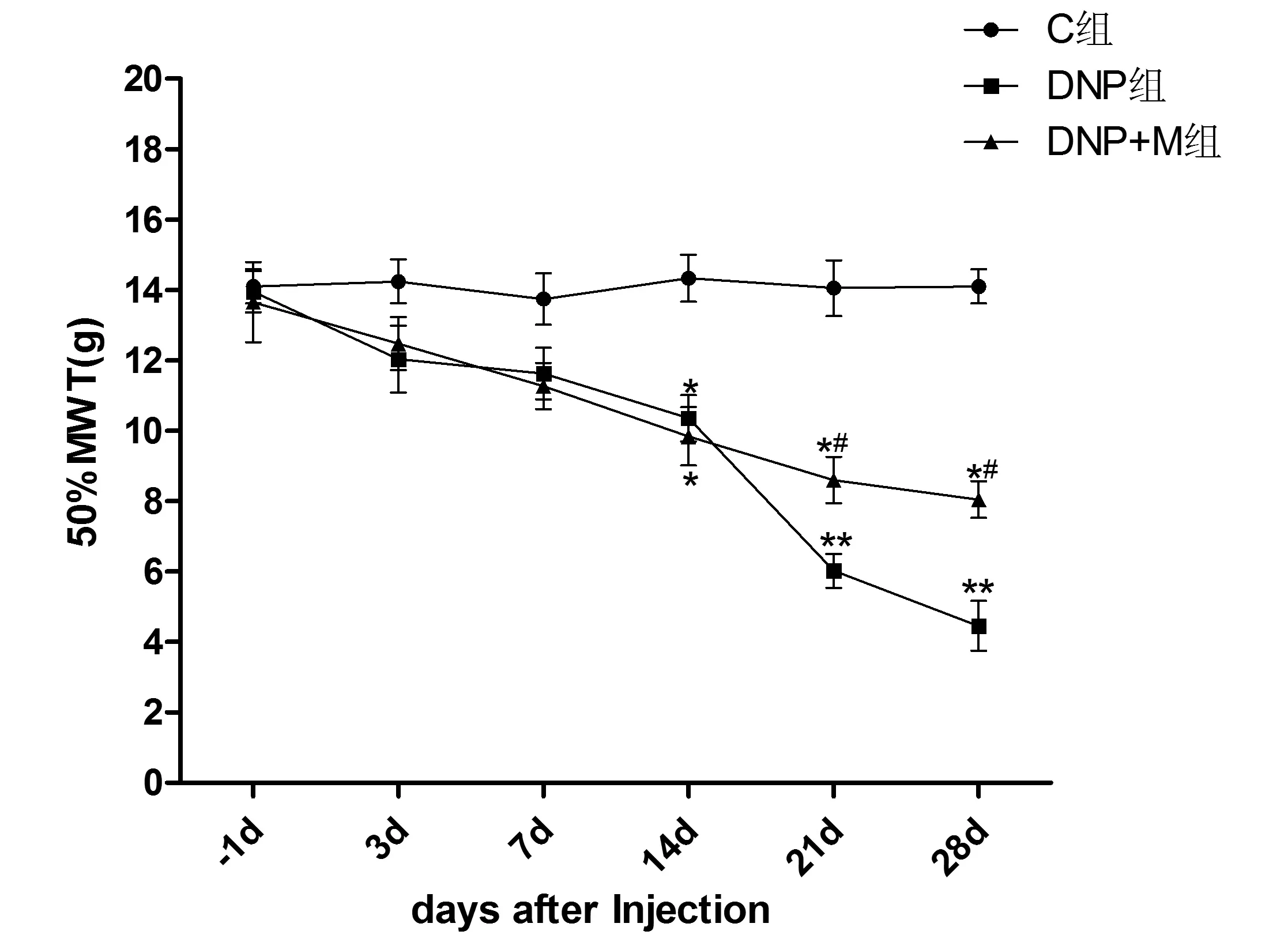
图1弥可保对DNP大鼠各时点MWT的影响与对照组相比较,*P<0.05,**P<0.01;与DNP组比较,#P<0.05
2.2形态学与Western blot结果为进一步探讨弥可保减轻DNP大鼠糖尿病神经病理疼痛的机制,我们检测了河豚毒素敏感性离子通道Nav1.7在大鼠DRG中的表达。我们选择了大鼠STZ注射后28 d时间点,免疫荧光显示,DNP模型大鼠的DRG神经元中的Nav1.7蛋白明显增加(P<0.05),同样Western blot结果显示,与C组相比较,DNP大鼠DRG中,Nav 1.7表达显著增加(P<0.05)。与DNP组比较,形态学和Western blot结果均显示,M组Nav 1.7表达明显减少(P<0.05)。见图2、3。
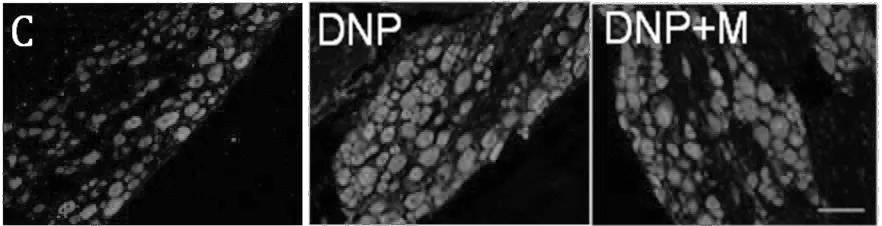

图23组大鼠DRG神经元Nav1.7表达的形态学结果与DNP组相比,*P<0.05,**P<0.01;scale bar=50 μm(n=9)
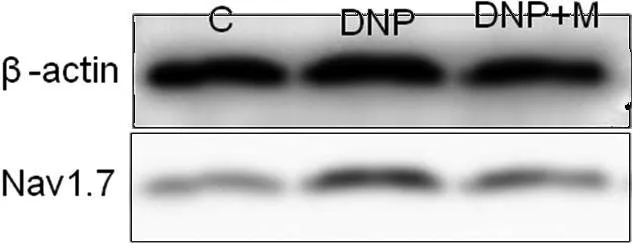

图33组大鼠DRG神经元Nav1.7表达的Western blot结果与DNP组相比,*P<0.05,**P<0.01
3讨论
弥可保主要成分为甲钴胺,维生素Bl2的一种衍生物,即在中心的钴分子上结合了1个甲基,其活性远胜于普通的维生素B12,能促进神经轴突的再生,修复损伤的神经,可改善糖尿病周围神经病变的症状,增加神经传导速度[7]。本研究选择弥可保进行实验,结果表明,给予弥可保治疗DNP大鼠痛阈明显升高,表明弥可保可减轻大鼠DNP。
Nav1.7是河豚毒素敏感性(TTX-S)钠离子通道,在疼痛中起着至关重要的作用。在大鼠糖尿病病理性疼痛模型中,Nav1.7的表达和电流均呈上升趋势[8-10],且在坐骨神经结扎的神经病理性疼痛模型中,DRG中Nav1.7的表达也呈上升趋势[11]。因此,在糖尿病神经病理性疼痛大鼠DRG神经元中Nav 1.7表达增加,可能是DRG神经元兴奋性大幅度提高的原因。本研究结果表明,与DNP组比较,弥可保组痛阈升高Nav1.7表达增加下调,说明腹腔注射弥可保可减轻糖尿病神经病理性疼痛,其机制可能与抑制DRG神经元Nav1.7的表达有关。
综上所述,弥可保腹腔注射可缓解大鼠糖尿病神经病理性疼痛,并显著下调糖尿病周围神经病变模型大鼠DRG中NaV1.7蛋白。由此我们推测,弥可保对糖尿病周围神经病变模型大鼠的治疗机制可能与其能够下调DRG中Nav1.7蛋白有关,弥可保有可能具有阻断NaV1.7通道激活途径中的某些环节或直接抑制Nav1.7通道活性的作用,但其明确的治疗机制尚不清楚,仍需进一步研究。
4参考文献
[1]Nie F, Su D, Shi Y, et al.A preliminary study on the role of the complement regulatory protein, cluster of differentiation 55, in mice with diabetic neuropathic pain[J].Mol Med Rep, 2015,11(3):2 076-2 082.
[2]Russell JW, Zilliox LA.Diabetic neuropathies[J].Continuum(Minneap Minn), 2014,20(5 Peripheral Nervous System Disorders):1 226-1 240.
[3]Mansouri M, Chafai Elalaoui S, Ouled Amar Bencheikh B, et al.A novel nonsense mutation in SCN9A in a Moroccan child with congenital insensitivity to pain[J].Pediatr Neurol, 2014,51(5):741-744.
[4]Yang Y, Wang Y, Li S, et al.Mutations in SCN9A, encoding a sodium channel alpha subunit, in patients with primary erythermalgia[J].J Med Genet, 2004,41(3):171.
[5]Gardiner M.Molecular genetics of infantile nervous system channelopathies[J].Early Hum Dev, 2006,82(12):775.
[6]Cox JJ, Reimann F, Nicholas AK, et al.An SCN9A channelopathy causes congenital inability to experience pain[J].Nature, 2006,444(7 121):894.
[7]Lu E, Meng Y.Comment on Deng et al.entitled “meta-analysis of methylcobalamin alone and in combination with prostaglandin E1 in the treatment of diabetic peripheral neuropathy”[J].Endocrine, 2014,47(3):973-974.
[8]Nam JS, Cheong YS, Karm MH, et al.Effects of nefopam on streptozotocin-induced diabetic neuropathic pain in rats[J].Korean J Pain, 2014,27(4):326-333.
[9]Chaplan SR, Bach FW, Pogrel JW, et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Methods, 1994,53(1):55-63.
[10]Chattopadhyay M, Mata M, Fink DJ.Continuous delta-opioid receptor activation reduces neuronal voltage-gated sodium channel(NaV1.7) levels through activation of protein kinase C in painful diabetic neuropathy[J].J Neurosci, 2008,28(26):6 652.
[11]Bartel DP.MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell, 2004,116(2):281.
(收稿 2015-06-07)
【中图分类号】R-332
【文献标识码】A
【文章编号】1673-5110(2016)11-0036-03
