熔融法制备非诺贝特缓释胶囊的处方工艺研究
2016-06-27傅行弟
傅行弟
(安徽先求药业有限公司,安徽 郎溪 242131)
熔融法制备非诺贝特缓释胶囊的处方工艺研究
傅行弟
(安徽先求药业有限公司,安徽 郎溪242131)
摘要:目的采用熔融法固体分散体技术代替微丸技术制备非诺贝特缓释胶囊。方法将主药与辅料熔融制备缓释颗粒,装入胶囊,以进口品为对照,按国家颁布的质量标准中释放度检查条件考查其释放。结果两者体外释放基本一致。结论熔融法固体分散体技术制备非诺贝特缓释胶囊较微丸技术简单方便,适合工业生产。
关键词:非诺贝特;迟效制剂;工艺学,制药;固体分散体技术
非诺贝特(fenofibrate,FB)为氯贝丁酯类血脂调节剂,能抑制胆固醇和甘油三酯的合成,增加固醇类的排泄。此外,尚能降低血浆纤维蛋白原含量和血小板的黏性,减少血栓的形成。目前国内已上市的非诺贝特缓释胶囊(利必非®)为上海爱的发制药有限公司生产(进口分装),规格为0.25 g,其内容物为缓释小丸,是在其速释小丸的基础上包缓释衣层制得,原、辅料主要选用微粉化的非诺贝特、中性蔗糖丸芯、羟丙甲纤维素、表面活性剂十二烷基硫酸钠及成丸与包衣材料,工艺采用微丸制备技术。由于该处方及生产工艺较复杂耗时,考虑到非诺贝特系难溶性药物和缓释制剂的技术要求,借鉴国外提高非诺贝特生物利用度的组方和工艺[1-3],结合非诺贝特熔点相对较低的特点,我们采用熔融法制备固体分散体技术制备了非诺贝特缓释胶囊[4-6],并与进口品进行了释放度和其他主要质量指标的对比研究。
1仪器与试药
1.1仪器恒温油浴锅(HH-S,金坛顺华)、摇摆制粒机(YK-160,鹭燕机械)、胶囊自动灌装机(NJP-200C,天宏机械)、 电子天平(AG285型,梅特勒)、智能溶出仪(ZRS-8G,天津天发)、紫外分光光度计(UV-1102,上海天美)。
1.2试药非诺贝特原料(耐司康药业,08-06-FP0226)、非诺贝特对照品(中国药品生物制品检定所,100733-200401)、市售非诺贝特缓释胶囊(上海爱的发制药有限公司,080204),自制非诺贝特缓释胶囊(先求药业,081201、081202、081203)、聚乙二醇(PEG6000,威尔化工)、泊洛沙姆(F-68,威尔化工)、硬脂酸(AS,湖州展望)、乙基纤维素(EC,泰安瑞泰)和十二烷基硫酸钠(SDS,仁驰化工)。
2方法与结果
2.1处方筛选非诺贝特在氯仿中极易溶解,在丙酮或乙醚中易溶,在乙醇中略溶,在水中几乎不溶,熔点相对较低(78~82 ℃),适合熔融法制备分散体型缓释颗粒。为优选最佳处方组成,设计了以下处方进行试制。
制备方法:按照表1的处方组成,分别称取FB、PEG6000、F-68和A.S,混合后置加热釜中(95±5)℃的油浴加热至完全熔化,加入EC搅拌至完全溶解,保温5 min,放出置样品盘中,冷却固化20 min后,置摇摆制粒机中,不锈钢网24目制粒,分盘冷风冷却1 h,整粒,取60~20目颗粒,加入适量的SDS,混匀,灌入1号胶囊,依法进行释放度测定,结果见表2。
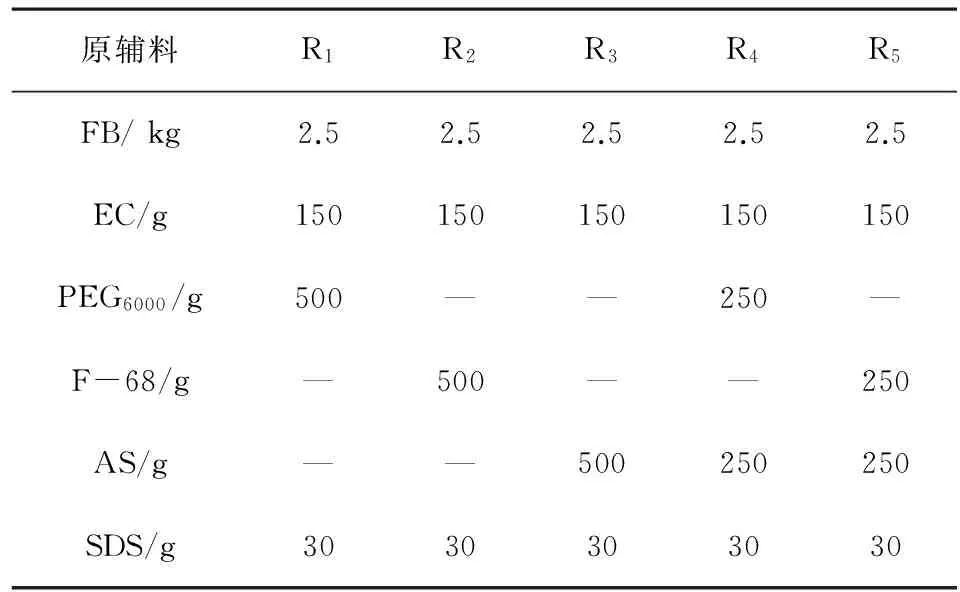
表1 熔融法各处方组成
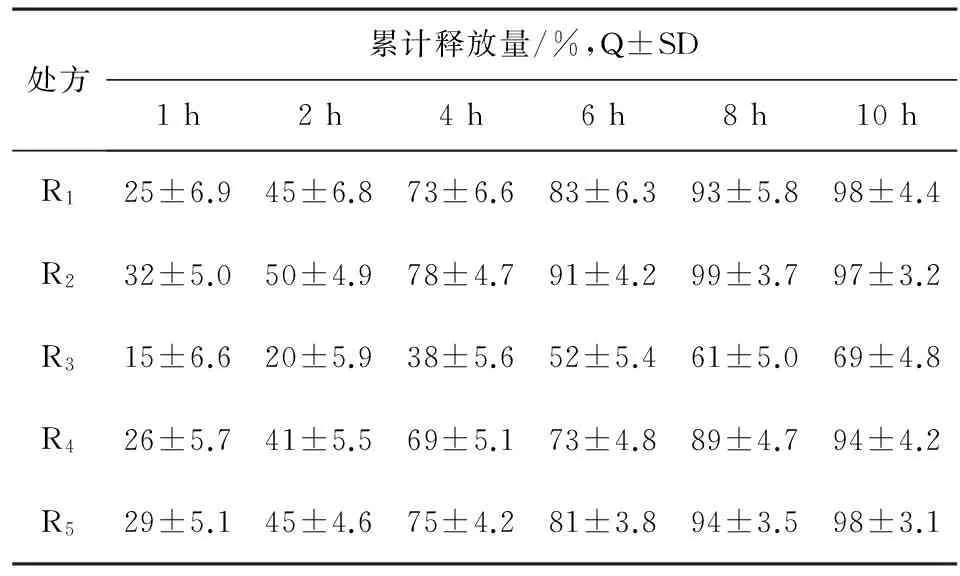
表2 熔融法各处方的释放度测定(n=6)
结果:依据实验数据得出处方中辅料PEG6000和F-68为稀释助熔调节剂,SDS为助溶剂和润滑剂,三者均对释放速度起促进释放作用;而EC和A.S为阻制剂,对释放速度起抑制作用;在处方中适量使用PEG6000、F-68和AS使分散体的黏稠度越小,易冷却固化,最终优选以F-68和SDS为释放促进剂,EC和A.S为释放抑制剂的处方R5为本品最佳处方组成。
2.2制备工艺研究结合熔融法工艺特性及制备过程中各参数变化情况,拟定进行研究如下。
2.2.1颗粒粒径大小分布测定按上述表1中R5处方组成,采用熔融法,用不锈钢网20目制粒,结果所得颗粒大小分布见表3。
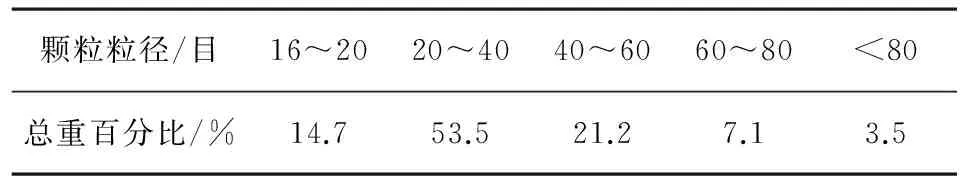
表3 颗粒粒径大小分布
结果:上述工艺制备的颗粒大小主要分布在16~60目,其中20~40目所占比例较多,依据颗粒的释放度大小及胶囊装量的均匀性进行内容物中颗粒粒径筛选。
2.2.2颗粒粒径大小对释放度影响见表4。
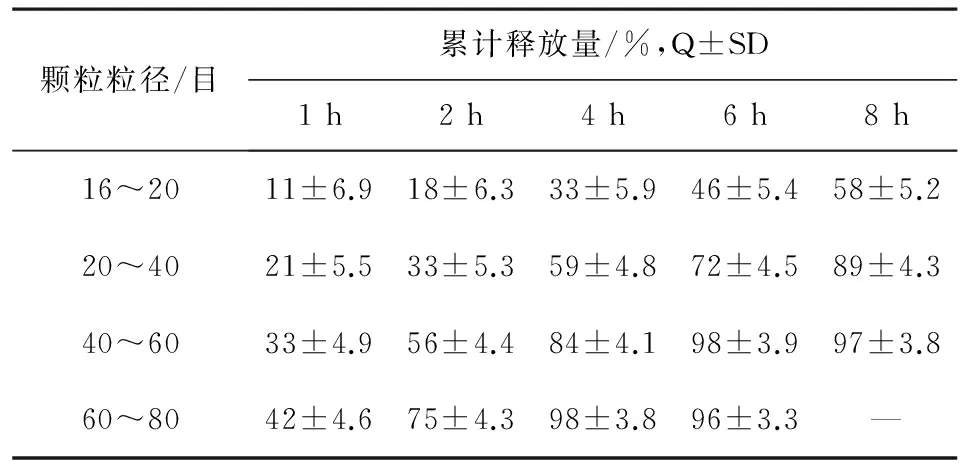
表4 不同粒径的颗粒对释放度影响(n=6)
结果:释放度随着颗粒的粒径减小其释放度明显加快,依据上市药品非诺贝特缓释胶囊(利必非®)的释放度限度控制为:1 h:10%~30%;4 h:50%~75%;7 h>75%[7],如本品颗粒粒径单纯控制在20目以上或40目以下时其释放度就会偏慢或偏快,颗粒粒径在20~40目范围内较为合适,但其成品率相对较低,结合上述工艺制备的颗粒粒经大小主要(约90%)分布在16~60目之间,可将颗粒的粒经控制在其区间进行混合后筛取不同大小进行释放度试验,结果见表5。
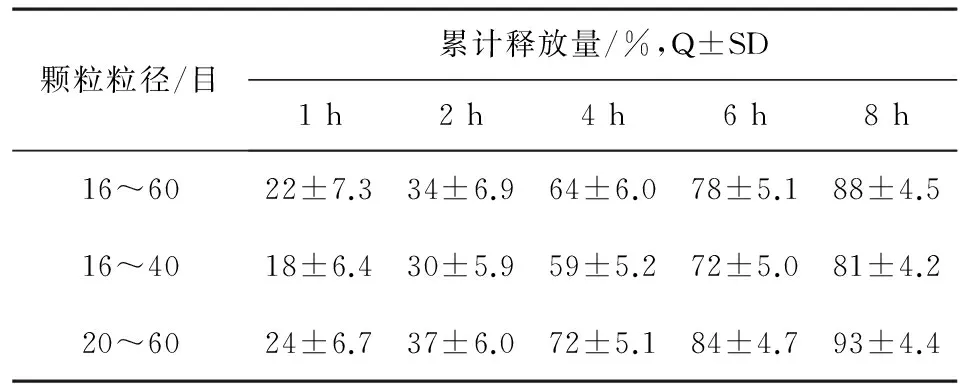
表5 不同粒径的颗粒对释放度影响(n=6)
结果:在粒经大小分布在16~60目之间的颗粒,其不同粒径段间的释放度均符合上市药品非诺贝特缓释胶囊的释放度限度控制标准。
2.2.3熔化次数对释放度影响工艺生产不仅要考虑颗粒大小均一性,同时还要考虑到颗粒成品率问题,结合与上市品的释放曲线接近程度,我们初步选定颗粒粒径大小为16~60目之间。同时在工业生产中可将粗颗粒、细粉和尾料进行重新熔化制粒,这种反复熔化是否会影响颗粒释放度,经反复多次熔化制备相同粒径(16~60目)大小的颗粒进行释放度比较,结果见表6。
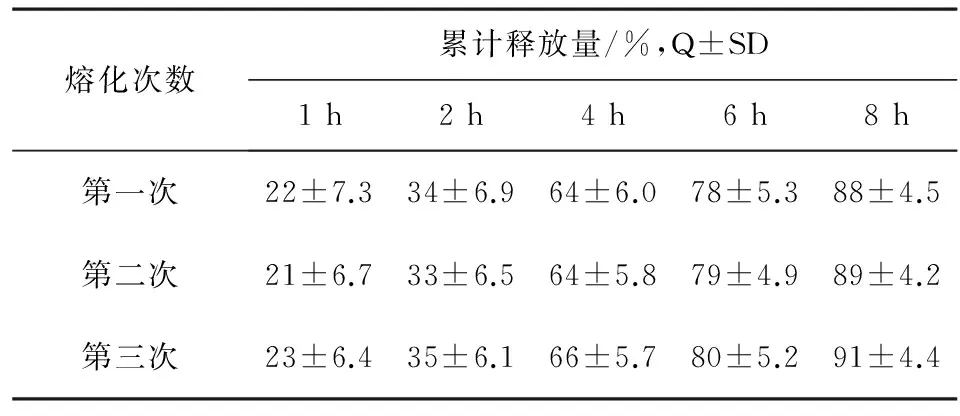
表6 熔化次数对释放度影响(n=6)
结果:不同熔化次数制得颗粒对释放度有一定影响,但影响不明显。在本品生产工艺中其细粉和尾料熔化次数控制在1~2次,由于其在整个颗粒组分中所占比例不大(约10%),因此其重复熔化后制得的颗粒与整个颗粒混合后对本品释放度基本无影响。
2.2.4熔化温度及保温时间对释放度影响工业生产设备温度变化较实验室仪器波动大,因此适当放大温度区间及操作时间进行参数研究,为后期工业大生产工艺操作制定提供参考依据,内容见表7。
结果:从不同熔化温度及保温时间对释放度的影响测定数据看,温度越高及保温时间越长所制得的颗粒其释放度相对越快,但对释放度影响程度不明显,为控制各批次中各颗粒释放度的稳定性以及药物稳定性,工业大生产时其熔化温度应控制在90~110℃之间,保温时间控制在20 min以内为宜。
3自制品与进口分装的非诺贝特缓释胶囊释放曲线比较
3.1释放度测定方法采用溶出度测定法第二法的装置,以0.1 mol·L-1十二烷基硫酸钠溶液1 000 mL为溶剂,转速为120 r·min-1,依法操作,在规定时间点分别取溶液10 mL滤过,并即时在操作容器中补充上述溶剂10 mL;分别精密量取续滤液2 mL置50 mL量瓶中,加乙醇稀释至刻度,摇匀,照紫外—可见分光光度法(中国药典2005年版二部附录 IV A),在288 nm的波长处分别测定吸光度。另精密称取非诺贝特对照品25 mg,置100 mL量瓶中,加乙醇溶解并稀释至刻度,摇匀,精密量取2 mL,置50 mL量瓶中,加0.1 mol·L-1十二烷基硫酸钠溶液2 mL,用乙醇稀释至刻度,摇匀,同法测定吸光度,分别计算出每粒在不同时间的释放量。
3.2释放曲线取本品,按照释放度规定方法操作,则分别在规定时间点取样测定其累积释放量,并与上市缓释胶囊体外释放相比较,结果见表8,图1。
从上述图表可以看见,自制品在体外前4 h较上市品偏快,而后相近,两者在10 h后基本全部释放出来,总体释放曲线较接近。
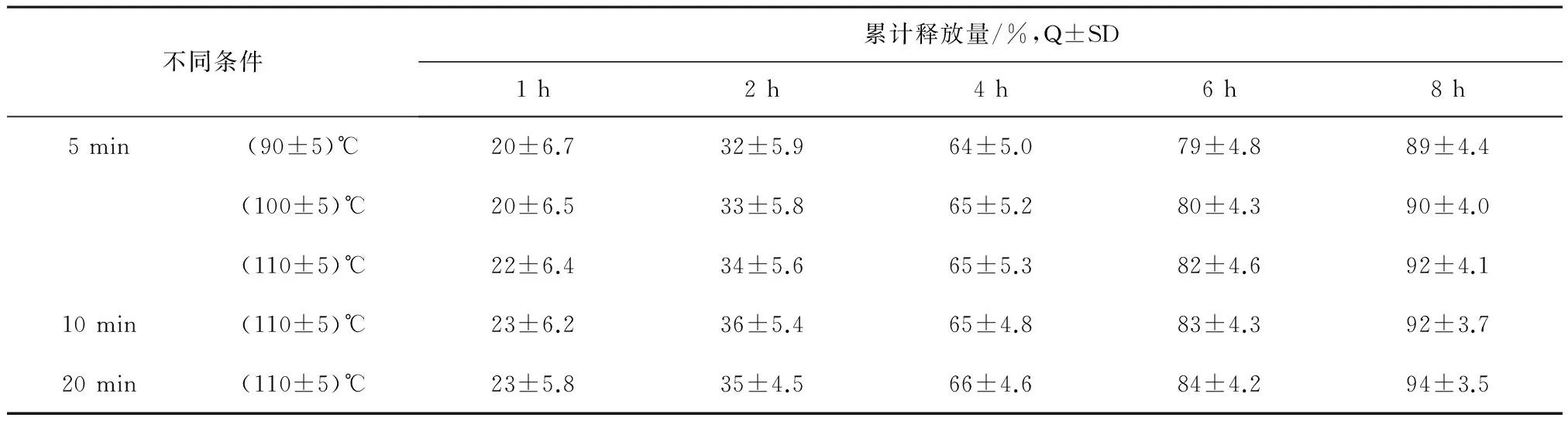
表7 熔化温度及保温时间对释放度影响(n=3)
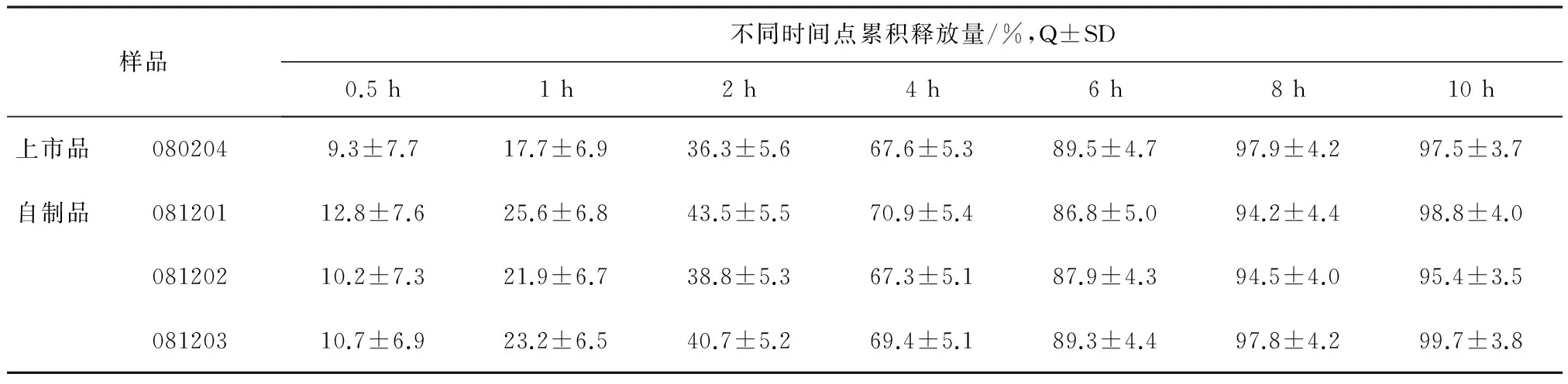
表8 上市品和自制品体外释放的比较(n=6)
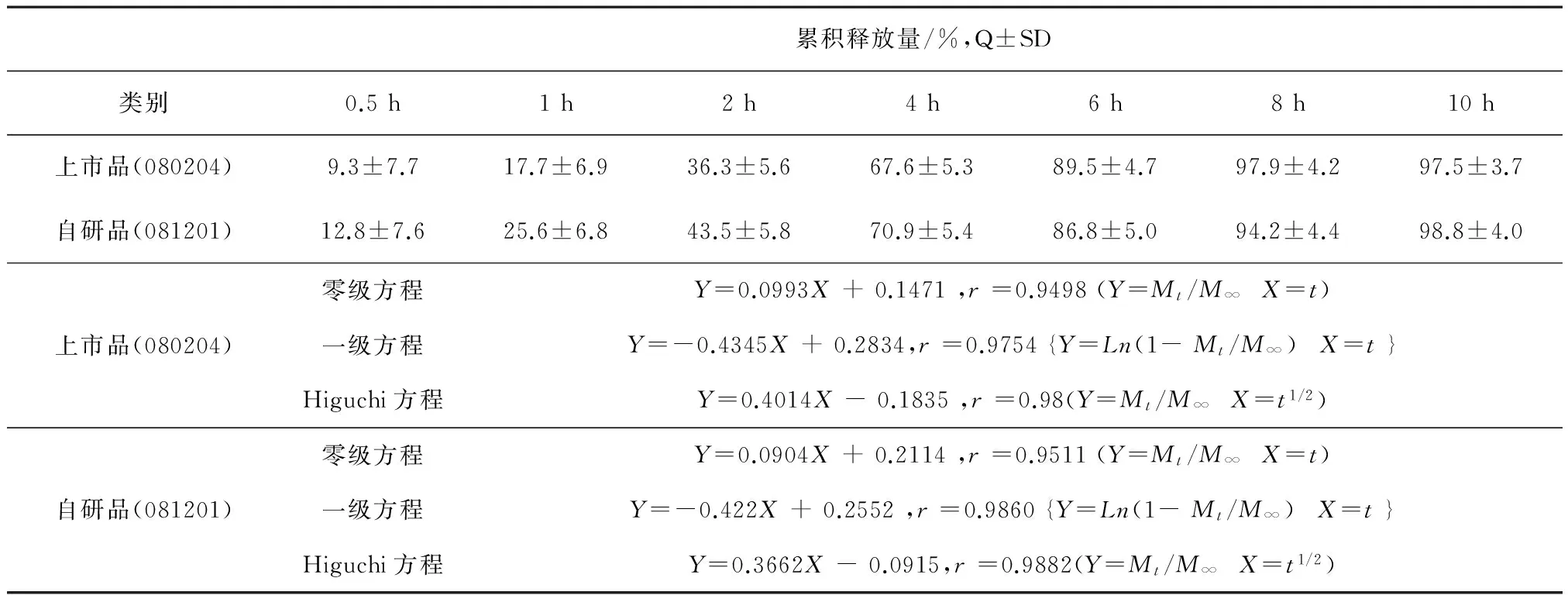
表9 释放曲线拟合(n=6)

图1 释放曲线
3.3释放曲线拟合见表9。从表9中看出:两者缓释制剂拟合曲线:均较近似一级方程和Higuchi方程,最适合用Higuchi方程拟合该品体外溶出动力学曲线。
4讨论
熔融法制备非诺贝特缓释胶囊,对胶囊内容物颗粒大小要求较严格,物料的熔化温度及固化时间对释放度均有一定影响,制粒时不锈钢筛网较尼龙筛网制得颗粒更均匀,20~60目外的颗粒可采用二次熔融法整粒,便于提高有效颗粒收率。
释放度方法选择:由于非诺贝特在水中几乎不溶,而在有机溶剂三氯甲烷中极易溶,在丙酮或乙醚中溶解,在乙醇中略溶,在强酸或强碱溶液中不稳定,文献报道溶出介质如选用0.1 mol·L-1盐酸、pH8磷酸盐和15%的乙醇对非诺贝特分散体制备的咀嚼片(规格:100 mg)45 min溶出量不足1%,表明非诺贝特在其条件下不溶;选用不同浓度的表面活性剂十二烷基硫酸钠(0.25%、0.5%、1%、0.1 mol·L-1)时,其溶出量随浓度增大而增加(17.4%、56.6%、88.6%和91.6 %)[8]。因此通常的水、酸、碱和低浓度的十二烷基硫酸钠溶液作溶出介质不能满足本品(规格:250 mg)释放漏槽条件。另有文献报道非诺贝特缓释包衣微丸在4种不同pH值(配制十二烷基硫酸钠溶液,用盐酸将其pH 分别调为1.2,5.0,6.8,7.4的溶液作为释放介质)的缓冲液中的释放速度基本相同,药物的释放不受pH 值影响,表明非诺贝特溶解度和溶出速度受十二烷基硫酸钠溶液浓度影响较大[9]。故本品在参考相关文献基础上,以上市制剂的部版标准[WS1-(X-223)-2003Z]中高浓度的表面活性剂十二烷基硫酸钠的相应溶液作溶出介质进行相关研究。
参考文献
[1]福赫尼实验室股份有限公司.具有高生物利用率的非诺贝特药物组合物及其制备方法:中国,1243438A[P].1998-01-06.
[2]埃迪克埃迪法姆药品实验室.含有非诺贝特的药物组合物及其制备方法:中国,1682707A[P].2004-10-01.
[3]特瓦制药工业有限公司.含有非诺贝特和表面活性剂混合物的制剂:中国,101217951A[P].2006-01-12.
[4]李芳,俸灵林,阎超.非诺贝特制剂研究进展[J].世界临床药物,2011,32(9):552-557.
[5]张晶晶,王少平.熔融法制备非诺贝特固体分散体及体外溶出研究[J].药学与临床研究,2014,22(2):109-111.
[6]郑杨,张志丽,王立红,等.非诺贝特固体分散体制备工艺研究及比较[J].中国药剂学杂志,2012,10(2):26-34.
[7]国家食品药品监督管理局.国家药品标准:非诺贝特缓释胶囊[WS1-(X-223)-2003Z].
[8]杨仲文,代东梅,程天贵,等.非诺贝特咀嚼片的溶出度考察[J].中国医院药学杂志,2005,25(6):530-532.
[9]关世侠,杨民,李海刚,等.非诺贝特缓释微丸的制备及释放度研究[J].中国医院药学杂志,2008,28(9):712-715.
Formulation and preparation process investigation on fenofibrate sustain-released capsule prepared by melting method
FU Xing-di
(AnhuiXianqiuPharmaceuticalCo.Ltd,Langxi,Anhui242131,China)
Abstract:ObjectiveAdopt solid dispersion technique with melting method to replace micropellets-capsule method in preparation of fenofibrate sustain-released capsule.MethodsPrepare sustain-released granules with active pharmaceutical ingredient(API) and excipients by melting method,and seal above granules in capsules.Using imported drugs as reference,conduct study vitro-release of self-made sustain-released capsule under the drug-release test conditions in quality standards enacted by SFDA.ResultsThe dissolution rate of self-made fenofibrate sustain-released capsule is basically the same as that of imported one.ConclusionThe preparation of fenofibrate sustain-released capsule by solid dispersion techniques with melting method is technologically accessible,and could be widely adopted in industrial manufacture.
Key words:Fenofibrate;Delayed-Action Preparations;Technology,Pharmaceutical;Solid dispersion technique
doi:10.3969/j.issn.1009-6469.2016.05.010
(收稿日期:2016-02-12,修回日期:2016-04-05)
