cAMP信号通路对根尖乳头干细胞增殖的影响
2016-06-27朱永娜苏圣哲
朱永娜,张 菁,苏圣哲,李 颂
(安徽医科大学口腔医学院 安徽医科大学附属口腔医院 安徽省口腔疾病研究中心实验室,安徽 合肥 230032)
◇临床医学◇
cAMP信号通路对根尖乳头干细胞增殖的影响
朱永娜,张菁,苏圣哲,李颂
(安徽医科大学口腔医学院 安徽医科大学附属口腔医院 安徽省口腔疾病研究中心实验室,安徽 合肥230032)
摘要:目的 探讨cAMP信号通路对根尖乳头干细胞(SCAP)增殖、迁移的影响。方法 酶消化法培养细胞;矿化诱导液和成脂诱导液诱导细胞后,茜素红和油红O染色鉴定细胞多分化潜能;分别用不同浓度的cAMP信号通路激活剂Forskolin和抑制剂H-89处理细胞;MTT和划痕实验检测各组细胞的增殖能力及迁移能力。结果 矿化和成脂诱导液分别诱导SCAP后,茜素红和油红O染色显示有钙盐沉积及脂滴形成。低浓度的Forskolin(2.5 μmol·L-1)促进细胞增殖,高浓度的Forskolin(10 μmol·L-1,20 μmol·L-1)则发挥相反作用。用低浓度H-89(5 μmol·L-1,10 μmol·L-1)抑制cAMP信号后,SCAP的增殖能力增加,而高浓度H-89(20 μmol·L-1)在MTT第3天时促进细胞增殖,第5天和第7天时抑制该细胞增殖。迁移结果显示高浓度Forskolin(10 μmol·L-1,20 μmol·L-1)抑制SCAP的迁移,而H-89( 5 μmol·L-1,10 μmol·L-1)促进该细胞的迁移。结论 cAMP信号通路对根尖乳头干细胞增殖、迁移有一定的调节作用。
关键词:牙乳头;间质干细胞;3′,5′-环AMP磷酸二酯酶类;信号传导
根尖乳头干细胞是2006年学者发现的一种新的成体间充质干细胞。2008年学者报道切除小型猪的根尖乳头后,牙根发育受限[1]。2014印度学者报道,把根尖乳头干细胞(Stem cell from the apical papilla,SCAP)移植到牙根未完全发育伴根尖炎的患牙根管内后,患牙根尖病损愈合同时牙根继续发育[2];另外文献报道一些因素如NFIC可以通过影响SCAP而影响牙根发育[3-4]。以上表明SCAP可以调节牙根发育。自我更新能力是干细胞的一个重要特征。作为一种新的干细胞,SCAP自我更新能力即增殖、迁移能力较牙髓干细胞和牙周膜干细胞强[5-6]。但是影响SCAP增殖、迁移的因素还不清楚。而信号通路对细胞的增殖、迁移有一定的调节作用。目前关于调节SCAP增殖、迁移的相关信号通路的报道较少。
细胞外刺激如甲状旁腺激素、肾上腺素等激活细胞内的cAMP(Cyclic adenosine monophosphate),后者作用于其受体即环磷腺苷酸依赖的蛋白激酶(protein kinase A),然后活化的PKA激活下游信号分子,从而发挥该信号通路对细胞的调节作用[7-8]。该信号通路分布于多种细胞中,同时本课题前期研究表明SCAP中也存在该信号通路[8-9]。cAMP信号通路能够调节多种细胞的增殖、迁移,如胚胎干细胞、血管平滑肌细胞和乳腺癌细胞等[10-12]。cAMP信号还参与其他信号对细胞的调节,如NF-κB(nuclear factor-kappa B)等。而NF-KB又调节SCAP的增殖、迁移[13-14]。因此我们推测cAMP信号对SCAP的增殖、迁移也有一定的调节。但是还未见cAMP信号调节SCAP增殖、迁移的相关报道。因此本课题探讨体外条件下cAMP信号通路对SCAP增殖、迁移的影响。
1 材料与方法
1.1 主要仪器和试剂细胞培养板(Corning-Costar,美国);CO2培养箱(Thermo,美国);超净工作台(苏州净化设备有限公司);倒置相差显微镜及照相系统(DMI3000B,Leica,日本);紫外分光光度仪(Shimadzu,日本);摇床(上海智城)。α-MEM 培养基、胎牛血清(Gibico,美国);I型胶原酶,Dispase酶,DMSO,MTT, Forskolin,H-89(Sigma,美国);茜素红,油红O(sigma,美国)。
1.2方法
1.2.1SCAP的分离培养经患者同意,收集安徽医科大学附属口腔医院14 ~ 18岁患者因正畸或阻生需要拔除的牙根发育未超过根长2/3的健康第三磨牙。分离根尖软组织,3 g·L-1I型胶原酶和4 g·L-1Dispase酶消化细胞,用20% FBS的α-MEM培养原代细胞[3]。 传代后培养液FBS调整为10%。
1.2.2SCAP的鉴定取生长状态良好的第3代细胞,以1×105个/孔接种于6孔板。然后按照张菁等[6]人方法分别诱导细胞向成脂细胞及成骨细胞分化,然后油红O和茜素红染色鉴定细胞分化能力。
1.2.3cAMP对细胞增殖的影响取生长状态良好的第3代SCAP,以4×103/孔种96孔板,FBS调整为2%。待细胞贴壁后饥饿24 h。然后更换含不同浓度的激活剂Forskolin(2.5,10,20 μmol·L-1)和抑制剂H-89(5,10,20 μmol·L-1)培养液,同时设立对照组,每组设立5个复孔。然后参照陈娜等[15]方法于1、3、5、7 d MTT测各组细胞的增殖情况。实验重复3次。
1.2.4cAMP对细胞迁移的影响取生长状态良好的第3代SCAP,以2×105/孔种6孔板。待细胞融合至孔底的40%时饥饿24 h。然后更换含不同浓度的Forskolin(10、20 μmol·L-1)和H-89(5、10 μmol·L-1)培养液,同时设立对照组。待细胞融合至孔底的90%时,用200 μL的枪头于孔底划痕。然后在划痕的0、10、20 h镜下拍照,测量划痕处无细胞区的宽度。实验重复3次。
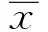
2结果
2.1 SCAP的分离培养培养3~6 d时镜下可见游离出的梭形原代细胞。待原代细胞融合至孔底的80%时,按1∶3传代。
2.2SCAP的鉴定用成脂条件培养液培养细胞五周后,油红O染色见脂滴形成如图1(A)。另外该细胞矿化诱导2周后茜素红染色,发现钙盐沉积如图1(B)。

图1SCAP的鉴定
2.3cAMP对细胞增殖的影响与对照组相比,用2.5 μmol·L-1的Forskoin刺激SCAP,该细胞增殖能力强,而当Forskoin浓度为10、20 μmol·L-1时则该细胞的增殖能力减弱。用 5、 10 μmol·L-1的H-89处理SCAP后,该细胞增殖能力增强。而用20 μmol·L-1的H-89处理SCAP后,在MTT第3天时促进该细胞增殖,在第5天及第7天时抑制细胞的增殖如图2。
2.4cAMP对细胞迁移的影响与对照组相比,用10、20 μmol·L-1的Forskoin处理SCAP后,该细胞的迁移能力降低。5、10 μmol·L-1的H-89处理SCAP后,该细胞迁移能力提高如图3。迁移率 = (原划痕宽度 - 现划痕宽度) / 原划痕宽度 × 100%。实验重复3次。

注:CON为对照组,FOR2.5是Forskolin2.5 μmol·L-1,For10是Forskolin 10 μmol·L-1,For20是Forskolin 20 μmol·L-1,H-5是H-89 5 μmol·L-1,H-10是H-89 10μmol·L-1,H-20是H-89 20 μmol·L-1(*P<0.05,**P<0.01)。
图2cAMP信号通路对SCAP增值的影响
3讨论
学者发现作为牙组织工程中新的种子细胞,SCAP增殖及迁移能力较强[5-6]。但是调节SCAP增殖和迁移的机制还不太清楚。信号通路是影响干细胞增殖的因素之一[14]。作为一种常见的信号通路,cAMP不仅调节干细胞的分化也能调节干细胞的增殖[14,16]。本课题组前期研究cAMP信号通路影响SCAP的分化,但cAMP是否对SCAP的增殖、迁移有一定的影响尚不清楚。本课题研究cAMP对SCAP增殖、迁移的影响,可以为SCAP在牙组织工程学中的应用提供理论基础。
Forskolin是cAMP信号的的激活剂,通过提高细胞内的cAMP水平激活该信号通路[17]。本实验发现用低浓度的Forskolin(2.5 μmol·L-1)处理SCAP后,SCAP的增殖能力增强。而用高浓度的Forskolin(10 、20 μmol·L-1)处理SCAP后,该细胞的增殖能力减弱。2008年文献报道激活骨髓间充质细胞内的cAMP后,影响该细胞的增殖,并且低浓度激活剂促进细胞增殖,而当激活剂浓度较高时则发挥相反作用[14]。本实验发现cAMP低浓度激活剂促进SCAP增殖,而高浓度激活剂抑制该细胞增殖,与文献报道一致。PKA是cAMP的下游信号,由调节亚基和催化亚基组成,主要有PKAⅠ和PKAⅡ两种类型[18]。细胞外信号激活细胞内的cAMP,活化的cAMP激活下游的PKAⅠ和PKAⅡ,当活化的PKAⅠ和PKAⅡ水平不同时,对细胞的调节作用不同[18]。在间充质干细胞内PKAⅠ活化水平高时抑制该细胞增殖,而当PKAⅡ活化水平较高时促进细胞增殖[14]。本实验中不同浓度的Forskolin对SCAP增殖的调节作用不同,可能因为不同浓度的Forskolin处理SCAP后,对细胞内PKAⅠ和PKAⅡ活化水平不同。另外本实验发现用Forskolin(10、20 μmol·L-1)处理SCAP后,细胞的迁移能力降低。2015年文献报道用10 μmol·L-1的Forskolin激活黑色素瘤细胞内的cAMP信号通路后,抑制了该细胞则迁移[19]。该报道与本研究结果一致。
H-89通过抑制PKA,抑制cAMP信号通路。用5、10 μmol·L-1的H-89处理SCAP后,促进SCAP的增殖,当用20 μmol·L-1的H-89处理SCAP,随着时间增加,细胞增殖能力减弱。H-89对SCAP增殖的调节有一定的浓度依赖性及时间依赖性。在血管平滑肌细胞中,用PKA抑制剂处理该细胞后,促进血管平滑肌细胞的增殖,与本实验结果一致[20]。H-89抑制抑制SCAP内的cAMP信号后,该细胞的迁移能力增强。
本研究发现用cAMP信号通路激活剂及抑制剂处理SCAP后,影响该细胞的增殖、迁移,表明cAMP信号对该细胞的增殖、迁移有一定的调节作用。2014年文献报道用TGF-β(transforming growth factor beta)刺激SCAP后,该细胞的增殖能力下降,TGF-β调节SCAP的增殖[21]。2015年有学者报道在肾细胞中cAMP可以促进TGF-β的表达,当细胞内的TGF-β表达升高时,又可以抑制cAMP对其的调节。cAMP信号通路对TGF-β的表达有一定的调节作用[22]。cAMP信号通路参与NF-κB信号的调节,后者对细胞的增殖、迁移又有一定的影响[11,13,23]。cAMP信号通路在调节SCAP的增殖,迁移时,可能与TGF-β、NF-κB有关,但是还需要进一步的研究证明。


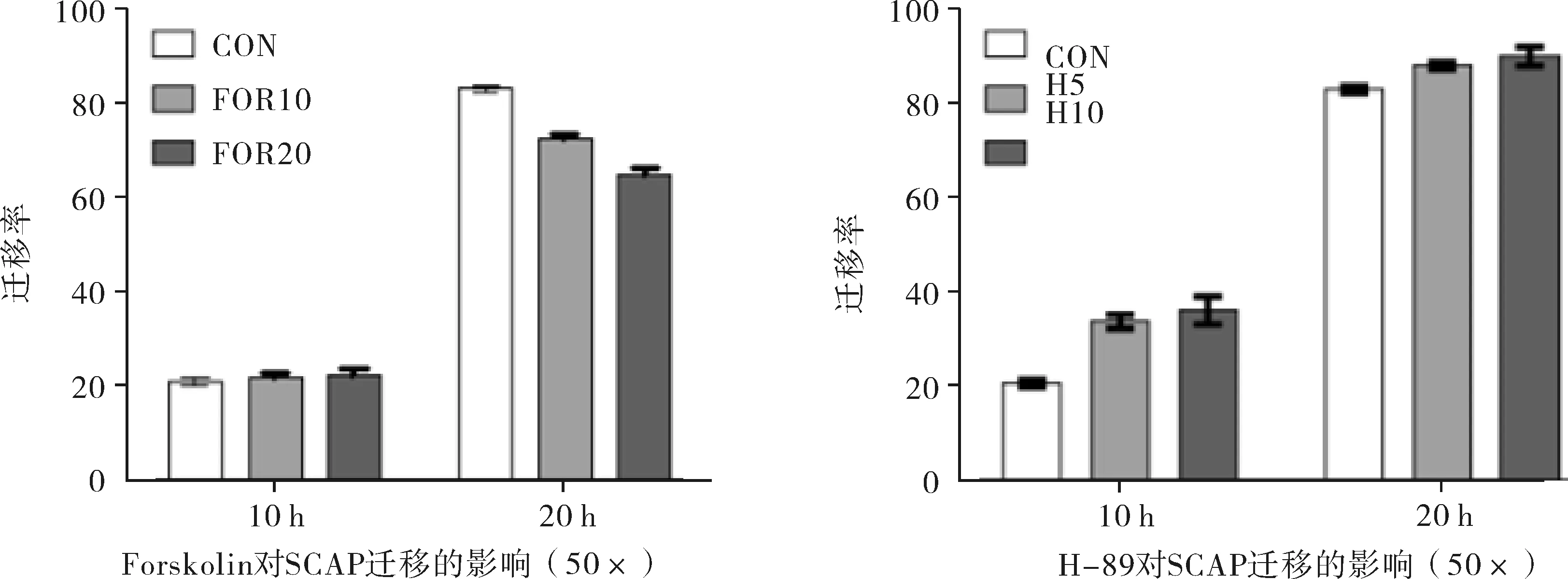
注:CON是对照组,FOR10是Forskolin 10 μmol·L-1,FOR20是Forskolin 20 μmol·L-1,H5是H-89 5 μmol·L-1,H10是H-89 10 μmol·L-1。
图3cAMP信号对SCAP迁移的影响
4结论
体外条件下,作为cAMP信号通路的激活剂及抑制剂,Forskolin和H-89影响SCAP的增殖和迁移,表明cAMP信号通路对的SCAP增殖、迁移有一定的调节作用,但是其具体机制还需要进一步的研究。
参考文献
[1]Huang GT,Sonoyama W,Liu H,et al.The hidden treasure in apical papilla: the potential role in pulp/dentin regeneration and bioroot engineering[J].J Endod,2008,34(6): 645-651.
[2]Vahab Shiehzadeh,Farhad Aghmasheh,Farideh Shiehzadeh,et al.Healing of large periapical lesions following delivery of dental stem cells with an injectable scaffold: New method and three case reports[J].Indian Journal of Dental Research,2014,25(2): 248-253.
[3]Zhang J,Wang ZH,Jiang Y,et al.Nuclear Factor I-C promotes proliferation and differentiation of apical papilla-derived human stem cells in vitro[J].Exp Cell Res,2015,332(2): 259-266.
[4]Park JC,Herr Y,Kim HJ,et al.Nfic gene disruption inhibits differentiation of odontoblasts responsible for root formation and results in formation of short and abnormal roots in mice[J].J Periodontol,2007,78(9): 1795-1802.
[5]Bakopoulou A,Leyhausen G,Volk J,et al.Comparative analysis of in vitro osteo/odontogenic differentiation potential of human dental pulp stem cells (DPSCs) and stem cells from the apical papilla (SCAP)[J].Arch Oral Biol,2011,56(7): 709-721.
[6]Chen E,Xiong HC,Huang YB,et al.Comparative analysis of in vitro periodontal characteristics of stem cells from apical papilla (SCAP) and periodontal ligament stem cells (PDLSCs)[J].Arch Oral Biol,2013,58(8): 997-1000.
[7]Ouyang H,Franceschi RT,McCauley L.Et al.Parathyroid hormone-related protein down-regulates bone sialoprotein gene expression in cementoblasts: role of the protein kinase A pathway[J].Endocrinology,2000,141(12): 4671-4680.
[8]Takuya Uemura,Yoichi Ohta,Yoshihiro Nakao,et al.Epinephrine accelerates osteoblastic differentiation by enhancing bone morphogenetic protein signaling through a cAMP/protein kinase A signaling pathway[J].Bone,2010,47(4): 756-765 .
[9]Rogne M,Taskén K.Compartmentalization of cAMP signaling in adipogenesis,lipogenesis and lipolysis[J].Horm Metab Res,2014,46(12): 833-840.
[10] Richard C Hewer,Graciela B Sala-Newby,Yih-Jer Wu,et al.Pka and epac synergistically inhibit smooth muscle cell proliferation[J].J Mol Cell,2011,50(1): 87-98.
[11] Mi Ok Kim a,Yu Jin Lee a,Jae Hong Park,et al.PKA and cAMP stimulate proliferation of mouse embryonic stem cells by elevating GLUT1 expression mediated by the NF-κB and CREB/CBP signaling pathways[J].Biochim Biophys Acta,2012,1820(10):1636-1646.
[12] Hongli Dong,Kevin P Claffey,Stefan Brocke,etal.Inhibition of breast cancer cell migration by activation of cAMP Signaling[J].Breast Cancer Res Treat,2015,152(1): 17-28.
[13] Li JJ,Yan M,Wang Zl,et al.Effects of canonical NF-κB signaling pathway on the proliferation and odonto/osteogenic differentiation of human stem cells from apical papilla[J].BioMed Research International,2014,76(5):491-498.
[14] Kleiveland CR,Kassem M,Lea T.Human mesenchymal stem cell proliferation is regulated by PGE2 through differential activation of cAMP-dependent protein kinase isoforms[J].Exp Cell Res,2008,314(8): 1831-1838.
[15] 陈娜,徐细明.氯化轧对胃癌MGC-803细胞增殖及凋亡的影响[J].安徽医药,2015,19(9):1806-1808.
[16] Jung MK,Jin SC,Yun HK,et al.An activator of the cAMP/PKA/CREB pathway promotes osteogenesis from human mesenchymal stem cells[J].Cell Physiol,2013,228(3): 617-626.
[17] Fu SP,Wang W,Liu BR,et al.β-Hydroxybutyric sodium salt inhibition of growth hormone and prolactin secretion via the cAMP/PKA/CREB and AMPK signaling pathways in dairy cow anterior pituitary cells[J].Int J Mol Sci,2015,16(2): 4265-4280.
[18] Kopperud R,Krakstad C,Dskeland SO,et al.cAMP effector mechanisms.Novel twists to an old signaling system[J].Febs Lett,2003,546(1): 121-126.
[19] Wnorowski A,Sadowska M,Paul RK,et al.Activation of β2-adrenergic receptor by (R,R')-4'-methoxy-1-naphthylfenoterol inhibits proliferation and motility of melanoma cells[J].Cell Signal,2015,27(5): 997-1007.
[20] Ndolfi C,Avvedimento EV,Di Lorenzo E,et al.Activation of cAMP-PKA signaling in vivo inhibits smooth muscle cell proliferation induced by vascular injury[J].Nat Med,1997,3(7): 775-779.
[21] He W,Zhang J,Niu Z,et al.Regulatory interplay between NFIC and TGF-β1 in apical papilla-derived stem cells[J] .J Dent Res,2014,93(5): 496-501.
[22] Weng L,Wang W,Su X,et al.The Effect of cAMP-PKA Activation on TGF-β1-Induced Profibrotic Signaling[J].Cell Physiol Biochem,2015,36(5): 1911-1927.
[23] Shabnam Zeighamy Alamdary,Hadi Digaleh,Fariba Khodagholi,et al.Dual Contradictory Effect of H-89 on Neuronal Retraction,Death and Inflammation in Differentiated PC12 Cells Subjected to Oxidative Stress[J].J Mol Neurosci,2013,51(3): 1030-1037.
The influence of cAMP signaling on proliferation of apical papilla stem cell
ZHU Yong-na,ZHANG Jing,SU Sheng-zhe,et al
(StomatologicHospital&College,AnhuiMedicalUniversity,KeyLaboratoryofOralDiseasesResearchofAnhuiProvince,Hefei,Anhui230032,China)
Abstract:Objective This study was designed to investigate the influence of the cAMP signaling on proliferation and migration of SCAP.Methods SCAP was cultured by Enzyme digestion method.After mineralization induction and adipogenic induction,the multiple differentiation potential of SCAP was identified by alizarin red staining and oil red O staining.SCAP was exposed to various concentrations of Forskolin and H-89 respectively.Cell proliferation ability and migration ability were checked by MTT assay and wound healing test.ResultsAfter mineralization induction and adipogenic induction,calcium deposition and lipid droplet were identified in SCAP by alizarin red staining and oil red O staining.Low concentration of Forskolin (2.5 μmol·L-1) promoted proliferation of SCAP,while high concentrations of Forskolin(10 μmol·L-1,20 μmol·L-1) inhibited proliferation of the cell.After inhibiting the signaling by H - 89 (5 μmol·L-1,10 μmol·L-1),the proliferation of SCAP was increased sharply.20 μmol·L-1H-89 promoted the proliferation of SCAP at the third day.However the proliferation of SCAP was inhibited at the fifth day and the seventh day by 20 μmol·L-1H-89.The SCAP stimulated by Forskolin(10 μmol/l,20 μmol·L-1) presented a lower migration capacity.While the SCAP stimulated by H - 89(5 μmol·L-1,10 μmol·L-1) exhibited an improved migration capacity.Conclusion The cAMP signaling can influence the proliferation and migration of SCAP.
Key words:Dental Papilla;Mesenchymal Stem Cells;3′,5′-Cyclic-AMP Phosphodiesterases;Signal Transduction
基金项目:安徽省自然科学基金资助项目(No 1408085QH178);安徽医科大学校科研基金资助项目(No 0401059101)
作者简介:朱永娜,女,硕士研究生 通信作者:李颂,女,主任医师,硕士生导师,研究方向:牙体牙髓病,E-mail:xlisong@sohu.com
doi:10.3969/j.issn.1009-6469.2016.05.016
(收稿日期:2015-11-18,修回日期:2016-01-27)
