高产色素红曲菌的筛选鉴定及其液态发酵条件优化
2016-06-27贾瑞博周文斌陈竟豪刘凯丽吕旭聪
贾瑞博,周文斌 ,陈竟豪,李 燕 ,刘凯丽 ,赵 慧,刘 斌 ,吕旭聪,3*
(1.国家菌草工程技术研究中心,福建 福州 350002; 2.福建农林大学食品科学学院,福建 福州 350002;3.阳光国际集团科技发展有限公司,福建 泉州 362000)
高产色素红曲菌的筛选鉴定及其液态发酵条件优化
贾瑞博1,2,周文斌1,2,陈竟豪2,李燕1,2,刘凯丽1,2,赵慧1,2,刘斌1,2,吕旭聪1,2,3*
(1.国家菌草工程技术研究中心,福建福州350002; 2.福建农林大学食品科学学院,福建福州350002;3.阳光国际集团科技发展有限公司,福建泉州362000)
摘要:从福建永春、安溪、古田、南平、三明、龙岩等地收集的红曲米中分离筛选得到了1株高产色素红曲菌L03,利用形态学和分子生物学的方法对其进行鉴定,结果表明为紫色红曲菌Monascus purpureus。同时通过单因素和正交优化试验确定了其最佳的液态发酵条件:以8%的甘油为碳源、1.5%蛋白胨为氮源、硫酸镁0.1%、磷酸二氢钾0.25%、接种量6%、发酵温度32℃、时间9 d、摇床转速180 r·min-1、250 mL容器中装液量100 mL,在此液态发酵条件下其总色价平均值为1 578 U·mL-1。
关键词:色素;红曲菌;筛选;鉴定;液态发酵;优化
红曲色素是红曲菌重要的次级代谢产物之一[1],具有抗氧化、抗疲劳、抑菌、增强免疫力、调节血压血脂等多重功能活性,是一种安全无毒的天然色素[2-3]。目前,红曲色素已被广泛应用于食品、医药及化工等领域[4],然而,红曲菌的产色素能力普遍偏低,这是限制红曲色素广泛应用的主要原因之一。国内外提高色素产量主要包括以下2种技术途径:第一,利用菌种筛选、诱变或基因工程技术选育高产色素的红曲菌菌株[5-8];第二,通过发酵条件的优化和控制提高红曲菌发酵液色价或达到高产某种色素的目的[9-10]。虽然通过诱变和基因工程的方法的确能提高色素的产量,但突变的机制不明确,突变位点难以控制,没有一定的方向性,因此工作量很大,而且不一定能保证效果,突变菌株也很可能再发生回复突变。基因工程方法所获得的菌株还需要进行安全性评估,所以通过基因改造获得的红曲色素产品作为天然食用色素的应用前景有着较大是局限性。
为此本研究从福建南平、三明、龙岩、古田等地收集的红曲米中分离纯化得到了20株红曲菌,以总色价为指标筛选得到1株高产色素菌株,并进一步利用形态学结合分子生物学方法进行菌种鉴定,并通过单因素和正交试验对碳源、氮源及发酵温度等3关键条件进行优化,确定该菌株的最佳液态发酵条件,为该红曲菌菌株的进一步开发利用提供技术支撑。
1材料与方法
1.1试验材料
1.1.1菌株从福建永春、安溪、古田、南平、三明、龙岩等地收集的红曲米中分离纯化得到20株红曲菌,编号L1~L20。
1.1.2培养基
(1)发酵培养基:量取甘油80 mL,豆粉10 g,硫酸镁1 g,磷酸二氢钾2.5 g,加去离子水溶解并定容至1 000 mL,取100 mL于250 mL锥形瓶分装,包扎,121℃灭菌20 min。
(2)菌种鉴定培养基[11]:麦芽汁琼脂培养基(Wa)、麦芽提取物琼脂培养基(MEA)、察氏酵母提取物琼脂培养基(CYA)、甘油硝酸盐琼脂培养基(G25N)、马铃薯葡萄糖琼脂培养基(PDA)。
1.1.3主要药品试剂和仪器 甘油、蛋白胨、酵母粉、硝酸钠、蔗糖、葡萄糖、α-乳糖、可溶性淀粉、七水硫酸镁,购于国药集团有限公司;酚∶氯仿∶异戊醇(25∶24∶1)、氯仿∶异戊醇(24∶1)、DNA Maker、Taq酶、goldview核酸染料、琼脂糖,购于上海生工生物工程有限公司。
超净工作台(苏州净化设备有限公司);THZ-C恒温振荡器(北京同正生物技术发展公司);高压灭菌锅(厦门精艺兴业科技有限公司);PCR仪T3(Thermocrcler Biometra);电泳仪(BIO-RAD公司);凝胶成像系统(SYNGENE GENEGENIUS);Nanodrop 2000(北京东林昌盛生物科技有限公司);分光光度计(上海精科仪器有限公司)。
1.2试验方法
1.2.1红曲菌的分离纯化 参考吴巧玉等[12]报道的高产淀粉红曲霉菌的分离纯化方法,从福建永春、安溪、古田、南平、三明、龙岩等地的红曲米中分离纯化得到20株红曲菌。
1.2.2高产色素红曲菌的筛选 将纯化得到的20株红曲菌株分别接种到发酵培养基中,32℃,180 r·min-1振荡培养6 d,参考童爱均等[13]的方法测定发酵液总色价。
1.2.3高产色素红曲菌的鉴定
(1)形态学观察:将纯化的高产色素菌采用点种法接种于Wa、PDA、MEA、CYA和G25N 5种培养基上。在25℃培养7 d,观察目标菌株在上述5中培养基上的菌落大小、边缘特征、颜色等。显微镜下观察菌丝形态、分生孢子、闭囊壳等显微形态特征,参照李忠庆等[14]的分类方法对筛选的红曲菌菌株进行分类鉴定。
(2)分子生物学鉴定:参照李钟庆等[14]的DNA提取方法提取高产色素菌总DNA,基因的扩增引物见表1,反应体系参照张颖慧等[15],PCR扩增程序为:95℃ 5 min,94℃ 40 s,52℃ 40 s,72℃ 90 s,35个循环,72℃ 10 min,4℃ 1 h。利用1.5%的琼脂糖凝胶电泳检测扩增结果,并将所得的PCR产物送往上海生工生物工程有限公司经纯化后,在ABI-PRISM3730型DNA自动测序仪上进行直接双向测序,测序结果采用美国国家生物技术信息中心NCBI(National Center for Biotechnology Information)提供的比对搜索程序BLAST(Basic Local Alignment Search Tool)与GeneBank数据库中的序列进行相似性分析。

表1 引物名称及序列
1.2.4高产色素红曲菌液态发酵条件优化
(1)单因素试验:①不同碳源对色素产量的影响:选择甘油、蔗糖、可溶性淀粉、大米粉、燕麦粉、α-乳糖6种碳源,添加量为6%,1%大豆粉为氮源,0.1%的硫酸镁,0.25%的磷酸二氢钾,在250 mL锥形瓶中装液量100 mL,接种量为5%,转速 180 r·min-1,32℃条件下培养10 d,参考童爱均等[13]的方法测定发酵液总色价;②不同氮源对色素产量的影响:选择蛋白胨、大豆粉、酵母粉、硝酸钠、硝酸铵等6 种不同氮源,添加量 1.0%,6%甘油为碳源,0.1%的硫酸镁,0.25%的磷酸二氢钾,在250 mL锥形瓶中装液量100 mL,接种量为5%,转速 180 r·min-1,32℃ 条件下培养10 d,参考童爱均等[13]的方法测定发酵液总色价;③不同温度对色素产量的影响:以6%甘油为碳源,1%大豆粉为氮源,0.1%的硫酸镁,0.25%的磷酸二氢钾,在250 mL锥形瓶中装液量为100 mL,接种量为5%,转速 180 r·min-1,培养时间为10 d,考察不同温度(26、28、30、32、34、36℃)对色素产量的影响。
(2)正交优化试验: 在单因素试验的基础上,选取甘油添加量、蛋白胨添加量、温度3个因素,以发酵液总色价为指标,进行三因素三水平的正交优化试验,因素水平表见表2。
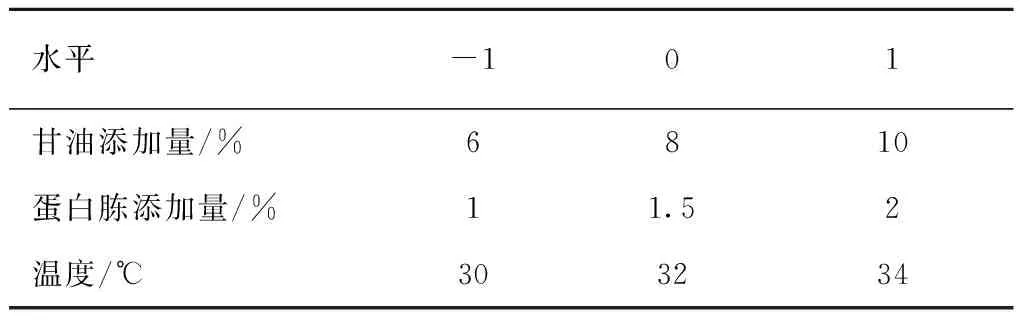
表2 正交试验的因素和水平
1.3数据统计
采用SPSS软件对数据进行方差分析,采用Design Expert软件进行正交试验设计与分析处理。
2结果与分析
2.1产高色素红曲菌的筛选
将分离得到的20株菌株接种到发酵培养基中,32℃,180 r·min-1振荡培养6d后,测定发酵液总色价,结果如图1所示。不同的红曲菌菌株的产色素能力差异显著,大多数产色能力较弱,总色价不超过1 000 U·mL-1。菌株L03、L13、L16产色能力较强,总色价分别为1 190、1 090、1 037 U·mL-1。平行试验发现,L03相对L13及L16而言,产色能力更稳定。所以本研究选取产色能力最强的菌株L03进行深入研究。
2.2菌株形态观察
红曲菌L03于Wa、PDA、MEA、CYA和G25N等5种培养基上,25℃培养7 d的菌落大小、边缘特征、颜色等见表3。根据菌株在不同培养基上的菌落特征和菌落直径,参照李忠庆等[14]的分类方法,初步推断L03可能为紫色红曲菌。

表3 菌株L03的菌落特征
2.3光学显微镜观察
红曲菌的菌落形态主要包括三方面:菌丝、有性生殖、无性生殖。红曲菌的菌丝有的无色透明,有的含深浅不同的红色色素,有的含深浅不同是褐色色素,含有横隔,是多细胞构造,具有不规则的分枝,菌丝之间常出现网结联合现象(图2-A)。红曲菌在有性生殖的过程中产生球状的闭囊壳(图2-B),其过程首先是在菌丝或侧枝的顶端形成一个多核的雄器,随后在雄器下面的细胞再长出雌性器官,最后两性器官周围生出的许多缠绕在一起的菌丝将二者包围,形成的闭囊壳。成熟之后的闭囊壳外壁很薄,一般只有一两层细胞,无孔口,内含有大量的子囊孢子,闭囊壳破裂后会将其散出,萌发后形成多核的菌丝体。红曲菌在无性生殖的过程中产生分生孢子(图2-C)。一般着生在菌丝或侧枝小梗的顶端,单生或者以向基式形成链。分生孢子是单细胞,多核,球形或倒梨形,通常透明或含少量色素。
2.4菌株的分子生物学鉴定
菌株L03的DNA提取结果如图3-A所示,利用Nanodrop 2000测定L03的DNA质量浓度为510 ng·μL-1,由于PCR扩增要求DNA质量浓度在30~50 ng·μL-1,所以需用双蒸水稀释至要求的浓度。4对引物的PCR 扩增产物电泳结果显示(图3-B)不同的引物扩增得到的产物片段大小不同,ITS1/ITS4、ITS4/ITS5和NL1/LS2三对引物扩增片段大小为600~800 bp,扩增片段条带单一,说明引物扩增效果较好;β-tubulin-F/β-tubulin-R扩增片段大小为1 000~1 500 bp,所有扩增出的条带均清晰、明亮,说明PCR扩增程序合适,可用于序列的测定。
用NCBI提供的比对搜索程序BLAST与GeneBank数据库中的序列进行相似性分析,从每对引物的比对结果中选择相似度≥99%的菌株进行分析(表4).引物ITS1/ITS4的PCR扩增比对结果的相似性最高的3株,分别为红色红曲菌、紫色红曲菌、 高粱红曲菌;引物ITS4/ITS5的PCR扩增比对结果的相似性最高的4株,分别为红色红曲菌、紫色红曲菌、 高粱红曲菌、橙色红曲菌;引物NL1/LS2的PCR扩增比对结果的相似性最高的4株,分别为红色红曲菌、紫色红曲菌、 旱生红曲菌、红曲菌属,L03与这些菌株的相似度都达到99%,所以无法从比对结果中断定L03的分类学地位;而β-tubulin-F/β-tubulin-R的PCR扩增比对结果的相似性最高的6株均为紫色红曲菌,L03与其相似度达到99%,结合不同DNA区域序列的鉴定结果,可以确定本试验的目标菌株L03即是紫色红曲菌,这与形态学鉴定结果一致。
2.5高产色素红曲菌液态发酵条件优化
2.5.1不同碳源对菌株L03色素产量的影响 甘油、蔗糖、燕麦粉、米粉等碳源比较适合菌株L03产色素,其中以甘油处理的色素含量最高,达到1 113 U·mL-1(图4),其颜色呈深紫红色;以蔗糖、燕麦粉和米粉为碳源时颜色均呈紫红色,以可溶性淀粉为碳源时呈橘红色。但以α-乳糖作为碳源时呈橘黄色,菌丝生长缓慢,原因可能是L03不能有效的利用α-乳糖,也可能是α-乳糖对菌丝的生长有抑制作用。
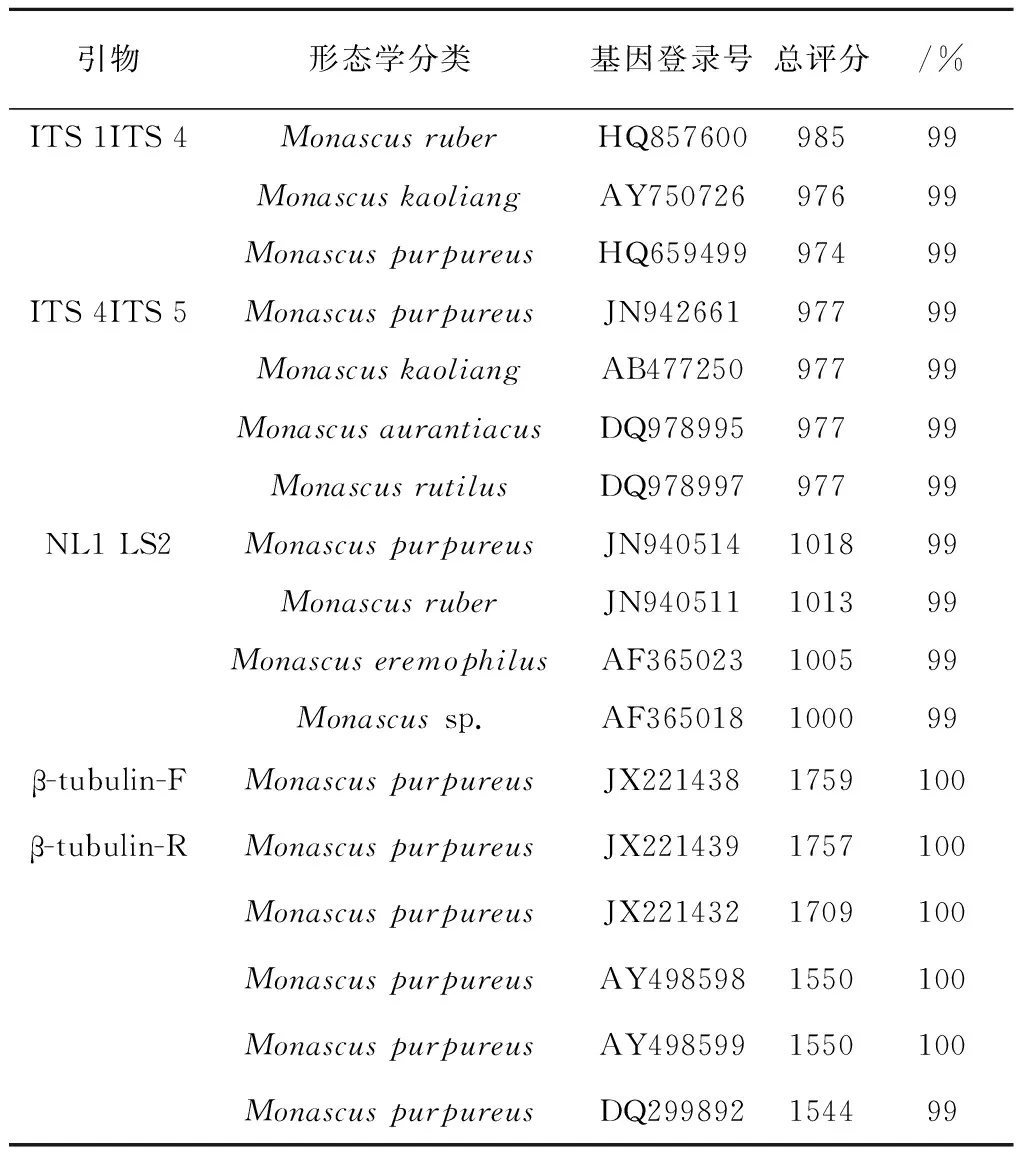
表4 菌株L03的PCR扩增测序结果的比对
2.5.2不同氮源对菌株L03色素产量的影响 在不同的氮源中,以蛋白胨为氮源的色价最高,达到了1 293 U·mL-1,硝酸钠、硝酸铵、硫酸铵作为氮源时菌丝生长缓慢,色价较低(图5)。不同的氮源条件下其发酵液的颜色差别也很明显,以蛋白胨为碳源时颜色呈深紫红色,以豆粉和酵母粉为氮源时呈紫红色,以硝酸钠为氮源时呈橘红色。
2.5.2不同温度对菌株L03色素产量的影响随着发酵温度的上升,菌株L03的产色能力逐渐增强,温度达到32℃时,发酵产物总色价达到1 020 U·mL-1。当温度超过32℃时,产色能力略有下降,因此选取32℃为菌株L03的最佳发酵温度。
2.6正交优化试验
从正价试验结果(表5)和方差分析结果(表6)可知,3个因素对L03液态发酵产色素的影响程度大小为:甘油添加量>蛋白胨添加量>发酵温度,其中,甘油添加量和蛋白胨添加量对总色价的影响达显著水平,而温度对其影响不显著。最优的组合方案是A2B2C2,即甘油的添加量8%、蛋白胨的添加量1.5%、发酵温度32℃。
2.7验证试验
通过优化试验确定了最优的液态发酵条件为:以8%的甘油为碳源、1.5%蛋白胨为氮源、0.1%的硫酸镁、0.25%的磷酸二氢钾、接种量6%、发酵温度32℃、时间9 d、转速180 r·min-1、在250 mL锥形瓶中装液量100 mL。在此液态发酵条件下进行3次稳定性验证试验,测得发酵液总色价平均值为1 578 U·mL-1。
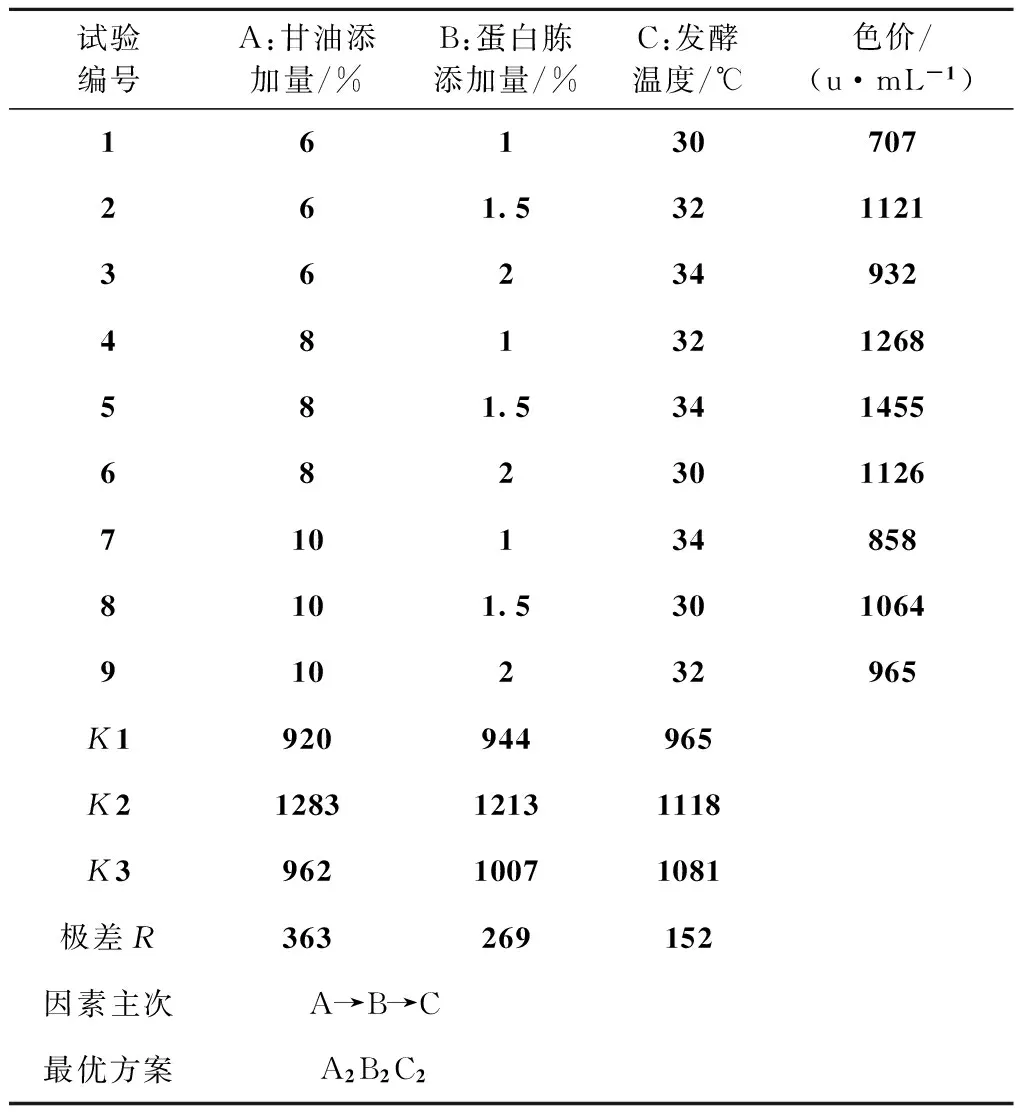
表5 正交试验结果
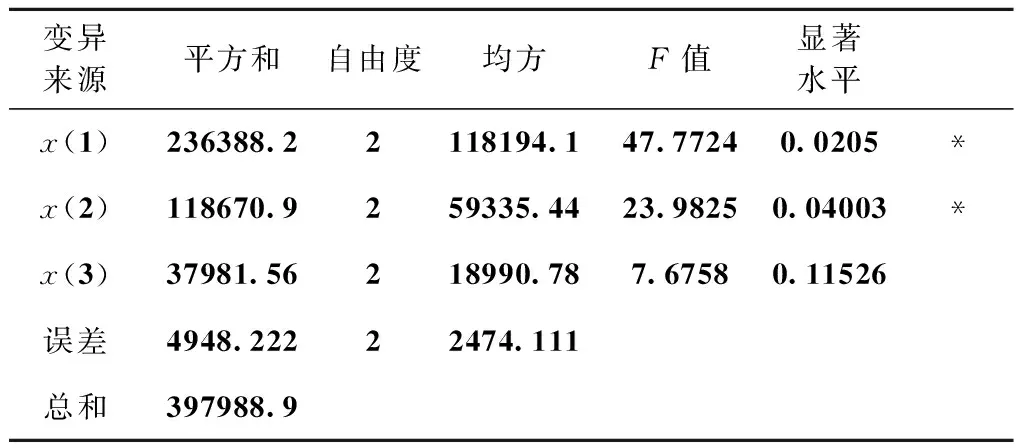
表6 方差分析
3讨论与结论
丝状真菌的分类通常是依据形态学和生理生化特征相结合的方法,但这类方法工作量大,相对繁琐,而且其准确性有待提高,况且不同学者的分类方法也不同,目前还没有一个确定统一的方法。近年来,随着分子生物学技术的快速发展,其应用也逐渐扩展到了红曲菌菌种鉴定等领域,但是,红曲菌的亲缘关系非常相似,仅凭借分子生物学的方法也很难将此类菌区分开,吕旭聪等[16]从福建红曲中分离得到了17种红曲菌,通过结合形态学和分子生物学的方法对其进行鉴定,取得了较理想的结果。
在红曲菌的形态鉴定方面以中科院微生物研究所李忠庆和郭芳的方法较为常用,其方法是依据红曲菌在不同培养基上的菌落特征、色泽、菌落直径等。而在分子鉴定方面,所选的DNA片段、引物对鉴定的结果影响较大,在具体鉴定的过程中,选择DNA片段及引物,应通过比较测序结果来确定。对于本试验的目标菌株L03来说,β-tubulin-F/β-tubulin-R是最适合的分子鉴定引物,其PCR扩增比对结果的相似性最高的10株均为紫色红曲菌Monascuspurpureus,L03与其相似度达到100%。
红曲菌液体发酵产色素的影响因素很多,如培养基的成分、水分含量、pH、发酵时间、温度、接种量、种龄、摇床转速等,发酵条件的不同会导致红曲菌产色素种类和产量的明显差异。其中,碳源和氮源是红曲菌生长的必需营养物质,两者的种类和含量会对发酵产生决定性影响。目前,在红曲菌发酵培养的过程中常见的碳源有:甘油、蔗糖、米粉等,常见氮源有:蛋白胨、豆粉、酵母粉等。Dikshit R等[21]的研究发现:以甘油为碳源时可促进色素的产生并提升红曲菌的生物量,添加甘油并不仅仅是能够提升培养基中的渗透压,还能作为一种重要的碳源参与红曲菌的代谢,这与本研究的结果一致。就氮源而言,大多数研究报道了无机氮源更有利于红曲菌株产色能力的提高,并且无机氮源相对有机氮源产的色素纯度更高,介于不同色素之间的杂色素成分较少[16-21]。但本研究的目标菌株L03的最佳氮源为蛋白胨,这可能是由于不同的菌种对氮源的要求和利用能力不一样造成的。
本研究以胞内外总色价为指标,从福建南平、三明、龙岩、古田等地的红曲米分离纯化得到的20株红曲菌中筛选得到了一株高产色素菌L03。利用形态学和分子生物学的方法对其进行鉴定,确定了该目标菌株为紫色红曲菌。并通过单因素和正交优化试验确定了其最佳的液态发酵条件:甘油的添加量8%、蛋白胨的添加量1.5%、0.1%的硫酸镁、0.25%的磷酸二氢钾、温度32℃、最适发酵时间9 d、转速180 r·min、接种量6%、在250mL锥形瓶中装液量100 mL。
参考文献:
[1]衣珊珊, 沈昌, 韩永斌, 等. 红曲色素形成机理及提高其色价的途径[J]. 食品科学, 2005, 26(7): 256-261.
[2]屈炯. 红曲色素组分分离及其功能的初步研究[D]. 华中农业大学, 2008.
[3]TREIBER L R, REAMER R A, ROONEY C S, et al. Origin of monacolin L from Aspergillus terreus cultures[J]. Journal of Antibiotics, 1989, 42(1): 30-36.
[4]贾波,周立平. 红曲菌研究之现状及发展前景[J]. 中国食品添加剂, 2002,(6): 32-35.
[5]吴巧玉, 莫一杰, 汪燕利, 等. 一株高产淀粉酶红曲霉菌株的分离鉴定及其培养特性研究[J]. 徐州工程学院学报:自然科学版, 2015,30(4):54-60.
[6]黄艳, 孟丽茹, 许赣荣, 等. 高产色素红曲菌的选育及摇瓶发酵培养基优化[J]. 中国食品添加剂, 2013,(6): 133-139.
[7]邹乐花, 李燕萍, 黄志兵, 等. 橙色红曲菌As3.4384 orf7基因缺失株的构建及其功能分析[J]. 中国生物工程杂志, 2011, 31(7):79-84.
[8]魏培莲, 秦红霞, 嘉晓勤. 红曲色素高产菌株的优选及其发酵条件优化[J]. 中国酿造, 2013, 32(3): 36-40.
[9]顾玉梅, 许赣荣, 陈蕴, 等. 红曲霉菌9903发酵工艺条件对色素及桔霉素生产的影响[J]. 无锡轻工大学学报, 2002, 21(1):43-47.
[10]邱鹏, 袁永俊, 豆剑伟, 等. 培养基成分对红曲色素发酵过程中生物量及色价的影响[J]. 广东化工, 2015, 42(1):9-11.
[11]倪莉, 吴智广, 张雯. 福建红曲中的红曲菌的生理生化特性研究[J].福州大学学报:自然科学版,2009,37(6): 929-934.
[12]吴巧玉, 莫一杰, 汪燕利, 等. 一株高产淀粉酶红曲霉菌株的分离鉴定及其培养特性研究[J]. 徐州工程学院学报:自然科学版, 2015,(4): 54-60.
[13]童爱均, 吕旭聪, 刘晓艳, 等. 固体发酵基质和外加碳氮源对红曲霉色素产量的影响[J]. 中国调味品, 2015, (5): 5-10.
[14]李钟庆, 郭芳. 红曲菌的形态与分类学[M]. 北京: 中国轻工业出版社, 2003.
[15]张颖慧,魏东盛,邢来君,等. 一种改进的丝状真菌 DNA 提取方法[J]. 微生物学通报. 2008, 35(3): 466-469.
[16]吕旭聪,翁星,韩妙坤,等. 福建红曲中红曲菌的分离鉴定及菌株特性研究. 中国食品学报, 2012, 12(2): 88-97.
[17]DIKSHIT R, TALLAPRAGADA P. Statistical optimization of pigment production by Monascus sanguineus under stress condition[J]. Preparative Biochemistry and Biotechnology, 2013, 44(1): 68-79.
[18]王贻莲, 扈进冬, 赵吉兴,等. 麦麸米糠混合发酵生产红曲色素条件的研究[J]. 山东科学, 2015, 28(6):121-126.
[19]侯敏, 王艳新, 唐帅,等. 不同碳源、氮源对红曲发酵产色素的影响[J]. 山西农业科学, 2015, 43(9):1119-1122.
[20]邱鹏, 袁永俊, 豆剑伟,等. 培养基成分对红曲色素发酵过程中生物量及色价的影响[J]. 广东化工, 2015, 42(1): 9-11.
[21]郭红珍, 王秋芬, 马立芝. 液态发酵产红曲色素的研究[J]. 食品工业科技, 2008, 29(3):154-156.
(责任编辑:黄爱萍)
Screening and Identifying a High Pigment-producingMonacusStrain, and Optimizing Its Liquid Fermentation
JIA Rui-bo1,2,ZHOU Wen-bin1,2,CHEN Jing-hao2,LI Yan1,2,LIU Kai-li1,2,ZHAO Hui1,2,LIU Bin1,2,LÜ Xu-cong1,2,3*
(1.NationalEngineeringResearchCenterofJUNCAOTechnology,Fuzhou,Fujian350002,China;2.CollegeofFoodScience,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China;3.SunshineInternationalGroupTechnologyDevelopmentCO.,Quanzhou,Fujian362000,China)
Abstract:The Monascus strain, L03, was isolated from the red kojic rice samples collected from Yongchun, Anxi, Gutian, Nanping, Sanming, and Longyan in Fujian for its high red-pigment-producing ability. Based on the morphology and molecular biology of L03, it was identified to be M. purpureus. Subsequently, single factor and orthogonal experiments were conducted to optimize the conditions for the liquid fermentation of the yeast. Color of the fermented suspension reached 1,578 U/mL when the yeast was inoculated 6% by weight into a liquid medium consisting of 8% of glycerol, 1.5 % of peptone, 0.1% of Mg2SO4, and 0.25% of KH2PO4 in a loading volume of 100 mL/250 mL and incubated at 32℃ with constant agitation at the speed of 180 rpm for 9 days.
Key words:red pigment; Monascus; selection; identification; liquid fermentation; optimization
收稿日期:2015-12-12初稿;2016-02-14修改稿
作者简介:贾瑞博(1991-),男,在读硕士生,研究方向:食品生物技术(E-mail:13044599915@163.com) *通讯作者:吕旭聪(1984-),男,助理研究员,博士,研究方向:食品生物技术(E-mail:xucong1154@qq.com)
基金项目:中国博士后科学基金项目(2015M570549);福建省教育厅科技计划项目A类课题(JA14107);福建省自然科学基金项目(2016J01095)
中图分类号:S 646
文献标识码:A
文章编号:1008-0384(2016)04-424-07
贾瑞博,周文斌,陈竟豪,等.高产色素红曲菌的筛选鉴定及其液态发酵条件优化[J].福建农业学报,2016,31(4):424-430.
JIA R-B,ZHOU W-B,LI Y,et al.Screening and Identifying a High Pigment-producingMonacusStrain, and Optimizing Its Liquid Fermentation[J].FujianJournalofAgriculturalSciences,2016,31(4):424-430.
