正常培养条件下绵羊卵母细胞减数分裂从中期I至中期III的动态变化过程
2016-06-23李欣欣白春玲魏著英李光鹏
李欣欣 白春玲 魏著英 李光鹏
(内蒙古大学 哺乳动物生殖生物学及生物技术教育部重点实验室,呼和浩特 010021)
正常培养条件下绵羊卵母细胞减数分裂从中期I至中期III的动态变化过程
李欣欣 白春玲 魏著英 李光鹏
(内蒙古大学 哺乳动物生殖生物学及生物技术教育部重点实验室,呼和浩特 010021)
以绵羊卵母细胞为研究对象,通过免疫组织化学的方法研究其染色体和纺锤体微管及微丝在体外成熟、孤雌激活过程中的动态变化。结果表明:(1)纺锤体的形态由中期的桶形,变成早后期的圆柱形及后期和末期细长而扁平的三角锥形,与椎体底面连接的染色质将来进入极体并最终被排出。(2)染色体形态从中期单个的清晰可见的状态,变为后期和末期凝缩的染色质状态,随后在下一个中期再次呈现出清晰可见的形态。(3)第一次减数分裂中期(MI)纺锤体比第二次减数分裂中期(MII)和第三次减数分裂中期(MIII)大,但MII期纺锤体形态比MI期更接近桶形。(4)几乎所有组成纺锤体的微管和微丝都被分配到极体中。
减数分裂;微管;微丝;纺锤体;卵母细胞;绵羊
哺乳动物配子形成的减数分裂过程,染色体只复制一次,细胞连续分裂两次,使配子染色体数目减半,从而保证了受精后物种染色体数目的恒定。前减数分裂间期(Pre-meiotic interphase)是减数分裂前的间期,主要为减数分裂进行物质准备,包括DNA的复制、相关蛋白质的合成及细胞分裂相关因子的装配。在前减数分裂间期之后有两次连续的减数分裂过程。第一次减数分裂后,染色体数目减半,第二次减数分裂则类似于同物种的有丝分裂[1]。两次连续的减数分裂,核是均等分裂的。对于雄性配子而言,胞质是均等分裂的,但是在雌性配子中,胞质呈不对称分裂方式。一个初级卵母细胞通过减数分裂形成一个稍大的卵母细胞和2-3个非常小的极体。细胞的不对称分裂一般发生在可以产生不同命运子细胞的体细胞中,相应地,其产生的子细胞大小也存在一定差异[2]。目前研究表明,Par蛋白和G蛋白信号通路调控细胞的不对称分裂、纺锤体的不对称性和微管的动态变化[2-4]。在卵母细胞减数分裂过程中,几乎所有的胞质都被分配到次级卵母细胞中,只有少量胞质进入极体。通常情况下,排出第一极体(Pb1)是完成第一次减数分裂(MI)的标志,随后卵母细胞将停滞在第二次减数分裂中期(MII)。MII期卵母细胞的激活与受精相关。如果没有受精,老化的卵母细胞会在胞内模拟受精的过程,增加胞内钙离子浓度,从MII期恢复。在一些哺乳动物中,如小鼠、仓鼠、大鼠,这种“部分激活”的卵母细胞无法进一步发育,只能停滞于一个新的中期样阶段(MIII)[5]。绵羊卵母细胞在孤雌激活后,停滞于MII期的卵母细胞进入第二次减数分裂并排出第二极体(Pb2),随后这些卵母细胞的染色体也要经历一个与前两个中期相似的排列方式,因此将这一阶段也称为MIII。细胞骨架的动态变化在染色体的凝集、同源染色体和姐妹染色体单体的分离、核物质向皮质区的运输、Pb1和Pb2的排出、细胞器的运输和重新定位都具有重要的作用。关于低等脊椎动物微管和微丝动态变化的研究已经非常广泛,如非洲爪蟾[6-9]和果蝇[7,10]。研究结果表明,纺锤体是一种呈动态变化的细胞器,它的形成和形态变化主要依赖于微管和微丝的活动及染色体和微管相关的动力蛋白的作用[8,11,12]。有关于哺乳动物减数分裂的研究多集中于啮齿类,特别是小鼠[13-17],在猪[18-21]、马[22,23]和牛[24,25]等家畜动物上的研究非常有限。这些研究揭示啮齿类动物在卵母细胞成熟和受精时细胞骨架的功能是非典型的[21,26]。牛卵母细胞微管组织和构成的机制与小鼠不同,但与蛙等低等脊椎动物更为相似[27,28]。
本研究系统分析绵羊卵母细胞减数分裂过程中纺锤体形成和形态变化,并对染色体的排列和分离及其动态变化进行细致的观察,同时研究MII期染色体和极体与微管和微丝之间的联系。此外对纺锤体形成、染色体分离、极体排出和卵母细胞不对称分裂的机制也进行了探讨。
1 材料与方法
1.1 材料
除特别提到化学试剂,其余均购自Sigma公司。
1.2 方法
1.2.1 绵羊卵母细胞的体外成熟 绵羊卵巢取自当地屠宰场,置于生理盐水中带回实验室。生理盐水清洗3遍后,在含采卵液(M199 + 2.2 g/L NaHCO3+ 10 mmol/L Hepes + 5 IU/mL肝素+ 1%FBS)的培养皿中,用手术刀片割取卵巢表面2-8 mm卵泡内的卵丘-卵母细胞复合体(COCs)。选取胞质均匀、卵丘细胞完整的卵母细胞在四孔板中进行成熟培养,成熟培养液为M199 + 10% OES + 0.01 g/mL E2+ 0.01 IU/mL FSH + 1 IU/mL LH + 2 mmol/L丙酮酸钠。按50枚/0.5 mL成熟培养液培养卵母细胞,培养条件为38.5℃、100%湿度和5% CO2的气相。
1.2.2 微管和微丝的免疫荧光染色 经0.1%透明质酸酶去除卵丘细胞的卵母细胞用PBS(-)+0.3% BSA洗3遍,PBS(-)+ 4%多聚甲醛+0.2% TritonX-100室温固定通透1 h,然后使用PBS(-)+3% BSA室温封闭1-2 h。微管免疫荧光染色:封闭后的卵母细胞在驴抗小鼠α-Tubulin单克隆抗体(用PBS(-)+0.3% BSA 1∶500稀释)中4℃孵育过夜。PBS(-)+0.3% BSA中洗3遍,在FITC标记的山羊抗鼠二抗(Upstate)中室温孵育1 h,二抗稀释比例为1∶500。PBS(-)+0.3% BSA洗3次,用10 μg/mL的PI对细胞核进行染色,封片后,激光共聚焦观察。微丝染色:卵母细胞固定通透后,放入用PBS(-)+0.3% BSA以1∶300稀释的FITC-鬼笔环肽中,37℃孵育1 h,PBS(-)+0.3% BSA洗3次,经PI染核后封片观察。研究中每组实验至少重复3次,每次重复设备都设置相同的参数,图片分析采用OLYMPAS图像分析软件进行。
核相的区分。GV:染色质呈丝状散乱分布。MI:染色体排列在赤道板上。AI:同源染色体彼此开始分离,纺锤体拉长。TI:同源染色体已经分离,染色质凝缩在一起。MII:染色体再一次排列在赤道板上,并形成Pb1,微管不与第二次减数分裂中期染色体相连。AII:同源染色体开始再次分离,纺锤体被拉长。TII:两部分染色体分离,并且具有明显的Pb1。MIII:染色体再次排列在赤道板上形成纺锤体,并且具有Pb1和Pb2。
1.2.3 实验设计
1.2.3.1 绵羊卵母细胞体外成熟不同时间Pb1的排出率 将体外成熟14、16、17、18、20、24和26 h的绵羊卵母细胞,在0.1%透明质酸酶中涡旋震荡去除卵丘细胞,统计绵羊卵母细胞成熟不同时间Pb1的 排出率。
1.2.3.2 绵羊卵母细胞体外成熟不同时间纺锤体和染色体的动态变化 1.2.3.1的结果表明,在成熟14 h时就有卵母细胞排出Pb1。因此,为了精确的确定核的状态和分析纺锤体和染色体在减数分裂中的动态变化,将体外成熟后0、2、4、6、8、10、12、14、16、17、18、20、24和26 h的卵母细胞分别固定,经微管和微丝及染色体的免疫荧光染色,观察纺锤体和染色体的形态。其中未排出Pb1的卵母细胞也分别进行固定。核相通过纺锤体和染色体的形态进行评估。
1.2.3.3 绵羊卵母细胞孤雌激活后不同时间纺锤体和染色体的动态变化 1.2.3.2的结果揭示了纺锤体和染色体在绵羊卵母细胞第一次减数分裂中所具有的一些独特的变化,本实验主要是研究纺锤体和染色体在绵羊卵母细胞第二次减数分裂中的动态变化规律。成熟25 h后,挑选具有Pb1的卵母细胞用5 μmol/L离子霉素处理5 min,洗3次,10 μg/mL CHX(CR1aa溶解)处理4 h,再洗3次后于CR1aa发育液中培养。经微管和微丝及染色体的免疫荧光染色,观察激活后0.5、1、3、4、6和8 h纺锤体和染色体的动态变化。
2 结果
2.1 绵羊卵母细胞体外成熟过程中的减数分裂进程
本研究共检测了231枚绵羊卵母细胞,其中排出Pb1的卵母细胞有186枚(表1),成熟率为80.5%。成熟培养0-4 h,多数的卵母细胞都处于GV期(图1-A)。体外培养4 h开始生发泡破裂(GVBD),8 h时几乎所有的卵母细胞都已发生GVBD。绵羊卵母细胞排出Pb1是不对称分裂的,开始观察到Pb1是体外成熟14 h,随着成熟时间的延长,Pb1的排出率逐渐升高,到26 h达到77.0%。其中体外成 熟14、16、17、18、20、24和26 h,Pb1的 排出率分别为8.9%、13.3%、20.2%、29.0%、45.2%、75.3%和77.0%。通过分析成熟不同时间排出第一极体的绵羊卵母细胞的核相发现,在成熟14 h,约90%的卵母细胞处于AI期(图1-E);到16 h时,约70%的卵母细胞处于AI期,其余的卵母细胞则到达TI期(图1-G),但没有卵母细胞进入MII期(图1-L);体外培养17 h,只有3.8%的卵母细胞进入MII期;24 h后,80%左右的卵母细胞到达MII期(图1-L)。没有排出Pb1的卵母细胞几乎都停滞在MI期(图1-H)。
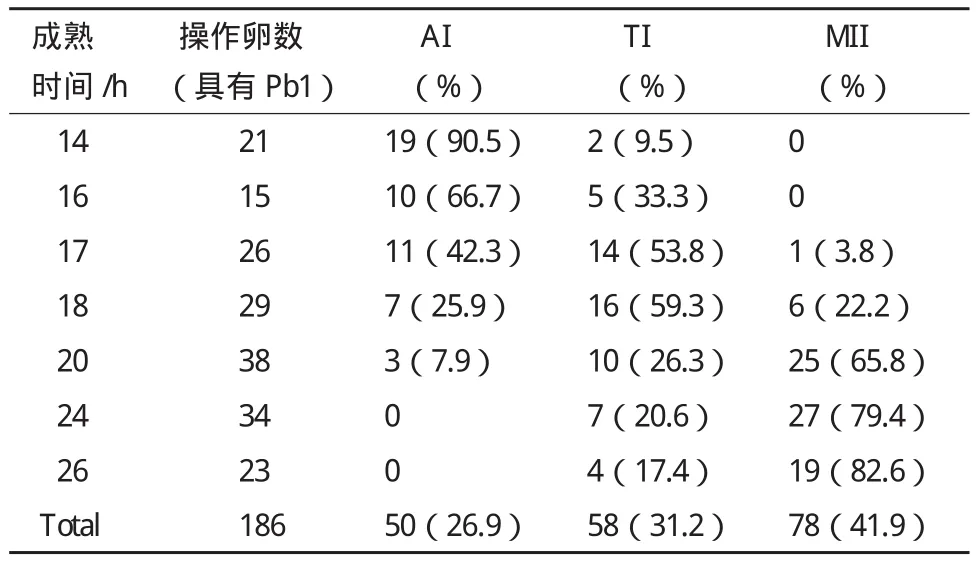
表1 排出第一极体的绵羊卵母细胞成熟不同时间所处核相
2.2 绵羊卵母细胞体外成熟不同时期染色体和微管的动态变化
将体外成熟0、2、4、6、8、10、12、14、16、17、18、20、24和26 h的卵母细胞分别进行免疫荧光染色观察其微管的动态变化。结果显示,在0-4 h的GV期卵母细胞核内,染色质呈丝状,并未观察到微管的特异性着色(图1-A)。当卵母细胞到达PreMI期,染色质部分凝缩,此时在染色质周围能够清晰看到特异性着色的微管(图1-B)。 在MI期,染色体整齐的排列在赤道板上,与微管形成桶形的纺锤体结构(图1-C)。AI期早期时,同源染色体开始从中期板向两极移动(图1-D)。到达AI期后,同源染色体分离形成两部分,而此时微管位于分开的两部分染色体中间(图1-E)。A I-TI期时,纺锤体变成细长的三角锥形,此时与锥体底面连接的那一部分染色体将会被排出(图1-F、G);在这一时期,有的卵母细胞还存在三极纺锤体结构(图1-I、J)。TI末期几乎所有微管都连接在之后要形成Pb1的染色体上,随染色体被一起排到卵母细胞外。典型的MII期染色体排列在赤道板上,形成MII期纺锤体,此时的染色体明显小于MI期,Pb1被排出(图1-H、K、L)。图1-F-H可以清晰的显示出微管跟随将要形成Pb1的染色体进行动态迁移的过程,微管与染色体一起被分配到Pb1中,并最终被排出。
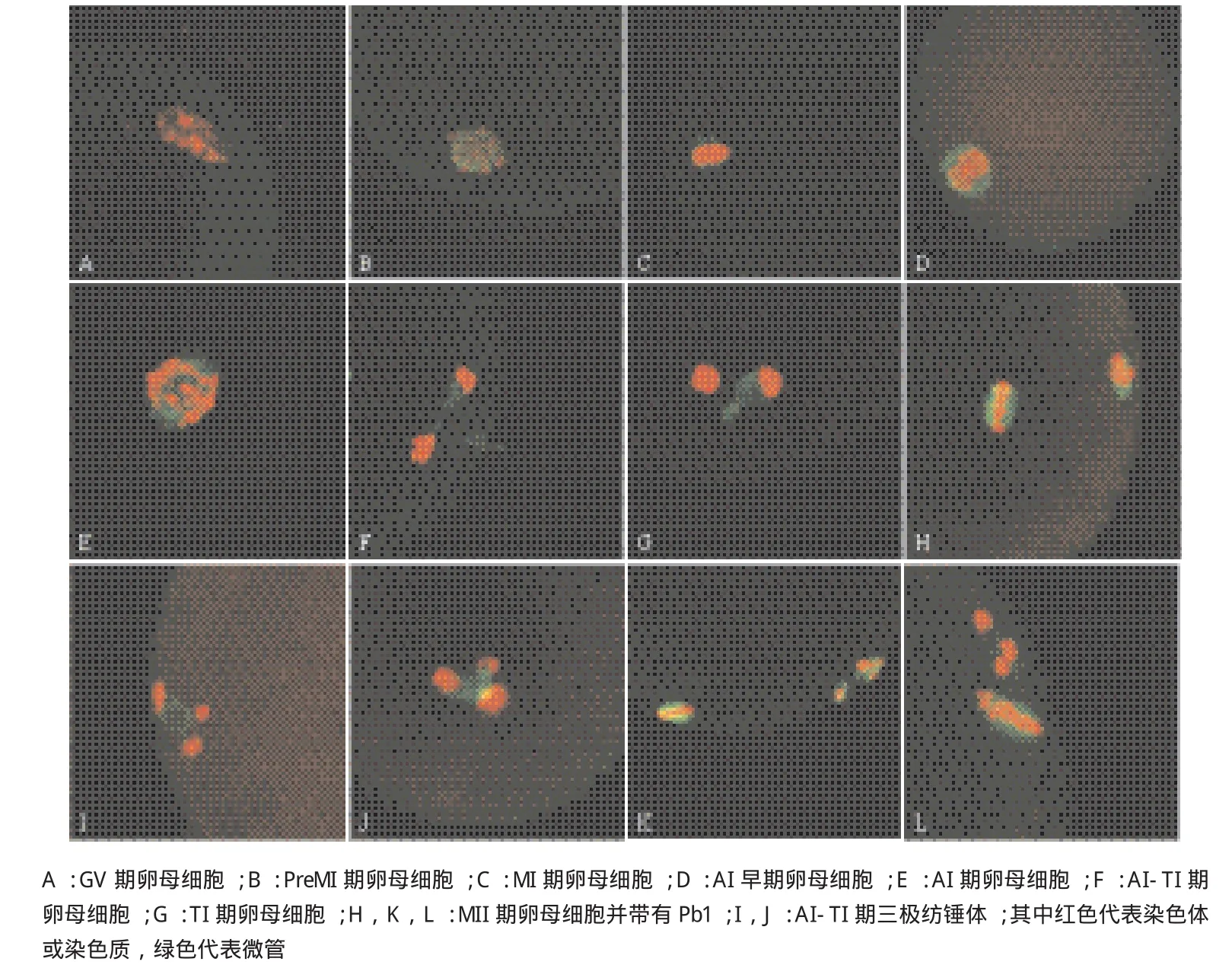
图1 绵羊卵母细胞体外成熟不同时期染色体和微管动态变化(100×)
2.3 绵羊卵母细胞体外成熟不同时期微丝的动态变化
GV期到AI期,微丝主要分布于卵膜下的皮质区(图2-A、B、C),此时并未观察到其与染色体之间的联系。到达AI期后,除了在卵膜下有微丝分布外,在分开的同源染色体周围可以清晰地看到微丝的聚集(图2-D)。AI-TI期时,位于分开的同源染色体周围的大部分微丝向之后要形成极体染色体的一方迁移(图2-E)。到MII时,极体染色体连同大部分的微丝被排出卵母细胞外。Pb1形成后,可以观察到形成第一次减数分裂纺锤体的大部分微管和微丝位于极体中。观察还发现,有些TI-MII期的卵母细胞,同源染色体之间并无微管与微丝的着色,但在将来要被排出形成Pb1的染色体周围却有大量的微管和微丝存在。随后微管和微丝重新聚集在同源染色体周围,并形成MII期纺锤体。
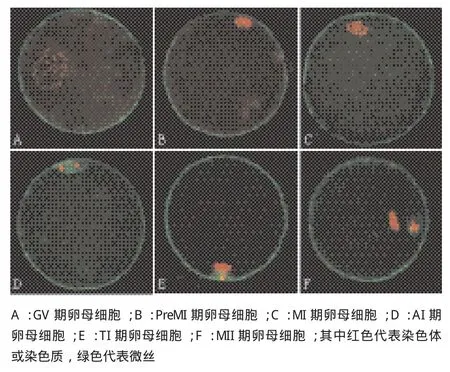
图2 绵羊卵母细胞体外成熟不同时期染色体和微丝的动态变化(100×)
2.4 绵羊卵母细胞孤雌激活后不同时间纺锤体和染色体的动态变化
绵羊卵母细胞MII期到MIII期纺锤体的动态变化与MI期至MII期高度相似。卵母细胞经25 h体外成熟后进入MII期(图3-A),之后被孤雌激活。分析MII期卵母细胞孤雌激活后进程(表2)可知,激活后0.5 h,68.0%的卵母细胞还是位于MII期,只有28.0%的卵母细胞到达AII期(图3-B、C),AII期的卵母细胞染色体开始从赤道板向两极分离,分开的两部分染色体中间有大量的微管相连。激活后1 h,绝大部分卵母细胞(73.9%)位于AII期,只有4.3%卵母细胞到达TII期(图3-D-G)。激活后2 h,55.6%的卵母细胞还是位于AII期,22.2%的卵母细胞到达TII期,开始有少量的卵母细胞(5.6%)到达MIII期(图3-H、I)。当卵母细胞到达早TII期,纺锤体变成细长的三角锥形(图3-D、E),此时与纺锤体底面连接的那部分染色体之后会被排出卵母细胞,成为Pb2染色体。随着卵母细胞到达晚TII期,形成中期染色体质的一方并没有微管相连,几乎所有的微管都跟随要形成Pb2的染色体排出卵母细胞(图3-F、G),激活后3 h,56.0%的卵母细胞到达TII期,20.0%的卵母细胞到达MIII期,有4.0%的卵母细胞形成原核。激活后4 h,半数的卵母细胞(58.6%)到达MIII期,17.2%的卵母细胞形成原核。MIII期的染色体并不像MI和MII期的染色体都整齐的排列在赤道板上,而是有部分染色体仍在赤道板之外(图3-H、I)。此时的纺锤体比MII期纺锤体小,而且Pb2也小于Pb1(图3-H、I)。激活后8 h,绝大部分的卵母细胞(89.7%)都已形成原核。
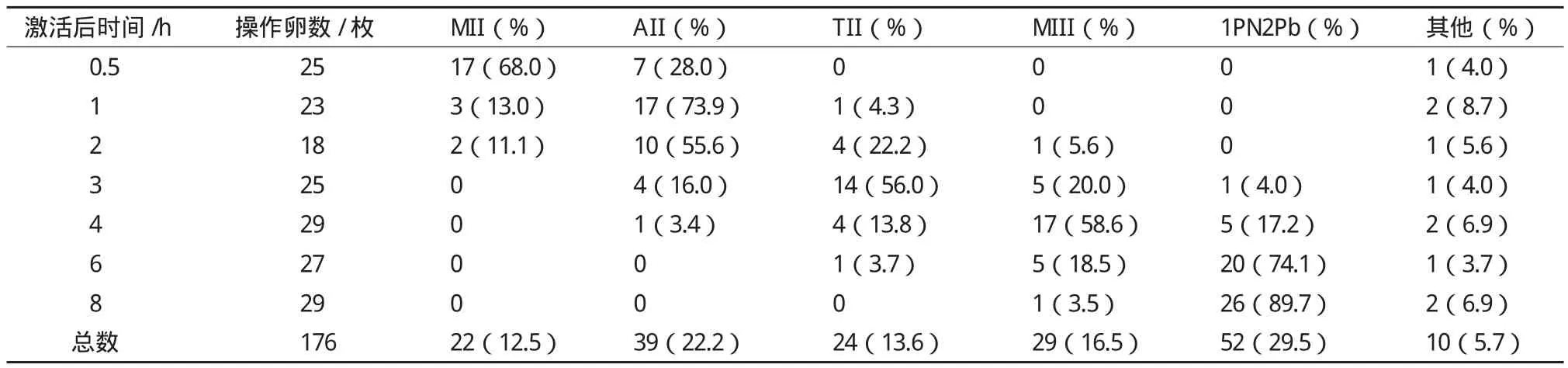
表2 MII期卵母细胞孤雌激活后进程
3 讨论
已有研究表明,微管和微丝在纺锤体的形成、染色体的排列及分离、极体的排出和胞质分裂过程中起着重要作用[15,17,22-24,29],但其相关的机制还不是十分明确。有关绵羊卵母细胞体外成熟过程中纺锤体的形成、极体的排放等现象尚未见到系统的观察报道,本研究以绵羊卵母细胞为模型,观察和描述了减数分裂及孤雌激活过程中构成纺锤体主要成分微管和微丝的动态变化及其在绵羊卵母细胞减数分裂MI-MIII期可能的命运。研究结果表明,纺锤体从MI和MII期的桶形变成早AI和AII期的圆柱形,然后变成TI和TII期细长的三角锥形。与小鼠典型的桶形染色体相比[13-15,17,30],绵羊MI的纺锤体直径明显要大,而且具有更大的平的两极,此时组成纺锤体的微管只覆盖于整齐排列的染色体表面,并不发出长的微管束到两级。在MI和MII纺锤体中,染色体整齐的排列在赤道板上。MIII纺锤体比MII期小,染色体并不严格地排列在赤道板上,有些染色体甚至在纺锤体之外,而且排列的方向似乎也是随机的。研究显示纺锤体的形状和大小也受环境因素影响,体外成熟的小鼠卵母细胞通常具有更大的纺锤体和更平的两极[17]。同时本研究还发现,构成纺锤体的大部分微管和微丝都随着将要形成Pb1和Pb2的染色体移动,并随着这些染色体被排出卵母细胞外。中期的染色体是单个分明的,容易观察。在后期的较晚阶段,直到卵母细胞到达下一个中期之前,染色体去凝缩,呈现团状的染色质状态。排出Pb1和Pb2以后,不清晰的中期染色体又开始变得清晰可见,可以分辨出单个的染色体,此时极体的染色质仍然凝缩成团,并且其周围聚集大量微管,此结果不同于小鼠和猪的研究结果[19-21],但与牛的研究结果一致[25]。绵羊卵母细胞到达早AI期时,要进入Pb1的染色质随着卵膜凸起被排出。体外成熟12 h便可观察到卵膜上的这种凸起,并且组装成类似Pb1的结构。在17 h前的AI和TI期,多数的卵母细胞都具有这种结构。几乎所有具有Pb1凸起的卵母细胞,在20 h时都能到达MII期。胞质分裂完成后,Pb1从卵母细胞分离,成为一个独立的小细胞,主要含有微管、微丝和少量胞质。事实表明是否具有Pb1并不是卵母细胞到达MII期所必须的。
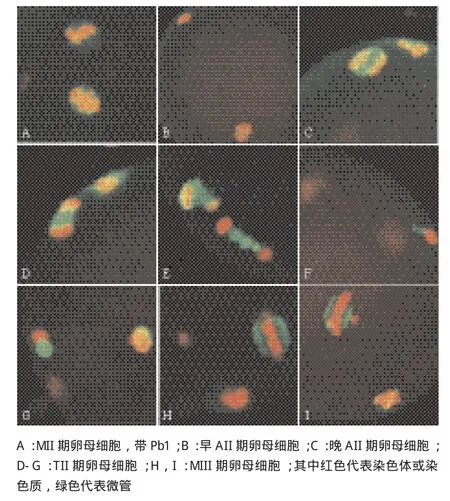
图3 绵羊卵母细胞MII-MIII期纺锤体和染色体的动态变化(100×)
微丝对于小鼠和猪的卵母细胞核迁移和极体的排放非常重要[21,30-32]。微丝的出现与分布也随着减数分裂呈动态变化,而且随着极体的排出,绝大多数微丝也被排出。这一现象与我们之前在牛卵母细胞中的观察结果一致[25]。处于GV、GVBD、PreMI和MI期的绵羊卵母细胞,微丝分布在卵膜下的皮质区,直到早AI期才出现在染色质区。微丝从AI到TI期变得非常明显。随着纺锤体微管的不断变化,微丝向两团染色中将来形成Pb1的一方移动。随着Pb1的排出,几乎所有的微丝都随着极体染色质排出。在第二次减数分裂中,Pb2的排出也存在相似的现象。但在猪卵母细胞成熟的过程中,微丝聚集在MI期纺锤体所在的区域,这可能是物种差异所致[21]。
根据在新杆状线虫上的报道,微管和微丝在不对称性分裂的建立和维持上具有重要作用[33,34]。因此,我们认为纺锤体微管和微丝主要参与卵母细胞的不对称分裂。在这种不对称分裂中,纺锤体及其相关成分令染色体均衡分布,并将其他分子不对称地分布到卵母细胞和极体中。次级卵母细胞的体积在第二次减数分裂完成后似乎没有明显的改变,其中含有早期胚胎发育所需的全部蛋白质和分子,极体则主要含有微管和微丝及少量的胞质。
哺乳动物卵母细胞,除小鼠外皆无中心体。小鼠多数的微管组织中心(MTOC)或胞质中心粒和具有微管成核活性的中心粒外周物质都在胞质中。小鼠减数分裂纺锤体极的形成与MTOC有关[15,16,35,36]。然而家畜动物因为缺乏中心粒,其微管的组装并不是由MTOC组织的[25],因此推测,其纺锤体的形成和染色体的分离可能与MTOC无关。绵羊的卵母细胞纺锤体与牛类似,都是典型的无星纺锤体,染色体可能在纺锤体的组装中起非常关键的作用。微管以随机的方式围绕染色体,其可能在染色体动力因子或联合微管相关动力因子的作用下,被分类捆扎成一种反平行且双极的排列方式[8,37]。我们的研究结果表明,染色体的形态从中期可见的单个的形态变为后期和末期杂乱无序的状态,之后在下一个中期时段又重新变得清晰可见。同时,纺锤体微管也从桶形变成圆柱形,再到锥形。位于分开的同源染色体和姐妹染色单体之间的大部分微管和围绕其周围的大部分微丝都跟随极体染色体体进行迁移,并最终分配到极体中。纺锤体形成和染色体分离似乎是依赖染色体完成的。
4 结论
本研究系统的分析了正常培养条件下绵羊卵母细胞减数分裂从中期I至中期III的动态变化过程。结果显示:(1)纺锤体的形态由中期的桶形,变成早后期的圆柱形及后期和末期细长而扁平的三角锥形,连接在锥体底面的染色质将来进入极体并最终被排出。(2)染色体形态从中期单个可见的状态,变为后期和末期凝缩的染色质状态,随后在下一个中期再次呈现出单个而清晰可见的形态。(3)第一次减数分裂中期(MI)纺锤体比第二次减数分裂中期(MII)和第三次减数分裂中期(MIII)大,MII期纺锤体形态比MI期更接近桶形。(4)几乎所有组成纺锤体的微管和微丝都被分配到极体中。
[1]Wolfe S. Molecular and cellular biology[M]. Belmont, California:Wadsworth Publishing Company, 1993:1050-1062.
[2]Kaltschmidt JA, Brand AH. Asymmetric cell division:microtubule dynamics and spindle asymmetry[J]. J Cell Sci, 2002, 115:2257-2264.
[3]Horvitz HR, Herskowitz I. Mechanisms of asymmetric cell division:two Bs or not two Bs, that is the question[J]. Cell, 1992, 68:237-255.
[4]Lu B, Jan L, Jan YN. Control of cell divisions in the nervous system:symmetry and asymmetry[J]. Annu Rev Neurosci, 2000, 23:531-556.
[5]Tripathi A, Kumar KV, Chaube SK. Meiotic cell cycle arrest in mammalian oocytes[J]. J Cell Physiol, 2010, 223:592-600.
[6]Ohsumi K, Sawada W, Kishimoto T. Meiosis-specific cell cycle regulation in maturing Xenopus oocytes[J]. J Cell Sci, 1994, 107:3005-3013.
[7]Endow SA. Microtubule motors in spindle and chromosome motility[J]. Eur J Biochem, 1999, 262:12-18.
[8]Wittmann T, Hyman A, Desai A. The spindle:a dynamic assembly of microtubules and motors[J]. Nat Cell Biol, 2001, 3:E28-34.
[9]Peter M, Labbe JC, Doree M, et al. A new role for Mos in Xenopus oocyte maturation:targeting Myt1 independently of MAPK[J]. Development, 2002, 129:2129-2139.
[10]Tavosanis G, Ll amazares S, Goulielmos G, et al. Essential role for gamma-tubulin in the acentriolar female meiotic spindle of Droso phila[J]. Embo J, 1997, 16:1809-1819.
[11]Barton NR, Goldstein LS. Going mobile:microtubule motors and chromosome segregation[J]. Pro c Natl Acad Sci USA, 1996, 93:1735-1742.
[12]Brunet S, Vernos I. Chromosome motors on the move. From motion to spindle checkpoint activity[J]. EMBO Rep, 2001, 2:669-673.
[13]Maro B, Howlett SK, Webb M. Non-spindle microtubule organizing centers in metaphase II-arrested mouse oo cytes[J]. J Cell Biol, 1985, 101:1665-1672.
[14]Schatten G, Simerly C, Schatten H. Microtubule configurations during ferti lization, mitosis, and early development in the mouse and the requirement for egg microtubule-mediated motility during mammalian fertilization[J]. Proc Natl Acad Sci USA, 1985, 82:4152-4156.
[15]Brunet S, Maria AS, Guillaud P, et al. Kinetochore f ibers are not involved in the formation of the first meiotic spindle in mouse oocytes, but control the exit from the first meiotic M phase[J]. J Cell Biol, 1999, 146:1-12.
[16]Combelles CM, Albertini DF. Microtubule patterning during meiotic maturation in mouse oocytes is determined by cel l cycle-specific sorting and redistribution of gamma-tubulin[J]. Dev Biol, 2001, 239:281-294.
[17]Sanfins A, Lee GY, Plancha CE, et al. Distinctions in meiotic spindle struc ture and assembly during in vitro and in vivo maturation of mouse oocytes[J]. Biol Reprod, 2003, 69:2059-2067.
[18]Kim NH, Funahashi H, P rather RS, et al. Microtubule and microfilament dynamics in porcine oocytes during meioticmaturation[J]. Mol Reprod Dev, 1996, 43:248-255.
[19]Lee J, Miyano T, Moor RM. Spindle formation and dynamics of gamma-tubulin and nuclear mitotic apparatus protein distribution during meiosis in pig and mouse oocytes[J]. Biol Reprod, 2000, 62:1184-1192.
[20]Wang WH, Abeydeera LR, Prather RS, et al. Polymerization of nonfilamentous actin into microfilaments is an important process for porcine oocyte maturation and early embryo development[J]. Biol Reprod, 2 000, 62:1177-1183.
[21]Sun QY, Lai L, Park KW, et al. Dynamic events are differently mediated by microfilaments, microtubules, and mitogen-activated protein kinase during porcine oocyte maturation and fertilization in vitro[J]. Biol Reprod, 2001, 64:879-889.
[22]Tremoleda JL, Schoevers EJ, Stout TA, et al. Organisation of the cytoskeleton during in vitro maturation of horse oocytes[J]. Mol Reprod Dev, 2001, 60:260-269.
[23]Tremoleda J L, Stout TA, Lagutina I, et al. Effects of in vitro production on horse embryo morphology, cytoskeletal characteristics, and blastocyst capsule formation[J]. Biol Reprod, 2003, 69:1895-1906.
[24]Kim NH, Cho SK, Choi SH, et al. The distribution and requirements of microtubules and microfilaments in bovine oocytes during in vitro maturation[J]. Zygote, 2000, 8:25-32.
[25]Li GP, Liu Y, Bunch TD, et al. Asymmetric division of spindle microtubules and microfilaments during bovine meiosis from metaphase I to metaphase III[J]. Mol Reprod Dev, 2005, 71:220-226.
[26]Simerly C, Navara C, Wu G, et al. Cytoskeletal organization and dynamics in mammalian oocytes during maturation and fertilization[M]// Grudzinskas J, Yovich J, editors. Gametes-The oocyte. Cambridge:Cambridge University Pres s, 1995:54-94.
[27]Long CR, Pinto-Correia C, Duby RT, et al. Chromatin and microtubule morphology during the first cell cycle in bovine zygotes[J]. Mol Reprod Dev, 1993, 36:23-32.
[28]Navara CS, First NL, Schatten G. Microtubule organizat ion in the cow during fertilization, polyspermy, parthenogenesis, and nuclear transfer:the role of the sperm aster[J]. Dev Biol, 1994, 162:29-40.
[29]Saunders KM, Parks JE. Effects of cryopreservation procedures on the cytology and fertilization rate of in vitro-matured bovine oocytes[J]. Biol Reprod, 1999, 61:178-187.
[30]Zhu ZY, Chen DY, Li JS, et al. Rotation of m eiotic spindle is controlled by microfilaments in mouse oocytes[J]. Biol Reprod, 2003, 68:943-946.
[31]Longo FJ, Chen DY. Development of cortical polarity in mouse eggs:involve ment of the meiotic apparatus[J]. Dev Biol, 1985, 107:382-394.
[32]Ryabova LV, Betina MI, Vassetzky SG. Influence of cytochalasin B on oocyte maturation in Xenopus laevis[J]. Cell Differ, 198 6, 19:89-96.
[33]Grill SW, Gonczy P, Stelzer EH, et al. Polarity controls forces governing asymmetric spindle positioning in the Caenorhabditis elegans embryo[J]. Nature, 2001, 409:630-633.
[34]Grill SW, Howard J, Schaffer E, et al. The distr ibution of active force generators controls mitotic spindle position[J]. Science, 2003, 301:518-521.
[35]Albertini DF. Cytoplasmic reorganization during the resumpti on of meiosis in cultured preovulatory rat oocytes[J]. Dev Biol, 1987, 120:121-131.
[36]Messinger SM, Albertini DF. Centrosome and microtubule dynamics during meiotic progression in the mouse oocyte[J]. J Cell Sci, 1991, 100:289-298.
[37]Scholey JM, Brust-Mascher I, Mogilner A. Cell division[J]. Nature, 2003, 422:746-752.
(责任编辑 马鑫)
Dynamic Changes of Sheep Oocyte Meiosis from Metaphase I to Metaphase III Matured in vitro
LI Xin-xin BAI Chun-ling WEI Zhu-ying LI Guang-peng
(The Key Laboratory of National Education Ministry for Mammalian Reproductive Biology and Biotechnology,Inner Mongolia University,Hohhot 010021)
Meiosis is a division mode in diploid organism to produce haploid gametes,which is the special mechanism of ensuring the chromosome’s number of a species after fertilization to be constant. The key step in the meiotic division is to separate the homologous chromosome and sister chromatids correctly,the dynamic changes of the cytoskeleton,in particular microtubules(MTs)and microfilaments(MFs),play critical roles in this process. In this study,the dynamic changes of chromosomes and spindle MTs and MFs during the maturing and parthenogenetic activation of sheep oocyte cells were studied by immunohistochemistry method. The results showed that:1)The morphology of spindle changed from barrel-shaped at metaphase stage to cylinder-shaped at early anaphase,and then to long,thin coneshaped at late anaphase and telophase. Chromatin connected with the floor of the cone became the polar bodies and expelled. 2)Chromosome morphology changed from visible individual at metaphase to condensed chromatin during anaphase and telophase stages,and then backed to visible individual chromosomes at the next metaphase. 3)The size of MI spindle was larger than that of the MII spindle and MIII. MII spindle,however,was more barrel-shaped than the MI spindle. 4)Almost all of the MTs and MFs composing the spindles were partitioned into the polar bodies.
meiosis;microtubule;microfilament;spindle;oocyte;sheep
10.13560/j.cnki.biotech.bull.1985.2016.05.030
2015-07-22
国家重点基础研究发展计划(2012CB722306),内蒙古科技项目(20130902,20110401)
李欣欣,女,博士,研究方向:哺乳动物生殖生物学;E-mail:xinxin_816@126.com
白春玲,女,博士,研究方向:哺乳动物生殖生物学;E-mail:chunling1980_0@163.com
