冠状动脉临界病变功能学和解剖学的有创评价方法及其预测价值的相关性
2016-06-23综述审校
陈 慰 综述,程 标 审校
(1.遵义医学院,贵州 遵义 563000;2.四川省医学科学院·四川省人民医院心内科,四川 成都 610072)
冠状动脉临界病变功能学和解剖学的有创评价方法及其预测价值的相关性
陈 慰1,2综述,程 标2△审校
(1.遵义医学院,贵州 遵义 563000;2.四川省医学科学院·四川省人民医院心内科,四川 成都 610072)
冠状动脉临界病变(冠状动脉造影狭窄程度介于40% ~70%)介入治疗策略的选择是有争议的。随着介入技术的发展,评价心肌缺血的有创检查方法为心脏介入医生选择临界病变治疗策略提供了重要的依据。其中,冠状动脉血流储备分数(fractional flow reserve,FFR)的测定对冠状动脉病变功能学评价具有重大价值,而血管内超声(intravascular ultrasound,IVUS) 和光学相干断层成像(optical coherence tomography,OCT)等技术的运用则是对冠状动脉粥样斑块形态学评价的重要补充。在这些有创检查方法的指导下对临界病变进行干预,极大地改善了冠心病患者的临床预后。本文将对上述检查方法各自的优势及其预测价值的相关性作一综述。
冠心病;临界病变;介入治疗;血流储备分数;血管内超声;光学相干断层成像
冠状动脉临界病变是指冠状动脉造影(coronary angiography,CAG)狭窄程度介于40% ~70%的病变[1]。目前临界病变多采用药物治疗,但临界病变处斑块可能不稳定(或从稳定斑块转变为不稳定斑块),容易破裂,从而导致急性冠状动脉综合征(acute coronary syndrome,ACS)。研究显示[2],经支冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后1年内68.5%的患者出现急性冠状动脉综合征表现,与非目标血管处的临界病变相关。然而并非所有的临界病变都需要接受PCI治疗,对临界病变进行介入干预是否能使患者获益仍然存在争议。因此,判断临界病变斑块的稳定性及其与心肌缺血的相关性尤为重要。目前,CAG仍然是评估冠状动脉狭窄程度的重要手段,但其局限性也非常显著,CAG无法准确评估狭窄对血流动力学的影响及冠状动脉病变处斑块的稳定性、病变的狭窄程度。无创性缺血检查方法(如运动平板试验、心肌核素显像及多巴酚丁胺负荷心动图等)无法确定罪犯病变或罪犯血管。有创方法如冠状动脉血流储备分数(fractional flow reserve,FFR)、血管内超声(intravascular ultrasound,IVUS) 、光学相干断层成像(optical coherence tomography,OCT)分别从病变的功能学意义和解剖学情况进行评价。本文将就临界病变有创评价方法及其对心肌缺血预测价值的相关性作一综述。
1 CAG在临界病变评估中的局限性
CAG是诊断冠状动脉粥样硬化性心脏病(coronary atherosclerotic disease,CAD)的一种常用而且有效的方法。由于冠状动脉血管通常存在扭曲、成角或重叠,以及受射线投射角度和参考段血管的影响,CAG对血管狭窄的评估可能不准确。FAME研究[3]显示,由CAG判定的三支血管病变,在使用FFR评估后仅有14%的为真正三支病变。该研究中表现为临界病变的患者中有1/3的缺血患者会被忽略;而病变程度介于70%~90%的患者中,则有20%没有合并缺血的患者被过度治疗。FAME研究验证了CAG在冠状动脉病变严重程度和功能学判断的局限性。
在冠状动脉早期病变的检出能力上,CAG存在局限性。组织病理学研究表明[4],只有当斑块的横截面积达到该处血管横截面积的40%~50%时,才能被CAG发现。因为,当冠状动脉血管斑块形成时,其外壁的外弹力膜会随之代偿性地扩张,只有当斑块面积超过外弹力膜面积的40%~50%时,斑块才会逐渐侵占管腔,从而在CAG影像上表现为狭窄,正是由于这种正性血管重构使得一部分冠状动脉早期病变不能被CAG检出。
CAG对冠状动脉斑块的成分及稳定性的识别能力同样有限。对于易损斑块而言,血管的二维显影仅能显示其部分特征(如斑块破裂留下的溃疡、血栓或不规则管腔等)。除此之外,CAG较低的分辨率(>500 μm),也可能使其观察到的影像常与易损斑块的病理解剖存在较大差异。对于钙化病变而言,CAG与其他腔内影像学技术相比,其评价冠状动脉钙化病变的能力和准确性具有明显差距。2014年冠状动脉钙化病变诊治中国专家共识[5]指出,CAG评价钙化病变的敏感性仅为50%,特异性为90%,其对点状钙化的检出率低,且不能区分浅层钙化与深层钙化。
综上,CAG仅仅是造影剂对冠状动脉轮廓的填充,不能有效判定狭窄处病变的病理生理变化、斑块性质、组织学形态特征、病理组成等。对于临界病变而言,CAG的局限性决定了它无法准确评估狭窄的形态学和功能学情况,无法判断病变本身是否能导致确切的心肌缺血。因此,对于临界病变患者,心脏介入医生在PCI术前制定治疗策略上需要借助更有力的方法。
2 临界病变功能学的有创评价方法
2.1 FFR在冠状动脉临界病变功能学评价中的作用 在冠状动脉疾病患者中,心肌缺血的存在往往是不良临床预后的一个重要危险因素[6]。评价临界病变与心肌缺血的相关性在CAD治疗决策的选择中具有举足轻重的意义。遗憾的是,PCI术前接受无创性心肌缺血负荷检查的患者仅为少数[7],况且无创检查不能对病变进行准确定位,而且敏感性和特异性较低。Pijls等[8]研究首次提示FFR<0.75预测心肌缺血有较高的敏感性(88%)和特异性(100%)。同时,其他一些研究[9]显示,FFR与其他无创性缺血检测具有良好的相关性。随后,FFR技术被越来越多地应用于各大临床研究中,证实其在心肌缺血检测中具有重要意义。近年来的多项研究表明,FFR是一个评价冠状动脉狭窄功能性意义的可靠指标,被视为冠状动脉临界病变生理学评价的“金标准”。因此,越来越多的心脏介入中心开始使用FFR来指导临界病变的治疗。
2.2 在FFR指导下的临界病变介入治疗 DEFER研究[10]纳入至欧洲和亚洲的14个心脏中心的325例单支冠状动脉临界病变(目测直径狭窄40%~70%)患者,随访5年,结果显示:对于冠状动脉临界病变患者,在FFR<0.75时行PCI治疗是合适的,该组患者临床预后明显改善;在FFR≥0.75时推迟行PCI治疗是合适的,因为此类患者每年心源性死亡和急性心肌梗死的风险不到1%,对该类患者行PCI治疗并未能够改善其总体预后,反而使其承担了高额的手术费用。
FFR指导干预多支病变同样具有显著优势。FAME研究[11]纳入美国和欧洲20个医学中心的1005例多支血管病变(至少存在2支或以上血管直径狭窄50%以上)的患者结果表明,FFR指导冠状动脉多支血管病变行PCI治疗可显著降低支架植入数目、全因死亡率或心肌梗死率。
DEFER研究[10]和FAME研究[11]先后在单支和多支血管病变患者中证实了基于FFR制定治疗策略的安全性和必要性,均表明在FFR指导下对冠状动脉临界病变选择适宜的治疗能显著改善该类患者的远期预后,降低其心血管病不良事件的发生率,同时也减少围手术期并发症发生率及患者的手术时间,节约大量医疗资源。FFR对临界病变的评估价值在其他的临床研究中也同样得到证实[9,12]。
最初的临床研究指出,FFR<0.75是预测心肌缺血的最佳截值,随着更多大型随机对照研究的结果公布,研究发现,采用FFR<0.8的截值,会使预测心肌缺血的敏感性增加。2014年FFR、IVUS及OCT国际介入专家使用共识[13]推荐使用FFR<0.8作为预测心肌缺血的参考标准,以FFR<0.8指导临界病变行PCI治疗与单纯药物治疗能有效改善临床预后。2014年欧洲心脏病指南[14]指出,FFR应作为IA类推荐适用于缺血相关血管不明确时病变功能学检查。
3 临界病变解剖学的有创评价方法
3.1 IVUS在冠状动脉临界病变解剖学评价中的应用 IVUS是一种血管内成像技术,不仅可以清晰显示出血管管腔形态、管腔及血管壁的直径、横截面积、病变长度;还能识别斑块的类型及性质,对斑块进行定性和定量分析[15]。
3.1.1 IVUS对早期病变的诊断 大多数冠状动脉血管在粥样硬化病变形成早期可出现代偿性向外扩张以代偿管腔的丢失,这种正性重构作用往往会导致在CAG检查中血管狭窄程度会被低估或难以被识别。而这类正性重构病变多为不稳定斑块,易发生破裂从而导致ACS事件的发生[16]。IVUS技术的应用在很大程度上弥补了CAG检查的缺陷,它能在看似正常的血管节段检出早期的内膜增厚和斑块形成。不仅如此,在对斑块性质的识别上IVUS也具有独特的优势。
3.1.2 IVUS对不稳定性(易损性)斑块的诊断 在冠心病的发生发展过程中,冠状动脉内粥样斑块的稳定性较管腔狭窄程度更具有决定性意义。有血栓形成倾向、可快速进展成为罪犯斑块的粥样病变被称为“不稳定斑块或易损斑块(vulnerable plaque,VP)”。VP这一概念最早由Muller 等[17]在1994年提出。典型的VP主要组织学特征为早期斑块、偏心分布、脂质核较大、纤维帽较薄(厚度≤65 μm)并伴有脂质池,由大量巨噬细胞及少量平滑肌细胞或胶原等成分组成[18]。传统的IVUS以血管外膜回声为参照,根据斑块超声回声的强弱,可对病变斑块的性质进行分类[19]。易损斑块IVUS定量指标为:脂质核> 1 mm2、脂质核/斑块比值>20%且纤维帽厚度<0.7 mm。大量的研究表明,约有60% ~ 70% 的 ACS是由轻到中度大小的VP破裂所导致,该类斑块的破裂通常伴随血小板急速聚集继发急性血栓从而产生急性心肌缺血[19,20]。Fuster 等[21]也曾报道在部分ACS或心源性猝死的患者中其冠状动脉狭窄程度仅处于临界值,其心血管不良事件的发生主要源于VP破裂。因此,对于CAD患者而言,早期有效地识别出VP,不仅对急性心血管事件的预测尤为重要,同样也是选择治疗策略的重要依据。IVUS 能够对冠状动脉内VP进行定性和定量分析,也能对冠状动脉内VP的成分及形态提供准确信息,这些功能都使介入医生对冠状动脉病变有了更加全面的认识。
3.1.3 IVUS对钙化病变的诊断 与钙化程度低的患者相比,钙化程度高的患者其所有的冠心病事件、非致死性心肌梗死及冠心病猝死事件的相对危险度更高[5,22]。IVUS是目前检测冠状动脉钙化病变的金标准[5],其敏感性为 90%,特异性为100%。根据钙化在血管内壁 IVUS成像上的分布位置,通常可分为三种类型,即内膜钙化、基底膜钙化和混合钙化,一般认为基底膜钙化不影响介入治疗,而内膜钙化会影响球囊扩张,对于该类钙化病变通常需要行切割球囊或旋磨术治疗[5]。根据钙化病变在IVUS成像上累及的血管腔范围,也可将钙化病变分为:0级为无钙化;Ⅰ级为钙化范围<90°;Ⅱ级为钙化范围在 91°~ 180°;Ⅲ级为钙化范围在181°~270°;Ⅳ级为钙化范围>271°[5]。对于Ⅳ级钙化病变通常需要使用旋磨术预处理[5]。除了钙化的范围,IVUS检查还可以准确地测量钙化病变的长度。
3.1.4 IVUS在诊断冠状动脉夹层、内膜下血肿及血栓中的价值 部分冠状动脉临界病变伴有冠状动脉夹层、内膜下血肿及血栓形成,此类病变是ACS的重要危险因素,因此有效地识别此类病变在治疗策略的选择中显得尤为重要。冠状动脉夹层常发生于斑块与正常血管内膜的交界处,在IVUS图像上通常表现为新月型的组织斑块影及其后的环形无回声区。在冠状动脉夹层的诊断中,IVUS不仅能清晰地显示血管横断面图像,对于夹层破口的定位、长度以及血栓负荷的判断具有一定的优势[23],能有效地指导夹层病变的介入治疗。当冠状动脉夹层仅表现为内膜下血肿时,CAG往往只能显示出管腔的充盈缺损,但在IVUS 成像中内膜下血肿的内膜片则能清晰地表现为一层搏动性的高回声结构,并且与真腔的高回声内层相连[24]。除此之外,IVUS技术还能有效的识别冠状动脉内血栓,通常表现为相对低回声或灰阶多变的、伴有斑点或闪烁的腔内团块影像,并能根据体积的大小粗略判断大血栓的性质。因此,IVUS对伴有夹层、内膜下血肿及血栓的临界病变的识别具有重要意义。
3.1.5 IVUS在指导临界病变介入治疗策略制定中的作用 目前CAG指导下非左主病变狭窄程度>75%或左主干病变狭窄程度>50%是公认的PCI术指征,但有相当一部分有缺血负荷的临界病变患者因此失去介入治疗机会。Auer等[24]研究结果显示:以心肌负荷灌注显像作为参考,以 CAG 中 75% 内径狭窄诊断心肌缺血的敏感性和特异性分别为49% 和90%,以50%内径狭窄作为标准时,其敏感性和特异性分别为96%和52%。而在IVUS 检查中,以管腔最小横截面积(MLA)<4 mm2作为诊断心肌缺血的标准时,其敏感性和特异性则高达88%和90%,显著优于CAG。
借助IVUS不仅能相对准确地评估心肌缺血,对冠状动脉临界病变患者的预后同样具有预测价值。PROSPECT 研究[25]是一项来自美国和欧洲的多中心前瞻性注册研究,该研究对入选697 名患者进行 IVUS 检查。3.4 年的随访结果表明,11% 的心血管病事件来自于非罪犯血管的临界病变,其接受介入治疗的比例与罪犯血管再次血运重建率相当。该研究还指出,管腔最小横截面面积(MLA) ≤4 mm2、薄帽纤维粥样斑块(TCFA)和斑块负荷≥ 70%是临界病变患者发生心血管病事件的独立危险因素。
而著名的LITRO 研究[26]针对左主干临界病变患者进行了一项多中心前瞻性注册研究,研究提示左主干 MLA ≥6 mm2作为延迟介入手术的界点是安全有效。
随着越来越多的临床研究对IVUS的应用价值进行肯定,2014年发表的FFR、IVUS及OCT国际介入专家使用共识[13]也做出了相关推荐:对于左主干病变,采用MLA<6.0 mm2作为标准行PCI治疗是必要的;IVUS对斑块形态学的评估是有益的。尽管,该共识并没有对IVUS在非左主干病变中的应用价值作出推荐,但也有部分学者认为MLA<4 mm2应当作为判断非左主干临界病变是否进行PCI治疗的标准。
3.2 OCT在冠状动脉临界病变解剖学评价中的应用 OCT是一种新的高分辨率断层成像模式,它将光学技术与超灵敏探测器合为一体,应用现代计算机图像处理,发展成为一种新兴的断层成像诊断技术。2001年美国麻省总医院Jang等[27]第1次将 OCT应用于冠心病介入领域,从此OCT在冠状动脉介入治疗中的应用逐渐推广,已被广泛用于临床心血管介入治疗中。
3.2.1 OCT在识别易损斑块中的价值 研究表明,在ACS患者中冠状动脉狭窄程度与临床症状不直接相关,对表现为稳定型心绞痛的临界病变患者,给予最佳药物治疗,其急性冠状动脉事件的发生率仍然较高[28]。因此,相对于心绞痛症状的程度,冠状动脉内粥样斑块的性质更是制定适宜治疗策略的重要依据。随着OCT在冠状动脉介入领域的应用,心脏介入医生对冠状动脉内粥样斑块的认识变得更加丰富和具体。
不同类型的动脉粥样斑块在OCT图像上有各自不同的特点:纤维斑块为均质的高信号区,纤维钙化斑块为边缘清晰的低信号区,富脂质斑块为边缘模糊的低信号区[29]。OCT成像,对上述斑块的检测具有很高的敏感性和特异性(纤维斑块71%~79%和97%~98%,纤维钙化斑块95%~96%和97%,脂质斑块90%~94%和90%~92%;κ=0.83~ 0.84,P< 0.01)。OCT的图像特点能够准确反映不同斑块的组织学特点,因此能很好地识别出富含脂质的斑块,这在临界病变的治疗中具有重要价值。冠状动脉粥样斑块的稳定性还与其纤维帽厚度密切相关,薄帽纤维粥样斑块 (thin-cap fibroatheroma,TCFA)更加容易破裂,从而导致急性冠状动脉事件。IVUS受较高分辨率的限制,无法有效识别TCFA,而OCT则以红外光波代替声波探查组织结构,OCT分辨率(2~30 μm)相比于IVUS分辨率(150~200 μm)高出10倍,因此在介入治疗中可用于精确测量斑块纤维帽的厚度,准确地识别易损斑块,预测可能破裂的斑块[30,31]。Jang等[30]研究发现纤维帽厚度≤65 μm的易损斑块在急性心肌梗死患者的冠状动脉血管内病变中占72%,在不稳定型心绞痛患者的血管病变中占50%,在稳定型心绞痛患者的血管病变中仅占20%。斑块纤维帽的平均厚度在急性心肌梗死组、不稳定型心绞痛组和稳定型心绞痛组间差异也有统计学意义。研究者指出,易损斑块的比例越高,纤维帽越薄,患者不良心血管病事件的严重程度就越高[30]。纤维帽周围炎性细胞(主要为巨噬细胞)浸润同样也是易损斑块的主要特点之一。有基础研究显示巨噬细胞内含有大量的吞噬溶酶体可以对纤维帽内基质进行降解,因此测定纤维帽中的巨噬细胞的含量,可以间接评价冠状动脉粥样斑块的易损性。冠状动脉粥样硬化斑块中可能导致斑块破裂的巨噬细胞的大小为20~30 μm,而OCT技术正好可检测到冠状动脉斑块中这些细胞的聚集,其在影像学上主要表现为纤维帽脂质池交界区大片高反射区[32]。Tearney 等[33]的研究表结果显示巨噬细胞的OCT评分和组织学CD68阳性评分之间有较高的正相关性(r= 0.84,P<0.001),OCT对CD68阳性评分>10%的巨噬细胞敏感性和特异性都达到100%。Macnill等[34]发现不稳定心绞痛和心肌梗死患者巨噬细胞的密度、纤维斑块及富含脂质的斑块明显增加,罪犯斑块表面巨噬细胞的密度比非罪犯病变大,破裂斑块表面的巨噬细胞密度比非破裂斑块大,提示斑块局部巨噬细胞密度升高与症状严重程度相关;斑块局部巨噬细胞密度越高,斑块的纤维帽越薄,斑块的稳定性越差;通过测定斑块内巨噬细胞含量可以预测急性事件。
3.2.2 OCT在识别微小夹层及斑块裂隙中的价值
OCT的高分辨率使其能很好地发现冠状动脉血管内微小夹层和斑块裂隙,准确地找到其他检查难以发现的夹层破口。Kubo等[35]对47例急性ST段抬高型心肌梗死的患者同时进行OCT和IVUS检查,研究结果表明:OCT对斑块裂隙检出率为73%,而IVUS对斑块裂隙的检出率仅为40%。
3.3.3 OCT在识别钙化病变及冠状动脉内血栓中的价值 2014年《冠状动脉钙化诊治中国专家共识》[5]指出OCT对钙化病变的识别具有很高的敏感性和特异性(分别为96%,97%)。钙化病变在OCT图像中表现为轮廓明显、边缘清晰的低信号区。除此之外,OCT还被认为是冠状动脉内血栓最有价值的影像学评价方法[4],可以鉴别血栓的性质,其通过红外线信号衰减程度对血栓中红细胞的含量进行衡量,即红细胞含量越高信号衰减越重,红色血栓在OCT成像中表现为突入管腔内的表面高信号区以及头部后方无信号区,白色血栓则表现为均一的低信号影像[4]。
OCT高分辨率和偏振特性使其可以有效识别冠状动脉内易损斑块、检出微小病变和钙化病变、区分冠状动脉内血栓性质,这些功能使其能够为临界病变治疗策略的选择提供有力依据。2014年FFR、IVUS及OCT国际介入专家使用共识[13]推荐指出,OCT用于斑块形态学评估可能获益。
4 冠状动脉临界病有创评价方法的相关性及联合应用价值
4.1 FFR与IVUS在冠状动脉临界病变评价中的相关性
4.1.1 FFR与IVUS在冠状动脉临界病变评价中的相关性 FFR与IVUS之间相关性的探索也是近年来国内外的研究热点。Kern 等[36]对21项冠心病影像学研究进行了荟萃分析,结果表明:与核素心肌灌注显像及超声多巴酚丁胺负荷试验相比,FFR<0.75诊断心肌缺血的敏感性和特异性均显著升高。而在Nishioka等[37]的研究中,IVUS也同样表现出了对心肌缺血极佳的预测能力;该研究中,MLA<4 mm2与心肌单光子发射计算机断层扫描(SPECT)测定的缺血负荷具有很强的相关性,其诊断心肌缺血的敏感性和特异性高达88%和90%。由此可见,FFR和IVUS均能对冠状动脉病变引起的心肌缺血进行有效预测,从而也间接反映了功能学测值与解剖学测值之间存在一定的相关性。
Takagi等[38]首次将FFR与IVUS进行了直接对比,研究者指出,对于同一处冠状动脉病变,由IVUS测定出MLA<3 mm2时,其预测该处病变FFR<0.75的敏感性为83%,特异性为92%;在IVUS 测定的管腔狭窄程度高于60%时,预测该处病变FFR<0.75 的敏感性达92%,而当管腔狭窄程度>70% 时,病变处FFR<0.75的检出率更是达到了100%。除此之外,如果将MLA和管腔狭窄程度进行联合预测,其预测FFR<0.75的敏感性和特异性将会更高(分别为100%和90%)。
多项针对临界病变的冠心病研究也将FFR和IVUS技术进行了对比。Leesar等[39]的研究提示,在对左主干(LMCA)临界病变的评估中,FFR和IVUS具有良好的相关性;该研究中,当IVUS-MLA < 5.9 mm2或IVUS-MLD<2.8mm时,能够较好地预测该处病变FFR<0.75。Park等[40]的研究结果也显示:对于孤立性左主干开口临界病变,预测FFR<0.8的最佳IVUS截值为MLA<4.5 mm2(敏感性77%,特异性82%)。然而,IVUS对FFR的预测并不恒定,Kang等[41]发现,在LMCA临界病变中,预测FFR<0.80的最佳IVUS MLA截止值<4.8 mm2(敏感性89%,特异性83%);预测FFR<0.75的最佳IVUS MLA截止值<4.1 mm2(敏感性95%,特异性83%)。上述研究中,预测FFR缺血阈值(FFR<0.75或FFR<0.80)的IVUS-MLA最佳截值变化较大,其主要原因可能是临界病变的解剖变异或病变本身的复杂性导致它很难凭借单一的解剖学测量值来指导血运重建。尽管如此,部分研究者仍认为IVUS可以在某种程度上预测狭窄病变带来的功能学改变,并以此确定冠状动脉临界病变的严重程度[42]。
FFR和IVUS在非左主干病变中的联合应用也并不少见。Han等[43]研究发现,IVUS预测FFR<0.8的最佳截值为MLA=2.75mm2(AUC :0.646,95% CI= 0.609~0.684),当IVUS-MLA<2.75 mm2时,该处冠状动脉临界病变可能对心肌的血供产生功能性影响。同样的,Waksman等[44]也对350例患者(共计367处临界病变)进行了FFR和IVUS检测,研究结果显示,MLA<3.07 mm2是预测FFR<0.8最佳截值(敏感性64%,特异性64.9%,AUC = 0.65);值得一提的是,当血管内径不同时,IVUS-MLA用以预测FFR<0.80的截值也不尽相同,在直径分别为2.5~3.0 mm、3.0~3.5 mm、>3.5 mm的临界病变中,预测FFR<0.8的最佳MLA 值分别为2.4 mm2(AUC = 0.66)、2. 7 mm2(AUC = 0.71) 、3.6 mm2(AUC = 0.68),在内径较大的血管中,MLA与FFR有着更好的相关性。不仅如此,在不同冠状动脉分支中,FFR与IVUS的相关性也存在一定差异,Kang等[41]的临界病变研究结果显示:在左前降支、左回旋支和右冠状动脉中,预测FFR<0.8的IVUS-MLA最佳截值分别为MLA<2.4 mm2、MLA<1.6 mm2和MLA<2.4 mm2。这些研究均提示:影响冠状动脉血流动力学的因素繁多,仅通过某一特点的IVUS测量值来预测缺血是不合理的;在制定冠状动脉临界病变治疗策略之前,直接可靠的功能学评估仍然必不可少。
4.1.2 FFR与IVUS对治疗冠状动脉临界病变的指导作用 Zuo等[45]将226例临界病变患者分为IVUS指导组、FFR指导组、最佳药物治疗组。术后1年随访结果显示,IVUS指导组接受PCI术的患者比例显著高于FFR指导组;但两组主要心血管不良事件的发生率无明显差别;因此,仅依靠IVUS测定的管腔面积作为介入治疗的标准可能会增加冠心病患者介入治疗的比例。类似的结果也出现在Nam等[46]的队列研究中,该研究共纳入167例冠状动脉临界病变患者,结果显示,相对于FFR指导组,IVUS指导组患者接受PCI治疗的比例更高,但两组患者心血管不良事件的发生率并无显著差异。
事实上,FFR和IVUS在冠状动脉临界病变治疗策略的制定中都占有举足轻重的地位,有良好的互补作用。因此,2014年FFR、IVUS及OCT国际介入专家使用共识[13]做出了推荐:FFR和IVUS均可用于评价左主干狭窄的功能学影响,采用FFR值为0.8或IVUS-MLA截止值为6 mm2评估是否需要血运重建是必要的;对于非左主干病变而言,FFR>0.8时使用药物保守治疗是安全的,然而,该共识并不推荐使用IVUS评价非左主干病变狭窄的功能学意义。
4.2 FFR与OCT在冠状动脉临界病变评价中的相关性 近年来,FFR作为功能学评价方法指导冠状动脉临界病变的治疗取得了很好的临床效果[10,47]。与此同时,OCT以其优良的分辨率为临床医生提供了精确的冠状动脉解剖和病理学信息,也为临界病变治疗策略的制定提供了重要的依据[48,49]。因此,越来越多的研究者开始对二者之间的相关性进行研究,试图寻求FFR值与OCT参数之间的定量关系,由此评估OCT测量值对冠状动脉病变功能学的预测能力。
Stefano等[50]首次描述了FFR和OCT参数之间关系。他们对14例冠心病患者的18处狭窄病变先后进行了FFR和OCT测量。遗憾的是,研究者未能发现FFR和OCT-MLA之间的显著相关性,二者仅在解剖学和生理学参数之间构成了潜在的互补。然而,随后进行的多项样本量更大的临床研究却得出了不同的结论。Shiono等[51]对59例CAD患者的62处临界病变同时进行了FFR和OCT检测,研究结果提示,FFR测值与OCT解剖学参数(包括MLA、MLD以及管腔面积狭窄百分比)有较为显著的相关性。受试者工作特征曲线(ROC)显示,OCT-MLA<1.91 mm2(敏感性93.5%,特异性77.4%)、MLD<1.35 mm(敏感性90.3%,特异性80.6%)和管腔面积狭窄率大于70%(敏感性96.8%,特异性为83.9%)是预测FFR<0.75的最佳截值。在另一项冠状动脉临界病变研究中,Gonzalo等[52]对56例CAD患者(共61处非左主干临界病变)行OCT和FFR检查后,评价了OCT测量参数在血流动力学影响方面的诊断效率。研究结果显示,FFR≤0.80的临界病变共有28处,OCT对该类病变具有较好的诊断效率(AUC :0.74;95% CI:0.61~0.84),其敏感性和特异分别为82%和63%,最佳诊断截值为1.95 mm2。
由此可见,OCT测量的解剖参数和FFR值在冠状动脉临界病变的评价中可能存在一定的相关性,但由于现有研究样本量较小,且FFR值与OCT测量参数尚无统一的截值;2014年FFR、IVUS及OCT国际介入专家使用共识[13]并不推荐常规使用OCT来判定临界病变的功能学意义。目前尚需要更多的大样本随机对照实验对FFR和OCT的相关性及其联合应用价值进行更加深入的研究。
4.3 IVUS与OCT在冠状动脉临界病变评价中的相关性 尽管IVUS和OCT技术均是在形态学和解剖学层面对冠状动脉病变进行评价,两者仍然有各自的特点。IVUS能够提供冠状动脉解剖结构的直观图像,其穿透力和扫描范围较大,可以显示冠状动脉全层的结构,识别斑块性质、测量管腔横截面积等,但其空间分辨率相对较低,图像清晰度较差。OCT具有较高的空间分辨率,但相对于IVUS技术,其穿透力和成像范围较小(表1)。
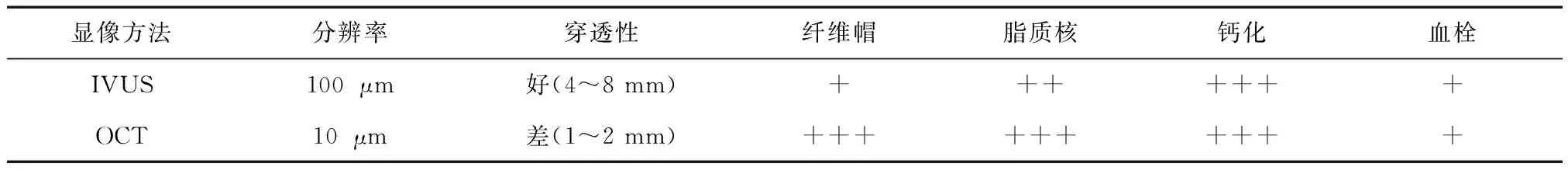
表1 OCT和IVUS 技术对比
+++:敏感性>90%;++:敏感性80%~90%;+:敏感性50%~80%;-:敏感性<50%
4.3.1 判断斑块成分IVUS与OCT均可用于斑块成分的评价。传统的IVUS根据斑块超声回声的强弱对病变斑块的性质进行分类,以血管外膜回声为参照,斑块回声强度表现为脂质斑块≤纤维斑块≤钙化斑块,但在实际应用中,回声特征相近的不同组织往往很难区分。在OCT图像中,纤维斑块、钙化成分及脂质成分均表现为各不相同的信号特点,容易区分,但由于OCT穿透力有限,因此难以评估大型斑块深部的组织构成。
4.3.2 鉴别易损斑块 IVUS具有良好的血管穿透性,能够检测脂质池容积,敏感性达到80%~90%,但是由于其空间分辨率仅100 μm,难以区分纤维帽厚度<70 μm的易损斑块。OCT空间分辨率较高,可以精确地测量易损斑块纤维帽的厚度和纤维帽中巨噬细胞的含量。Kubo等[35]对30例急性心肌梗死患者行OCT和IVUS检查的研究结果显示,OCT较IVUS能更加有效地识别斑块破裂(73% vs 40%,P= 0.009);除此之外,OCT在识别侵蚀斑块、测量斑块纤维帽厚度等方面也优于IVUS检查。
4.3.3 血栓病变、微小夹层和斑块裂隙的识别 由于较高的分辨率,OCT在对该类微小病变的识别中更具优势。对于冠状动脉内血栓而言,常规的IVUS检查仅能根据血栓体积的大小粗略判断血栓的成分,且因受分辨率限制,其难以对微小的附壁血栓进行识别。然而,OCT则由于其较高的分辨率,利用红细胞不透光的物理特点,精确识别出红色血栓和白色血栓。Kubo等[35]的研究证实了以上观点,研究者指出,OCT对血栓病变的识别高达100%,而IVUS仅为33%。除此之外,该研究还证实,OCT对探测微小夹层和斑块裂隙也更加敏感,它对斑块裂隙的检出率为73%,而IVUS仅为40%。
4.3.4 评价管腔狭窄程度 OCT和 IVUS均可用于精确测定冠状动脉管腔面积及狭窄程度,但其预测冠状动脉功能性狭窄的截值却存在差异。在非左主干病变中,IVUS-MLA<3 mm2被认为预测FFR<0.75的有效阈值[38],但有研究[53,54]报道显示,对于同一处病变,OCT测量的冠状动脉管腔尺寸较IVUS的测值偏小。Yamaguchi等[53]的研究发现,在对冠状动脉管腔面积的测量上,OCT-MLA的数值明显小于IVUS-MLA(平均误差0.4 mm2)。此外,Gonzalo等[54]的研究还以FFR作为标准,以此来评价OCT和IVUS对于血管狭窄严重程度的预测能力,研究结果显示,OCT和IVUS均在不同程度上高估了真实的管腔面积(即低估了病变的狭窄程度);在管腔直径>3 mm的冠状动脉血管中,IVUS与OCT预测功能力学异常时的阈值无明显差异;而在直径<3 mm的小血管中,FFR<0.75时所对应的IVUS-MLA测值大于OCT-MLA测值[(1.67±0.54)mm2vs (1.11±0.53 mm2)]。研究者指出,应用OCT评价冠状动脉临界病变狭窄程度可能比IVUS更加有效,这种优势是在直径<3 mm的冠状动脉血管中更加显著。
综上所述,IVUS和OCT作为冠状动脉病变解剖学检查的有效手段,其作用有一定重叠性的同时也各具优劣。IVUS的高组织穿透力和OCT的高分辨率在冠状动脉临界病变的评价中呈现出良好的互补作用,其联合应用或许能够为临界病变治疗决策的制定提供更加全面的证据。
5 结语
冠状动脉临界病变患者的管理一直以来都是冠心病领域中一个重要且富有争议的临床话题。本综述回顾了目前常用的临界病变有创评价方法,对FFR、IVUS及OCT各自的特点、相关性及联合应用价值做了简要的描述和展望。就现有的研究证据而言,评价临界病变的功能学指标(FFR)和解剖学参数(OCT与IVUS)之间有良好的相关性,这三种技术分别代表了冠状动脉狭窄严重程度功能学和解剖学的金标准。正因如此,在FFR、IVUS及OCT技术的有效指导下,临界病变治疗将会更加合理,该类患者的临床预后也将得到进一步改善。
此外,对于冠状动脉临界病变而言,上述有创检查方法也存在各自的局限性,FFR尽管能够较为准确地检测血流动力学状态,但其在斑块性质的识别上存在明显的不足,而IVUS及OCT技术的应用恰恰可以对这些病变信息进行良好的补充。因此,在临界病变患者中,通过整合FFR、OCT和IVUS获取的信息能够更加全面地对病变特点进行评价,在此指导下的血运重建术或最佳药物治疗可能将在更大程度上改善患者的临床预后。然而,目前仍然缺乏足够的随机对照研究数据支持这一观点;但可以预见的是,更多的大样本随机对照研究将会对这些技术的联合应用进行更加深入的讨论,它们将会为冠心病患者临界病变治疗策略的选择提供更多的有力参考依据。
[1] Tobis J,Azarbal B,Slavin L.Assessment of intermediate severity coronary lesions in the catheterization laboratory[J].J Am Coll Cardiol,2007,49(8):839-848.
[2] Glaser R,Selzer F,Faxon DP,et al.Clinical progression of incidental,asymptomatic lesions discovered during culprit vessel coronary intervention[J].Circulation,2005,111(2):143-149.
[3] Tonino PA,Fearon WF,De Bruyne B,et al.Angiographic versus functional severity of coronary artery stenoses in the FAME study fractional flow reserve versus angiography in multivessel evaluation[J].J Am Coll Cardiol.2010,55(25):2816-2821.
[4] Fujii K,Hao H,Ohyanagi M,et al.Intracoronary imaging for detecting vulnerable plaque[J].Circ J,2013,77(3):588-595.
[5] 王伟民,霍勇,葛均波.冠状动脉钙化病变诊治中国专家共识[J].中国介入心脏病学杂志,2014,22(2):69-73.
[6] Beller GA,Zaret BL.Contributions of nuclear cardiology to diagnosis and prognosis of patients with coronary artery disease[J].Circulation,2000,101(12):1465-1478.
[7] Nakamura M.Angiography is the gold standard and objective evidence of myocardial ischemia is mandatory if lesion severity is questionable.- Indication of PCI for angiographically significant coronary artery stenosis without objective evidence of myocardial ischemia (Pro)- [J].Circ J,2011,75(1):204-210.
[8] Pijls NH,De Bruyne B,Peels K,et al.Measurement of fractional flow reserve to assess the functional severity of coronary-artery stenoses[J].N Engl J Med,1996,334(26):1703-1708.
[9] De Bruyne B,Pijls NH,Kalesan B,et al.Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease[J].N Engl J Med,2012,367(11):991-1001.
[10]Pijls NH,van Schaardenburgh P,Manoharan G,et al.Percutaneous coronary intervention of functionally nonsignificant stenosis:5-year follow-up of the DEFER Study[J].J Am Coll Cardiol,2007,49(21):2105-2111.
[11]Pijls NH,Fearon WF,Tonino PA,et al.Fractional flow reserve versus angiography for guiding percutaneous coronary intervention in patients with multivessel coronary artery disease:2-year follow-up of the FAME (Fractional Flow Reserve Versus Angiography for Multivessel Evaluation) study[J].J Am Coll Cardiol,2010,56(3):177-184.
[12]Akasaka T.What can we expect in PCI in patients with chronic coronary artery disease-Indication of PCI for angiographically significant coronary artery stenosis without objective evidence of myocardial ischemia (Con)- [J].Circ J,2011,75(1):211-217,210.
[13]Lotfi A,Jeremias A,Fearon WF,et al.Expert consensus statement on the use of fractional flow reserve,intravascular ultrasound,and optical coherence tomography:a consensus statement of the Society of Cardiovascular Angiography and Interventions[J].Catheter Cardiovasc Interv,2014,83(4):509-518.
[14]Kolh P,Windecker S,Alfonso F,et al.2014 ESC/EACTS Guidelines on myocardial revascularization:the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS).Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI) [J].Eur J Cardiothorac Surg,2014,46(4):517-592.
[15]Nicholls SJ,Sipahi I.Emerging role of intravascular ultrasound in the assessment of experimental anti-atherosclerotic therapies[J].Curr Med Chem,2006,13(15):1727-1734.
[16]Takano M,Mizuno K,Okamatsu K,et al.Mechanical and structural characteristics of vulnerable plaques:analysis by coronary angioscopy and intravascular ultrasound[J].J Am Coll Cardiol,2001,38(1):99-104.
[17]Muller JE,Abela GS,Nesto RW,et al.Triggers,acute risk factors and vulnerable plaques:the lexicon of a new frontier[J].J Am Coll Cardiol,1994,23(3):809-813.
[18]Fox JJ,Strauss HW.One step closer to imaging vulnerable plaque in the coronary arteries[J].J Nucl Med,2009,50(4):497-500.
[19]Mintz GS,Nissen SE,Anderson WD,et al.American College of Cardiology Clinical Expert ConsensusDocument on Standards for Acquisition,Measurement and Reporting of Intravascular Ultrasound Studies (IVUS).A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents[J].J Am Coll Cardiol,2001,37(5):1478-1492.
[20] Langer HF,Haubner R,Pichler BJ,et al.Radionuclide imaging:a molecular key to the atherosclerotic plaque[J].J Am Coll Cardiol,2008,52(1):1-12.
[21]Fuster V,Fayad ZA,Badimon JJ.Acute coronary syndromes:biology.Lancet,1999,353 Suppl 2:SII5-9.
[22]Williams M,Shaw LJ,Raggi P,et al.Prognostic value of number and site of calcified coronary lesions compared with the total score[J].JACC Cardiovasc Imaging,2008,1(1):61-69.
[23]Koschyk DH,Meinertz T,Nienaber CA.Images in cardiovascular medicine.Intravascular ultrasound for stent implantation in aortic dissection[J].Circulation,2000,102(4):480-481.
[24]Auer J,Punzengruber C,Berent R,et al.Spontaneous coronary artery dissection involving the left main stem:assessment by intravascular ultrasound[J].Heart,2004,90(7):e39.
[25]Stone GW,Maehara A,Lansky AJ,et al.A prospective natural-history study of coronary atherosclerosis[J].N Engl J Med,2011,364(3):226-235.
[26]de la Torre Hernandez JM,Hernández HF,Alfonso F,et al.Prospective application of pre-defined intravascular ultrasound criteria for assessment of intermediate left main coronary artery lesions results from the multicenter LITRO study[J].J Am Coll Cardiol,2011,58(4):351-358.
[27]Jang IK,Bouma BE,Kang DH,et al.Visualization of coronary atherosclerotic plaques in patients using optical coherence tomography:comparison with intravascular ultrasound[J].J Am Coll Cardiol,2002,39(4):604-609.
[28]Rzeczuch K,Szajn G,Jankowska E,et al.borderline coronary lesions may lead to serious coronary events--long-term outcome in 65 conservatively treated patients[J].Kardiol Pol,2005,63(7):50-56.
[29]Yabushita H,Bouma BE,Houser SL,et al.Characterization of human atherosclerosis by optical coherence tomography[J].Circulation,2002,106(13):1640-1645.
[30]Jang IK,Tearney GJ,MacNeill B,et al.In vivo characterization of coronary atherosclerotic plaque by use of optical coherence tomography[J].Circulation,2005,111(12):1551-1555.
[31]Kato K,Yonetsu T,Kim SJ,et al.Nonculprit plaques in patients with acute coronary syndromes have more vulnerable features compared with those with non-acute coronary syndromes:a 3-vessel optical coherence tomography study[J].Circ Cardiovasc Imaging[J].2012,5(4):433-440.
[32]van Soest G,Goderie T,Regar E,et al.Atherosclerotic tissue characterization in vivo by optical coherence tomography attenuation imaging[J].J Biomed Opt,2010,15(1):011105.
[33]Tearney GJ,Yabushita H,Houser SL,et al.Quantification of macrophage content in atherosclerotic plaques by optical coherence tomography[J].Circulation,2003,107(1):113-119.
[34]MacNeill BD,Jang IK,Bouma BE,et al.Focal and multi-focal plaque macrophage distributions in patients with acute and stable presentations of coronary artery disease[J].J Am Coll Cardiol,2004,44(5):972-979.
[35]Kubo T,Imanishi T,Takarada S,et al.Assessment of culprit lesion morphology in acute myocardial infarction:ability of optical coherence tomography compared with intravascular ultrasound and coronary angioscopy[J].J Am Coll Cardiol,2007,50(10):933-939.
[36]Kern MJ,Samady H.Current concepts of integrated coronary physiology in the catheterization laboratory[J].J Am Coll Cardiol,2010,55(3):173-185.
[37]Nishioka T,Amanullah AM,Luo H,et al.Clinical validation of intravascular ultrasound imaging for assessment of coronary stenosis severity:comparison with stress myocardial perfusion imaging[J].J Am Coll Cardiol,1999,33(7):1870-188.
[38]Takagi A,Tsurumi Y,Ishii Y,et al.Clinical potential of intravascular ultrasound for physiological assessment of coronary stenosis:relationship between quantitative ultrasound tomography and pressure-derived fractional flow reserve[J].Circulation,1999,100(3):250-255.
[39]Leesar MA,Masden R,Jasti V.Physiological and intravascular ultrasound assessment of an ambiguous left main coronary artery stenosis[J].Catheter Cardiovasc Interv,2004,62(3):349-357.
[40]Park SJ,Ahn JM,Kang SJ,et al.Intravascular ultrasound-derived minimal lumen area criteria for functionally significant left main coronary artery stenosis[J].JACC Cardiovasc Interv,2014,7(8):868-74.
[41]Kang SJ,Ahn JM,Song H,et al.Usefulness of minimal luminal coronary area determined by intravascular ultrasound to predict functional significance in stable and unstable angina pectoris[J].Am J Cardiol,2012,109(7):947-953.
[42]McDaniel MC,Eshtehardi P,Sawaya FJ,et al.Contemporary clinical applications of coronary intravascular ultrasound[J].JACC Cardiovasc Interv,2011,4(11):1155-1167.
[43]Han JK,Koo BK,Park KW,et al.Optimal intravascular ultrasound criteria for defining the functional significance of intermediate coronary stenosis:an international multicenter study[J].Cardiology,2014,127(4):256-262.
[44]Waksman R,Legutko J,Singh J,et al.FIRST:Fractional Flow Reserve and Intravascular Ultrasound Relationship Study[J].J Am Coll Cardiol,2013,61(9):917-923.
[45]Zuo H,Liu Q,Zhang Z,et al.Outcomes of percutaneous coronary intervention for intermediate coronary artery disease guided by intravascular ultrasound or fractional flow reserve[J].Nan Fang Yi Ke Da Xue Xue Bao,2014,34(5):704-708.
[46]Nam CW,Yoon HJ,Cho YK,et al.Outcomes of percutaneous coronary intervention in intermediate coronary artery disease:fractional flow reserve-guided versus intravascular ultrasound-guided[J].JACC Cardiovasc Interv,2010,3(8):812-817.
[47]Pijls NH,Fearon WF,Tonino PA,et al.Fractional flow reserve versus angiography for guiding percutaneous coronary intervention in patients with multivessel coronary artery disease:2-year follow-up of the FAME (Fractional Flow Reserve Versus Angiography for Multivessel Evaluation) study[J].J Am Coll Cardiol,2010,56(3):177-184.
[48]Takarada S,Imanishi T,Liu Y,et al.Advantage of next-generation frequency-domain optical coherence tomography compared with conventional time-domain system in the assessment of coronary lesion[J].Catheter Cardiovasc Interv,2010,75(2):202-206.
[49]Kataiwa H,Tanaka A,Kitabata H,et al.Head to head comparison between the conventional balloon occlusion method and the non-occlusion method for optical coherence tomography[J].Int J Cardiol,2011,146(2):186-190.
[50]Stefano GT,Bezerra HG,Attizzani G,et al.Utilization of frequency domain optical coherence tomography and fractional flow reserve to assess intermediate coronary artery stenoses:conciliating anatomic and physiologic information[J].Int J Cardiovasc Imaging,2011,27(2):299-308.
[51]Shiono Y,Kitabata H,Kubo T,et al.Optical coherence tomography-derived anatomical criteria for functionally significant coronary stenosis assessed by fractional flow reserve[J].Circ J,2012,76(9):2218-2225.
[52]Gonzalo N,Gonzalo N,Escaned J,et al.Morphometric assessment of coronary stenosis relevance with optical coherence tomography:a comparison with fractional flow reserve and intravascular ultrasound[J].J Am Coll Cardiol,2012,59(12):1080-1089.
[53]Yamaguchi T,Terashima M,Akasaka T,et al.Safety and feasibility of an intravascular optical coherence tomography image wire system in the clinical setting[J].Am J Cardiol,2008,101(5):562-567.
[54]Gonzalo N,Serruys PW,García-García HM,et al.Quantitative ex vivo and in vivo comparison of lumen dimensions measured by optical coherence tomography and intravascular ultrasound in human coronary arteries[J].Rev Esp Cardiol,2009,62(6):615-624.
The functional and anatomy invasive assessment of intermediate coronary lesionsand the relationship of their predictive value for the clinical signicance of coronary artery stenoses
CHEN Wei1,2,CHENG Biao2△
R541.4; R445.1; R540.4+6
B
1672-6170(2016)03-0162-09
2016-01-27;
2016-03-26)
△通讯作者,硕士生导师
