抗磷脂综合征7例患者临床、影像及病理特点分析
2016-06-23傅珏周月平余莎莎安金朱德生
傅珏 周月平 余莎莎 安金 朱德生
抗磷脂综合征7例患者临床、影像及病理特点分析
傅珏周月平余莎莎安金朱德生
344000 南昌大学抚州医学院病理教研室(傅珏、余莎莎);南昌大学第五附属医院细胞室(周月平),病理科(安金);200040 复旦大学附属华山医院神经内科(朱德生)
摘要:目的探讨抗磷脂综合征(antiphospholipid syndrome,APS)的临床表现、生化检查、神经影像和皮肤病理特点。方法回顾性分析7例诊断为APS患者的临床资料、神经影像和皮肤病理资料。结果慢性起病3例,临床表现为反复头痛、记忆力下降为主;神经影像学检查结果示病灶分布于大脑皮质下白质及侧脑室旁白质,呈脑梗死或脱髓鞘改变,颅内中等血管狭窄、小血管闭塞或继发扩张;皮肤活检病理检查:光镜示真皮内小血管周围少量淋巴细胞浸润,电镜示上皮组织下小血管管壁增厚、管腔狭窄或闭塞。结论APS以反复头痛或脑梗死为主要临床表现,影像学以多灶性、不对称性、脑白质缺血或脱髓鞘信号改变为特点,皮肤病理检查以小血管狭窄或闭塞为特点。熟悉APS的临床、影像学与病理学特点有利于对其做出早期诊断。
关键词:抗磷脂综合征;临床特征;神经影像;皮肤病理
抗磷脂抗体综合征(antiphospholipid syndrome,APS)是一种非特异性的自身免疫性疾病,是由抗磷脂抗体引起的临床上以血栓形成、习惯性流产或伴血小板减少为特征的症候群[1]。目前,有关免疫炎症性脑血管病的研究日益受到国内外学者的重视,而针对APS致中枢神经病变的研究较少,临床易误诊。本文收集了7例以中枢神经症状为首发临床表现就诊的APS患者的临床资料,并对其中枢神经影像及皮肤病理特点进行分析,旨在提高对本病的认识。
1对象和方法
1.1对象收集2009-01-2014-12就诊于作者医院神经内科确诊的APS患者7例,诊断符合2006年Sapporo最新APS诊断标准[2]:至少同时符合1条临床诊断标准和1条实验室诊断标准,前者包括临床出现血管栓塞或病态妊娠事件;后者包括2次或2次以上(每次间隔至少12周)血浆狼疮抗凝物阳性,血清或血浆抗心磷脂抗体阳性、抗β2糖蛋白I抗体阳性。其中男2例,女5例;年龄28~61岁,平均(44.8±11.6)岁;病程 1~185 d,病程中位数为42 d,四分位数间距为118 d。
1.2方法回顾性分析本组病例的临床表现、生化,中枢神经影像学和皮肤组织病理学检查资料。神经影像学检查包括头颅CT、MRI、MRA及DSA等。皮肤组织活检取材于患者右股外侧皮肤或者左外踝皮肤组织,带皮组织大小0.5 cm×0.4 cm×0.2 cm,石蜡包埋,制成4~8 μm厚组织切片,行HE 染色、油铅染色,分别置光镜和电镜下观察皮肤组织病理学改变。所有检查经患者或患者家属知情同意。
2结果
2.1临床表现与生化检查 7例患者中,急性起病(≤1个月)2例,亚急性起病(1~3个月)2例,慢性起病(≥3个月)3例。行腰穿脑脊液检查4例。有前驱病史者3例,6例患者有习惯性流产、静脉窦血栓、血小板减少性紫癜、系统性红斑狼疮等既往病史。各例患者临床、生化检查特点见表1和表2。
2.2神经影像学改变 7例患者均行头颅CT+MRI平扫检查,其中5例行头颅MRI增强检查病灶呈多灶性、不对称性、皮层下或深部脑白质受累为主。具体结果见表2。病灶呈缺血性信号改变,主要为脑白质细胞毒性水肿(脑梗死)或脱髓鞘信号改变,颅脑CT均呈低或等密度,MRI呈长T1、长T2信号;2例患者T2 FLAIR像呈高信号、DWI像未见异常信号,提示脱髓鞘改变,其中1例患者抗血小板治疗后复查MRI T2 FLAIR像提示高信号减弱或消失,另1例不同白质部位观察到新发的脱髓鞘高信号;3例脑梗死患者DWI像呈高信号;MRI增强未见强化信号。
7例患者行头颅MRA检查,2例行DSA检查。MRA检查结果示颅内中等血管(大脑前动脉、大脑中动脉、大脑后动脉)局部或多节段狭窄或者闭塞2例;DSA检查结果示小血管狭窄或继发局部扩张2例。某2例APS患者典型影像学表现见图1、2。
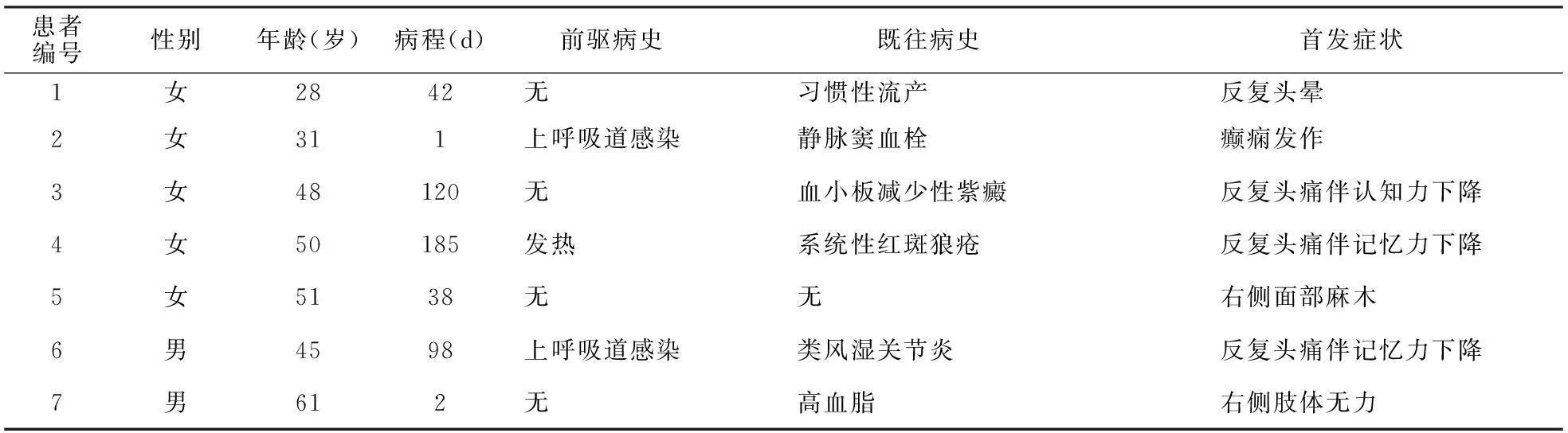
表 1 7例APS患者临床特点
注:APS:抗磷脂抗体综合征,表2、图1~2同
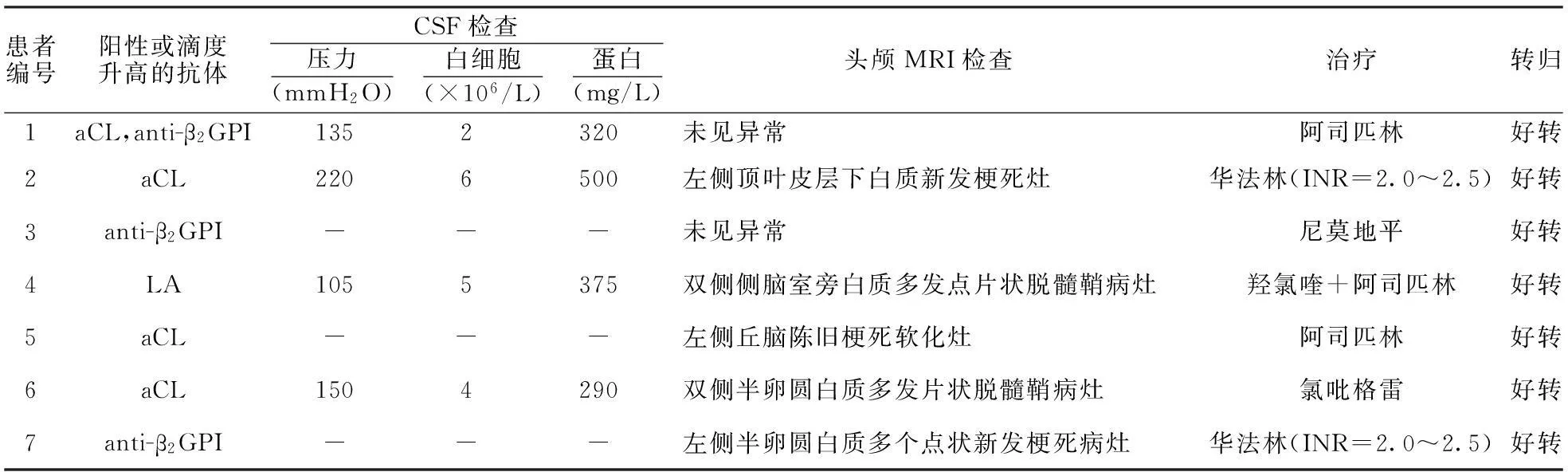
表 2 7例APS患者生化、影像学特点及治疗转归
注:1 mmH2O=9.80×10-3kPa;CSF:脑脊液;aCL:抗心磷脂抗体;anti-β2GPI:抗β2糖蛋白I抗体;LA:狼疮抗凝物抗体;INR:国际标准化比值;-:未检测

A:头颅CT检查结果未见异常;B:头颅MRI T1像显示左侧顶叶半卵圆区白质多个低信号病灶(箭头所示);C:MRI T2像示病灶呈高信号(箭头所示);D:DWI示多个点状病灶呈高信号(箭头所示);E:头颅MRA检查结果示左侧大脑前动脉起始部缺失,左侧大脑中动脉及右侧大脑前动脉局部信号变浅变细(箭头所示);F:DSA检查示左侧大脑前及大脑中动脉供血区域微血管扩张(箭头所示)
图1APS患者(61岁,病例7)影像学检查结果
A:头颅MRI T1像检查示双侧侧脑室旁脑白质低信号病灶,右侧明显(箭头所示);B:MRI T2像检查示病灶呈高信号(箭头所示);C:DWI像未见异常信号;D:冠状位FLAIR像示双侧侧脑室旁脑白质多发点片状高信号(箭头所示);E:头颅MRA检查示颅内中等血管未见异常;F:DSA检查示右侧大脑前及大脑中动脉供血区域局部微血管扩张(箭头所示)
图2APS患者(50岁,病例4)影像学检查结果
2.3病理学检查 3例患者行皮肤活检,光镜下观察显示:2例患者皮肤真皮浅层胶原纤维增生,小血管壁周围轻度水肿及少量淋巴细胞浸润,管腔内可见红细胞聚集(图3A);1例未见异型的鳞状上皮,真皮内未见出血、坏死及水肿,小血管及汗腺未见炎性细胞浸润;电镜下观察示:2例患者皮肤组织上皮细胞结构清楚,毛细血管管壁较厚,结构紊乱,部分小血管整个管腔闭塞(图3B);1例患者上皮下结缔组织内小血管壁增厚,少数小血管管腔狭窄或闭塞,内皮细胞胞质内有大量空泡结构,某些血管壁结构紊乱,管腔内见胞质脱落物。

A:光镜下观察示真皮浅层胶原纤维增生,小血管壁周围轻度水肿及少量淋巴细胞浸润(箭头所示,HE ×10);B:电镜下观察示上皮组织下小血管管壁增厚、管腔狭窄或闭塞(箭头所示,油铅染色 ×2500)
图3APS(病例4)患者外踝皮肤组织病理活检结果
3讨论
APS是由抗磷脂抗体引起的自身免疫性疾病,最早由Hughes于1983年提出,亦称抗磷脂-血栓综合征,其发病机制尚不明确。血清中存在抗磷脂抗体是其发病的关键因素。抗磷脂抗体主要包括抗心磷脂抗体、狼疮抗凝物、抗β2糖蛋白I抗体等。抗心磷脂抗体是目前所知能直接诱发血液高凝状态的唯一自身抗体,它与缺血性脑血管病密切相关,尤其与无高血压、高血脂或糖尿病等典型危险因素的青年缺血性脑卒中相关。Neville等对415例APS患者开展的前瞻性队列研究表明,抗心磷脂抗体可促进血小板的活化和聚集,抗心磷脂抗体是独立于高脂血症、高血压、糖尿病、吸烟和年龄等之外的缺血性脑血管病独立危险因素[3]。Blank等动物实验研究结果也支持抗β2糖蛋白I抗体具有特异性的致病作用,包括血栓形成及胎儿流失[4]。Dieude等研究表明系统性红斑狼疮患者狼疮抗凝物与血栓风险增加呈正相关[5]。APS 的病因包括自身免疫性疾病、肿瘤、感染和炎性反应等,其中最常见的是系统性红斑狼疮,文献报道系统性红斑狼疮合并APS的发生率为20%~50%[6]。本组APS患者出现习惯性流产、静脉窦血栓、血小板减少性紫癜、系统性红斑狼疮等血栓性、免疫性疾病史伴上呼吸道感染前驱病史,并存在抗磷脂抗体阳性或滴度升高等生化免疫异常,提示抗体介导的自身免疫反应在APS的发病中起重要作用。
血栓事件是APS的一个重要标志,由于血液循环中存在抗磷脂抗体,易导致血液呈高凝状态而形成血栓。国外有研究结果显示,APS患者中总的血栓事件发生率为87.9%,血栓发生率最高的是深静脉血栓,占31.7%,脑梗死发生率为13.1%[7]。成年APS患者以脑梗死和短暂性脑缺血发作为首发症状,具体可表现为发作性黑曚、感觉异常与眩晕等[8]。除了急性脑卒中症状外,也可发展为血管性痴呆。国外Menon 等研究显示在继发于系统性红斑狼疮的APS患者中,抗心磷脂抗体与认知功能障碍有关[9]。本组患者2例急性起病,2例亚急性起病,3例慢性起病,急性及亚急性起病患者以脑梗死症状为主要临床表现,其他症状包括头晕、症状性癫痫等;慢性起病患者以反复头痛、记忆力或认知力下降为主要临床表现。
本组APS患者中枢神经影像特点表现为多灶性、不对称性、皮层下或深部脑白质分布为主,病灶可在不同时间反复消失或新发,病灶呈缺血性信号改变,主要为白质脱髓鞘或细胞毒性水肿信号改变。典型病灶头颅CT呈低或等密度,而微小病灶不易观察;MRI检查能发现皮层下白质或深部白质病灶,并呈长T1、长T2信号改变,急性脑梗死患者DWI呈高信号伴ADC值降低,而发生活动性脑白质脱髓鞘患者T2 FLAIR像呈高信号伴ADC值升高。国外有研究结果显示,颅内中小血管狭窄或闭塞易发生脑血栓事件,而颅内微小动静脉闭塞易诱发脑白质脱髓鞘改变[10]。本组APS患者虽然影像学检查提示颅内病灶为散在的非特异性小软化灶,且病灶不能解释病灶与头痛的关系,但皮层、皮层下及基底节区白质病灶的出现与头晕、记忆力下降等临床症状有关。Hanly最新研究结果显示APS患者轻度痴呆症状与脑白质脱髓鞘损害有关[11]。因此,当青年患者临床出现反复头痛、记忆力下降,特别是伴有神经影像学检查示多发腔隙性脑梗死或脑白质脱髓鞘病变患者,尚需排除APS的可能。头颅MRA大多仅能发现一、二级颅内血管有轻度狭窄或闭塞,可以提供责任血管,而DSA检查在观察颅内微小血管时仅仅提示局部乏血管区或微血管扩张,这可能与抗磷脂抗体的免疫反应损伤脑微小血管内皮细胞,导致血液凝血功能障碍、微小血管狭窄或继发扩张有关。
由于APS患者血液中抗磷脂抗体的存在,易引起血管内皮细胞损伤,导致多系统、多脏器、微小血管血栓形成,但其临床表现与神经影像特点难以与中枢神经系统血管炎相鉴别。本组3例患者为明确诊断进行了皮肤活检病理检查,结果显示:APS的基本病理改变是动静脉血管内血栓形成,导致管腔狭窄或闭塞,光镜下表现为红细胞聚集、淋巴细胞浸润的特点,而电镜下可观察到微小血管管腔闭塞。目前,国内外对APS皮肤组织与脑组织活检的病理研究甚少,仅有的文献资料多局限于小鼠皮肤与脏器组织的病理观察,临床尚无公认的病理诊断标准。国外针对1例APS意外死亡患者尸检的研究显示,患者心脑肾小动脉以及毛细血管内有大量透明血栓形成[12]。另外,Nayer等也仅报道了灾难性APS患者存在脑组织血栓性微血管病理改变[13]。因此,抗磷脂抗体是一个潜在的多脏器、微小血管栓塞事件的危险因素。由于脑活检属有创检查,患者依从性差,故对于疑似APS患者广泛开展脑组织活检尚有很大难度,而皮下组织微创活检,取材部位可为下肢外踝或股外侧皮肤,创伤小、操作简单、便于开展,临床上对于探讨APS病理特点及开展结缔组织疾病如血管炎等的鉴别诊断有一定帮助。
综上所述,APS以反复头痛或脑梗死为主要临床表现,影像学以多灶性、不对称性、皮层下或基底节区脑白质缺血或脱髓鞘信号改变为特点,皮肤病理特点为小血管狭窄或闭塞。熟悉APS的临床、影像与病理学特点有助于对其进行早期诊断。
参考文献:
[1]Bertolaccini ML, Amengual O, Andreoli L, et al. 14th International Congress on Antiphospholipid Antibodies Task Force. Report on antiphospholipid syndrome laboratory diagnostics and trends [J]. Autoimmun Rev, 2014, 13(9):917-930.
[2]Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS) [J]. J Thromb Haemost, 2006, 4(2):295-306.
[3]Neville C, Rauch J, Kassis J, et al. Antiphospholipid antibodies predict imminent vascular events independently from other risk factors in a prospective cohort [J]. Thromb Haemost, 2009, 101(1):100-107.
[4]Blank M, Baraam L, Eisenstein M, et al. beta2-Glycoprotein-I based peptide regulate endothelial-cells tissue-factor expression via negative regulation of pGSK3beta expression and reduces experimental-antiphospholipid-syndrome [J]. J Autoimmun, 2011, 37(1):8-17.
[5]Dieude M, Correa JA, Neville C, et al. Association of autoantibodies to heat-shock protein 60 with arterial vascular events in patients with antiphospholipid antibodies[J]. Arthritis Rheum, 2011, 63(8):2416-2424.
[6]Matyja-Bednarczyk A, Swadzba J, Iwaniec T, et al. Risk factors for arterial thrombosis in antiphospholipid syndrome [J]. Thromb Res, 2014, 133(2):173-176.
[7]Rodriguez GJ, Khamashta MA. Clinical advances of interest in the diagnosis and treatment of patients with antiphospho-lipid syndrome [J]. Rev Clin Esp(Barc), 2013, 213(2):108-113.
[8]王露. 抗磷脂综合征的神经系统表现[J]. 中国神经免疫学和神经病学杂志, 2013,20(1):55-58.
[9]Menon S, Rahman MA, Ravirajan CT, et al. The production, binding characteristics and sequence analysis of four human IgG monoclonal antiphospholipid antibodies [J]. J Autoimmun, 1997, 10(1):43-57.
[10]Oku K, Amengual O, Atsumi T. Pathophysiology of thrombosis and pregnancy morbidity in the antiphospholipid syndrome [J]. Eur J Clin Invest, 2012, 42(10):1126-1135.
[11]Hanly JG. Antiphospholipid syndrome: an overview [J]. CMAJ, 2003, 168(13):1675-1682.
[12]Sciascia S, Sanna G, Murru V, et al. Anti-prothrombin (aPT) and anti-phosphatidylserine/prothrombin (aPS/PT) antibodies and the risk of thrombosis in the antiphospholipid syndrome. A systematic review [J]. Thromb Haemost, 2014, 111(2):354-364.
[13]Nayer A, Ortega LM. Catastrophic antiphospholipid syndrome: a clinical review [J]. J Nephropathol, 2014, 3(1):9-17.
(本文编辑:时秋宽)
Study on clinical manifestation, imaging and pathology features of 7 patients with antiphospholipid syndrome
FUJue,ZHOUYueping,YUShasha,ANJin,ZHUDesheng*.
*DepartmentofNeurology,HuashanHospital,FudanUniversity,Shanghai200040,ChinaCorresponding author: ZHU Desheng, Email: deshengzhu2008@sina.com
ABSTRACT:ObjectiveTo explore the clinical manifestation, biochemical examinations, neuroimaging and pathological characteristics of antiphospholipid syndrome (APS). MethodsThe clinical, neuroimaging and pathological data of 7 APS patients, diagnosed by serum antibody with thrombus or miscarriages events, were analyzed retrospectively. ResultsThe onset of the disease was chronic in 3 patients with recurring headache and declined memory. Lesions were distributed in subcortical and periventricular white matter, and mostly presented with multiple infarcts and demyelination on neuroimaging. Stenosis was observed in the intracranial medium vessels and occlusion or secondary expansions were observed in the small vessels. Small number of lymphocytes around the small vessels in derma were observed under a light microscope. Electronmicroscopy showed that capillary walls were thickened, and stenosis or totally occlusion were observed in some small vessels. ConclusionsRecurrent headaches and cerebral infarction are the main clinical manifestations of APS. Signal changes of multiple cerebral ischemia and demyelinating, asymmetrically involved in both lobes of the brain white matter, are the imaging characteristics of APS patients. Microvascular stenosis or occlusions are the main pathological changes. These clinical, imaging and pathological features are helpful in early diagnosis of neurological APS.
Key words:antiphospholipid syndrome; clinical manifestation; neuroimaging; skin pathology
doi:10.3969/j.issn.1006-2963.2016.01.007
基金项目:中国博士后基金面上资助项目(2014M560297);江西省卫生厅科技计划资助项目(20112025);医学院科技重点课题资助项目(CDFY-KJ1504)
通讯作者:朱德生, Email:deshengzhu2008@sina.com
中图分类号:R593.2
文献标识码:A
文章编号:1006-2963 (2016)01-0029-05
(收稿日期:2015-08-11)
