JAK2/STAT3通路介导热休克蛋白70对脑出血的神经保护作用
2016-06-23袁志俊李小刚何晓英
袁志俊 李小刚 何晓英
JAK2/STAT3通路介导热休克蛋白70对脑出血的神经保护作用
袁志俊李小刚何晓英
646000四川医科大学附属第一医院神经内科
摘要:目的观察蛋白酪氨酸激酶2/信号转导和转录激活因子3 (janus kinase 2-signal transducer and activator of transcription 3,JAK2/STAT3)信号通路特异性拮抗剂α-氰基-(3,4-羟基)N-苄苯乙烯胺〔alpha cyano-(3-hydroxy) N-styrene benzyl amine,AG-490〕对脑出血大鼠脑组织热休克蛋白70(heat shock protein 70,HSP70)、磷酸化蛋白酪氨酸激酶 2(phosphorylated janus kinase 2, P-JAK2)、磷酸化信号转导和转录激活因子 3(phosphorylated signal transducer and activator of transcription 3,P-STAT3)表达的影响,并分析HSP70与P-JAK2、P-STAT3的相关性,探讨JAK2/STAT3信号通路是否介导HSP70对大鼠脑出血后的神经保护作用。 方法将健康雄性Sprague-Dawley(SD)大鼠100只随机分为正常组、假手术组、脑出血和AG-490组;采用大鼠自体血注入法建立脑出血模型;各组按造模成功后时间分为6 h、24 h、48 h、72 h、7 d共5个亚组,对各组大鼠进行神经功能缺损评分(neurological severity scores,NSS);免疫组化染色检测血肿周围HSP70表达,采用Western blot检测大鼠血肿周围脑组织P-JAK2、P-STAT3的表达。结果脑出血组和AG-490组HSP70、P-JAK2、P-STAT表达均高于假手术组和正常组(P<0.05),并于造模后48 h达高峰(P<0.05);AG-490组HSP70、P-JAK2、P-STAT表达较脑出血组低(P<0.05);脑出血组HSP70表达与NSS评分呈负相关(r=-0.511,P<0.05),HSP70表达与P-JAK2、P-STAT3的表达呈正相关(r=0.790,P<0.05;r=0.447, P<0.05)。结论JAK2/STAT3信号通路可能通过上调HSP70的表达进而对大鼠脑出血后起神经保护作用。
关键词:脑出血;HSP70蛋白质类;janus激酶2; STAT3转录因子
脑出血是常见病,其年发病率为60~80/10万人,在我国约占急性脑血管病的30%,其死亡率在急性脑血管病中最高。蛋白酪氨酸激酶2/信号转导和转录激活因子3 (janus kinase 2-signal transducer and activator of transcription 3,JAK2/STAT3)信号转导通路是一条细胞内信号转导途径,它是多种细胞因子和生长因子信号转导的共同通路,在细胞的增殖、分化、凋亡以及免疫调节等过程中发挥重要作用。研究表明JAK2/STAT3通路激活与脑损伤密切相关,它参与脑缺血再灌注损伤、蛛网膜下腔出血后脑损伤等的调控[1-2]。α-氰基-(3,4-羟基)N-苄苯乙烯胺〔alpha cyano-(3-hydroxy) N-styrene benzyl amine,AG-490〕是JAK2/STAT3信号通路的一种特异性拮抗剂,结构类似酪氨酸,可以和受体酪氨酸激酶竞争结合位置,抑制应激反应时STAT3的磷酸化,从而降低STAT3的活性[3]。热休克蛋白70(heat shock protein 70,HSP70)是一种应激蛋白,也是一种内源性的细胞保护蛋白,在正常组织中表达较少,当机体受到损伤、感染、中毒等刺激时表达增多。Madamanchi 等[4]的研究结果显示,JAK2/STAT3信号通路活化可激活HSP70基因,促进HSP70蛋白表达。本实验采用大鼠自体血注入法建立脑出血模型,并于造模前给予腹腔注射AG-490干预,检测大鼠血肿周围HSP70及磷酸化JAK2(P-JAK2)、磷酸化STAT3(P-STAT3)的表达变化,旨在探讨JAK2/STAT3信号通路在HSP70表达变化中的介导作用,为进一步明确脑出血后脑损伤的发病机制及治疗提供线索。
1材料和方法
1.1实验动物 健康雄性SD大鼠100只,体质量250~300 g,鼠龄2~3个月(由四川医科大学实验动物中心提供)。将实验动物随机分为对照组、假手术组、脑出血组和AG-490干预组,各组25只。按造模成功后时间将各组大鼠再分为6 h、24 h、48 h、72 h、7 d共5个亚组,每亚组5只。
1.2实验试剂与仪器 SDS-PAGE凝胶、5%(质量浓度)牛血清白蛋白、HSP70抗体、P-JAK2单克隆抗体、P-STAT3单克隆抗体、AG-490、SABC免疫组化染色试剂盒、DAB显色试剂盒购自巴傲得生物科技有限公司。鼠脑立体定向仪、50 μL微量注射仪购自世界精密仪器商贸(上海)有限公司。其他仪器包括Olympus光学显微镜、光学显微镜照相系统、Image-J图像分析系统等。
1.3方法
1.3.1脑出血模型制备:采用二次注入法建立脑出血模型[5]。该方法采用尾动脉为供血动脉,虽然有一定创伤,但不影响大鼠肢体的功能,行为学评分更准确,成功率较高。术毕根据Longa等[6]5级评定方法进行神经功能缺损评分,1~3分者为大鼠脑出血造模成功。AG-490干预组大鼠于造模成功后立即予腹腔注射AG-490〔0.15 mg/(kg·d)〕,共3 d,假手术组大鼠按相同方案注入等量生理盐水,对照组大鼠未予任何处理。
1.3.2神经功能缺损评分(neurological severity scores,NSS):采用Garcia等[7]NSS评分标准:包括运动、感觉、平衡测试、反射消失或不正常运动、行走。18 分为正常,13~17分为轻度损害,7~12 分为中度损害,1~6分为重度损害。
1.3.3免疫组化:采用免疫组织化学方法检测HSP70蛋白的表达,实验步骤严格按说明书进行。选择5个不重叠的血肿区域采集图像,然后用Image-Pro-Plus5.0软件分析蛋白阳性表达的累积光密度值,并计算平均值。
1.3.4Western blot检测:采用Western blot检测P-JAK2和P-STAT3的表达,实验步骤严格按说明书进行。分析蛋白条带的相对密度。
1.4统计学处理 结果以均数±标准差表示,采用SPSS19统计软件进行统计学分析,组内不同时间均数比较采用重复测量数据的方差分析,两两比较采用SNK-q检验,相关分析采用直线相关分析。以P<0.05为差异有统计学意义。
2结果
2.1NSS评分 正常组与假手术组NSS评分比较差异无统计学意义(P>0.05),脑出血组和AG-490组NSS评分均低于假手术组(P<0.05),AG-490组NSS评分高于脑出血组(P<0.05)。脑出血组和AG-490组大鼠造模成功后48 h神经功能缺损最严重(P<0.05)。结果见表1。
2.2免疫组化 正常组及假手术组未见或可见少量HSP70表达;脑出血组和AG-490组造模成功后6 h血肿周围可见少量HSP70表达, 24 h开始明显增多,48 h达高峰(P<0.05),7 d仍有少量表达,各时间点其表达均高于假手术组(P<0.05),AG0-490组各时间点HSP70表达均低于脑出血组(P<0.05)。结果见表2、图1。
2.3Western blot检测 各组大鼠血肿周围组织P-JAK2和P-STAT3表达变化趋势与HSP-70变化一致。具体结果见表3、4和图2。
2.4相关性分析 脑出血组大鼠NSS评分与HSP70表达呈负相关(r=-0.511,P<0.05),HSP70与P-JAK2、P-STAT3的表达呈正相关(r=0.790,P<0.05;r=0.447,P<0.05)。
3讨论
JAK/STAT信号通路根据结构差异可分为两类[8]:一类是JAK家族,其本质是一组蛋白酶,相对分子质量120 000~130 000之间,包括JAK1、JAK2、JAK3和TYK2;另一类是在研究干扰素时发现的STAT家族,是位于染色体内的一组转录因子,相对分子量约4 000~113 000,约由750~850个氨基酸构成,是JAK的下游底物,包括STAT1-4,STAT5a、b和STAT6。JAK2/STAT3信号传导是指信使物质遇到细胞外的刺激时,识别并结合于胞膜的受体诱导其在胞浆内形成JAK2结合位点,结合后JAK2发生磷酸化并暴露STAT3的锚定点,STAT3磷酸化而活化并移向胞核内,完成与目的基因的信号传导和表达调控[9]。由此可知,JAK2/STAT3信号转导通路的激活在JAK2与STAT3发生磷酸化后实现,因此动态监测P-JAK2和P-STAT3蛋白的表达,可以了解JAK2/STAT3信号通路的活化情况。徐海发等[1]实验结果显示:大鼠脑缺血再灌注损伤后脑组织P-JAK2、P-STAT3表达增多,JAK2/STAT3信号通路被激活,其可能参与脑损伤的过程。本实验结果显示:P-JAK2和P-STAT3在脑出血组中表达明显较正常组和假手术组高,表明脑出血时JAK2/STAT3信号通路被激活。AG-490是一种选择性拮抗JAK2酪氨酸磷酸化的抑制剂, 可有效阻断其下游信号转导和转录因子STAT3的活化, 进而阻断JAK2/STAT3信号通路[10]。本实验结果显示:P-JAK2和P-STAT3在AG-490组表达较假手术组高,而较脑出血组低,表明AG-490能有效地阻断JAK2/STAT3信号通路。除此之外,AG-490能影响人的多项生命活动,如可显著缩小脑梗死面积, 减少细胞凋亡, 改善神经功能缺损[11];亦可抑制骨髓瘤淋巴细胞细胞的增殖, 诱导细胞凋亡等[3]。
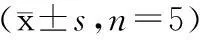
表 1 各组大鼠造模成功后不同时间NSS评分比较
注:NNS:神经功能缺损评分;AG-490:α-氰基-(3,4-羟基)N-苄苯乙烯胺,表2~4同;分别与正常组、假手术组比较,aP<0.05;与脑出血组比较,bP<0.05;与组内其他时间点比较,cP<0.05

表 2 各组大鼠造模成功后不同时间点HSP70表达的累积光密度值±s,n=5)
注:HSP-70:热休克蛋白70;分别与正常组、假手术组比较,aP<0.05;与脑出血组比较,bP<0.05;与其他时间点比较,cP<0.05;-:表示未进行统计学处理

A:组正常;B:假手术组;C:脑出血组;D:AG-490干预组;箭头所示为HPS70阳性细胞
图1各组大鼠造模成功后48 h血肿周围HSP70阳性细胞表达(免疫组化染色×400)
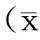
表 3 各组大鼠造模成功后不同时间点P-JAK2表达的相对吸光度值比较±s,n=5)
注:P-JAK2:磷酸化蛋白酪氨酸激酶2;与正常组、假手术组比较,aP<0.05;与脑出血组比较,bP<0.05;与其他时间点比较,cP<0.05;-:表示未进行统计学处理

表 4 各组大鼠造模成功后不同时间点P-STAT3表达的相对吸光度值比较±s,n=5)
注:P-STAT3:磷酸化信号转导和转录激活因子3;与正常组、假手术组比较,aP<0.05;与脑出血组比较,bP<0.05;与其他时间点比较,cP<0.05;-:表示未进行统计学处理
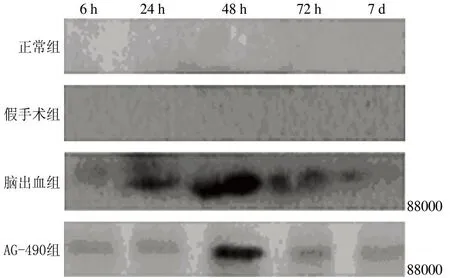
图2各组大鼠血肿周围P-JAK2(A)和P-STAT3(B)表达(Western blotting)
HSP是指细胞在应激原和高温诱导下生成的一类具有高度保守性的蛋白质,其相对分子质量在80 000~110 000、68 000~74 000和18 000~30 000之间,可分为HSP110、HSP70、HSP60和小分子量HSP等几个家族。当细胞在受到某些不利因素,如高热、感染、缺血、缺氧及化学物质等刺激时,HSP70会迅速短暂地大量合成而发挥细胞保护功能。相关研究结果显示HSP70具有神经功能保护作用[12-13],其机制包括:(1)分子伴侣作用,HSP70能对抗内源性损伤因子引起的毒性作用,清除细胞内异常的蛋白质,减轻损伤及应激反应引起的细胞膜蛋白的变性,保护脑组织细胞的蛋白;(2)减少氧自由基释放, 稳定细胞膜和溶酶体, 防止蛋白质变性;(3)抑制细胞因子的炎性反应,起一定的非特异性免疫保护作用;(4)抗凋亡作用,凋亡是脑组织缺血低氧性损伤后的主要病理改变,Kitamura等[14]研究发现,JAK2/STAT3信号通路是导致创伤后神经细胞凋亡的重要途径,而HSP70是其中的一种抑制分子。刘胜中等[15]研究表明:心脏经停搏液处理后,心肌组织中HSP70表达明显增加;同时加用AG-490阻断JAK2/STAT3信号通路后,HSP70表达降低,凋亡心肌细胞增加,提示心脏停搏液可能通过JAK2/STAT3途径,激活STAT3,上调HSP70表达,调动心脏内源性的保护机制。本实验结果显示:AG-490组NSS评分较假手术组低,较脑出血组高,P-JAK2、P-STAT3、HSP70的表达较假手术组高,而较脑出血组低,且P-JAK2、P-STAT3与HSP70的表达呈正相关,表明在SD大鼠造模后腹腔注射通道阻断剂AG-490,可下调HSP70在大鼠血肿周围的表达,进而产生神经保护作用,此作用可能由JAK2/STAT3途径介导。
综上所述,本研究结果显示,大鼠脑出血时JAK2/STAT3信号通路被激活,血肿周围脑组织HSP70表达增多,而JAK2/STAT3通道阻滞剂AG-490干预可使大鼠神经功能缺损减轻,降低大鼠脑组织血肿周围P-JAK2、P-STAT3、HSP70的表达,且P-JAK2、P-STAT3与HSP70的表达呈正相关,提示JAK2/STAT3信号通路可能通过上调HSP70的表达进而对大鼠脑出血后起神经保护作用,此研究可为进一步明确脑出血后脑组织损伤机制及治疗提供新的线索。
参考文献:
[1]徐海发,蒋晶晶,马静萍.重组人粒细胞集落刺激因子对大鼠脑缺血再灌注损伤后p-JAK2及p-STAT3信号通路的影响[J].中国神经免疫学和神经病学杂志,2014,21(4):273-277.
[2]Chen G, Zhang S, Shi J, et al. Effects of recombinant human erythropoietin (rhEPO) on JAK2/STAT3 pathway and endothelial apoptosis in the rabbit basilar artery after subarachnoid hemorrhage[J]. Cytokine,2009,45(3):162-168.
[3]董梅,辛立建,陈丽萍,等.SOCS1-JAK2-STAT3信号通路在C57BL-6小鼠实验性自身免疫性脑脊髓炎模型中作用机制探讨[J].中国免疫学杂志,2014,7(4): 459-463.
[4]Madamanchi NR,Li S,Patterson C,et al. Reactiveoxy genspecies regulate heat-shock protein 70 via the JAK/STAT pathway[J]. Arterioscl Throm Vasc,2001,21(3):321-326.
[5]李慧,娄季宇,杨霄鹏.大鼠脑出血模型制作技巧[J].中国实用神经病杂志,2007,10(2):152-153.
[6]Long EZ,Weinstein PR, Carlson S, et al. Reversible Middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[7]Garcia JH,Wagner S,Liu KF,et al.Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rat statistical validation[J]. Stroke,1995,26(4):627-635.
[8]Morales JK, Falanga YT, Depcrynski A, et al. Mast cell homeostasis and the JAK-STAT pathway[J]. Genes Immun, 2010,11(8):599-608.
[9]Lai SY, Johnson FM.Defining the role of the JAK-STAT pathway in head and neck and thoracic malignancies: implications for future therapeutic approaches[J]. Drug Resist Updat,2010, 13(3):67-78.
[10]Nomura N, Nunes P, Bouley R, et al.High-throughput chemical screening identifies AG-490 as a stimulator of aquaporin 2 membrane expression and urine concentration[J]. Am J Physiol Cell Physiol, 2014,307(7):597-605.
[11]张合鹏,杜爱玲,李磊,等.AG490对大鼠脑损伤后血-脑屏障通透性及白细胞介素6和肿瘤坏死因子α表达的影响[J]. 中国脑血管病杂志, 2015(12),3: 134-139.
[12]Choi JI, Kim SD, Kim SH, et al. Semi-quantitative analyses of hippocampal heat shock protein-70 expression based on the duration of ischemia and the volume of cerebral infarction in mice[J]. J Korean Neurosurg Soc,2014,55(6):307-312.
[13]Gómez-Choco M, Doucerain C, Urra X, et al.Presence of heat shock protein 70 in secondary lymphoid tissue correlates with stroke prognosis[J]. J Neuroimmunol,2014, 15 (2):67-74.
[14]Kitamura C,Ogawa Y,Nishihara T,et al.Transient co-localization of c-Jun N-terminal kinase and c-Jun with heat shock protein 70 in pulp cells during apoptosis[J]. J Dent Res,2003,82(2):91-95.
[15]刘胜中,甘崇志,杨双强.JAK2/STAT3通过上调HSP70蛋白介导TTX心肌保护作用[J].西部医学,2011,23(3):415-418.
(本文编辑:时秋宽)
The neuroprotective effect of heat shock protein 70 through the JAK2/STAT3 signaling pathway in cerebral hemorrhage
YUANZhijun,LIXiaogang,HEXiaoying*.
*DepartmentofNeurology,TheFirstAffiliatedHospitalofSichuanMedicalCollege,LuzhouSichuan646000,ChinaCorresponding author: HE Xiaoying, Email: 102050228@qq.com
ABSTRACT:ObjectiveTo investigate the effect of Alpha cyano-(3-hydroxy) N-styrene benzyl amine (AG-490) [the janus kinase 2-signal transducer and activator of transcription 3(JAK2/STAT3) signaling pathways specific antagonist] on the expression of heat shock protein 70 (HSP70), phosphorylated janus kinase 2( P-JAK2) and activator of transcription 3(P-STAT3) in cerebral hemorrhage rat models, and the correlation between the JAK2/STAT3 signaling pathway and the expression of HSP70. To investigate the role of JAK2/STAT3 signal pathway and HSP70 in neuroprotective effects of cerebral hemorrhage rats. MethodsOne hundred healthy male Sprague-Dawley rats were randomly divided into four groups: the normal group, the sham operation group, the cerebral hemorrhage group and the AG-490 group. The autologous arterial blood was stereotaxically injected to the right caudate nucleus to establish cerebral hemorrhage rat models. According to the different sacrificed time, every group was divided into 5 subgroups: 6 h, 24 h, 48 h, 72 h, 7 d. The rats were evaluated by the neurological deficit scores (Neurological Severity Scores, NSS), the expressions of HSP70, P-JAK2, and P-STAT3 were detected by immunostaining and Western blot using rat brain tissue around the hematoma. ResultsHSP70, P-JAK2 and P-STAT expressions in the cerebral hemorrhage group and the AG-490 group were higher than those of the sham group and the normal group (P<0.05), and 48 h after modeling their expressions reached a peak (P<0.05). HSP70, P-JAK2 and P-STAT expressions in the AG-490 group were lower than those of the cerebral hemorrhage group (P<0.05). NSS and HSP70 expression were negatively correlated (r=-0.511, P<0.05), HSP70 expression was positively correlated with P-JAK2 and P-STAT3 expression (r=0.790, P<0.05; r=0.447, P<0.05) in the cerebral hemorrhage group. ConclusionsJAK2/STAT3 signaling pathway may play a role in neuroprotection after cerebral hemorrhage by upregulating the expression of HSP70.
Key words:cerebral hemorrhage; HSP70 heat-shock proteins; janus kinase 2;STAT3 transcription factor
doi:10.3969/j.issn.1006-2963.2016.01.004
基金项目:四川省卫生厅科研课题(110368)
通讯作者:何晓英,Email:l02050228@qq.com
中图分类号:R744.5
文献标识码:A
文章编号:1006-2963 (2016)01-0014-05
(收稿日期:2015-04-02)
