血清超敏C反应蛋白、载脂蛋白A1与2型糖尿病肾病的相关性探讨
2016-06-20西电集团医院西安710077王海宁李万顺孙巨军
西电集团医院(西安710077) 王海宁 李万顺 孙巨军
血清超敏C反应蛋白、载脂蛋白A1与2型糖尿病肾病的相关性探讨
西电集团医院(西安710077)王海宁李万顺△孙巨军
摘要目的:探讨超敏C反应蛋白(hs-CRP)及载脂蛋白A1(ApoA1)与2型糖尿病肾病(DKD)发生及发展的相关性。方法:147例2型糖尿病患者根据Mogensen分期标准进行分组:单纯糖尿病组47例,早期DKD组58例,临床DKD组42例,以40例健康体检者作为对照组,采用免疫透射比浊法测定ApoA1及hs-CRP水平,比较各组血清ApoA1、hs-CRP、三酰甘油(TG)、肌酐(Cr)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平,并分析血清ApoA1、hs-CRP水平与其他指标的相关性。结果:早期DKD组及临床DKD组ApoA1水平低于对照组及单纯糖尿病组(P<0.01),糖尿病各组hs-CRP、TG、TC、TC、Cr及LDL-C水平均明显高于对照组、HDL-C水平明显低于对照组(P<0.05、P<0.01);早期DKD组及临床DKD组hs-CRP、TG水平均显著高于单纯糖尿病组,且临床DKD组ApoA1低于早期DKD组,hs-CRP及Cr明显高于早期DKD组(P<0.05)。2型糖尿病患者血清ApoA1水平与HDL-C水平呈正相关(r=0.82,P<0.05),与尿白蛋白排出率呈负相关(r=-0.59,P<0.05);血清hs-CRP水平与患者体重指数、腰围、TG水平及尿白蛋白排出率均呈正相关(r=0.51、0.39、0.33、0.46,P<0.05),与HDL-C水平呈负相关(r=-0.27,P<0.05)。结论:检测2型糖尿病患者血清ApoA1及hs-CRP水平可以敏感地反映患者早期肾功能损伤情况,有助于早期诊断DKD并进行有效干预,以改善患者预后。
主题词糖尿病, 2型 糖尿病肾病/诊断 C-反应蛋白质/血液 载脂蛋白A-Ⅰ/血液
糖尿病肾病(Diabetic kidney disease,DKD)是糖尿病最常见的慢性微血管并发症之一,其病理表现以肾小球周边出现嗜酸性K-W结节为特征,临床表现为蛋白尿、水肿、高血压、贫血、进行性肾功能减退等,早期病情隐匿,是目前引起终末期肾病的主要原因之一[1],约10%~20%的糖尿病肾病最终发展成终末期肾病[2]。肾穿刺病理活检可以发现早期DKD,是诊断DKD的唯一“金标准”,然而,该检查为有创性检查、操作复杂,不易被患者接受而难以广泛开展。近年研究显示,慢性炎症在DKD的发生及发展中发挥重要作用[3]。超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)是反映血管炎症的重要标志物之一,其在体内的水平可能预示糖尿病并发症的发生。载脂蛋白能够调节机体脂蛋白代谢,与肾小球硬化密切相关,载脂蛋白A1(Apoprotein A1,ApoA1)是高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)的主要结构蛋白,但其测定精度优于HDL-C。本研究拟探讨hs-CRP及ApoA1与2型糖尿病患者肾功能损害的关系,以早期诊断、有效控制DKD的发生及发展。
对象与方法
1对象本研究共纳入2013年5月至2015年8月我院收治的147例门诊及住院患者,均根据1999年WHO制订的2型糖尿病诊断标准[4]临床确诊为2型糖尿病,男89例,女58例;年龄36~75岁,平均53.6±4.3岁。排除2型糖尿病急性并发症、急慢性严重感染、原发性肾病等其他原因引起的肾脏疾病,以及泌尿系统感染、运动、酮症酸中毒、原发性高血压等可能引起尿白蛋白排出率(UAER)升高的因素,所有患者纳入本研究前3个月内均未服用维生素B12、叶酸等。根据Mogensen分期标准[5]分组:①单纯糖尿病组:UAER<30 mg/24h或<20 μg/min,共47例;②早期DKD组:UAER持续30~300 mg/24h或持续20~200 μg/min,共58例;③临床DKD组:UAER>300 mg/24h或>200 μg/min,共42例。选择同期40例健康体检者作为对照组,经体检排除2型糖尿病、肾病和其他器质性疾病。所有受试者均签署知情同意书。
2方法根据以下公式计算所有受检者的体重指数(BMI):BMI=体重(kg)/身高(m)2;并留取当日晨至次日的24 h尿液,加入8~10 ml甲醇混匀后取10 ml,采用放射免疫法检测UAER。所有受检者禁食10 h以上,次日清晨采集空腹静脉血,于4℃以3000 r/min离心15 min后,分离血清检测,三酰甘油(TG)、总胆固醇(TC)、肌酐(Cr)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。采用免疫透射比浊法测定ApoA1及hs-CRP水平,使用仪器为罗氏Cobas8000全自动生化分析仪,检测试剂、校准品及质控品均为北京利德曼生化股份有限公司产品。ApoA1的正常参考值范围为1.40~1.45 g/L,hs-CRP的正常参考值范围为0~10 mg/L。所有测定均严格按照《全国临床检验操作规程》[6]及试剂盒说明书要求进行操作。

结果
14组受检者一般资料比较见表1。早期DKD组及临床DKD组患者的病程较单纯糖尿病组长,3组间比较,差异有统计学意义(P<0.05),两两比较结果显示,临床DKD组患者病程明显较早期DKD组长(P<0.05);4组受检者腰围比较,差异有统计学意义(P<0.05),其中单纯糖尿病组、早期DKD组及临床DKD组腰围均显著大于对照组,临床DKD组腰围大于单纯糖尿病组及早期DKD组,差异有统计学意义(P<0.05)。4组受检者性别比、年龄、体重指数、收缩压及舒张压比较,差异均无统计学意义(P>0.05)。
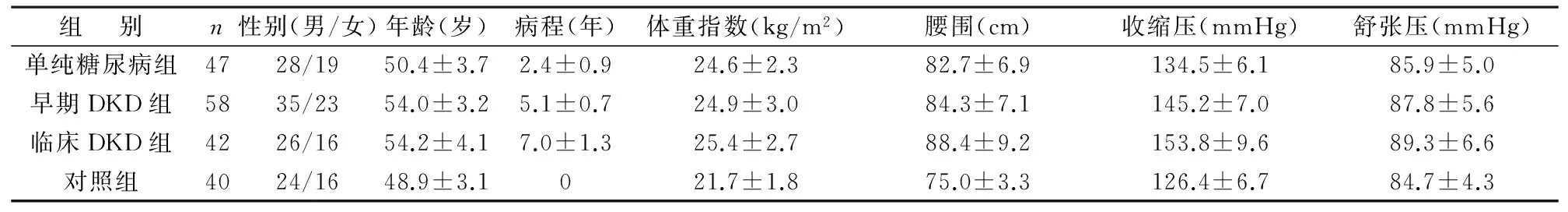
表1 4组受检者一般资料比较
24组受检者观察指标比较见表2。4组受检者ApoA1、hs-CRP、TG、TC、TC、Cr、HDL-C及LDL-C检测水平比较,差异均有统计学意义(P<0.05),其中单纯糖尿病组ApoA1较对照组差异无统计学意义(P>0.05),早期DKD组及临床DKD组ApoA1低于单纯糖尿病组,差异有统计学意义(P<0.01);糖尿病各组hs-CRP、TG、TC、TC、Cr及LDL-C水平均明显高于对照组、HDL-C水平明显低于对照组,差异有统计学意义(P<0.05,P<0.01);早期DKD组及临床DKD组hs-CRP及TG水平均显著高于单纯糖尿病组,且临床DKD组ApoA1水平低于早期DKD组、hs-CRP及Cr水平明显高于早期DKD组,差异有统计学意义(P<0.05)。
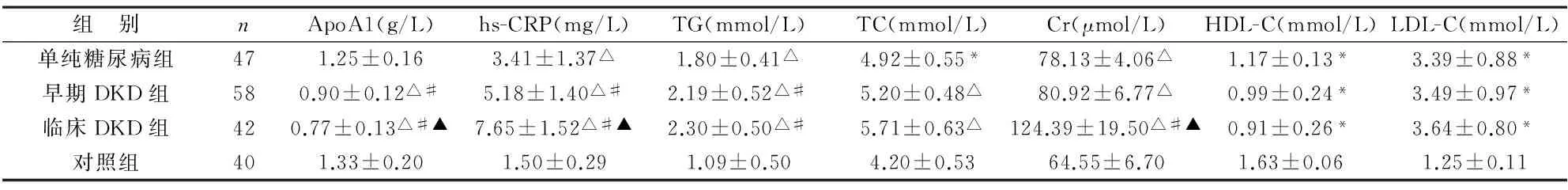
表2 4组受检者ApoA1、hs-CRP、TG、TC、Cr、HDL-C及LDL-C比较
注:与对照组比较,*P<0.05,△P<0.01;与单纯糖尿病组比较,#P<0.05;与早期DKD组比较,▲P<0.05
3ApoA1、hs-CRP与其他指标的相关性分析见表3。147例2型糖尿病患者血清ApoA1水平为0.96±0.17 g/L,其与患者UAER水平呈负相关(r=-0.59,P<0.05),与HDL-C水平呈正相关(r=0.82,P<0.05)。147例2型糖尿病患者血清hs-CRP水平为5.20±1.61 mg/L,其与患者体重指数、腰围、TG及UAER水平均呈正相关(r=0.51、0.39、0.33、0.46,P<0.05),与HDL-C水平呈负相关(r=-0.27,P<0.05)。
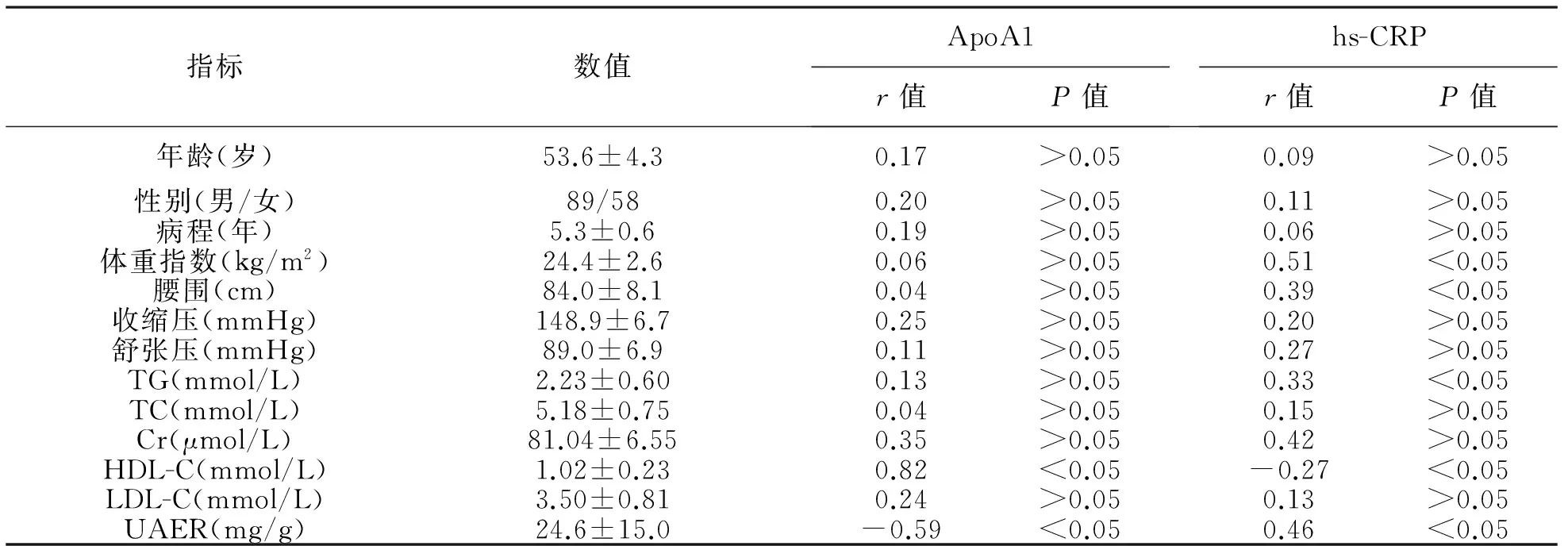
表3 血清ApoA1、hs-CRP与其他指标的相关性分析
讨论
DKD的发病机制目前尚未阐明,近年研究发现其发生可能是一种免疫系统诱导的细胞因子介导的急性期时相反应[3,7]。hs-CRP是一种敏感的急性期时相蛋白,在高血压、糖尿病患者尿白蛋白的产生过程中具有重要作用。Zambrano-Galvan等[8]的研究表明,hs-CRP是UAER升高的独立危险因素(B=0.50,β=0.583,P=0.02),并与UAER呈显著正相关。本研究结果显示,早期DKD组及临床DKD组患者的血清hs-CRP水平均显著高于单纯糖尿病组(P<0.05),且临床DKD组的血清hs-CRP水平较早期DKD组高(P<0.05),说明血清hs-CRP水平与患者肾脏损害程度密切相关,随着糖尿病患者肾损伤程度的加重,其血清hs-CRP水平亦随之升高;此外,患者血清hs-CRP水平与UAER水平呈正相关(r=0.46,P<0.05),与Zambrano-Galvan等[8]的报道结果一致。Pearson相关分析结果显示,血清hs-CRP水平与患者体重指数、腰围、TG均呈正相关(r=0.51、0.39、0.33,P<0.05),提示高体重指数是肥胖者患者血清hs-CRP水平升高的重要因素,肥胖时多种激素分泌增多、血脂增高、氧化应激增强及血流动力学改变等致机体发生慢性炎症,进而使hs-CRP水平升高。上述研究结果提示体重指数和UAER是血清hs-CRP水平的主要独立影响因素,hs-CRP水平可以预测DKD的发生及发展。
脂代谢紊乱在DKD的发生及发展中发挥重要作用,DKD患者发生肾小动脉硬化,与肾微血管病变共同导致肾小球硬化。ApoA1是一种主要由肝脏和小肠合成的HDL-C的结构蛋白,能够与HDL受体特异性地结合,直接作用于动脉壁,防止LDL氧化聚集,促使胆固醇经动脉壁流出,具有明显的抗动脉粥样硬化作用[9]。Alberga等[10]的研究结果显示,糖尿病伴临床白蛋白尿患者的ApoA1水平较糖尿病不伴白蛋白尿患者明显下降。本研究结果显示,早期DKD组及临床DKD组ApoA1低于单纯糖尿病组及对照组(P<0.01),而且临床DKD组ApoA1水平低于早期DKD组(P<0.05),与Alberga等[10]的报道一致;结合相关分析结果,糖尿病患者血清ApoA1水平与UAER水平呈负相关(r=-0.59,P<0.05),与HDL-C水平呈正相关(r=0.82,P<0.05),说明随着2型糖尿病患者UAER的逐渐升高,血清ApoA1水平逐渐降低,提示ApoA1水平与DKD的疾病进展密切相关。
综上所述,检测2型糖尿病患者血清ApoA1及hs-CRP水平可以敏感地反映患者早期肾功能损伤情况,有助于早期诊断DKD并进行有效干预。临床上应该积极预防和早期治疗DKD,以改善患者的预后,延缓进入终末期肾病。
参考文献
[1]冯绍华,罗秀珍 .中西医结合治疗糖尿病肾病的临床进展[J].陕西中医,2014,35(2): 252-254.
[2] Bentata Y, Chemlal A, Karimi I,etal. Diabetic kidney disease and vascular comorbidities in patients with type 2 diabetes mellitus in a developing country [J]. Saudi J Kidney Dis Transpl, 2015, 26(5): 1035-1043.
[3]Vasanthakumar R, Mohan V, Anand G,etal. Serum IL-9, IL-17, and TGF-β levels in subjects with diabetic kidney disease (CURES-134) [J]. Cytokine, 2015, 72(1): 109-112.
[4]钱荣立.关于糖尿病的新诊断标准与分型[J].中国糖尿病杂志,2010,8(1):5-6.
[5]中华中医药学会肾病分会.糖尿病肾病诊断辨证分型及疗效评定标准[J].上海中医药杂志,2007,41(7):7-8.
[6]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006: 89-100.
[7]牛春波,李建华.糖尿病肾病发病机制及治疗研究新进展[J]. 国际检验医学杂志,2014,35(16):2204-2206.
[8]Zambrano-Galvan G, Rodriguez-Moran M, Simental-Mendia LE,etal. C-reactive protein is directly associated withurinary albumin-to-creatinine ratio [J]. Arch Med Res, 2011, 42(6): 451-456.
[9]郭笑丹,徐杰,田黎,等. 2型糖尿病患者糖尿病肾病的危险因素临床分析[J].陕西医学杂志,2015,44(4):457-458.
[10]Alberga AS, Pru’homme D, Kenny GP,etal. Effects of aerobic and resistance training on abdominal fat, apolipoproteins and high-sensitivity C-reactive protein in adolescents with obesity: the HEARTY randomizedclinical trial[J]. Int J Obes, 2015, 39(10):1494-1500.
(收稿:2015-11-26)
【中图分类号】R587.2
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.06.032
△陕西省千阳县人民医院
