猪肺炎支原体PCR检测方法的建立与应用
2016-06-19师丽刚
师丽刚,周 飞
(1.河南省洛阳市动物疫病预防控制中心,河南 洛阳 471002;2.河南省洛阳市动物卫生监督所,河南 洛阳 471000)
猪肺炎支原体PCR检测方法的建立与应用
师丽刚1,周 飞2
(1.河南省洛阳市动物疫病预防控制中心,河南 洛阳 471002;2.河南省洛阳市动物卫生监督所,河南 洛阳 471000)
根据猪肺炎支原体(Mhp)的P36基因的核苷酸序列,设计一对引物,建立一种猪肺炎支原体PCR检测方法,此方法对对照菌株显示为阴性,对猪肺炎支原体的扩增结果显示为阳性,并对此方法进行了特异性和敏感性试验,结果成功建立了猪肺炎支原体特异且敏感的PCR检测方法。采用已经建立的PCR方法对18份疑似猪支原体肺炎(MPS)样品进行检测,发现有9份呈现阳性,占比50%。试验结果表明,建立的该PCR检测方法可用于猪支原体的临床诊断,能为其以后的防控提供有力依据。
猪肺炎支原体;PCR
猪支原体肺炎(Mycoplasmal pneumonia of swine,MPS)是由猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)所引发[1],引起猪的一种低死亡率、高发病率的慢性呼吸道传染病,又称猪霉形体肺炎、猪气喘病。自1965年Mare等[2]发现Mhp以来,无数国内外学者先后通过培养基分离获得Mhp。尽管Mhp可在人工培养基上生长,但其对营养要求较高,并且培养时间过长[3],从而以此进行临床诊断意义不大。该病在临床上主要特征是:气喘,呼吸比较困难,腹式呼吸但体温表现正常。发病时间不固定,但以冬、春寒冷季节发生较多。患病猪只生长缓慢,饲料利用率低。因此世界各国养猪产业均受到其不同程度的影响,普遍流行于澳大利亚、欧美等畜牧业发达国家[4],它也是对我国养猪产业造成重大经济损失的疫病之一,估计我国每年因此病造成的经济损失不低于百亿元人民币[5-6]。鉴于MPS对养猪业巨大的影响,为了减少经济损失,对Mhp进行早期诊断成为了当前研究的重点工作之一。
众多试验数据表明,常规的病原分离检测方法所用时间较长[7],不利于控制疫病的发展和把握最佳的治疗时间,应用间接血凝试验(IHA)[8]、补体结合试验(CFT)、核酸探针[9]、酶联免疫吸附试验(ELISA)[10]、免疫酶试验(RIDEA)和免疫荧光试验(IF)等血清学方法诊断MPS,用ELISA方法得出的试验结果较为理想[11-12],但是由于猪肺炎支原体的抗原与猪体内的猪鼻支原体、滑液支原体、絮状支原体等存在交叉反应,使得应用传统的ELISA和病原分离方法很难以区分。因此,及时建立一种既准确、快速、简便又特异性强、灵敏度高的方法就显得特别重要。伴随着现代生物技术的迅速发展,PCR技术应运而生。其检测方式不仅具有很高的敏感性和特异性,与此同时还克服了血清学交叉反应的缺点。
Mhp存在一些免疫显性蛋白,包含粘附素P97、三个膜蛋白P74、P65和P46[13]以及黏附素P97[14],细胞溶脂蛋白P36等。其中P36是乳酸脱氢酶蛋白(LDH)具有很高的种内保守性,与其他支原体无穿插反应,能诱发早期免疫反应[15]。本试验经过研究按照P36基因设计了一对特异性引物,建立了迅速精确的PCR诊断办法,并用该办法检测分析了采集的病料。
1 材料和方法
1.1 菌株 猪肺炎支原体、猪鼻支原体、鸡毒支原体、猪传染性胸膜肺炎放线杆菌、大肠杆菌、沙门氏菌均由洛阳市动物疫病预防控制中心实验室分离、鉴别并保存。
1.2 主要试剂与器材 动物基因组DNA抽提试剂盒购自上海生工生物工程有限公司,无水乙醇购自天津市富宇精细化工有限公司,Ex Taq(5 U/μL)、dNTP Mixture(2.5 mmol/μL)、MgCl2(25 mM/μL)、10X PCR Buffer(Mg2+free)、DNA Marker、RNase Free dH2O等均购自TaKaRa公司,EB染料替代染液购自上海莱枫生物科技有限公司,琼脂糖购于Biowest公司。2 mL玻璃匀浆器研磨器购自海门海泰实验器材北京销售部,PCR仪购自意大利泰克尼公司(TECHNE),Neofuge 15R台式高速冷冻离心机购自Heal Force Development Ltd(力康发展有限公司),琼脂糖凝胶电泳仪购自大连捷迈科贸有限公司(Jim-X Scientific company),自动凝胶图像分析仪购自沙船(天津)生物科技发展有限公司。
1.3 引物设计与合成 按照Mhp的P36基因序列设计了一对引物P1:GAGCCTTCAAGCTTCACCAAGA,P2:GTGGACTACCAGGGTATCT。目的基因片段大小650 bp,设计的引物交由生工生物工程(上海)有限公司代为合成。
1.4 PCR模板制备 病料DNA的提取:取病猪肺脏0.49 g放入2 mL玻璃匀浆器中,加入500 μL PBS(pH=8)缓冲液中研磨,接下来的步骤完全遵循上海生工生物工程有限公司动物基因组抽提试剂盒中的操作说明进行。DNA提取完成后置于-20℃保存待用。
1.5 PCR反应 MhpP36基因的扩增采用的是50 μL的PCR反应体系。包括模板DNA 5 μL,Ex Taq酶(5 μ/μL)0.25 μL,dNTP Mixture(2.5 mmol/μL)4 μL,10X PCR Buffer(Mg2+free)5 μL,Mgcl2(25 mM/μL)3 μL,正反引物(10 umol/L)各1 μL,加RNase Free dH2O至50 μL。将PCR反应程序内容顺序设置为:94℃预变性5 min,94℃变性40 S,54℃退火40 S,72℃延伸1 min,进行35个循环后,72℃再延伸5 min。在反应进行的同时,制一块1%的琼脂凝胶。待PCR体系反应完成后,取上述扩增产物5 μL进行点样,后于120 V电压下电泳,然后观察结果。
1.6 特异性试验 用上述试验方法,分别对临床上常见的传染病病原如猪鼻支原体、鸡毒支原体进行检测,依照上面的试验材料和操作步骤进行PCR扩增,然后电泳观察结果。
1.7 敏感性试验 将提取的DNA进行定量,测其浓度为2.6 ng/μL,取1 μL样本进行10倍倍比稀释,使其浓度依次为2.6×10-1、2.6×10-2、2.6×10-3、2.6×10-4、2.6×10-5、2.6×10-6、2.6×10-7和2.6×10-8ng/μL。后按照已建立好的PCR扩增条件和方法进行扩增,进行PCR敏感性试验。
1.8 重复性试验 用上述已经建立的PCR检测方法,对传支原体进行检测3次,用于验证本检测办法的稳定性和重复性。
2 结果与分析
2.1 扩增产物的检测 PCR反应完成后经过1%的琼脂凝胶电泳,结果显示扩增产物在650 bp处有明显可见的特异性DNA扩增条带,和之前预期的大小相符,如图1。后对扩增后的产物进行测序,结果显示扩增的序列与作为对照的猪肺炎支原体基因序列相同。

图1 猪肺炎支原体PCR扩增结果Fig.1 Mycoplasma pneumoniae PCR amplification results
2.2 特异性试验 根据上述方法,用所设计的引物P1: GAGCCTTCAAGCTTCACCAAGA, P2: GTGGACTACCAGGGTATCT。分别对猪肺炎支原体,猪鼻支原体,鸡毒支原体、胸膜肺炎放线杆菌、大肠杆菌、沙门氏菌进行同条件扩增,结果显示(图2),仅对Mhp扩增出650 bp的特异性条带,其余均未扩增出相应的片段。以上数据证明所设计的引物具备很强的特异性。
2.3 敏感性试验 取DNA作10-1~10-8的倍比稀释后,其模板DNA浓度依次为1:2.6 μg/μL;2:2.6×10-1μg/μL;3:2.6×10-2μg/μL;4:2.6× 10-3μg/μL;5:2.6×10-4μg/μL;6:2.6×10-5μg/μL;7:2.6×10-6μg/μL;8:2.6×10-7μg/ μL。按上述PCR操作方法和步骤进行敏感性试验。结果如图3,用该引物进行PCR扩增时,最低能从2.6×10-3μg/μL倍稀释的模板中看到扩增的目的基因条带,上述数据表明使用该引物进行PCR检测的最低检出量2.6×10-3μg/μL。
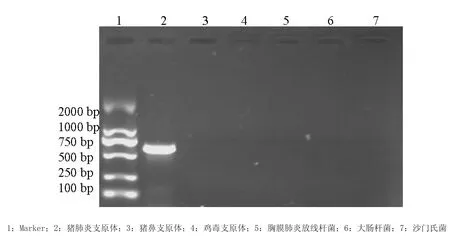
图2 PCR特异性试验结果Fig.2 PCR specific experimental results
2.4 重复性试验 按上述方法,反复操作3次,结果相同,表示所建立的办法是准确、稳定的。
2.5 检测方法的应用 运用本试验所建立的PCR检测办法对18份疑似猪肺炎支原体病料进行检测,检测结果显示有9份病料显示为阳性,9份为阴性,阳性检出率达到50%。

图3 PCR敏感性试验结果Fig.3 PCR sensitivity test results
3 讨论与结论
最近几年的实验室检测结果显示,大型规模猪场中Mhp能与多种细菌、病毒等病原共同作用,由此,引发一系列的猪呼吸道疾病综合征,严重减少了猪场经济效益,妨碍了养猪业的发展。该病已成为制约猪养殖行业发展的主要传染病之一。所以,做出对MPS及早预防和正确诊断方案是全人类当前需迫切处理的重要任务。
纵观国内外这几年畜牧业的发展历程,有很多有关猪肺炎支原体检测方法方面的报道,但报道病原菌检测方法的却很少。传统的病原鉴定向来都以分离培养为前提,而后再根据形态、免疫学及生理生化特征作进一步鉴定,不仅程序繁琐,而且病原检出率低,与疾病的讯速诊断、治疗原则相违背,有弊于临床试验中对该疾病的准确诊断。此外猪感染猪肺炎支原体时,普遍伴随着猪鼻支原体和絮状支原体的感染,又因为猪肺炎支原体比猪鼻支原体和絮状支原体培育条件较为严峻,生长较为迟缓,所以在分离培养猪肺炎支原体时常常被别的两种支原体掩盖,并且三者在血清学反应上有一定交叉性,结果采用血清学方法检测此病可能会出现假阳性反应。本试验采用优化条件后建立的猪肺炎支原体PCR检测方法,直接从病料提取细菌DNA,不用进行病原菌的分离培养,而是直接进行PCR扩增,即可判断是否有猪肺炎支原体感染。试验通过DNA基因序列设计出特异性引物,扩增出 650 bp的特异片段,而对于常见的猪鼻支原体、鸡毒支原体、胸膜肺炎放线杆菌、大肠杆菌、沙门氏菌则不能扩出特异片段,说明该方法具有很高的特异性。对疑似猪肺炎支原体病料进行检测,结果阳性检出率达到50%,表明PCR方法较传统方法有检测速度快,灵敏度高等优点,能对该病做有效诊断。本试验建立的猪支原体肺炎PCR检测办法能能对该病进行讯速诊断与流行病学调查。
[1]李莹莹,何颖,赵武,等.猪支原体肺炎研究进展[J].动物医学进展,2013,34(10):95-100.
[2]Mare C J,Switzer W P.New species:Mycoplasma hyopneumoniae,a causative agent of viruspigpneumonia[J].VetMedSmallAnimClin, 1965,60:841-846.
[3]毕丁仁,王桂枝.动物霉形体及研究方法[M].北京:中国农业出版社,1998:9.
[4]张旭,白方方,武昱孜,等.PCR技术检测猪支原体肺炎的研究进展[J].生物技术通报,2012(5):54-60.
[5]华利忠,邵国青,周勇岐.以疫苗免疫为核心的猪气喘病控制与净化技术[J].中国兽药杂志,2012,46(7):50-53.
[6]杨莉,杨茂生,吴位珩,等.猪气喘病的研究进展[J].上海畜牧兽医通讯,2011(6):7-9.
[7]孔令增,刘艳芬,刘铀.广东猪肺炎支原体的分离与鉴定[J].中国兽医科学,2013,43(10):1016-1020.
[8]张顺凤.间接血凝试验及猪气喘病检测[J].甘肃畜牧兽医,1996,26(1):5-7
[9]李桂兰,张映,邵国青.猪肺炎支原体斑点杂交检测方法的建立与应用[J].山西农业大学学报(自然科学版),2012,32(6):536-539.
[10]刘茂军,靳岷,杜改梅,等.检测猪肺炎支原体抗体间接ELISA方法的建立[J].江苏农业学报,2007,23(5):437-441.
[11]Armstrong C H,Freeman M J,Sands-Freeman l,et al.Comparison of zhe enzyme-linked immunosorbent assay and the indirect hemagglutinationandcomplementfixationtestsfor detecting antibodies to Mycoplasma hyopneumoniae[J].Can J Comp Med,1983,47(4):464-470.
[12]Bereiter M,Young T F,Joo H S,et al.Evaluation of the ELISA and comparison to the complement fixation test and radial immmunodiffusion enzyme assay for detection of antibodies agsinst Mycoplasma hyopneumoniae in swineserum[J].Vet Microbiol,1990,25(2-3):177-192.
[13]Futo S,Seto Y,Okada M,et al.Recombinant 46-kilodalton surface antigen(P46)of Mycoplasma hyopneumoniae expressed in Escherichia coli can be used for early specific diagnosis of mycoplasmal pneumonia of swine by enzyme-linked immunosorbent assay[J].Journalofclinical microbiology,1995,33(3): 680-683.
[14]Okada M,Asai T,Futo S,et al.Serological diagnosis of enzootic pneumonia of swine by adouble-sandwichenzyme-linkedimmunosorbent assay using a monoclonal antibody and recombinant antigen(P36)of Mycoplasma hyopneumoniae[J].Vet Microbiolo,2005,105(3-4):251-259.
[15]迟灵芝,徐斌,迟学芝.猪肺炎支原体P36基因的突变及序列分析[J].现代生物医学进展,2010,10(16):15-18.
Establishment and application of PCR detection method of mycoplasma pneumonia in pigs
Shi Ligang1,Zhou Fei2
(1.Luoyang animal disease prevention and control center,Henan Luoyang 471000; 2.Luoyang animal health supervision,Henan Luoyang 471000)
Based on the nucleotide sequence of Mycoplasma hyopneumoniae(Mhp)of the P36 gene,a pair of primers were designed.PCR detection method for the control strain was negative for Mhp amplification was positive,and the method was specific and sensitive test was successfully established for hyopneumoniae.18 parts suspected swine mycoplasma pneumonia(MPS)for testing and found that nine were positive,accounting for 50%.Experimental results show that the PCR method can be used for clinical diagnosis of MPS,which may provide a strong basis for the future prevention.
Mycoplasmal pneumonia of swine;PCR
S858.282
:B
:1672-9692(2016)09-0011-05
2016-07-25
师丽刚(1980-),男,山西省长治人,兽医师,毕业于南京农业大学兽医专业,主要从事兽医临床及实验室诊断工作。
