大鼠脊髓渐进性压迫损伤减压后白血病抑制因子的变化
2016-06-18史迎宾王顺利喻斌焦云龙
史迎宾,王顺利,喻斌,焦云龙
大鼠脊髓渐进性压迫损伤减压后白血病抑制因子的变化
史迎宾,王顺利,喻斌,焦云龙
【摘要】目的研究大鼠脊髓慢性渐进性压迫损伤减压后白血病抑制因子(LIF)水平的变化及其与神经功能恢复的关系。方法将56只Wistar大鼠随机分为假手术组,慢性渐进性脊髓损伤组,慢性渐进性脊髓损伤减压后1、3、7、14、28 d组,每组各8只。采用Tarlov评分及斜板试验评价各组大鼠神经功能恢复情况,免疫组织化学法测定各组脊髓组织LIF的表达水平。结果脊髓慢性渐进性压迫损伤减压后LIF表达明显增强,3 d达到高峰,以后逐渐降低,14 d开始趋于平衡;脊髓神经功能于前14 d恢复较快,之后有升高但变化较慢。结论大鼠慢性渐进性压迫脊髓损伤减压后LIF表达明显增强,可能与神经功能的恢复有关。
【关键词】脊髓损伤;慢性病;脊髓压迫;细胞因子类;白血病抑制因子;神经功能;功能恢复;大鼠,Wistar
作者单位:450052河南大学附属郑州市骨科医院骨科
E-mail:676345128@qq.com
白血病抑制因子(leukemia inhibitory factor,LIF)是一种多功能细胞因子,具有抑制髓样白血病细胞系M1生长和促进其分化的作用。近年来的研究表明,LIF具有广泛的生物学意义[1],在神经系统发育和损伤后修复,尤其是急性脊髓损伤中扮演重要角色[2-4]。然而,LIF对慢性压迫性脊髓损伤有何影响,目前尚未可知。本研究通过观察大鼠脊髓慢性渐进性压迫损伤减压后LIF的变化特点,探讨其变化规律以及与神经功能恢复之间的关系。
1 材料与方法
1.1主要试剂与仪器
LIF抗血清(大鼠抗大鼠IgG1单抗)、DAB显色剂及SP试剂盒均购自武汉博士德生物工程有限公司,苏木精-伊红染色试剂来自河南大学附属郑州市骨科医院骨病研究所;Mias图像分析软件计算机图像分析系统由四川大学图像图形研究所研制;CKX41型倒置显微镜产自日本奥林巴斯公司。
1.2实验动物及分组
健康清洁级成年雄性Wistar大鼠56只(河南大学实验动物中心提供,医学实验动物合格证号:医动字第14-008),体质量280~320 g,平均体质量300 g。按随机数字表法分为假手术组(对照组),慢性渐进性脊髓压迫损伤组(损伤组),慢性渐进性脊髓压迫损伤减压后1、3、7、14、28 d组(各减压组),每组各8只,分笼饲养。喂养条件:温度18~22℃,自由进饮食。
1.3手术方法
实验设计由第一作者完成,实施与评估由所有作者共同完成。损伤组:1%戊巴比妥钠(40 mg/kg)腹腔麻醉,取后正中切口,神经剥离子行骨膜下剥离,分离竖脊肌,显露T10棘突并咬除之,直径2.7 mm手摇钻打孔,显露硬膜后旋入直径0.3 mm、螺距0.5 mm平头塑料螺钉2圈(约椎板厚度);之后每隔7 d切开背部约5 mm,显露螺钉,将螺钉旋入0.25 mm,分4次完成,建立中度慢性渐进性脊髓压迫损伤模型。减压组:中度慢性渐进性脊髓压迫损伤模型建立方法同损伤组,在损伤模型建立10 d后取出压迫装置,分别于之后的1、3、7、14、28 d进行神经功能评估,记录数值后麻醉取材。对照组:仅行T10棘突和部分椎板咬除术。手术清醒后均放入普通鼠笼喂养,每天人工排尿2~3次。56只大鼠中3只因术后感染死亡,其余全部存活,死亡大鼠后续补上。术后观察大鼠的一般状况及行为学变化。
1.4神经功能评估
采用改良Tarlov评分法和斜坡实验对大鼠各组神经功能情况进行评估[5-6],其中减压组分别于减压术后1、3、7、14、28 d,损伤组于模型制作完毕后、对照组于术后即刻进行神经功能评估。改良Tarlov评分法:0分,完全瘫痪,无肌肉收缩;1分,无自主性运动,仅限于髋膝关节的非反射性运动;2分,肢体髋膝踝关节3个主要关节运动;3分,能主动支持体重和不协调步态或偶尔出现协调步态,能行走,但有中度强直;4分,前肢和后肢协调步态,能行走,轻度强直或有共济失调;5分,能正常行走[5]。斜坡实验采用Rivlin法,即在一长方形木板上垫以5 mm橡胶垫,板可绕下边旋转,斜板角度可测出,逐渐增大角度直至大鼠刚好可维持5 s时,记录临界角[6]。
1.5组织取材及病理观察
记录小鼠神经功能情况后,即以1%戊巴比妥钠40 mg/kg腹腔注射麻醉,左心室插管,剪开右心耳,快速灌注PBS 200 mL,待流出液体清亮后再灌注40 g/L多聚甲醛200 mL,切除以伤段为中心长约2 cm的脊髓标本,立即用40 g/L中性甲醛固定48~72 h,常规石腊包埋,连续切片,片厚4 μm。光镜下观察各组脊髓病理学变化,并进行免疫组织化学染色;术后7 d在损伤组、减压组各随机选取1只大鼠取材,进行苏木精-伊红染色,以证实损伤程度。
1.6免疫组化染色
采用链酶亲和素-生物素-过氧化物酶复合物(strept-avidin biotin-enzyme complex,SABC)法,参照SABC免疫组化试剂盒说明书中的步骤进行免疫组化染色。石蜡切片常规脱蜡至水。用新鲜配置的3% v/v过氧化氢室温下孵育5~10 min,灭活内源性过氧化物酶,蒸馏水洗3次。将切片浸入0.01 mol/L、pH值为6.0的柠檬酸盐缓冲液中,微波炉加热至沸腾后断电,间隔5~10 min反复1~2次。冷却后以0.1 mol/L PBS溶液(pH值7.4)洗涤1~2次。滴加5%山羊血清封闭液,室温孵育20 min,甩去多余液体,不洗。滴加1∶50稀释的大鼠抗大鼠LIF,4℃冰箱孵育24 h,0.1 mol/L磷酸盐缓冲液(pH值7.4)冲洗,2 min×3次。滴加生物素化山羊抗大鼠IgG,室温下孵育20 min,0.1 mol/L磷酸盐缓冲液(pH值7.4)冲洗,2 min×3次。滴加SABC室温孵育20 min,0.1 mol/L磷酸盐缓冲液(pH值7.4)冲洗,5 min×4次。DAB显色:取1 mL蒸馏水稀释,滴加到标本上显色,显微镜下控制反应时间,一般在5~30 min之间,蒸馏水充分冲洗。苏木素轻度复染。脱水、透明、中性树脂封片。显微镜下观察、摄片。
1.7脊髓灰质LIF表达检测
LIF染色以细胞及其突起呈棕黄色为阳性,采用计算机图像分析系统测量各组各时间点脊髓灰质LIF的表达。物镜放大10倍视野下,随机选择视野中的阳性反应细胞并测定其灰度值,灰度值与细胞反应强度成反比,每次取5个视野,以其平均值作为测定值。
1.8统计学方法
应用SPSS 16.0统计软件进行分析,符合正态分布的计量数据以均数±标准差(x-±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1一般情况及神经功能评分
大鼠脊髓压迫后均出现不同程度的后肢肌力减退、行走缓慢、步态异常等运动功能障碍,减压后运动功能恢复明显,以减压后1、3、7 d恢复速度较快,14 d后维持在一定水平,28 d运动功能部分恢复正常。各组改良Tarlov评分及斜板试验结果比较,差异均有统计学意义(F = 8.563,8.923;P = 0.004,0.003)。见表1。
2.2病理观察
损伤组大鼠脊髓扁平化,横径增大,矢状径减小,部分动物脊髓背侧可见一明显凹陷;减压后脊髓扁平化减轻,矢状径明显增加,脊髓背部仍可见明显压痕。
损伤组光镜下脊髓白质主要表现为不规则片状脱髓鞘区,主要位于与灰质相邻的侧索后索深层区域,同时伴胶质细胞增生。脊髓灰质内主要表现为神经细胞坏死退变,神经元数量减少,以前角神经元减少为主;灰质内胶质细胞增生较白质更加明显;中央管受压变扁,甚至闭缩(图1A)。减压组光镜下灰质内前角细胞数量减少,部分胞体固缩、变形,突触减少,神经细胞周围有裂隙;白质后外侧纤维排列紊乱,可见少量片状脱髓鞘改变,周围有少量空泡(图1B)。

表1 大鼠脊髓慢性渐进性压迫损伤及减压后改良Tarlov评分及斜板试验结果(x-±s,n = 8)
2.3脊髓灰质LIF表达
对照组脊髓灰质几乎不表达LIF,损伤及减压后各时相点脊髓灰质LIF表达均增加,各组比较,差异有统计学意义(F = 21.564,P = 0.004),提示脊髓慢性渐进性损伤及减压后LIF大量表达,减压3 d时LIF达到峰值,随着减压时间的延长,LIF表达有所降低,28 d时仍有一定表达(表2,图2)。
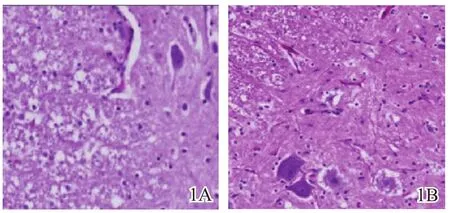
图1 大鼠脊髓损伤及减压后苏木精-伊红染色结果(×20)1A损伤组1B减压组
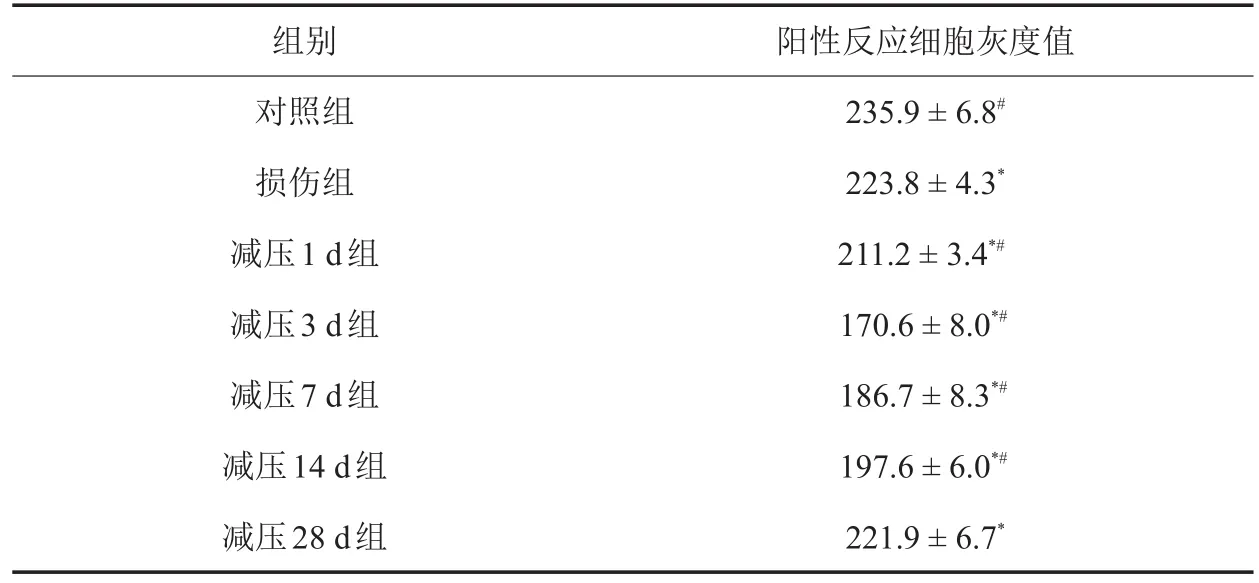
表2 大鼠慢性渐进性压迫脊髓损伤及减压后脊髓灰质LIF表达(x-±s,n = 8)
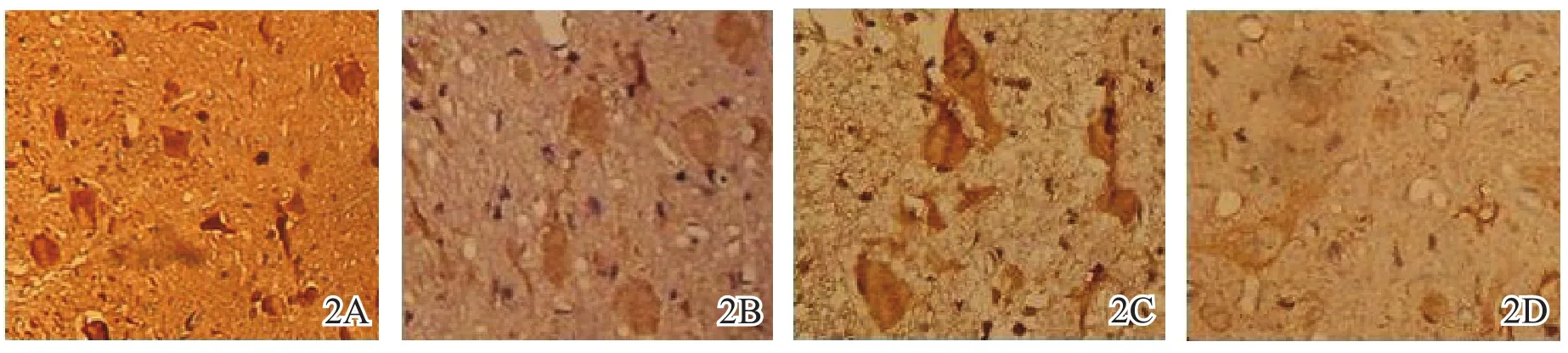
图2 大鼠脊髓损伤及减压后白血病抑制因子免疫组化表达结果(×400)2A假手术组2B减压后1 d组2C减压后3 d组2D减压后28 d组
3 讨论
3.1慢性渐进性脊髓损伤的病理机制及其治疗
慢性渐进性压迫性脊髓损伤是一种持续存在的静态损伤,其主要病理过程是原发性损伤基础上继发的病理性炎症反应,即血管通透性增加和邻近组织部位水肿,而周围组织的肿胀进一步造成血液供应的减少,加之炎症介质的生成,导致神经细胞坏死、凋亡[7-8]。对于慢性渐进性脊髓损伤,近年来人们主要采取药物治疗、细胞移植与基因治疗等方法。其中神经营养因子类药物可促进脊髓损伤患者神经元再生,减轻神经元损伤,对神经功能的恢复起到重要作用。而作为具有广泛生物学功能的神经营养因子,LIF被证实可通过调整神经系统,影响脊髓损伤后的炎症反应,进而达到促进脊髓功能恢复的目的[9-10]。
3.2 LIF与脊髓损伤
LIF是一种由靶组织产生并通过轴突末端受体介导的神经营养因子,在神经细胞的生理病理过程中担负着重要作用[11]。有学者研究发现,LIF可促使体外培养的神经干细胞增殖速度加快,同时细胞分化受到抑制[12];另外,LIF与特定受体结合后可促进轴突前体分泌神经肽类物质,进而加速乙酰胆碱等相关物质的合成[13]。亦有学者在制作脊髓损伤模型的过程中检测到LIF的表达增加,进而提出“LIF在脊髓损伤过程中可能参与神经元的修复,提高神经元的生存率”的结论[14-15]。另有实验结果证实LIF可能通过JAK/STAT信号转导途径发挥病理生理学效应[16-17];脊髓损伤原位给予LIF可改变神经轴突的生长方式并促进其他神经营养因子的分泌和表达[12]。总之,通过多水平调节促进神经细胞的存活以及神经元胞体的分化,LIF可起到挽救神经元、促进神经再生的作用。
3.3慢性渐进性脊髓损伤及减压后LIF表达变化
目前的研究结果提示,急性期神经系统损伤后LIF表达会发生变化,这一变化与神经元细胞的存活和修复密切相关[13,15,18];其更显著的生物学功能是通过抑制少突胶质细胞凋亡和轴突的脱髓鞘样变来减轻神经元的损伤,在致伤因子去除后的神经修复过程中发挥作用[19-21]。但到目前为止,脊髓慢性渐进性压迫损伤中LIF的变化及其与神经功能恢复的关系尚不清楚。本研究发现,慢性渐进性脊髓压迫性损伤大鼠脊髓灰质中LIF表达量增加,特别是在减压后其表达量显著增加,这一现象在减压后3 d达到高峰,28 d时仍有一定的表达,提示随着脊髓致伤因子的消除,在脊髓自我修复的过程中LIF表达量增加,间接证明LIF可能在受损脊髓的神经功能恢复过程中扮演重要角色。Li等[11]的实验结果表明,注射LIF后脊髓损伤小鼠的运动功能学评分显著高于对照组,且神经前体细胞的表达量亦增高,因此我们进一步推测,激活LIF的表达有可能对脊髓功能恢复起到促进作用,这为寻找脊髓慢性损伤的有效治疗方法提供了一个新的思路。
我们的实验结果显示,LIF的变化规律并不完全与神经功能恢复的变化规律一致,这可能与神经在肌肉的重复性支配相关,慢性渐进性损伤中未受损部位不出现LIF反应性表达也可能是原因之一。下一步我们将通过PCR、蛋白印迹实验等分子生物学途径进一步证实以上结果,为脊髓损伤神经营养因子治疗的深入研究提供更多的实验室依据。
参考文献
[1]Broholm C, Pedersen BK. Leukaemia inhibitory factor: an exercise-induced myokine [J]. Exerc Immunol Rev, 2010, 16: 77-85.
[2]Turnley AM, Bartlett PF. Cytokines that signal through the leukemia inhibitory factor receptor-beta complex in the nervous system [J]. J Neurochem, 2000, 74(3): 889-899.
[3]Cho N, Nguyen DH, Satkunendrarajah K, et al. Evaluating the role of IL-11, a novel cytokine in the IL-6 family, in a mouse model of spinal cord injury [J]. J Neuroinflammation, 2012, 9: 134.
[4]Butzkueven H, Emery B, Cipriani T, et al. Endogenous leukemia inhibitory factor production limits autoimmune demyelination and oligodendrocyte loss [J]. Glia, 2006, 53(7): 696-703.
[5]Tarlov IM, Klinger H, Vitale S. Spinal cord compression studies:Ⅰ: experimental techniques to produce acute and gradual compression [J]. AMA Arch Neurol Psychiatry, 1953, 70(6): 813-819.
[6]Rivlin AS, Tator CH. Objective clinical assessment of motor function after experimental spinal cord injury in the rat [J]. J Neurosurg, 1977, 47(4):577-581.
[7]Hirai T, Uchida K, Nakajima H, et al. The prevalence and phenotype of activated microglia/macrophages within the spinal cord of the hyperostotic mouse (twy/twy) changes in response to chronic progressive spinal cord compression: implications for human cervical compressive myelopathy [J]. PLoS One, 2013, 9(5): e64528.
[8]Navarro R, Juhas S, Keshavarzi S, et al. Chronic spinal compression model in minipigs: a systematic behavioral, qualitative, and quantitative neuropathological study [J]. J Neurotrauma, 2012, 29(3): 499-513.
[9]Kerr BJ, Patterson PH. Potent pro-inflammatory actions of leukemia inhibitory factor in the spinal cord of the adult mouse [J]. Exp Neurol, 2004, 188(2): 391-407.
[10]Vidal PM, Lemmens E, Dooley D, et al. The role of “anti-inflammatory”cytokines in axon regeneration [J]. Cytokine Growth Factor Rev, 2013, 24(1): 1-12.
[11]Ostasov P, Houdek Z, Cendelin J, et al. Role of leukemia inhibitory factor in the nervous system and its pathology [J]. Rev Neurosci, 2015, 26(4): 443-459.
[12]Li Y, Zang D. The neuron regrowth is associated with the proliferationof neural precursor cells after leukemia inhibitory factor administration following spinal cord injury in mice [J]. PLoS One, 2014, 9(12): e116031.
[13]侯玲玲.白血病抑制因子[J].动物医学进展, 1999, 20(3): 15-17.
[14]Butzkueven H, Emery B, Cipriani T, et al. Endogenous leukemia inhibitory factor production limits autoimmune demyelination and oligodendrocyte loss [J]. Glia, 2006, 53(7): 696-703.
[15]Banner LR, Patterson PH, Allchorne A, et al. Leukemia inhibitory factor is an anti-inflammatory and analgesic cytokine [J]. J Neurosci, 1998, 18(14): 5456-5462.
[16]Auernhammer CJ, Melmed S. Leukemia-inhibitory factorneuroimmune modulator of endocrine function [J]. Endocr Rev, 2000, 21(3): 313-345.
[17]Nicola NA, Babon JJ. Leukemia inhibitory factor (LIF) [J]. Cytokine Growth Factor Rev, 2015, 26(5): 533-544.
[18]Marriott MP, Emery B, Cate HS, et al. Leukemia inhibitory factor signaling modulates both central nervous system demyelination and myelin repair [J]. Glia, 2008, 56(6): 686-698.
[19]Nygårdas M, Paavilainen H, Müther N, et al. A herpes simplex virus-derived replicative vector expressing LIF limits experimental demyelinating disease and modulates autoimmunity [J]. PloS one, 2013, 8(5): e64200.
[20]Azari MF, Profyris C, Karnezis T, et al. Leukemia inhibitory factor arrests oligodendrocyte death and demyelination in spinal cord injury [J]. J Neuropathol Exp Neurol, 2006, 65 (9): 914-929.
[21]Gresle MM, Alexandrou E, Wu Q, et al. Leukemia inhibitory factor protects axons in experimental autoimmune encephalomyelitis via an oligodendrocyte-independent mechanism [J]. PLoS One, 2012, 7(10): e47379.
(本文编辑:白朝晖)
短篇论著
Changes of LIF expression after decompression in rats with chronic gradual compressive spinal cord injury
SHI Yingbin, WANG Shunli, YU Bin, JIAO Yunlong. Department of Orthopaedics, Zhengzhou Orthopaedics Hospital Affliated to Henan University, Zhengzhou, Henan 450052, China
【Abstract】Objective To observe the changes of leukemia inhibitory factor (LIF) expression after decompression in rats with chronic gradual compressive spinal cord injury, and to explore their relations to nerve function recovery. Methods Fifty-six Wistar rats were divided into 7 groups randomly, including sham-operated group, chronic gradual spinal cord injury group, chronic gradual spinal cord injury + decompression 1, 3, 7, 14, 28 day's group (n = 8). In each group, Tarlov scoring and inclined plane test were used to evaluate nerve function, and the expression of LIF level in spinal cord tissue was measured by immunohistochemistry method. Results In decompression groups, expressions of LIF levels in spinal cord tissue showed significantly increased, which reached the highest level after 3 day, afterwards, it decreased gradually, and recovered slowly after 14 day. Nerve function recovered faster in 14 days after decompression, and then recovered slowly. Conclusion For chronic gradual compressive spinal cord injury in rats, expressions of LIF levels in spinal cord tissue significantlyincrease after the decompression, which perhaps related to nerve functional recovery of spinal cord.
【Key words】Spinal cord injuries; Chronic disease; Spinal cord compression; Leukemia inhibitory factor; Nerve function; Recovery of function; Rats, Wistar
中图分类号:R651.22,R363.272
文献标识码:A
文章编号:1674-666X(2016)01-033-06
DOI:10.3969/j.issn.1674-666X.2016.01.006
收稿日期:(2015-11-24;修回日期:2015-12-22)
