下调Rab11基因对宫颈癌HeLa/SiHa细胞侵袭迁移的影响及机制探讨
2016-06-17阚岩岩张建华章龙珍
阚岩岩,张建华,周 敏,章龙珍,王 侠
1.徐州医学院研究生学院肿瘤学系,江苏 徐州 221002;2.徐州医学院附属医院放疗科,江苏 徐州 221002
下调Rab11基因对宫颈癌HeLa/SiHa细胞侵袭迁移的影响及机制探讨
阚岩岩1,张建华1,周 敏1,章龙珍2,王 侠2
1.徐州医学院研究生学院肿瘤学系,江苏 徐州 221002;2.徐州医学院附属医院放疗科,江苏 徐州 221002
[摘要]背景与目的:Rab11基因在宫颈癌细胞中高表达,可能与细胞恶性转化相关。本研究采用RNA干扰技术下调Rab11基因表达,并探讨其对宫颈癌HeLa/SiHa细胞侵袭迁移的影响及可能的相关机制。方法:将HeLa/SiHa细胞分为2组:阴性对照组(转染阴性对照的小干扰RNA)和Rab11 siRNA干扰组(转染小干扰Rab11siRNA)。蛋白[质]印迹法(Western blot)检测Rab11干扰效果,检测转染Rab11 siRNA后,侵袭相关蛋白Rac1、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)和MMP9表达的变化;细胞划痕损伤实验检测细胞迁移;Transwell实验检测细胞侵袭;细胞免疫荧光实验从形态学角度探索在小干扰Rab11后Rac1蛋白在细胞膜上聚集位置的变化。结果:转染小干扰Rab11siRNA到HeLa/SiHa细胞后,Rab11蛋白表达受到高效抑制(P<0.01);细胞迁移、侵袭能力受到抑制(P<0.05),Rac1蛋白表达明显下调(P<0.01),MMP2、MMP9蛋白表达下调(P<0.05),Rab11 siRNA处理组细胞运动前端细胞膜下Rac1蛋白聚集量减少。结论:Rab11基因表达下调可以抑制HeLa/ SiHa细胞的迁移和侵袭,其机制可能与Rac1、MMP2和MMP9蛋白表达量下降及Rac1定位的改变有关。
[关键词]Rab11;Rac1;基质金属蛋白酶;宫颈癌;细胞侵袭;细胞迁移
Correspondence to: WANG Xia E-mail: wangxia_66@163.com
随着宫颈癌癌前筛查的普及、诊断率的提高,宫颈癌发病年龄呈低龄化趋势[1]。尽管手术和同步放化疗对早期宫颈癌患者治愈率达80%~95%,但对局部晚期及复发转移的宫颈癌患者仍未有令人满意的治疗手段,亟需寻找有效的治疗方式。Rab基因于1983年第一次被发现并命名,目前为止有60多个家族成员被发现[2]。Rab11是Rab小分子GTP酶家族的一个亚家族成员,最早由Hale发现并命名,参与多种蛋白的运输,与乳腺癌、直肠癌等的侵袭、迁移密切相关[3-5]。Rac1(Ras-related C3 botulinum substrate 1)是Rho家族Rac亚家族的成员,主要调节肌动蛋白骨架重组、细胞周期的进行和特定基因表达[6]。有研究认为,Rac1参与多种肿瘤细胞的侵袭迁移[7],Rab11可以调控Rac1来控制细胞发生集体迁移的过程[8],基质金属蛋白酶(matrix metalloproteinase,MMP)可在多种癌组织中表达,且其表达的强弱与肿瘤的侵袭性和转移能力密切相关[9],但目前在宫颈癌细胞中尚未发现Rac1和MMP在Rab11基因的诱导下发生迁移和侵袭作用的报道。本研究应用RNAi技术,将Rab11基因的特异性小分子干扰RNA(siRNA)转染入HeLa/SiHa细胞,以观察阻断Rab11基因表达对细胞侵袭、迁移的影响;同时检测Rac1、MMP2、MMP9蛋白表达和Rac1蛋白聚集位置的变化,初步了解其在Rab11 siRNA干扰后在宫颈癌中的分子机制。
1 材料和方法
1.1材料
人宫颈癌细胞株HeLa及SiHa购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,DMEM-1640培养基购自美国Hyclone公司,胎牛血清(fetal bovine serum,FBS)购自杭州四季青生物科技有限公司,转染试剂脂质体LipofectamineTM2000购自美国 Invitrogen 公司,anti-Rab11、anti-actin购自美国Santacruz公司,anti-Rac1购自美国PTG公司,anti-MMP2、anti-MMP9和二抗购自美国Bioworld公司,免疫荧光二抗购自徐州微科曼得生物工程有限公司,Matrigel基质胶购自美国BD公司,细胞侵袭细胞培养板购于美国Corning公司。Rab11 siRNA由上海吉玛制药技术有限公司合成,si-Rab11序列为:5’-GAGCACCAUUGGAGUAGAGTT-3’, 小干扰阴性对照组(si-negative control)siRNA序列为:5’-UUCUCCGAACGUGUCACGUTT-3’。
1.2方法
1.2.1细胞培养及转染
HeLa、SiHa细胞用含10%灭活的FBS DMEM-1640培养液,于37℃、CO2体积分数为5%的培养箱中培养,取对数生长期的细胞,用0.25%胰酶消化、传代。
将培养He La/Si Ha细胞分为2组:sinegative control组及小干扰Rab11 siRNA组。转染前一天将HeLa/SiHa细胞接种于6孔板中,转染时细胞融合达到60%~80%,按LipofectamineTM2000说明书的步骤分别转染阴性对照组和Rab11 siRNA组。
1.2.2蛋白[质]印迹法(Western blot)检测
分组同细胞转染,HeLa/SiHa细胞在转染48 h后,蛋白裂解液裂解细胞并提取总蛋白。30 μg蛋白经SDS-PAGE胶分离后,转移至硝酸纤维素膜上,5%脱脂奶粉封闭2 h,加入一抗,4℃温育过夜,加入荧光二抗(1∶10 000稀释)室温温育2 h。TBST洗膜后,曝光分析。
1.2.3细胞侵袭能力检测
按BioCoat Matrigel invasion chamber试剂盒说明书进行试验,显微镜下取6个不同的视野(×200)进行计数,重复3次,计算侵袭细胞的平均数。
1.2.4细胞迁移能力检测
待转染后细胞数达70%生长融合时,用移液枪头沿培养板底部呈一字型划痕,用PBS洗,换上无血清的培养基,分别于培养0、6、12、24和36 h时在倒置显微镜下(10×10)测量划痕的宽度。细胞迁移率=(1-测量时划痕宽度/初始划痕宽度)×100%。
1.2.5细胞免疫荧光实验检测Rac1的定位改变
将两组转染后的细胞培养48 h的6孔板(铺有盖玻片)从培养箱中取出,PBS洗后,4%多聚甲醛固定20 min,0.5%TritonX-100处理细胞10 min,2%BSA封闭l h,每个盖玻片上滴加50 μL稀释好的一抗,置于4℃过夜,每个盖玻片上加入50 μL左右稀释好的荧光二抗,室温温育1 h,每孔加入染核试剂DAPI少许,室温下放置5 min,加入封片剂封片,荧光显微镜下观察拍照。
1.3统计学处理
所有研究均设3份平行实验,采用SPSS 16.0软件对上述结果进行分析,计量资料采用±s表示,组间两两比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1Rab11 siRNA干扰后Rab11蛋白的抑制情况
Western blot检测结果显示,在25×103处有灰色条带显示,Rab11蛋白在Rab11 siRNA组的表达量明显低于si-negative control组(HeLa组t=5.120,P<0.01,SiHa组t=4.956,P<0.01,图1)。
2.2Rab11 siRNA转染后细胞侵袭能力的检测
Transwell小室实验结果显示,与si-negative control组相比,转染Rab11 siRNA组HeLa/ SiHa细胞的侵袭能力明显下降,差异均有统计学意义(HeLa组t=16.841,P<0.01;SiHa组t=18.244,P<0.01,图2)。

图 1 Rab11 siRNA对于Rab11蛋白表达的影响Fig. 1 Effect of Rab11 siRNA on Rab11 expression
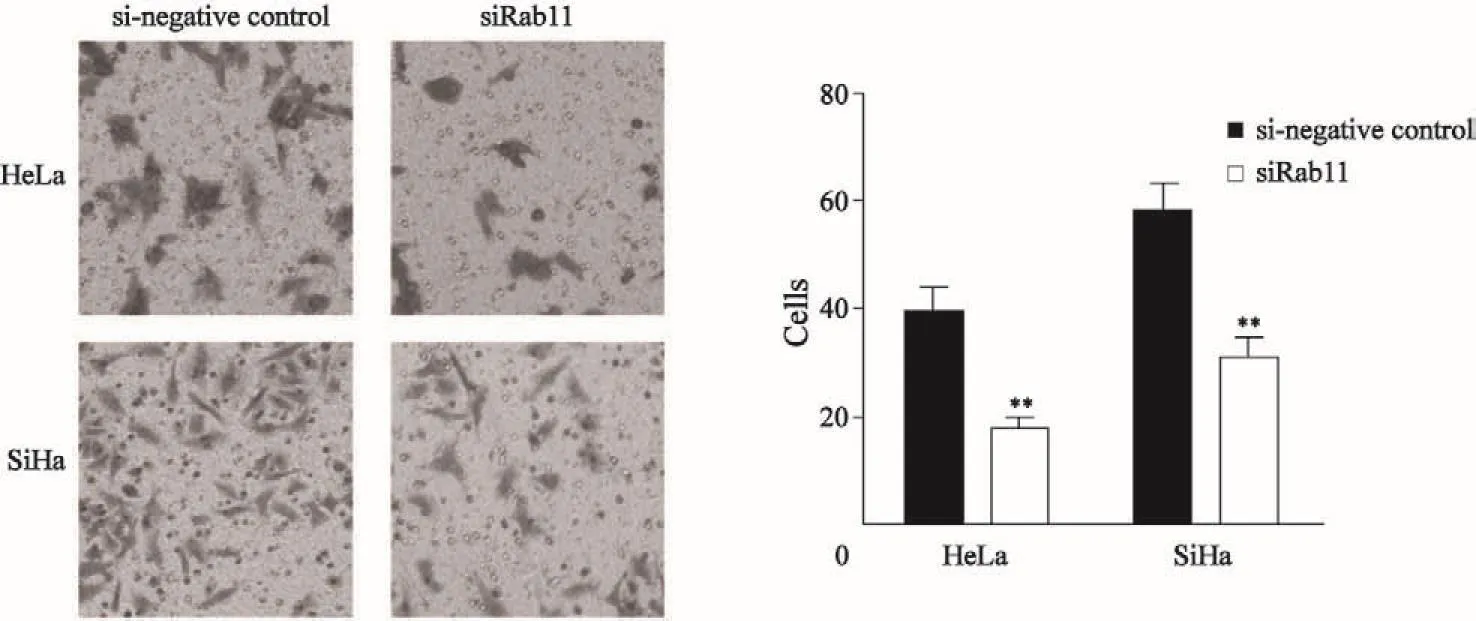
图 2 Rab11 siRNA对宫颈癌HeLa/SiHa细胞侵袭能力的影响Fig. 2 Effect of Rab11 siRNA on cervical cancer HeLa/SiHa cell invasion capacity
2.3Rab11 siRNA转染后细胞迁移能力的检测
细胞划痕损伤实验结果显示,Rab11 siRNA组与si-negative control组相比,HeLa/SiHa细胞的迁移能力明显降低(HeLa组24 h t=3.909,P<0.01,36 h t=2.997,P<0.05,SiHa组24 h t=4.007,P<0.01,36 h t=2.838,P<0.05,图3)。
2.4Rab11 siRNA干扰后Rac1、MMP2和MMP9蛋白的表达情况
Western blot检测结果显示,在21×103、72×103和92×103处有灰色条带显示,Rac1、MMP2和MMP9蛋白在Rab11 siRNA组的表达量明显低于si-negative control组(Rac1蛋白HeLa组t=8.794,P<0.01,SiHa组t=15.650,P<0.01;MMP2蛋白HeLa组t=5.634,P<0.01,SiHa组t=4.391,P<0.05;MMP9蛋白HeLa组t=3.430,P<0.05,SiHa组t=4.082,P<0.05,图4)。
2.5转染Rab11 siRNA对宫颈癌细胞骨架蛋白Rac1定位的影响
Rab11 siRNA组与si-negative control组相比,分布在细胞周围的红色荧光强度降低,集中在细胞膜前端上的红色荧光明显减少(红色荧光为分布在细胞膜上的Rac1蛋白,蓝色荧光为细胞核DAPI染色,图5)。

图 3 Rab11 siRNA对宫颈癌HeLa/SiHa细胞迁移能力的影响Fig. 3 Effect of Rab11 siRNA on cervical cancer HeLa/SiHa cell migration capacity
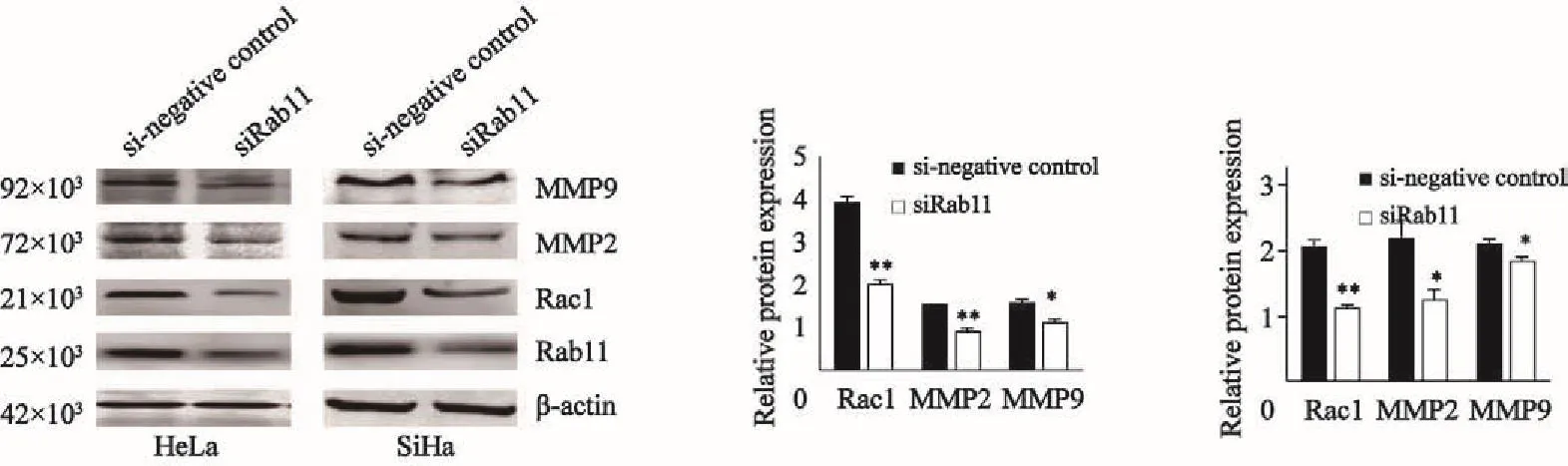
图 4 Rab11 siRNA对宫颈癌HeLa/SiHa细胞中Rac1、MMP2和MMP9蛋白表达的影响Fig. 4 Effect of Rab11 siRNA on Rac1, MMP2 and MMP9 expression in human cervical cancer HeLa/SiHa cell
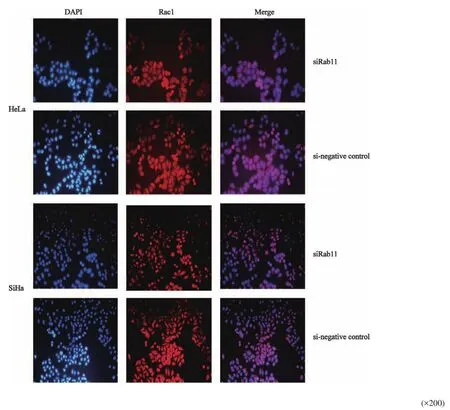
图 5 免疫荧光法检测Rab11 siRNA对宫颈癌细胞Rac1定位的影响Fig. 5 Immunoflorescence analysis of Rac1 localization in human cervical cancer cell transiently transfected withRab11 siRNA
3 讨 论
全世界范围内,宫颈癌占女性肿瘤发病率的第5位,占女性肿瘤死亡率的第4位[10]。近10年宫颈癌发病率不断增高,尤其是亚洲发展中国家。宫颈癌患者的预后与肿瘤的侵袭、转移密切相关,远处转移已成为提高患者生存率的主要障碍。深入研究宫颈癌的迁移、侵袭机制对于改善宫颈癌患者的总体预后水平起着至关重要的作用。
Rab11是Rab小分子GTP酶家族的一个亚家族成员,在内吞再循环过程中,Rab11作为关键调节因子,参与调节再循环内体的形成、运输,并引导携带受体的膜泡锚定于质膜之上,实现了受体和脂质的循环利用[11]。Rab11基因在乳腺癌、食管癌及皮肤癌等肿瘤中高表达,并在部分肿瘤的侵袭转移过程中起着重要作用[12-14]。然而,Rab11在宫颈癌细胞中的研究目前报道甚少。本研究采用siRNA技术,转染宫颈癌HeLa/SiHa细胞,经Western blot证明沉默效果的基础上,细胞划痕实验显示,Rab11下调表达24和36 h后,HeLa/SiHa细胞的迁移能力明显下降;Transwell实验显示,HeLa/SiHa细胞的侵袭能力明显下降,与未下调组相比,差异均有统计学意义。
Rac1是Rho家族Rac亚家族的成员。在细胞的迁移过程中,Rac1是形成含丰富肌动蛋白的膜上褶皱所必需的,这种褶皱被称为板状伪足,它被认定为引导细胞迁移和细胞运动的驱动力[6]。近年研究表明,Rac1在结肠癌、胃癌和肺癌组织中的表达明显升高,且与其侵袭、转移密切相关[7]。Liu等[15]发现,干涉HeLa 和SiHa细胞中Rab5a基因的内源性表达后,活化的Rac1水平下调,肿瘤细胞侵袭能力降低,证明Rac1与宫颈癌的侵袭迁移密切相关。Rab11 与Rab5同属于Rab小分子GTP酶家族的成员,其作用有所不同,Rab11主要作用是调节细胞的囊泡运输,Rab5主要负责调控胞吞泡与早期内体的融合。同时有研究显示,在肺癌细胞中,下调Rab11后Rac1蛋白表达量显著降低[14]。本实验通过Western blot检测,在HeLa/SiHa细胞转染Rab11 siRNA后,与对照组相比,Rac1蛋白的表达明显降低,进一步证实了Rab11能够调控Rac1蛋白的表达。有研究提示,Rac1的高度表达可破坏钙黏蛋白依赖的细胞连接,并通过调节肌动蛋白丝的聚合重组改变细胞的形态表型,增强细胞的迁移侵袭能力[16]。细胞免疫荧光实验发现,转染组与对照组比较,细胞免疫荧光强度减弱,Rac1的表达受到抑制,使细胞骨架重构,在细胞运动前端的胞膜下Rac1蛋白聚集减少,进而抑制片状伪足的形成及膜的多极化,抑制肿瘤细胞,最终抑制宫颈癌细胞的迁移、侵袭。有文献报道,在集体细胞迁移过程中,Rab11调控酪氨酸激酶的下游分子Rac1来控制膜突蛋白的活性以调节细胞间信息传递,本研究结果与之相符[8, 17]。在肿瘤细胞分泌的MMP中,MMP2和MMP9是最主要的降解型胶原酶,在肿瘤的新生血管形成、肿瘤细胞的浸润和转移灶的形成过程中均起重要作用。本实验通过Western blot检测结果显示,与未下调组相比,转染组MMP2与MMP9蛋白表达降低,提示Rab11可以通过调控宫颈癌HeLa/SiHa细胞中MMP2、MMP9蛋白的表达来影响细胞的侵袭、迁移。
目前有关Rab11基因与宫颈癌侵袭迁移关系的研究鲜有报道。本研究结果显示,在宫颈癌HeLa/SiHa细胞中,通过RNA干扰使Rab11基因表达沉默,进而对宫颈癌细胞的恶性行为产生抑制作用,这种抑制作用是通过对细胞中Rac1、MMP2和MMP9蛋白表达下调和对Rac1蛋白位置的改变而引发肿瘤细胞性状改变,从而抑制其转移能力。
综上所述,siRab11对宫颈癌HeLa/SiHa细胞的迁移、侵袭有较好的抑制作用,为进一步开展宫颈癌分子靶向治疗奠定了基础,为降低宫颈癌患者的远处转移率提供了理论依据。为更好地了解Rab11基因在宫颈癌发生、发展中的作用,有必要进一步研究Rab11与其他调节侵袭、迁移相关基因之间的关系和体内试验的进一步证实。
[参 考 文 献]
[1] 韩娜娜, 邵文裕, 刘开江, 等. Ⅰb2期巨块型宫颈癌术前不同治疗方法的疗效观察[J]. 中国癌症杂志, 2015, 25(1):56-62.
[2] BRIGHOUSE A, DACKS J B, FIELD M C. Rab protein evolution and the history of the eukaryotic endomembrane system[J]. Cell Mol Life Sci, 2010, 67(20): 3449-3465.
[3] HALES C M, GRINER R, HOBDY-HENDERSON K C, et al. Identification and characterization of a family of Rab11-interacting proteins[J]. J Biol Chem, 2001, 276(42):39067-39075.
[4] YOON S O, SHIN S, MERCURIO A M. Hypoxia stimulates carcinoma invasion by stabilizing microtubules and promoting the Rab11 trafficking of the alpha6beta4 integrin[J]. Cancer Res, 2005, 65(7): 2761-2769.
[5] CHUNG Y C, WEI W C, HUANG S H, et al. Rab11 regulates E-cadherin expression and induces cell transformation in colorectal carcinoma[J]. BMC Cancer, 2014, 14: 587. DOI:10.1186/1471-2407-14-587.
[6] YIP S C, EL-SIBAI M, CONIGLIO S J, et al. The distinct roles of Ras and Rac in PI 3-kinase-dependent protrusion during EGF-stimulated cell migration[J]. J Cell Sci, 2007,120(Pt 17): 3138-3146.
[7] WHALEY-CONNELL A T, MORRIS E M, REHMER N, et al. Albumin activation of NAD(P)H oxidase activity is mediated via Rac1 in proximal tubule cells[J]. Am J Nephrol, 2007,27(1): 15-23.
[8] EMERY G, RAMEL D. Cell coordination of collective migration by Rab11 and Moesin[J]. Commun Integr Biol,2013, 6(4): e24587.
[9] LU Z, LU N, LI C, et al. Oroxylin A inhibits matrix metalloproteinase-2/9 expression and activation by upregulating tissue inhibitor of metalloproteinase-2 and suppressing the ERK1/2 signaling pathway[J]. Toxicol Lett,2012, 209(3): 211-220.
[10] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015,136(5): E359-386.
[11] HUTAGALUNG A H, NOVICK P J. Role of Rab GTPases in membrane traffic and cell physiology[J]. Physiol Rev,2011, 91(1): 119-149.
[12] MORROW A A, ALIPOUR M A, BRIDGES D, et al. The lipid kinase PI4KIIIbeta is highly expressed in breast tumors and activates Akt in cooperation with Rab11a[J]. Mol Cancer Res, 2014, 12(10): 1492-1508.
[13] ROBERT M E, WASHINGTON M K, LEE J R, et al. Rab11a immunohistochemical analysis does not distinguish indefinite,low-, and high-grade dysplasia in Barrett esophagus[J]. Am J Clin Pathol, 2005, 124(4): 519-527.
[14] JAYACHANDRAN G, SAZAKI J, NISHIZAKI M, et al. Fragile histidine triad-mediated tumor suppression of lung cancer by targeting multiple components of the Ras/Rho GTPase molecular switch[J]. Cancer Res, 2007, 67(21):10379-10388.
[15] LIU S S, CHEN X M, ZHENG H X, et al. Knockdown of Rab5a expression decreases cancer cell motility and invasion through integrin-mediated signaling pathway[J]. J Biomed Sci, 2011, 18(1): 58.
[16] LOZANO E, BETSON M, BRAGA V M. Tumor progression:Small GTPases and loss of cell-cell adhesion[J]. Bioessays,2003, 25(5): 452-463.
[17] RAMEL D, WANG X, LAFLAMME C, et al. Rab11 regulates cell-cell communication during collective cell movements [J]. Nat Cell Biol, 2013, 15(3): 317-324.
Effect of silencing Rab11 by RNAi on invasion and migration of cervical cancer cell lines HeLa/SiHa and its mechanism
KAN Yanyan1, ZHANG Jianhua1, ZHOU Min1, ZHANG Longzhen2, WANG Xia2(1. Department of Oncology, the Graduate School, Xuzhou Medical College, Xuzhou 221000, Jiangsu Province, China; 2.Department of Radiotherapy, the Affiliated Hospital of Xuzhou Medical College, Xuzhou 221000, Jiangsu Province, China)
[Key words]Rab11;Rac1;Matrix metalloproteinase;Cervical cancer;Cell invasion;Cell migration
[Abstract]Background and purpose: The expression of Rab11 gene was increased in cervical cancer cell and may be involved in the cellular malignant transformation. This study used the sequence-specific siRNA knocking down the expression of Rab11 gene and aimed to investigate its effect on invasion and migration of cervical cancer cell lines HeLa/SiHa and its mechanism. Methods: HeLa/SiHa cells were divided into 2 groups: non-specific siRNA group transfected with unrelated siRNA (Rab11-NC) and Rab11 siRNA group transfected with Rab11 siRNA (Rab11siRNA). Western blot was used to examine the Rab11 protein expression. Cell migration and invasion were detected by cell scratch and Transwell invasion assay. Western blot was used to further investigate the expression of Rac1, matrix metalloproteinase 2 (MMP2) and MMP9 which were critical for regulating cell invasion. Moreover, immunofluorescence was used to identify intracellular location of Rac1 in HeLa/SiHa cells. Results: The Rab11 siRNA inhibited expression of Rab11 gene (P<0.01). The invasion and migration capacities of HeLa/SiHa cells were markedly inhibited in Rab11siRNA group (P<0.05). The expression of Rac1 significantly decreased (P<0.01). The expression of MMP2 and MMP9 decreased (P<0.05) as well. The recruitment of Rac1 to protruding edge significantly decreased following down-regulation of Rab11. Conclusion: Down-regulated Rab11 expression could inhibit the expression of Rac1, MMP2 and MMP9, and alter the location of Rac1, leading to suppression of HeLa/SiHa cells migration and invasion.
DOI:10.3969/j.issn.1007-3969.2016.03.006
中图分类号:R737.33
文献标志码:A
文章编号:1007-3639(2016)03-0238-07
基金项目:江苏省徐州市科技发展基金(KC14SH111)。
通信作者:王 侠 E-mail: wangxia_66@163.com
收稿日期:(2015-06-08 修回日期:2015-08-30)
