重组人促红细胞生成素对短暂性缺氧新生大鼠的神经保护作用
2016-06-17张梅梅闫方方
张梅梅,闫方方,蒋 超,孟 颜
郑州大学第五附属医院儿童康复医学科 郑州 450052
重组人促红细胞生成素对短暂性缺氧新生大鼠的神经保护作用
张梅梅△,闫方方,蒋超,孟颜
郑州大学第五附属医院儿童康复医学科 郑州 450052
△女,1960年9月生,本科,主任医师,研究方向:小儿神经病学,E-mail:mmzhang@zzu.edu.cn
关键词促红细胞生成素;缺氧缺血性脑病;新生大鼠;神经保护作用
摘要目的:探讨重组人促红细胞生成素(rhEPO)对新生大鼠缺氧缺血性脑病(HIE)的神经保护作用。方法:将7日龄雄性SD大鼠随机分为对照组、单纯缺氧组和治疗组。对照组不做缺氧处理,治疗组先建立短暂性脑缺氧大鼠模型,后经腹腔注射法给予rhEPO 治疗,对照组和单纯缺氧组于相同时间点腹腔注射等量生理盐水。采用干-湿重法测量脑组织含水量,尼氏染色观察海马CA1区神经元形态学变化,Western bolt检测海马组织中凋亡相关蛋白cleaved-Caspase-3、Bcl-2、Bax的表达情况。Morris水迷宫检测大鼠的神经行为学变化。结果:与对照组相比,单纯缺氧组大鼠脑组织含水量增加,海马CA1区退行变性神经元数目增多(P<0.001),细胞核固缩、深染明显;cleaved-Caspase-3、Bcl-2及Bax表达增加(P<0.001)。治疗组与单纯缺氧组相比,脑组织含水量及海马CA1区变性神经元数目明显减少,cleaved-Caspase-3、Bax表达减少而Bcl-2表达增加(P<0.05)。单纯缺氧组大鼠的学习记忆能力较对照组明显下降,而治疗组的学习记忆能力较单纯缺氧组有显著改善(P<0.001)。结论:rhEPO对HIE新生大鼠具有神经保护作用,能够减轻急性期脑水肿及海马神经元损伤,改善大鼠学习记忆能力。
缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是新生儿期最常见的脑病,其病情重、病死率高,并可导致永久性神经功能缺陷,已成为严重危害新生儿健康的重要因素[1]。亚低温治疗是目前惟一有效的临床治疗方法,但其远期神经保护效果并不明显,因此神经保护疗法仍为目前研究的热点[2]。促红细胞生成素(erythropoietin,EPO)的神经保护作用已在脑损伤模型得到证实[3],但其对HIE的神经保护作用鲜有报道。该实验旨在探讨EPO对HIE的神经保护作用,为临床EPO的应用提供理论依据。
1对象与方法
1.1实验动物、主要试剂与药品健康雄性7日龄SD大鼠120只,清洁级,体重10~13 g,由河南省实验动物中心提供;在光照、黑暗12 h交替、恒温恒湿环境中由母鼠自由喂养。重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)(沈阳三生制药有限公司),兔抗鼠cleaved-Caspase-3、 Bcl-2、Bax及GAPDH抗体(美国加州圣克鲁兹生物技术公司),羊抗兔辣根过氧化物酶二抗、Western bolt试剂盒(上海生工生物工程有限公司),BCA蛋白浓度测定试剂盒及超敏ECL化学发光试剂盒(中国碧云天生物技术有限公司),甲酚紫染色液(德国Sigma生物技术公司),其他常规试剂均为国产分析纯级。
1.2模型建立及实验分组参照Samaiya等[4]的方法建立新生大鼠窒息模型,具体如下:将7 日龄SD大鼠置于37 ℃恒温密闭缺氧装置中,以2.5 L/min的流量从进气口持续输入100%氮气10 min,然后将大鼠置于常氧环境中恢复至苏醒后送回母鼠身边喂养。按随机数表法将建模成功大鼠随机分为单纯缺氧组(n=40)、治疗组(n=40),另设对照组(n=40)不给予缺氧处理。治疗组于缺氧后0、24和48 h 3个时间点分别经腹腔注射rhEPO 5 000 U/kg,对照组和单纯缺氧组于相同时间点腹腔注射等量生理盐水。
1.33组大鼠脑组织含水量测定缺氧后48及72 h,每组随机选取8只大鼠,断头取脑后去除脑干和小脑,用灵敏度为0.001 g的数字天平测量其湿重,后置于58 ℃烤箱中烤至恒重,用脑含水量公式计算脑组织含水量[5]:脑含水量=(湿重-干重)/湿重×100%。
1.43组大鼠海马CA1区退行变性神经元数目的尼氏染色法检测缺氧后第7 天,每组取6只大鼠灌注取脑,将脑组织修块后置于40 g/L多聚甲醛固定液中4 ℃过夜;梯度蔗糖脱水,冰冻切片机制备包含海马组织的20 μm脑组织冠状切片。切片经干燥、水洗后,置于焦油紫染色液中37 ℃染色10 min,后行分化、脱水、透明、封片等处理,于光学显微镜下观察脑组织形态学变化。每只大鼠挑选3张脑片,每张脑片挑选3个高倍镜视野,计数海马CA1区退行变性神经元数目并计算其百分比。
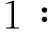
1.63组大鼠行为学检测术后4周,每组取12只大鼠进行Morris水迷宫实验。①参考记忆实验:共4 d,每d每只大鼠进行4次实验,每次实验让大鼠分别从不同象限面朝池壁入水,大鼠找到隐藏平台所用时间为逃避潜伏期,如果大鼠在60 s内未找到平台,则逃避潜伏期记录为60 s;每轮实验结束后,允许大鼠在平台停留10 s;每两次实验间隔为30 min。②探索实验:于实验第5天撤走平台,随机挑选一个入水点入水,观察大鼠在原平台象限停留时间及穿越原平台的次数。在上述2个实验中,大鼠的游泳速度被记录,作为评判大鼠运动能力的基线。数据由Morris水迷宫自动监视系统生成。
1.7统计学处理采用SPSS 21.0进行分析,应用单因素方差分析和LSD-t检验比较缺氧后不同时间点3组大鼠脑组织含水量、海马CA1区退行变性神经元数目、海马组织中cleaved-Caspase-3、Bcl-2及Bax蛋白表达的差异,应用重复测量数据的方差分析比较3组大鼠行为学的变化,检验水准α=0.05。
2结果
2.1缺氧后不同时间点3组大鼠脑组织含水量比较见表1 。
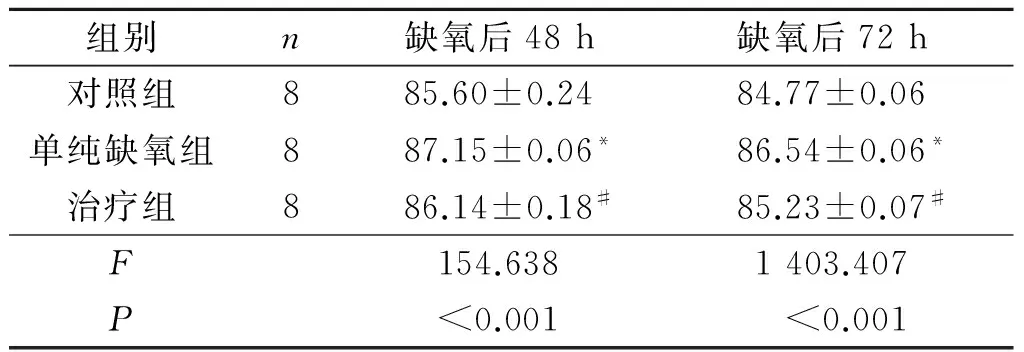
表1 缺氧后不同时间点
*:与对照组相比,P<0.05;#:与单纯缺氧组相比,P<0.05。
2.23组大鼠海马CA1区退行变性神经元数目尼氏染色结果见图1。对照组海马CA1区细胞排列整齐,核固缩少见;单纯缺氧组细胞排列紊乱,形态异常,核固缩、深染明显,神经细胞变性严重;治疗组海马CA1区细胞核固缩、深染情况较单纯缺氧组显著改善。单纯缺氧组海马CA1区变性神经元所占百分比(56.32%±5.27%)较对照组(6.97%±1.04%)明显增加,治疗组变性神经元所占百分比(25.20%±3.05%)较单纯缺氧组显著减少(F=293.626,P<0.001)。
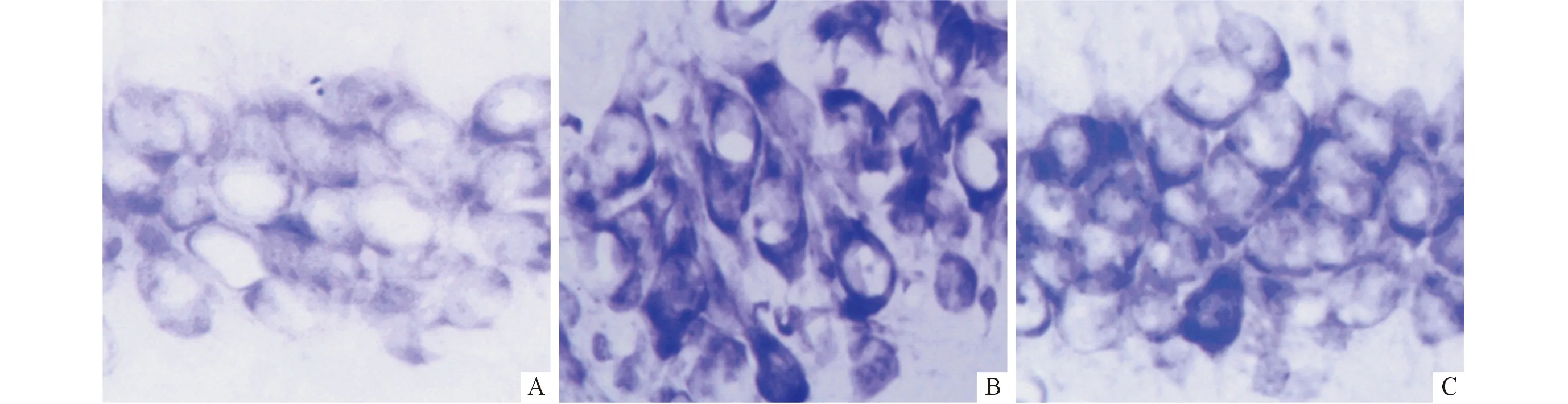
A:对照组;B:单纯缺氧组;C:治疗组。图1 各组大鼠海马CA1区尼氏染色结果(×400)
2.33组大鼠海马组织中cleaved-Caspase-3、Bcl-2及Bax蛋白的表达见图2、表2。
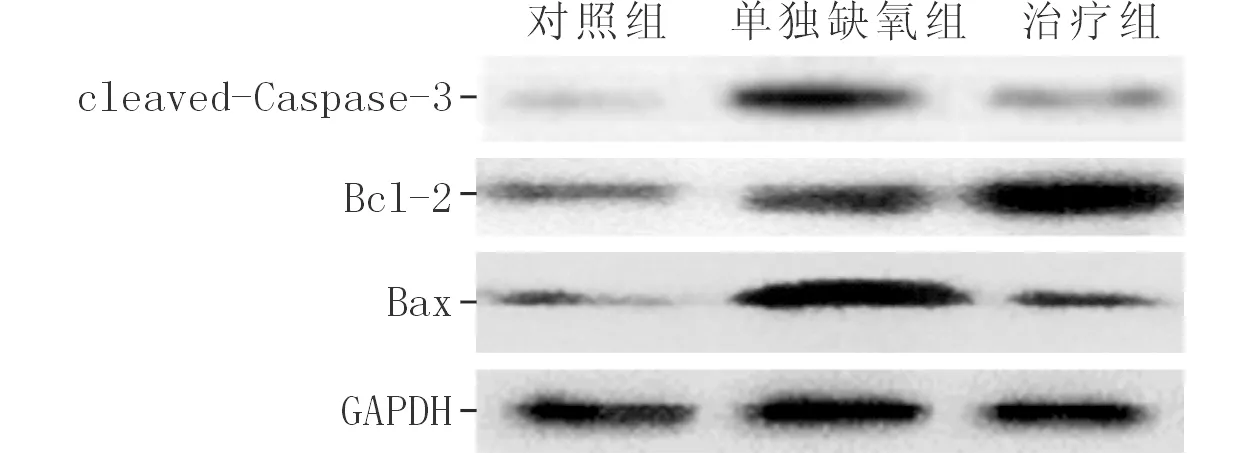
图2 3组大鼠海马组织中cleaved-Caspase-3、Bcl-2及Bax蛋白的表达

组别nclaved-Caspase-3Bcl-2BaxBcl-2/Bax对照组60.097±0.0401.440±0.0790.505±0.0923.800±0.898单纯缺氧组61.310±0.079*3.374±0.225*4.631±0.786*0.746±0.135*治疗组60.340±0.076#5.680±0.256#0.960±0.043#6.418±0.466#F525.748663.72137.906139.283P<0.001<0.001<0.001<0.001
*:与对照组相比,P<0.05;#:与单纯缺氧组相比,P<0.05。
2.43组大鼠行为学检测结果见表3、4。与对照
组相比,单纯缺氧组的逃避潜伏期明显延长,平台象限停留时间及穿越原始平台次数减少,表现出显著的认知功能缺损;而与单纯缺氧组相比,治疗组的逃避潜伏期明显缩短,平台象限停留时间及穿越原始平台次数增加,认知功能明显改善。各组间游泳速度差异无统计学意义(P>0.05)。
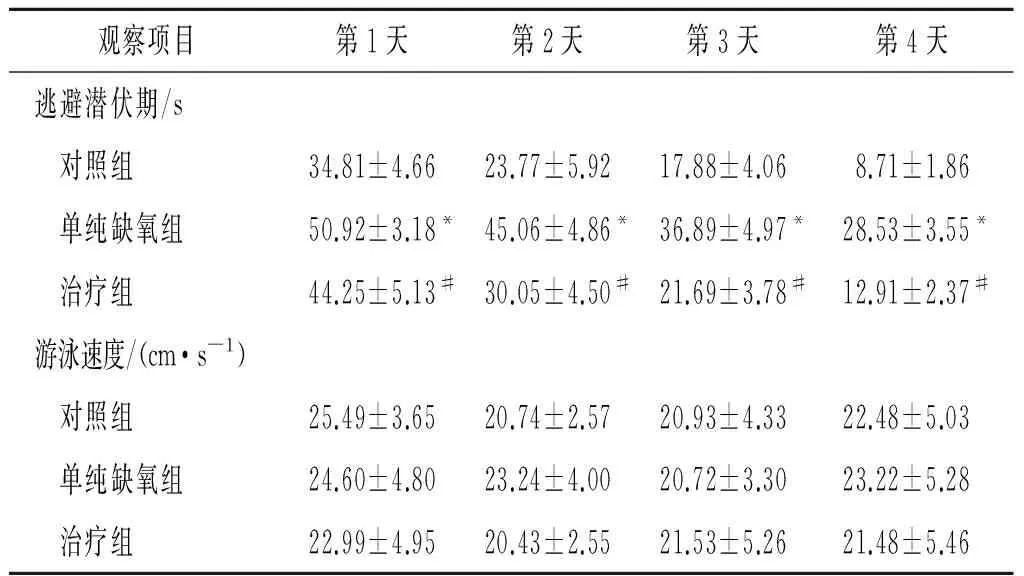
表3 Morris水迷宫
逃避潜伏期:F组间=205.795,P<0.001;F时间=279.989,P<0.001;F交互=3.653,P=0.003。*:与对照组相比,P<0.05;#:与单纯缺氧组相比,P<0.05。游泳速度:F组间=1.170,P=0.323;F时间=2.925,P=0.097;F交互=0.180,P=0.836。
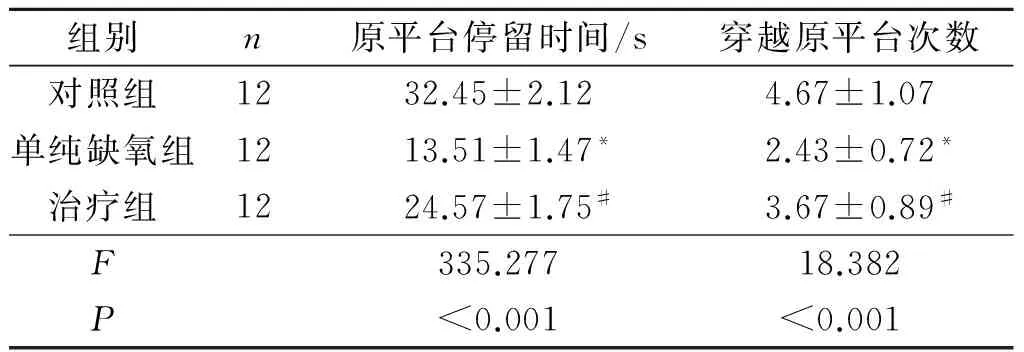
表4 Morris水迷宫探索实验结果
*:与对照组相比,P<0.05;#:与单纯缺氧组相比,P<0.05。
3讨论
HIE的发病率及死亡率高,其中约25%的存活患儿可产生智力障碍、癫痫、脑性瘫痪等神经系统后遗症[2]。EPO是一种活性糖蛋白,因其促红细胞生成作用被应用于贫血的治疗。近二十年来,EPO的非造血作用逐渐被阐明[3,6-7]。研究[8-9]表明,EPO受体在皮质、海马等脑组织、胶质细胞、神经元、内皮细胞中均有表达,且表达量受缺氧刺激调控。
EPO的神经保护作用虽已在脑损伤模型中得到证实[10-11],但仍缺乏EPO对于HIE保护作用的研究。故作者选用Samaiya等[4]的方法,造成新生大鼠全脑弥漫性损伤,模拟临床HIE的病理变化过程,探究EPO的神经保护作用。
高剂量EPO全身应用可通过未成熟及缺氧损伤脑组织的血脑屏障发挥神经保护作用,该实验采用一种有效的给药方法[12],即高剂量rhEPO(5 000 U/kg)连续3 d腹腔给药,以提高通过血脑屏障的EPO含量。脑组织含水量测定结果证实rhEPO应用能显著减轻缺氧后急性期脑水肿。
HIE的主要病理改变为缺氧造成的急、慢性脑损伤,故该实验选择对缺氧敏感且与学习记忆能力密切相关的海马作为研究对象。尼氏染色结果显示rhEPO能够减轻缺氧对神经元造成的损伤。Morris水迷宫结果表明rhEPO治疗可明显改善后期大鼠的学习记忆能力。
Bcl-2是抗凋亡蛋白,而Bax是促凋亡蛋白,Bcl-2和Bax的比值是决定细胞存亡的关键。半胱天冬酶家族(Caspases)是哺乳动物细胞凋亡的启动者和执行者,其中Caspase-3是凋亡执行者中最关键的蛋白酶,而Caspase-3的激活是Bax诱导的细胞凋亡的必经步骤[13-14]。该研究通过Western blot检测表明:缺氧处理能够增加促凋亡蛋白的表达;而rhEPO干预后,抗凋亡蛋白表达显著增加而促凋亡蛋白表达减少,从蛋白水平证明了rhEPO具有一定的抗凋亡作用。
总之,该实验通过对缺氧损伤急性期脑组织含水量、病理学改变、凋亡相关蛋白及后期行为学表现的研究,证实了EPO的神经保护作用,为EPO神经保护研究提供了新的实验依据,而有关合适的临床给药途径、给药剂量及全身大剂量应用后的并发症等问题仍有待进一步探究。
参考文献
[1]MARTINEZ-BIARGE M,DIEZ-SEBASTIAN J,WUSTHOFF CJ,et al.Antepartum and intrapartum factors preceding neonatal hypoxic-ischemic encephalopathy[J].Pediatrics,2013,132(4):e952
[2]ZUBCEVIC S,HELJIC S,CATIBUSIC F,et al.Neurodevelopmental follow up after therapeutic hypothermia for perinatal asphyxia[J].Med Arch,2015,69(6):362
[3]RANGARAJAN V,JUUL SE.Erythropoietin: emerging role of erythropoietin in neonatal neuroprotection[J].Pediatr Neurol,2014,51(4):481
[4]SAMAIYA PK,KRISHNAMURTHY S.Characterization of mitochondrial bioenergetics in neonatal anoxic model of rats[J].J Bioenerg Biomembr,2015,47(3):217
[5]何远宏,李魁,王建平,等.骨髓单个核细胞移植对脑出血大鼠的影响[J].郑州大学学报(医学版),2014,02(2):264
[6]TORUN YA,OZDEMIR MA,ULGER HA,et al.Erythropoietin improves brain development in short-term hypoxia in rat embryo cultures[J].Brain Dev,2014,36(10):864
[7]JUUL SE,FERRIERO DM.Pharmacologic neuroprotective strategies in neonatal brain injury[J].Clin Perinatol,2014,41(1):119
[8]WANG L,DI L,NOGUCHI CT.Erythropoietin, a novel versatile player regulating energy metabolism beyond the erythroid system[J].Int J Biol Sci,2014,10(8):921
[10]WANG L,WANG X,SU H,et al.Recombinant human erythropoietin improves the neurofunctional recovery of rats following traumatic brain injury via an increase in circulating endothelial progenitor cells[J].Transl Stroke Res,2015,6(1):50
[11]徐发林,郭佳佳,王彩红,等.不同时机应用促红细胞生成素对感染所致新生大鼠脑损伤的保护作用[J].中华实用儿科临床杂志,2014,29(17):1325
[13]WU N,LI W,SHU W,et al.Protective effect of picroside Ⅱ on myocardial ischemia reperfusion injury in rats[J].Drug Des Devel Ther,2014,8:545
[14]WEI P,ZHIYU C,XU T,et al.Antitumor effect and apoptosis induction of Alocasia cucullata (Lour.) G. Don in human gastric cancer cells in vitro and in vivo[J].BMC Complement Altern Med,2015,15:33
(2015-10-12收稿责任编辑赵秋民)
Neuroprotective effect of recombinant human erythropoietin for transient cerebral hypoxia neonatal rats
ZHANGMeimei,YANFangfang,JIANGChao,MENGYan
DepartmentofPediatricNeurology,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordserythropoietin;hypoxic-ischemia encephalopathy;neonatal rat;neuroprotective effect
AbstractAim: To explore the neuroprotective effect of recombinant human erythropoietin (rhEPO) for hypoxic-ischemic encephalopathy(HIE) in neonatal rats.Methods: Seven-day-old SD neonatal rats were randomly allocated into three groups: control group, anoxia group and rhEPO treatment group. The control group did not undergo anoxia. After the establishment of anoxia model, the rhEPO treatment group received rhEPO by intraperitoneal injection. Neonatal rats in control group and anoxia group received the treatment with the same volume of normal saline at the same time point. Brain water content(BWC) was estimated by dry-wet method;morphological changes in neurons of hippocampus CA1 area were observed by Nissl staining;apoptosis-related proteins such as cleaved-Caspase-3, Bcl-2 and Bax were measured by Western bolt. Neurological behavior was assessed by Morris water maze test(MWM).Results: Compared with control group, the BWC as well as the number of denatured neurons of hippocampus CA1 area in anoxia group was significantly increased(P<0.001); the nucleus pycnosis and hyperchromasia were evidently seen. In addition, the expressions of cleaved-Caspase-3, Bcl-2 and Bax in anoxia group were significantly increased compared with those of control group(P<0.001). Compared with anoxia group, the BWC, the number of denatured neurons of hippocampus CA1 area and expressions of cleaved-Caspase-3 and Bax in rhEPO treatment group were significantly decreased, while the expression of Bcl-2 was significantly increased (P<0.05). The ability of learning and memory in anoxia group was significantly decreased compared with control group, while the ability of learning and memory in rhEPO treatment group was significantly improved compared with anoxia group(P<0.001).Conclusion: RhEPO has neuroprotective effect by reducing acute brain edema, alleviating injury of neurons in hippocampus and improving the neurological behavior of neonatal rats with HIE.
doi:10.13705/j.issn.1671-6825.2016.03.025
中图分类号R722
