持续性牵张力在高糖状态下对子宫平滑肌细胞收缩蛋白表达的影响
2016-06-16毛敬韩志敏周木兰董玲玲
毛敬,韩志敏,周木兰,董玲玲
持续性牵张力在高糖状态下对子宫平滑肌细胞收缩蛋白表达的影响
毛敬,韩志敏,周木兰,董玲玲
【摘要】目的:探讨持续性牵张力在高糖环境下对大鼠子宫平滑肌细胞催产素受体和前列腺素受体表达的影响。方法:体外培养大鼠子宫平滑肌细胞,高糖作用不同时间后,观察高糖状态下大鼠子宫平滑肌细胞催产素受体和前列腺素受体表达变化情况。对高糖状态下的肌细胞施加持续性牵张力,明确牵张力对肌细胞催产素受体和前列腺素受体表达的影响以及高糖和牵张力之间的协同作用,同时采用晚期糖基化终末产物(AGEs)抑制剂(sRAGE)拮抗高糖作用作为对照,比较加入抑制剂后,催产素受体和前列腺素受体表达变化情况。结果:单独高糖培养或单独持续性牵张力都可导致大鼠子宫平滑肌细胞裂解液中催产素受体和前列腺素受体表达量上升,二者同时施加,可使催产素受体和前列腺素受体表达进一步上升,并有一定的协同效应。加入sRAGE后均可使催产素受体和前列腺素受体表达部分下降,但仍高于生理糖浓度组。结论:高糖状态及牵张力均可促进肌细胞催产素受体和前列腺素受体表达增加,并有一定协同作用,AGEs参与了这一过程,但并不是唯一途径。
【关键词】应力,物理;葡萄糖;子宫;肌细胞,平滑肌;收缩蛋白质类;受体,催产素;受体,前列腺素
作者单位:200126上海,同济大学附属第一妇婴保健院
(J Int Obstet Gynecol,2016,43:230-233)
妊娠期糖尿病是目前妇产科临床上常见的一种疾病,国内统计其发生率将近占全部孕妇的20%[1],并有逐年上升趋势,对孕妇和胎儿均有不同程度的危害,其并发症的发生率与孕妇妊娠期糖尿病的严重程度成正比。平滑肌是子宫最主要的成分,妊娠期糖尿病患者子宫平滑肌组织处于一个特殊的环境,不仅受高糖环境的影响,也受妊娠时子宫膨大的牵张力的影响,子宫肌肉组织收缩活性的异常,易引发流产、早产、胎盘功能不全和胎儿发育异常等并发症。目前研究表明高糖环境或牵张力可导致多种细胞增殖活性降低,引发凋亡现象[2-4],但关于高血糖对子宫肌肉组织收缩蛋白有何影响、是通过何种途径实现的以及牵张力在其中的作用,目前尚少见报道。另有研究表明,高糖状态下晚期糖基化终末产物(AGEs)聚集,与晚期糖基化终末产物受体(RAGE)结合,进而可以通过多种方式激活下游因子并影响细胞功能,可溶性RAGE(sRAGE)可竞争性与AGEs结合,从而阻断AGEs与RAGE的结合,抑制AGEs的功能[5-6],包括细胞增殖、分化及凋亡等。本实验通过体外培养大鼠子宫平滑肌细胞,阐明在高糖环境和牵张力双重作用下,子宫平滑肌细胞相关收缩蛋白催产素受体和前列腺素受体表达的变化情况,并进一步明确AGEs抑制剂对此过程的调控作用,以期为降低妊娠期糖尿病并发症提供参考。
1 材料与方法
1.1试剂和仪器胎牛血清(美国Gibco公司),细胞培养基(DMEM,美国Gibco公司),胰蛋白酶(美国Amresco公司),Triton X-100(美国Sigma公司),乙二胺四乙酸(EDTA,美国Amresco公司),酶联免疫吸附(ELISA)试剂盒(上海研域化学试剂有限公司),细胞培养箱(美国ThermoForma公司),ELx800 uv型酶联免疫检测仪(美国Bio-Tek公司),TDZSWS型自动平衡高速离心机(湖南湘仪离心机仪器有限公司),TGL-16G型高速台式离心机(上海安亭科学仪器厂),温控超速离心机(德国Eppendorf公司),FV500激光共聚焦显微镜(日本Olympus公司),倒置相差显微镜(德国Leica公司)。
1.2大鼠肌细胞预处理分离培养正常大鼠子宫平滑肌细胞,噻唑蓝(MTT)比色法观察细胞增殖情况并绘制细胞生长曲线,细胞接种于96孔培养板,从次日开始每天取出一个培养板,共检测7 d。每孔加入MTT溶液20 mL,37℃继续孵育4 h,终止培养,小心吸弃孔内培养上清液,每孔加入150 mL的二甲基亚砜(DMSO),震荡10 min,使甲瓒充分溶解,用Synergy HT多功能酶标仪选择490 nm波长,测定吸光度值(A值),并以时间为横轴,A值为纵轴绘制细胞生长曲线。因对数生长期细胞是细胞增殖最活跃的时期,各项指标表达相对显著并且稳定,因此本研究采取对数生长期细胞进行试验。1.3高糖状态对肌细胞催产素受体和前列腺素受体表达的影响采用对数生长期细胞,生理糖浓度(5.5 mmol/L)进行细胞培养24 h,在细胞培养基中加入葡萄糖,使培养液中葡萄糖终浓度达到35 mmol/L,高糖状态下对大鼠子宫平滑肌细胞进行体外培养,时间分别为0,6,12,24 h,然后采用蛋白质印迹法(Western-blot法)检测各时间点细胞裂解液中催产素受体和前列腺素受体的浓度变化情况。
1.4牵张力和高糖协同作用下肌细胞催产素受体和前列腺素受体表达的变化采用对数生长期细胞,生理糖浓度(5.5 mmol/L)进行细胞培养24 h,本实验共分6组,对照组(C组)采用生理糖浓度继续培养24 h;高糖组(G组)采用高糖浓度(35 mmol/L)继续培养24 h;高糖+抑制剂组(G+sRAGE组)细胞在其培养液中加入AGEs的抑制剂sRAGE(浓度为1mg/L),于加入葡萄糖的同时加入,作用时间同为24 h,拮抗高糖作用;牵张力组(F组)细胞采用美国Flexercell公司细胞拉伸加载装置对细胞进行应力加载,根据参考文献及预实验[4],力值大小为细胞表面拉伸力的20%,性质为持续性牵张应力,持续时间24 h;高糖+牵张力组(G+F组)细胞加入高糖的同时施加牵张力,作用时间同为24 h;高糖+牵张力+抑制剂组(G+ F+sRAGE组)细胞加入高糖的同时施加牵张力,并同时加入AGEs的抑制剂sRAGE(浓度为1 mg/L),作用时间同为24 h; Western-blot法检测细胞裂解液中催产素受体和前列腺素受体的浓度变化情况。
1.5Western-blot法测定催产素受体和前列腺素受体含量每组细胞收集1×107个细胞,弃去培养液,用磷酸盐缓冲液(PBS)冲洗3次,裂解后常规提取总蛋白,绘制蛋白标准曲线,聚丙烯酰胺凝胶(SDS-PAGE)电泳,化学发光法检测每组样本中催产素受体和前列腺素受体蛋白含量,并分别与各自内参(Actin)对比,即比较目的蛋白与内参蛋白灰度值的比值,检测相对含量并进行统计分析。
1.6统计学方法用SPSS 17.0软件对所得数据进行分析。定量资料用均数±标准差(±s)表示,高糖状态不同时间点对受体表达影响采用重复测量资料的方差分析;牵张力和高糖作用对受体表达的影响为2×2析因设计资料,采用析因方差分析;加入sRAGE后对受体表达的影响采用两独立样本均数比较的t检验。P<0.05为差异有统计学意义。
2 结果
MTT法检测大鼠子宫平滑肌细胞生长曲线呈S型,细胞第1~2天处于静止期,无明显增长,从第3天开始进入快速生长期,细胞增殖加速,第6天开始进入平台期,生长受到抑制,见图1。本实验选择第3天的细胞进行后续实验。
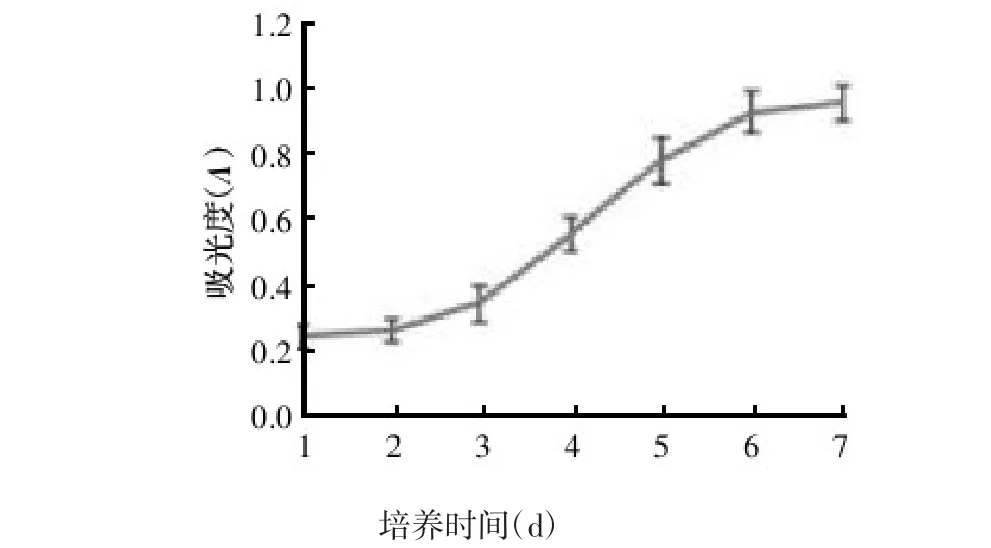
图1 大鼠子宫平滑肌细胞生长曲线
本实验结果发现,随着高糖作用时间增加,细胞裂解液中催产素受体(F时间=22.549,P=0.000)和前列腺素受体(F时间=20.21,P=0.000)表达量上升,差异有统计学意义,见表1、图2和图3。
表1 高糖作用下肌细胞催产素受体和前列腺素受体表达变化 (±s)
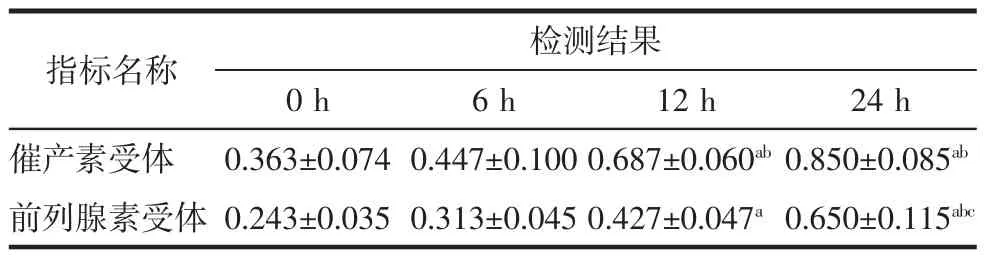
表1 高糖作用下肌细胞催产素受体和前列腺素受体表达变化 (±s)
注:a与0 h比较;b与6 h比较;c与12 h比较,均P<0.05。
指标名称 检测结果0 h 6 h 12 h 24 h催产素受体 0.363±0.074 0.447±0.100 0.687±0.060ab0.850±0.085ab前列腺素受体0.243±0.035 0.313±0.045 0.427±0.047a0.650±0.115abc
析因方差分析示,单独高糖培养或单独持续性牵张力都可导致大鼠子宫平滑肌细胞裂解液中催产素受体(FG=112.94,FF=99.07)和前列腺素受体(FG= 136.91,FF=121.57)表达量上升(P<0.05);二者同时施加,可使催产素受体(FG×F=15.77)和前列腺素受体(FG×F=7.91)表达进一步上升,二者存在协同作用(P<0.05)。在高糖状态下以及高糖和牵张力同时存在时分别加入sRAGE后均可使催产素受体和前列腺素受体表达下降,但仍高于生理糖浓度和单独牵张力时的催产素受体和前列腺素受体表达水平(P<0.05),见表2、表3、图4和图5。

图2 高糖状态对肌细胞催产素受体的影响
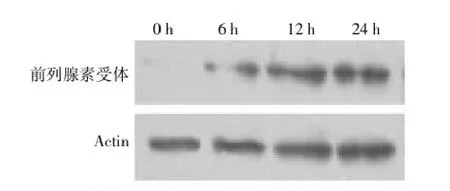
图3 高糖状态对肌细胞前列腺素受体的影响(Western-blot法)

图4 高糖、牵张力及sRAGE对肌细胞催产素受体的影响
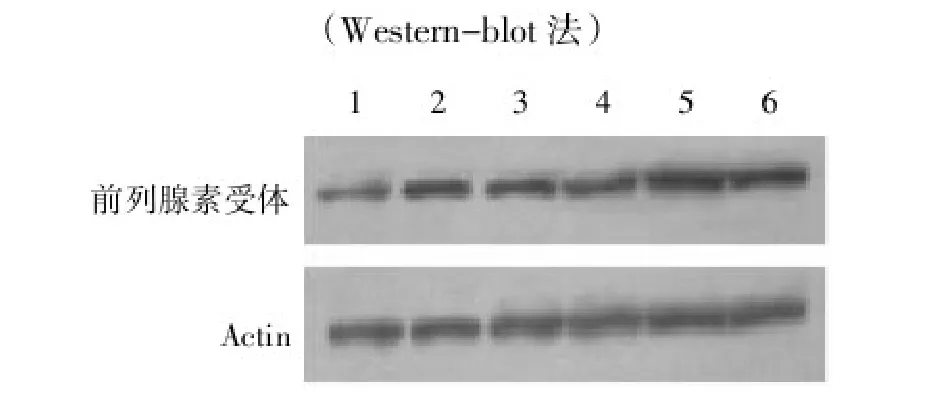
图5 高糖、牵张力及sRAGE对肌细胞前列腺素受体的影响(Western-blot法)
表2 牵张力和高糖作用下肌细胞催产素受体和前列腺素受体表达变化 (±s)
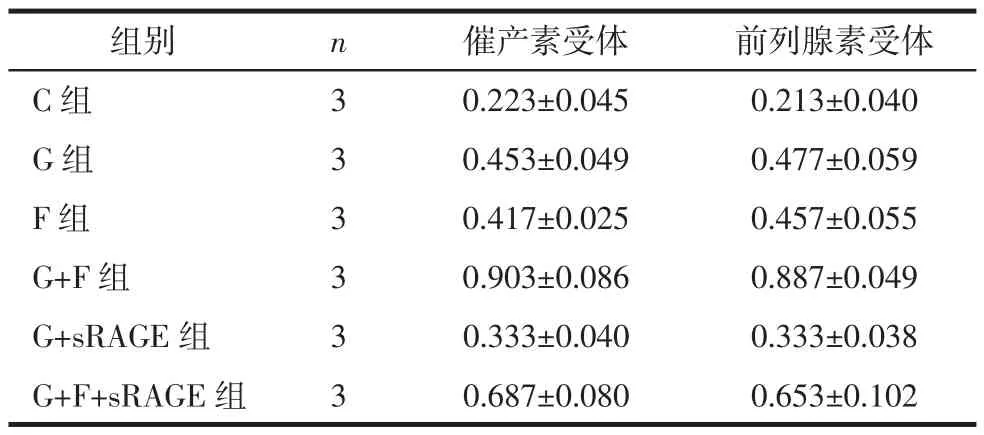
表2 牵张力和高糖作用下肌细胞催产素受体和前列腺素受体表达变化 (±s)
组别 n 催产素受体 前列腺素受体C组 3 0.223±0.045 0.213±0.040 G组 3 0.453±0.049 0.477±0.059 F组 3 0.417±0.025 0.457±0.055 G+F组 3 0.903±0.086 0.887±0.049 G+sRAGE组 3 0.333±0.040 0.333±0.038 G+F+sRAGE组 3 0.687±0.080 0.653±0.102

表3 各组合分析的统计量值
3 讨论
在分娩调节中,临产后一个重要变化是一系列炎性介质的释放[如白细胞介素1(IL-1)、IL-6、IL-8]及收缩相关蛋白在子宫平滑肌细胞膜的协调表达,临产后触发强烈而协调的宫缩将胎儿娩出[7-8]。这些收缩蛋白主要包括催产素受体、前列腺素受体、β-肾上腺素受体、促肾上腺皮质激素释放激素受体以及钾离子通道蛋白等[9-11]。子宫催产素受体在整个妊娠期逐渐增加,产程开始后子宫平滑肌的催产素受体水平比正常子宫高200多倍。前列腺素可通过前列腺素E受体1和3(EP1和EP3),促进细胞内第二信使磷脂酰肌醇/二酰甘油(IP3/DAG)表达、降低细胞内环磷酸腺苷(cAMP)水平,使细胞质钙离子浓度升高,从而收缩平滑肌。但在高糖状态下,机械牵张力是否会对催产素及其受体途径产生影响,具体机制如何,少见报道。因此,本研究重点探讨催产素受体及前列腺素受体在高糖和牵张力影响子宫平滑肌细胞收缩功能过程中的表达变化情况,为后续实验奠定基础。
Zhang等[12]在实验中发现,经过小剂量链脲佐菌素处理过的小鼠,胰岛素的分泌降低,对照组小鼠表现出明显的高血糖,而中枢注射催产素的治疗组小鼠血糖得到明显改善,并且血清胰岛素水平提高,该研究提示催产素有一定的降血糖作用,而本研究结果也表明子宫肌细胞催产素受体的分泌量随着高糖作用时间的增加而显著上升,说明高糖可以呈时间依赖性地促进催产素受体的表达,这与赵军等[13]研究结果一致。高糖条件下催产素分泌量表达升高,进而起到一定的降血糖作用,可能是自体神经内分泌调控机制起到的保护作用,其具体机制有待于进一步研究,但这一过程可能与腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路有关,研究发现催产素能够诱导骨骼肌细胞的葡萄糖摄取,并刺激骨骼肌细胞内钙离子浓度增加,启动钙调蛋白依赖性蛋白激酶,上调AMPK的活性,AMPK可以磷酸化磷酸果糖激酶,增加其活性,进一步增强糖酵解途径,最终提高对葡萄糖的摄取[14]。尽管如此,以上研究都没有涉及到细胞力学刺激在这一过程中的作用。
本研究还发现,牵张力本身也可以促进催产素受体和前列腺素受体的表达,这完全符合体内妊娠过程的实际生理情况,即在妊娠末期,子宫过度膨大,平滑肌所受的牵张力也达到最大,此时催产素受体和前列腺素受体的表达可协助启动分娩过程。但在以往研究中,尚未查阅到有文献报道牵张力和高糖共同作用对肌细胞收缩相关蛋白的影响,因而本研究正是对这一方面进行了补充,本研究结果表明,牵张力和高糖有一定的协同作用,表现为牵张力可以加剧高糖状态促进肌细胞催产素受体和前列腺素受体表达升高这一过程,说明高糖环境下妊娠期子宫更易受到牵张力的影响,导致收缩蛋白表达增加。收缩蛋白的异常表达会使得子宫平滑肌收缩异常,进而引发流产、早产、胎盘功能不良及胎儿发育异常等并发症,糖尿病妊娠者早产发生率可达到10%~25%,胎儿畸形率也高于非糖尿病孕妇,严重畸形发生率为正常妊娠的7~10倍,且与受孕后最初数周高血糖水平密切相关,是构成围生儿死亡的重要原因。
本研究还发现,AGEs的抑制剂sRAGE部分抑制这一过程,但不能完全阻断,表现为加入sRAGE后,催产素受体和前列腺素受体的表达虽然低于不加入组(即G+sRAGE组低于G组,G+F+sRAGE组低于G+F组),但仍高于对照组(即G+sRAGE组高于C组,G+F+sRAGE组高于F组),说明高糖状态下AGEs的聚集虽然可以引起肌细胞催产素受体和前列腺素受体的表达升高,但并不是唯一途径,高糖状态还可能通过其他途径引起相应收缩蛋白表达升高,因此单一的抑制剂不能完全阻断这一效果。
参考文献
[1]徐湘,朱晓巍,蒋艳敏,等. 2748例住院孕妇妊娠期糖尿病发病率及危险因素的研究[J].南京医科大学学报(自然科学版),2015,35(5):695-698.
[2]Weinberg E,Maymon T,Weinreb M. AGEs induce caspase -mediated apoptosis of rat BMSCs via TNF -α production and oxidative stress[J]. J Mol Endocrinol,2014,52(1):67-76.
[3]Renaud J,Bournival J,Zottig X,et al. Resveratrol protects DAergic PC12 cells from high glucose -induced oxidative stress and apoptosis:effect on p53 and GRP75 localization[J]. Neurotox Res,2014,25(1):110-123.
[4]Liu J,Wang Y,Yuan X,et al. Cyclic-stretch induces the apoptosis of myoblast by activation of Caspase -3 protease in a magnitude -dependent manner[J]. Int J Biochem Cell Biol,2010,42(12):2004-2011.
[5]Guo C,Zeng X,Song J,et al. A soluble receptor for advanced glycation end -products inhibits hypoxia/reoxygenation -induced apoptosis in rat cardiomyocytes via the mitochondrial pathway[J]. Int J Mol Sci,2012,13(9):11923-11940.
[6]李健. RAGE基因与糖尿病慢性并发症[J].实用临床医学,2011,12(1):133-136.
[7]Markovic D,Bari MF,Lu B,et al. Corticotropin-releasing hormone interacts with interleukin-1β to regulate prostaglandin H synthase-2 expression in human myometrium during pregnancy and labor[J]. J Clin Endocrinol Metab,2013,98(7):2864-2875.
[8]Kim PY,Zhong M,Kim YS,et al. Long chain polyunsaturated fatty acids alter oxytocin signaling and receptor density in cultured pregnant human myometrial smooth muscle cells[J]. PLoS One,2012,7(7):e41708.
[9]Balki M,Kanwal N,Erik -Soussi M,et al. Contractile efficacy of various prostaglandins in pregnant rat myometrium pretreated with oxytocin[J]. Reprod Sci,2012,19(9):968-975.
[10]王琪,刘宏,吕玲.子宫收缩的分子机制与相关调控药物的研究进展[J].中国医院药学杂志,2012,32(17):1393-1396.
[11]Arrowsmith S,Wray S. Oxytocin:its mechanism of action and receptor signalling in the myometrium[J]. J Neuroendocrinol,2014,26(6):356-369.
[12]Zhang H,Wu C,Chen Q,et al. Treatment of obesity and diabetes using oxytocin or analogs in patients and mouse models[J]. PLoS One,2013,8(5):e61477.
[13]赵军,逄力男,魏亿慧,等. 2型糖尿病及合并代谢综合征危险因素患者尿8-异前列腺素F2α水平分析[J].临床合理用药杂志,2012,5(4):20-21.
[14]Lee ES,Uhm KO,Lee YM,et al. Oxytocin stimulates glucose uptake in skeletal muscle cells through the calcium -CaMKK -AMPK pathway[J]. Regul Pept,2008,151(1/2/3):71-74.
[本文编辑秦娟]
Effect of Continuous Stretch on Contractile Protein Expression of Uterine Smooth Muscle under High Glucose Circumstance
MAO Jing,HAN Zhi-min,ZHOU Mu-lan,DONG Ling-ling. Shanghai First Maternity and Infant Hospital,Tongji University,Shanghai 200126,China
【Abstract】Objective:To analyze the effect of continuous stretch on oxytocin receptors and prostaglandin receptors expression of uterine smooth muscle cells under high glucose circumstance. Methods:Rat uterine smooth muscle cells were separated and cultured under high glucose circumstance for different durations,then we detected oxytocin receptors and prostaglandin receptors expression changes of smooth muscle cells. Continuous stretch was forced on cells under high glucose circumstance to determine synergistic effect of stretch and high glucose. At the same time,as a control team,advanced glycation end products(AGEs)inhibitor(sRAGE)was added to antagonize the effect of high glucose,then evaluate the expression of oxytocin receptors and prostaglandin receptors. Results:Both high glucose circumstance and continuous stretch could lead to oxytocin receptors and prostaglandin receptors expression of rat uterine smooth muscle cells increasing. Exerting high glucose and continuous stretch simultaneously could promote oxytocin receptors and prostaglandin receptors expressions even further and synergistic effect could be detected. After adding sRAGE,oxytocin receptors and prostaglandin receptors expressions decreased to some extend,but not completely,still higher than the normal glucose teams. Conclusions:Both continuous stretch and high glucose could promote oxytocin receptors and prostaglandin receptors expressions and there exist a synergistic effect between them. AGEs was involved in this process,but this is not the only signal pathway.
【Keywords】Stress,mechanical;Glucose;Uterus;Myocytes,smooth muscle;Contractile proteins;Receptors,oxytocin;Receptors,prostaglandin
收稿日期:(2015-09-08)
