紫外线照射对采后苹果抗灰霉病作用的研究
2016-06-15张晓晓周会玲周晓婉
樊 胜,张晓晓,周会玲,田 蓉,周晓婉
(西北农林科技大学 园艺学院,陕西 杨凌712100)
紫外线照射对采后苹果抗灰霉病作用的研究
樊胜,张晓晓,周会玲,田蓉,周晓婉
(西北农林科技大学 园艺学院,陕西 杨凌712100)
[摘要]【目的】 研究紫外线照射处理对采后苹果抗灰霉病的作用效果,了解紫外线照射处理诱导灰霉病抗性的机理。【方法】 以晚熟苹果品种‘粉红女士’(Malus domestica ‘Pink Lady’)为材料,对其进行7.0 kJ/m2短波紫外线照射(处理组),以未经紫外线照射的果实为对照组,常温下放置2 d后接种灰葡萄孢菌(Botrytis cinerea Pers.),观察灰霉病发生情况,并测定相关生理指标。【结果】 随着接种后时间的延长,苹果灰霉病发病率迅速增加,病斑直径不断扩大,对照组果实在接种后2 d发病率约为60%,而处理组发病率约为40%,低于对照组;在接种后4 d,处理组和对照组发病率均达到100%,到12 d果实全部腐烂,病斑直径达到最大。在整个贮藏期内,处理组果实的呼吸速率和乙烯释放速率均低于对照组,处理组果实的苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、β-1,3葡聚糖酶和几丁质酶活性均高于对照组。【结论】 紫外线照射可以降低贮藏过程中果实的呼吸速率和乙烯释放速率,诱导果实酶活性增强,对采后‘粉红女士’苹果灰霉病有一定的抑制作用。
[关键词]‘粉红女士’苹果;紫外线照射;灰霉病;抗病性
苹果栽培种植面积很广,我国的苹果产业已进入由传统产业向现代产业、由世界苹果生产大国向苹果产业强国转变的重大历史阶段[1]。然而,苹果易受微生物的侵害,苹果采后环节因真菌感染而造成的病害给人们带来巨大损失。据报道,在发达国家,果蔬采后腐烂造成的损失有20%~25%[2],而在发展中国家,由于缺乏贮运冷藏设备及相关保鲜措施损失更为严重[3]。‘粉红女士’(Malusdomestica‘Pink Lady’)作为一种红色晚熟的新品种,在世界各地也有种植,因其丰产,且风味酸甜逐渐受到人们的喜爱[4]。
苹果在采后贮藏过程中,病菌侵害是很难避免的。为了满足苹果供应的长期性,就必须控制贮藏过程中病害的发生。灰霉病作为苹果采后常见病害,防治采用的方法主要有化学防治和物理方法。其中物理方法主要是通过控制环境中的温、湿度来控制灰霉病的发生,投资成本较大;化学涂膜、使用防腐剂等来控制采后苹果的腐烂,或多或少会对果蔬造成一定的影响,很难满足人们对绿色果实的要求,因此防治措施仍然以采前化学防治为主,而长期以来的化学药物防治逐渐使病原菌灰霉葡萄孢产生抗药性,同时其存在的农药残留对人体也有很大的伤害,也会造成环境污染等问题。张帆等[5]研究发现,1-MCP处理对富士苹果灰霉病有一定抑制作用;袁仲玉等[6]认为,一定浓度的芦荟粗提物可以降低苹果采后灰霉病的发病率。短波紫外线作为无污染、无残留的杀菌保鲜新技术,在辣椒[7]、番茄[8]、草莓[9]、鲜切瓜[10]、牛角椒[11]等园艺产品上的研究较多,但都是集中在贮藏过程中一些生理指标的变化,对于侵染性病害的研究较少,尤其是对紫外线照射处理对采后苹果灰霉病的防治效果未见报道。本试验以晚熟苹果品种‘粉红女士’为材料,研究紫外线照射处理对采后苹果灰霉病的抗性作用,明确紫外线照射处理对灰霉病的抗性机理,为采用短波紫外线防治采后苹果灰霉病提供理论依据。
1材料与方法
1.1材料
1.1.1供试苹果和灰葡萄孢菌菌株苹果品种‘粉红女士’:于2013-10-25上午采收于陕西省杨凌示范区管理较好的农家果园,挑选生长于树冠外围、色泽相近、大小基本一致且无病虫害、无机械损伤的果实,及时运回实验室预冷。灰葡萄孢菌(BotrytiscinereaPers.)菌株:由西北农林科技大学植物保护学院植物病理研究室提供。
1.1.2主要试剂氢氧化钠、硼酸、盐酸、乙醇、冰醋酸、酚酞、葡萄糖、琼脂硼砂、无水醋酸钠、聚乙烯吡咯烷酮(PVP)、TritoX-100、愈创木酚、巯基乙醇等,均购于陕西杨凌鑫方化学试剂玻璃公司。
1.1.3主要仪器与设备包括ULTRAVIOLET-C 30W/G30 T8紫外灯(荷兰Philips公司)、ZQJ-254型紫外线强度计(上海宝山顾村电光仪器厂)、紫外可见分光光度计(日本岛津公司,UV2550)、超低温冰箱(日本三洋电器)、GC-14A型气相色谱仪(日本岛津公司)、HEL-7100型红外线CO2分析仪等。
1.2试验方法
1.2.1孢子悬浮液的配制将灰葡萄孢菌菌株接种到PAD培养基上,27 ℃恒温培养1周,用含 0.05% Tween-20的无菌水冲洗菌落上的分生孢子,借助血球计数板将孢子悬浮液浓度调整约为 1.5×106mL-1,备用。
1.2.2试验处理经过预冷的苹果果实用体积分数5%的酒精擦洗表面,自然晾干后分成处理组和对照组,各120个。根据吴芳芳等[12]的研究结果并结合本试验的预试验结果,选取剂量为7.0 kJ/m2的紫外线照射。处理组用7.0 kJ/m2的紫外线进行照射,常温放置2 d后进行接种(试验所选紫外灯功率为30 W,有效波长为245 nm,灯管与苹果表面的距离为35 cm,用ZQJ-254型紫外线强度计测得紫外辐射强度为2.5 W/m2,根据照射时间计算得照射剂量为7.0 kJ/m2)。对照组果实未经紫外线照射,直接在常温下放置2 d后进行接种。
接种时,用直径3 mm的消毒钉子在处理组和对照组的苹果赤道部位均匀刺3个4 mm深、3 mm宽的伤口,分别在果实的伤口处接种20 μL的 1.5×106mL-1的灰葡萄孢菌孢子悬浮液;然后置于PVC保鲜袋中,常温放置。每隔2 d测量1次果实病斑直径,统计发病率,并取病斑周围健康组织用于相关指标的测定,直到病斑直径长大至无法取样为止。每次取9个果实,重复3次。
1.3测定项目及方法
1)病斑直径。随机选取处理组和对照组的10个果实,做好标记,每次固定这些果实,采用十字交叉法,用游标卡尺测量病斑直径[6],每隔2 d测量1次。
2)发病率。观察果实发病情况,接种后的果实表面开始出现腐烂症状的为发病果实,发病率为发病果实伤口数和总果实的比值[6]。
4)失重率。 失重率的测定采用称量法[11]。
3)呼吸速率。每次固定10个果子,放置于干燥器中,用HEL-7100型红外线CO2分析仪测定呼吸速率(mg/(kg·h))。
4)乙烯释放速率。先用排水法收集乙烯,之后用GC-14A型气相色谱仪测定,配备GDX-502色谱柱,柱温为70 ℃,氢气0.7 kg/cm2,空气0.7 kg/cm2,氮气1.0 kg/cm2,氢火焰离子化检测器检测,检测室温度110 ℃。
5)酶活性。取留样组织部位,按照袁仲玉等[6]的方法测定苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、β-1,3葡聚糖酶和几丁质酶活性。每个样品重复3次。
1.4数据处理
采用Microsoft Excel 2013及DPS v7.05软件对试验数据进行统计与分析。
2结果与分析
2.1紫外线照射对苹果发病率和病斑直径的影响
观察发现,接种灰葡萄孢菌的粉红女士苹果,在室温放置过程中迅速感病,病斑直径不断扩大。紫外线照射对苹果发病率和病斑直径的影响见图1和图2。由图1可以看出,在接种后2 d,对照组果实发病率约为60%,而经过7.0 kJ/m2照射的处理组果实发病率约为40%;到接种后4 d,对照组和处理组的果实全部感病,此时发病率为100%。结果表明,紫外线照射处理对粉红女士苹果的发病率有一定的影响。
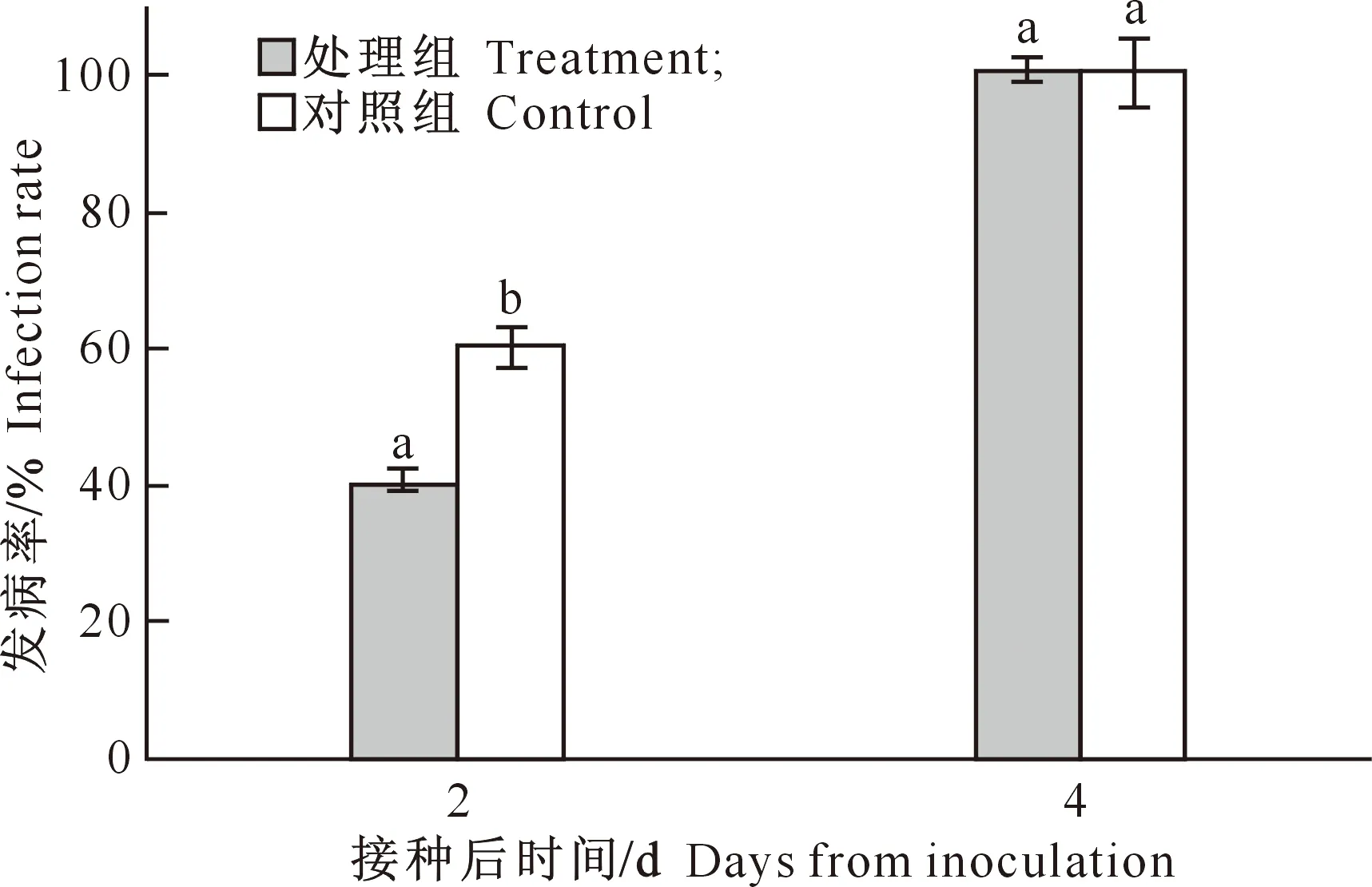
图 1紫外线照射对接种灰霉病苹果发病率的影响
不同小写字母表示处理间差异达显著水平(P<0.05)。下同
Fig.1Effect of UV-C irradiation on infection of apple fruit Different lowercase letters represent significant
difference (P<0.05).The same below
由图2可以看出,随着接种时间的延长,病斑直径不断增大,紫外线处理组能够有效抑制粉红女士果实病斑直径的扩大。在整个贮藏期内,经过紫外线照射处理的平均病斑直径小于对照组。从接种后的第4天开始,处理组和对照组的病斑直径差异显著(P<0.05),到接种后的第8天,处理组和对照组的病斑直径均相差5 mm左右;第10天到第12天病斑直径差异稳定在3 mm,到第12天果实表面全部腐烂。
2.2紫外线照射对接种灰霉病苹果失重率的影响
紫外线照射对接种灰霉病苹果失重率的影响见图3。
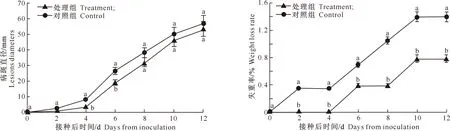
图 2 紫外线照射对接种灰霉病苹果病斑直径的影响
由图3可以看出,紫外线照射对接种后感染灰霉病的粉红女士苹果的失重率也有影响。对照组果实在接种后第2天失重率就达到0.4%;而处理组的果实第2天失重率未发生变化,到接种后的第4天其质量才开始减轻。随着时间的延长,失重率变化较快,对照组从第4天开始失重率一直上升,直到接种后的第10天失重率趋于稳定;而处理组的失重率在第6天保持平稳,第8天开始上升。在试验的最后2 d处理组和对照组的果实失重率变化平稳。
2.3紫外线照射对接种灰霉病苹果呼吸速率和乙烯释放速率的影响
病原菌的入侵会导致寄主植物的呼吸速率增强,这是一个普遍发生的过程,即随着真菌子实体的形成,呼吸作用逐渐增强,待真菌子实体全部长成时,呼吸作用达到最大值,接着开始下降[13]。图4显示,处理组的呼吸速率从第2天开始迅速上升,在接种后的第6天达到最大峰值,之后开始下降;而对照组的呼吸速率在接种后的第4天达到最大值,接着开始下降。在整个贮藏期内,处理组的呼吸速率基本都小于对照组,而且处理组的呼吸高峰推迟了2 d,说明紫外线照射处理对粉红女士苹果的呼吸作用有明显的抑制。
乙烯作为植物的报警信号,在植物受到病原菌侵染时可以诱导并参与植物对病原菌的防御[13]。由图5可以看出,随着病原的侵入,对照组的乙烯释放速率在第4天达到最大值,而处理组的乙烯释放速率在接种后的第6天达到最大,这是因为用紫外线照射处理苹果的病斑直径较小,故乙烯释放速率较低。在整个贮藏期,对照组的乙烯释放速率高于处理组。
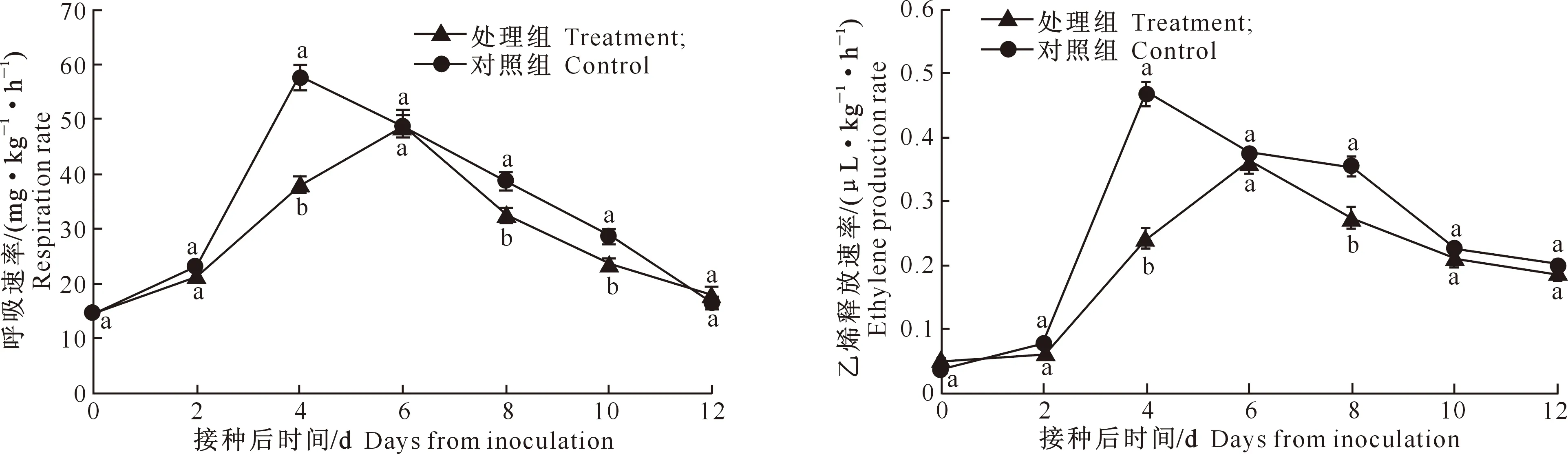
图 4 紫外线照射对接种灰霉病苹果呼吸速率的影响
2.4紫外线照射对接种灰霉病苹果相关酶活性的影响
2.4.1PAL活性紫外线照射对接种灰霉病苹果PAL活性的影响见图6。

图 6 紫外线照射对接种灰霉病苹果PAL活性的影响
苯丙氨酸解氨酶(PAL)在植物体内产生次生代谢物中有着非常重要的作用,是苯丙烷类代谢过程中一个关键酶和限速酶,当植物受到病原菌侵染时,能迅速合成与抗病有关的生化物质木质素、保卫素等,有效地阻止病原菌的扩增[14]。图6结果表明,苹果果实在受到病原菌侵染时,体内PAL活性呈上升趋势,且在整个贮藏期内,处理组果实的PAL活性均高于对照组,说明紫外线照射处理能够诱导粉红女士苹果内PAL活性增强。在整个贮藏期内,处理组和对照组的PAL活性差异显著(P<0.05),其中处理组在接种后的第8天时,PAL活性达到最大值,之后PAL活性变化呈先下降后上升趋势;而对照组的PAL活性第6天达到最大值,之后变化规律跟处理组相似,但是其PAL活性一直低于处理组。
2.4.2PPO活性PPO活性也常作为表征果实抗病性的指标之一,PPO能将酚类物质氧化成对病原菌有害的醌类物质[13]。图7结果表明,粉红女士苹果在受到病原菌侵染时,其体内的PPO活性基本上呈先上升后下降趋势,处理组与对照组均在第8天达到最大值;除了接种后第0天、第4天和第12天两者差异不显著之外,在其余贮藏期内,处理组和对照组的PPO活性差异均达到显著水平(P<0.05),到接种后的第12天,处理组和对照组的PPO活性相近。
2.4.3POD活性POD是植物体内重要的氧化酶,该酶不仅可以催化脂肪酸反应,而且可以催化芳香胺和酚类物质氧化,是木质素合成的关键酶之一,同时其还参与乙烯的生物合成和氧化自由基的消除反应[13]。图8结果表明,与对照组相比,经紫外线照射后,果实在感病之后其体内POD的活性增强。紫外线照射的处理组在接种后第6天POD活性达到最大值,而对照组的POD活性在接种后的第8天达到了峰值;处理组和对照组POD活性分别达到最大值后开始呈现下降趋势,而对照组的下降速率高于处理组,但是在整个下降过程中处理组粉红女士的POD活性一直高于对照组。在本试验中,除处理后第0天和第8天外,其余贮藏期内,处理组POD活性均显著高于对照组(P<0.05)。
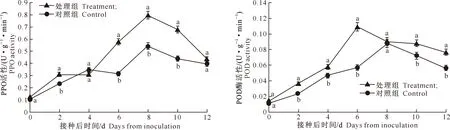
图 7 紫外线照射对接种灰霉病苹果PPO活性的影响
2.4.4β-1,3葡聚糖酶活性β-1,3葡聚糖是大多数病原真菌细胞壁的主要成分之一,而β-1,3葡聚糖酶是能够降解该糖的非常重要的PR蛋白[15],当植物受到外界真菌侵染时β-1,3葡聚糖酶会累积。如图9所示,处理组果实的β-1,3葡聚糖酶活性在接种后的前8 d一直处于上升趋势,于第8天达最大值,之后开始下降,直到第10天趋近平稳;而对照组的果实在感病之后,β-1,3葡聚糖酶活性在第8天达到最大值,从第8天后呈现下降的趋势。在整个贮藏期内,从接种后的第2天开始,处理组和对照组苹果的β-1,3葡聚糖酶活性就开始出现差异,经过紫外线照射处理的β-1,3葡聚糖酶活性一直高于对照组,分别在第4天,第6天,第8天和第12天差异达显著水平(P<0.05),说明紫外线照射处理能够诱导粉红女士苹果果实β-1,3葡聚糖酶活性增强。
2.4.5几丁质酶活性几丁质是构成绝大多数真菌细胞壁的主要成分,植物虽然几乎不含几丁质,但是几丁质酶的活性却非常高。当植物受到外来病原的侵染或者其他外界刺激时,体内几丁质酶活性迅速升高,几丁质酶通常与植物的抗病性有着密切关系[16]。紫外线照射对接种灰霉病苹果几丁质酶活性的影响见图10。

图 9 紫外线照射对接种灰霉病苹果β-1,3葡聚糖酶活性的影响
从图10可以看出,接种后的0~6 d,处理组和对照组果实体内的几丁质酶活性快速上升;之后随着接种后时间的延长,处理组和对照组果实的几丁质酶活性逐渐趋于稳定。在接种后的第0天、第6天和第12天两者几丁质酶活性基本相等,在其余贮藏期内,处理组几丁质酶活性高于对照组,在第2天时二者差异达到显著水平(P<0.05)。
3讨论
3.1紫外线照射抑制苹果灰霉病的发生和发展
由于紫外线能够穿透果蔬的表面组织,故紫外线照射作为一种杀菌消毒手段被广泛的应用。本研究中,与对照组相比,紫外线照射能够降低苹果果实的呼吸速率和乙烯释放速率。S-腺苷蛋氨酸(SAM)是乙烯合成的前体物质,果实经过紫外线照射之后,刺激SAM合成腐胺从而导致其合成乙烯的量减少[17]。
本研究结果表明,7.0 kJ/m2的紫外线照射对采后粉红女士的病斑直径、失重率、呼吸速率和乙烯释放速率均起到了一定抑制作用。但是高剂量、长时间的紫外线照射会造成果实表面出现一些病斑、黑褐色症状,反而不利于贮藏保鲜,如预试验中选取10.0 kJ/m2紫外线照射处理反而会更容易导致苹果病害的发生,说明高剂量紫外线照射会导致果实表面出现病斑,容易导致外界微生物侵入,这与Manzocco等[18]研究结果一致。
3.2紫外线照射诱导果实抗病性的提高
大量的研究表明,紫外线照射可以促进种子萌发、植物生长、诱导植保素的合成等[19-20];同时紫外线照射处理可以提高植物体抗氧化性[21],使植物体内总酚含量升高[22]。
紫外线作为一种非生物胁迫,可以诱导植物抗病性增强,而PAL、PPO、POD活性常被用来作为表征植物抗病性的指标[23]。PAL是植物苯丙烷类代谢的关键酶,POD和PPO也参与酚类化合物、木质素、植保素的合成;而β-1,3葡聚糖酶和几丁质酶属于病程相关蛋白家族,当受到病原菌侵染、机械损伤或环境胁迫时,可以诱导寄主产生防御反应。植物体内的抗病性,主要由抗病基因及其编码蛋白酶来调控。Xu等[24]研究表明,紫外线处理对采后梨果实的病斑直径有明显的控制作用,POD、CAT和β-1,3葡聚糖酶活性明显上升;Müller等[25]研究表明,采后紫外线处理可诱导苹果汁中果胶酶和聚半乳糖醛酸酶活性升高,在果汁生产中应用效果较好;Jiang等[26]研究表明,紫外线照射处理可以保持蘑菇新鲜度,增加类黄酮和抗坏血酸含量,增强抗氧化能力,维持营养物质含量,延长货架期;Charles等[27]的研究结果也显示,紫外线处理可以诱导番茄果实β-1,3葡聚糖酶活性增强。本试验结果表明,经过7.0 kJ/m2紫外线照射处理后,处理组苹果果实的PAL、POD、PPO、几丁质酶和β-1,3葡聚糖酶活性明显高于对照组,从而使果实抗病性增强,抑制病斑直径扩增及病害的发生发展。
纵观前人的研究可知,紫外线照射处理主要是通过诱导增强了果实抗病性,人们对紫外线照射的机制仍有很多未知,对其作用的分子机制仍不是很了解。不同成熟期、不同品种果实的最佳紫外线照射剂量并不相同;不同园艺产品的最佳紫外线照射剂量也不尽相同,关于紫外线照射在果实贮藏保鲜和抗病性方面的生理机制以及分子机制还有待更深入的研究。
4结论
1)紫外线照射能够减少粉红女士苹果的失重率,降低粉红女士苹果采后呼吸速率和乙烯释放速率,减缓衰老,同时能够抑制病斑直径的扩增。
2)紫外线照射诱导粉红女士苹果采后苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、β-1,3葡聚糖酶和几丁质酶活性均增加,从而增强果实的抗病性。
[参考文献]
[1]刘军弟,霍学喜,韩明玉,等.中国苹果产业发展现状及趋势分析 [J].北方园艺,2012(20):164-168.
Liu J D,Huo X X,Han M Y,et al.Status,trend and suggestions for development of apple industry in China [J].Northern Horticulture,2012(20):164-168.(in Chinese)
[2]高华,赵政阳.陕西苹果品种发展历史、现状及育种进展 [J].西北林学院学报,2008,23(1):130-133.
Gao H,Zhao Z Y.Advances in the researches of apple breeding and development in Shaanxi Province [J].Journal of Northwest Forestry University,2008,23(1):130-133.(in Chinese)
[3]EI- Ghaouth A,Wilon C L.Biologically based technologies for the control of postharvest diseases [J].Postharvest News and Information,1995,6:5-11.
[4]鲁玉妙,高华,赵政阳,等.粉红女士苹果品质特性分析评价 [J].果树学报,2003,20(6):503-505.
Lu Y M,Gao H, Zhao Z Y,et al.Analysis and evaluation on fruit quality of Pink Lady apple [J].Journal of Fruit Science,2003,20(6):503-505.(in Chinese)
[5]张帆,任小林,王位涛,等.采后1-MCP处理对富士苹果灰霉病的影响 [J].西北农业学报,2008,17(3):210-214.
Zhang F,Ren X L,Wang W T,et al.Effect of 1-MCP on gray mold of ‘Fuji’ apple [J].Acta Agriculturae Boreali-Occidentalis Sinica,2008,17(3):210-214.(in Chinese)
[6]袁仲玉,周会玲,田蓉,等.芦荟粗提物对苹果采后灰霉病的防治效果与机理 [J].农业工程学报,2014,30(4):255-263.
Yuan Z Y,Zhou H L,Tian R,et al.Effects and mechanism of aloe vera extracts on control of botrytis in postharvest apples [J].Transactions of the Chinese Society of Agricultural Engineering,2014,30(4):255-263.(in Chinese)
[7]Vicente A R,Pineda C,Lemoine L,et al.UV-C treatments reduce decay,retain quality and alleviate chilling injury in pepper [J].Postharvest Biology and Technology,2005,35(1):69-78.
[8]Maharaj R,Arul J,Nadeau P.UV-C irradiation effects on levels of enzymic and non-enzymic phytochemicals in tomato [J].Innovative Food Science & Emerging Technologies,2014,21:99-106.
[9]Erkan M,Wang S Y,Wang C Y.Effect of UV treatment on antioxidant capacity,antioxidant enzyme activity and decay in strawberry fruit [J].Postharvest Biology and Technology,2008,48(2):163-171.
[10]Manzocco L,Da Pieve S,Maifreni M.Impact of UV-C light on safety and quality of fresh-cut melon [J].Innovative Food Science & Emerging Technologies,2011,12(1):13-17.
[11]杨华,尹明安,于巧平,等.短波紫外线处理对牛角椒果实保鲜效果及生理指标的影响 [J].西北农林科技大学学报:自然科学版,2011,39(8):147-152.
Yang H,Yin M A,Yu Q P,et al.Effects of UV-C on ox horn pepper fruit shelf-life and its post-harvest physiology mechanism [J].Journal of Northwest A&F University:Natural Science Edition,2011,39(8):147-152.(in Chinese)
[12]吴芳芳,郑有飞,檀根甲,等.UV-C对苹果采后炭疽病的控制 [J].农业环境科学学报,2006,25(4):1081-1083.
Wu F F ,Zheng Y F,Tan G J,et al.Control of anthracnose of post-harvested apple by UV-C light irradiation [J].Journal of Agro-Environment Science,2006,25(4):1081-1083.(in Chinese)
[13]高必达,陈捷.生理植物病理学 [M].北京:科学出版社,2006.
Gao B D,Chen J.Physiological plant pathology [M].Beijing:Science Publishing Company,2006.(in Chinese)
[14]Capanoglu E,Beekwilder J,Matros A,et al.Correlation of rutin accumulation with 3-o-glucosyl transferase and phenylalanine ammonia-lyase activities during the ripening of tomato fruit [J].Plant foods for Human Nutrition,2012,67(4):371-376.
[15]Wojtasik W,Kulma A,Dymińska L,et al.Fibres from flax overproducing β-1,3-glucanase show increased accumulation of pectin and phenolics and thus higher antioxidant capacity [J].BMC Biotechnology,2013,13(10):1-16.
[16]Sharma N,Sharma K P,Gaur R K,et al.Role of chitinase in plant defense [J].Asian J Biochem,2011,6:29-37.
[17]Maharaj R,Arul J,Nadeau P.Effect of photochemical treatment in the preservation of fresh tomato (Lycopersiconesculentumcv.Capello) by delaying senescence [J].Postharvest Biology and Technology,1999,15(1):13-23.
[18]Manzocco L,Da Pieve S,Bertolini A,et al.Surface decontamination of fresh-cut apple by UV-C light exposure:Effects on structure,colour and sensory properties [J].Postharvest Biology and Technology,2011,61(2):165-171.
[19]Wilson C L,El Ghaouth A,Chalutz E,et al.Potential of induced resistance to control postharvest diseases of fruits and vegetables [J].Plant Disease,1994,78(9):837-844.
[20]Rodov V,Ben-Yehoshua S,Kim J J,et al.Ultraviolet illumination induces scoparone production in kumquat and orange fruit and improves decay resistance [J].Journal of the American Society for Horticultural Science,1992,117(5):788-792.
[21]Dogu-Baykut E,Gunes G,Decker E A.Impact of shortwave ultraviolet (UV-C) radiation on the antioxidant activity of thyme (ThymusvulgarisL.) [J].Food Chemistry,2014,157:167-173.
[22]Jagadeesh S L,Charles M T,Gariepy Y,et al.Influence of postharvest UV-C hormesis on the bioactive components of tomato during post-treatment handling [J].Food and Bioprocess Technology,2011,4(8):1463-1472.
[23]李波,王军,孙思.植物诱导抗病机制的研究进展 [J].中国植保导刊,2013,33(9):19-24.
Li B,Wang J,Sun S.Research progress on mechanism of plant induced disease resistance [J].China Plant Protection,2013,33(9):19-24.(in Chinese)
[24]Xu L,Du Y.Effects of yeast antagonist in combination with UV-C treatment on postharvest diseases of pear fruit [J].BioControl,2012,57(3):451-461.
[25]Müller A,Briviba K,Gräf V,et al.UV-C treatment using a Dean vortex technology:Impact on apple juice enzymes and toxicological potential [J].Innovative Food Science & Emerging Technologies,2013,20:238-243.
[26]Jiang T,Jahangir M M,Jiang Z,et al.Influence of UV-C trea-tment on antioxidant capacity,antioxidant enzyme activity and texture of postharvest shiitake (Lentinusedodes) mushrooms during storage [J].Postharvest Biology and Technology,2010,56(3):209-215.
[27]Charles M T,Tano K,Asselin A,et al.Physiological basis of UV-C induced resistance to Botrytis cinerea in tomato fruit:Ⅴ.Constitutive defence enzymes and inducible pathogenesis-related proteins [J].Postharvest Biology and Technology,2009,51(3):414-424.
Effect of UV-C irradiation on gray mold of postharvest apples
FAN Sheng,ZHANG Xiao-xiao,ZHOU Hui-ling,TIAN Rong,ZHOU Xiao-wan
(CollegeofHorticulture,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 The study investigated the effects of UV-C treatment on gray mold of postharvest apples.【Method】 Apples of Malus domestica ‘Pink Lady’ were inoculated with Botrytis cinerea 2 days after treatment with 7.0 kJ/m2 UV-C irradiation,and normal apples without treatment were used as control. Incidence of gray mold was observed and related physiological indicators were measured. 【Result】 The infection rate increased rapidly and the diameters of lesions extended continuously with the extension of inoculation time.The infection rate of the control 2 days after treatment was 60%,higher than that of the treatment group (40%).After 4 days,the infection rates of both groups were 100%,the average diameters of lesions reached the maximum,and all apples decayed after 12 days.Apples in treatment group had lower respiration rate and production rate of ethylene and higher activities of phenylalanine ammonium lyase (PAL),peroxidase(POD),polyphenol oxidase(PPO),β-l,3-glucanase,and chitinase compared to the control group.【Conclusion】 UV-C irradiation treatment reduced the respiration rate and production rate of ethylene,increased the fruit enzyme activities,and had certain inhibition against gray mold.
Key words:‘Pink Lady’ apple;UV-C irradiation;gray mold;resistance
[收稿日期]2014-06-25
[基金项目]国家现代苹果产业技术体系建设专项(nycylx-08-05-02);西北农林科技大学基本科研业务专项(Z109021201)
[作者简介]樊胜(1991-),男,陕西渭南人,在读硕士,主要从事果树生物技术研究。E-mail:likessd@126.com[通信作者]周会玲(1969-),女, 陕西商洛人,副教授,硕士生导师,主要从事园艺产品采后处理及贮藏保鲜研究。
[中图分类号]S661.109+.3
[文献标志码]A
[文章编号]1671-9387(2016)02-0172-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160108.1022.048.html
E-mail:zhouhuiling@nwsuf.edu.cn
