钙处理对低温胁迫下枇杷幼苗Ca2+-ATPase活性和膜脂过氧化水平的影响
2016-06-15吴锦程吴毕莎黄玲玲张伟芳郑福明
吴锦程,陈 宇,吴毕莎,黄玲玲,张伟芳,郑福明
(莆田学院 环境与生物工程学院,福建 莆田 351100)
钙处理对低温胁迫下枇杷幼苗Ca2+-ATPase活性和膜脂过氧化水平的影响
吴锦程,陈宇,吴毕莎,黄玲玲,张伟芳,郑福明
(莆田学院 环境与生物工程学院,福建 莆田 351100)
[摘要]【目的】 探讨钙处理对低温胁迫下枇杷叶片Ca2+-ATPase活性和膜脂过氧化的调节机制,为枇杷抗寒性研究提供依据。【方法】 采用外源钙(5 mmol/L CaCl2)和钙调素拮抗剂三氟拉嗪(Trifluoperazine,TFP,100 mmol/L)处理Hoagland营养液砂培法培养的2年生“早钟6号”枇杷(Eriobotrya japonica Lindl.cv.Zaozhong No.6)容器幼苗,设钙预处理、TFP预处理和先TFP后钙处理,以未做预处理为对照,于-6 ℃人工气候室进行低温胁迫处理,研究钙处理对低温胁迫下枇杷成活率、CaM含量以及Ca2+-ATPase、CAT、SOD活性和H2O2、MDA含量的影响。【结果】 与对照相比,钙处理显著提高了低温胁迫后枇杷幼苗的成活率、叶片细胞CaM含量以及质膜、内质网膜、液泡膜和线粒体膜Ca2+-ATPase活性,并激活了CAT和SOD活性,降低了细胞H2O2和MDA含量;而钙调素拮抗剂TFP对钙处理所诱导的上述生理效应均有抑制作用,削弱了幼苗对低温胁迫的抗氧化能力,加剧了低温对幼苗的伤害。【结论】 钙处理提高了枇杷幼苗的抗冻能力,Ca2+-CaM信使系统可能参与了低温胁迫下枇杷抗冻性的诱导和调控。
[关键词]枇杷;低温胁迫;钙调蛋白;Ca2+-ATPase;膜脂过氧化
低温逆境胁迫是影响果树地理分布和产量的重要因素。枇杷(EriobotryajaponicaLindl.)为原产于我国的一种较典型的亚热带常绿果树,喜温暖、湿润的气候条件。我国南亚热带及热带边缘地区(如福建和广东等省)栽培的枇杷品种耐寒性较差,特别是在海拔相对较高的山地,枇杷冻害时有发生,其中以早熟品种“早钟6号”枇杷(EriobotryajaponicaLindl.cv.Zaozhong No.6)冻害发生较为严重[1-3]。
植物细胞在正常生理代谢条件下,细胞质内Ca2+浓度通常保持在较低的水平,而高温、低温、盐渍等逆境刺激均可升高胞质Ca2+水平。胞质内Ca2+浓度过高或长时间处于高浓度状态将致使细胞代谢功能紊乱甚至停止活动,最终导致植株死亡[4-5]。因此,胞质内高浓度Ca2+能否及时被泵回胞外或钙库中将直接关系到逆境刺激对细胞的伤害程度。胞质Ca2+浓度的调节主要依赖定位于质膜和细胞器外膜上的Ca2+-ATP酶(Ca2+-ATPase)来实现[6]。在低温胁迫条件下,经低温锻炼的水稻(OryzasativaL.)、冬黑麦(SecalecerealeL.)和毛白杨(PopulustomentosaCarr)能有效地维持或激活Ca2+-ATPase活性,这与其抗冷性的提高密切相关[6-8]。陈亚华等[9]的研究结果显示,耐冷水稻品种根系的质膜、液泡膜Ca2+-ATPase活性明显高于冷敏感品种。相关研究认为,低温胁迫下胞质、细胞核Ca2+浓度增加与其质膜和核膜的Ca2+-ATPase活性下降或失活相关,并导致细胞的伤害或死亡[10-11],表明Ca2+-ATPase对低温逆境产生应答可能是通过调节细胞中Ca2+水平而实现的。钙调素(CaM)是一种分布较广、功能多样化的调节蛋白,在植物Ca2+信使系统对外界环境的响应中发挥重要的作用[8]。低温逆境下,植物细胞内自由基产生和消除的平衡遭到破坏,出现活性氧的过多积累并导致膜脂过氧化,但同时细胞也会通过Ca2+直接作用或CaM活化相关靶酶等生理响应机制以抵御低温的伤害[12-13]。Ca2+-CaM作为细胞内的第二信使参与了众多的细胞生理反应[14-17]。但钙处理对低温胁迫下枇杷叶片细胞Ca2+-ATPase活性变化与膜脂过氧化水平的影响尚未见相关报道。本试验通过喷施Ca2+处理抗冻性较差的“早钟6号”枇杷容器苗,研究低温逆境胁迫对枇杷叶片细胞微粒体膜Ca2+-ATPase活性与膜脂过氧化的影响,以期进一步揭示Ca2+处理诱导树体对低温胁迫的生理应答机制,为枇杷抗寒性研究提供理论依据。
1材料与方法
1.1材料与处理
选取用Hoagland营养液培养的健康、生长势一致的2年生“早钟6号”枇杷容器苗(福建省莆田市果树研究所提供)为试材。
以置于人工气候室进行单一低温胁迫处理的容器苗为对照(CK)。25 ℃下,每天17:00给容器苗叶片喷洒CaCl2溶液(5 mmol/L,pH 6.5)一次,连续喷洒3 d,并于第5天进行低温胁迫处理,以此为处理1 (T1)。参照林素英等[18]的方法将容器苗先在含100 mmol/L钙调素拮抗剂三氟拉嗪(Trifluoperazine,TFP)的Hoagland营养液中培养24 h,然后更换正常营养液并进行低温胁迫处理,以此为处理2 (T2)。以先后经TFP、CaCl2和低温胁迫处理(处理方法同上)为处理3 (T3)。5株枇杷容器苗为1个重复,每处理重复3次,共15株。低温胁迫处理参照吴锦程等[19]的方法,将容器苗置于人工气候室(相对湿度为70%,光照时间为06:30-18:30,光照强度为2 000 lx)中,通过程序降温至-6 ℃并保持6 h,后于25 ℃下平衡10 h。
1.2样品采集及膜制剂的制备
选取枝条自上往下数第3~5片叶片(叶龄10~15 d)进行取样,每重复共取10片叶组成混合样,经液氮速冻后保存于-70 ℃低温冰箱中待测。低温胁迫后将各处理容器幼苗转到室温下培养7 d,统计继续生长的幼苗成活率。
膜制剂的制备参照赵士诚等[20]的方法,将提取液于4 ℃ 2 000×g离心10 min,去沉淀,取上清液于4 ℃ 13 000×g离心15 min,沉淀即为线粒体膜制剂。将提取线粒体后的上清液于4 ℃ 80 000×g离心30 min,取其沉淀悬浮液,将悬浮液用梯度为0%,10%,22%,30%,45% (质量分数)的蔗糖在4 ℃条件下以100 000×g冷冻离心2 h,其中10%~22%蔗糖处理对应组分为液泡膜制剂,22%~30%蔗糖组分为内质网膜制剂,30%~45%蔗糖组分为细胞质膜制剂,各膜制剂用液氮速冻后于-70 ℃保存,用于测定Ca2+-ATPase活性。
1.3测定项目与方法
细胞质膜、内质网膜和线粒体膜Ca2+-ATPase活性的测定参照赵士诚等[20]的方法,液泡膜Ca2+-ATPase活性的测定参照曾韶西和李美茹[6]的方法,略作修改:1 mL反应体系中含50 mmol/L (pH 6.0)的Tris-Mes,4.0 mmol/L的ATP-Na2,1.0 mmol/L的(NH4)2MoO4,1.0 mmol/L的NaN3,0.1 mmol/L的Na3VO4,0.1 mmol/L的EDTA-Na2,体积分数0.02%的曲拉通X-100,膜蛋白50 μg。以上各反应体系中以加与不加3.0 mmol/L CaCl2的酶活性之差为Ca2+-ATPase活性。酶反应由50 μL 60 mmol/L的ATP-Na2启动。37 ℃下保温反应30 min后,加0.5 mL的10% SDS终止反应,空白不加ATP-Na2。反应释放的无机磷采用Ohnishi等[21]的方法测定,Ca2+-ATPase活性单位为“μmol/(mg·h)”。
CAT和SOD活性以及H2O2和MDA含量的测定参照李合生[22]的方法。钙调素(CaM)含量测定参照罗充等[23]的酶联免疫法(ELISA)。以上指标测定均重复3次。
1.4数据处理
采用Excel 2003和SAS 9.0统计软件进行差异显著性检验并绘图,结果均为3次重复的平均值。
2结果与分析
2.1钙处理对低温胁迫下枇杷幼苗抗冻性的影响
一定低温胁迫下植物的成活率是衡量其抗冻性的重要指标之一。图1结果显示,低温胁迫后常温下恢复生长7 d,单一低温胁迫处理(CK)枇杷的幼苗成活率为20.0%,而低温胁迫前经钙预处理(T1)的幼苗成活率达57.78%,比CK幼苗成活率提高了37.78% (P<0.05),可见钙处理能够显著增强枇杷幼苗的抗冻能力。低温胁迫前经TFP预处理(T2)的幼苗成活率仅为6.67%,而先后经TFP、CaCl2和低温胁迫处理(T3)的幼苗成活率为15.56%。T2处理幼苗成活率比CK降低了13.33% (P<0.05),而T3处理幼苗成活率比T1处理降低了42.22% (P<0.05),表明钙调素拮抗剂TFP明显地抑制了由钙处理所诱导的幼苗抗冻能力的提高,同时也削弱了未经钙预处理幼苗的抗冻性。
2.2钙处理对低温胁迫下枇杷叶片CaM含量的影响
CaM是细胞重要的Ca2+信号感受器,在逆境胁迫中起到传导Ca2+信号的作用,并参与细胞内多种生理过程的调控。钙处理对低温胁迫下枇杷叶片CaM含量的影响见图2。
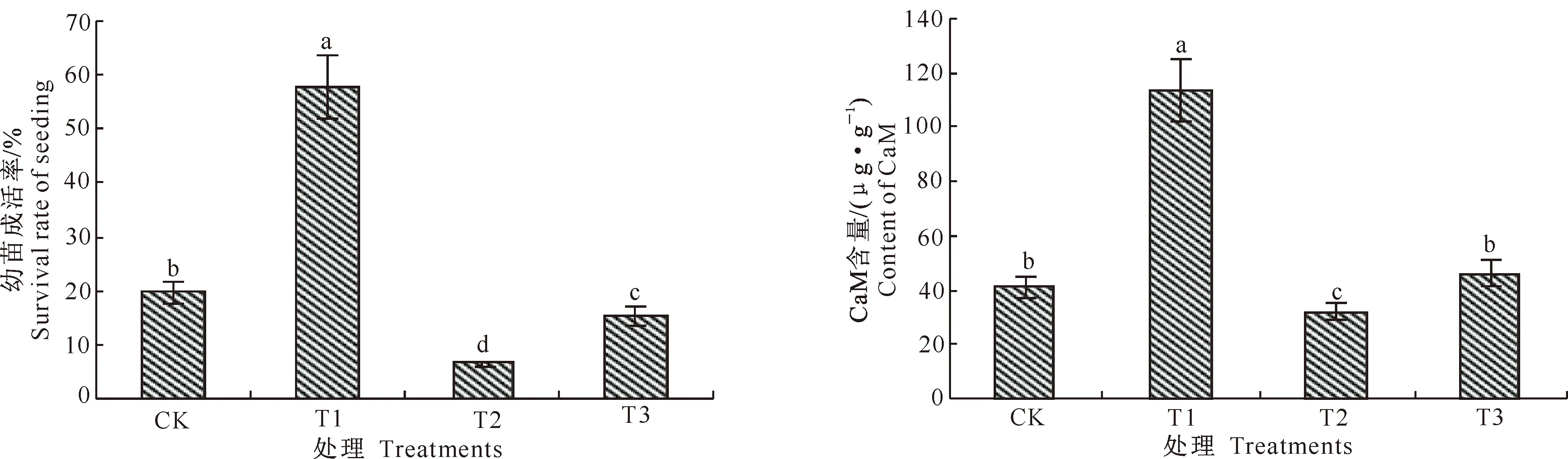
图 1 钙处理对低温胁迫下枇杷幼苗成活率的影响
由图2可见,低温胁迫前经钙预处理(T1)的枇杷叶片细胞CaM含量高于单一低温胁迫处理(CK),二者差异达显著水平(P<0.05),说明外源钙处理可提高低温胁迫下枇杷幼苗叶片细胞CaM含量。T1处理叶片细胞CaM含量显著高于T3处理 (P<0.05),CK叶片细胞CaM含量显著高于T2处理 (P<0.05),但T3处理的CaM含量又恢复至与CK相当水平,说明TFP处理所致的CaM抑制是可逆的。可见TFP处理对低温胁迫下CaM的生成具有抑制作用,也抑制了低温胁迫下钙处理对细胞CaM积累的促进效应。各处理枇杷幼苗叶片细胞CaM含量的差异与幼苗成活率的表现趋势基本一致。
2.3钙处理对低温胁迫下枇杷叶片细胞膜Ca2+-ATPase活性的影响
细胞受到逆境刺激可导致胞质内Ca2+水平升高,Ca2+-ATPase可将Ca2+泵出细胞外或钙库中,从而使细胞中的Ca2+维持在一定的水平,以维持细胞代谢的正常运行[10]。从图3可以看出,枇杷叶片质膜Ca2+-ATPase的活性最高,其次依次为内质网膜、液泡膜和线粒体膜,可知质膜、内质网膜和液泡膜是枇杷叶片细胞Ca2+-ATPase存在的主要场所。T1处理枇杷叶片质膜、内质网膜、液泡膜和线粒体膜的Ca2+-ATPase活性分别是CK的1.4,2.25,1.8,2.0倍(P<0.05),说明低温胁迫下枇杷叶片Ca2+-ATPase活性的上升与钙处理有关。T2处理枇杷叶片质膜、内质网膜、液泡膜和线粒体膜的Ca2+-ATPase活性均比CK有不同程度降低,说明钙调素拮抗剂TFP对Ca2+-ATPase活性具有抑制作用。T3处理枇杷叶片质膜、内质网膜、液泡膜和线粒体膜的Ca2+-ATPase活性均显著低于T1处理(P<0.05),但T3处理叶片细胞4种膜的Ca2+-ATPase活性均不同程度高于T2处理。T1处理枇杷叶片4种膜Ca2+-ATPase活性均显著高于T2、T3和CK。可见钙处理对枇杷叶片Ca2+-ATPase具有激活作用,但TFP抑制了钙处理对低温胁迫下枇杷叶片Ca2+-ATPase活性上升的诱导作用,且这种抑制作用在不同细胞膜之间存在差异。
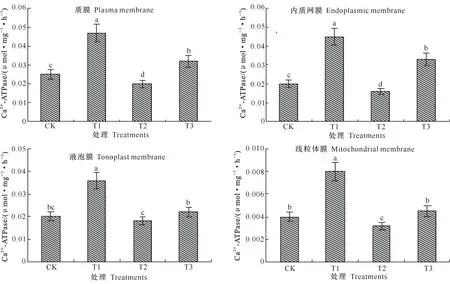
图 3钙处理对低温胁迫下枇杷叶片质膜、内质网膜、液泡膜、线粒体膜Ca2+-ATPase活性的影响
Fig.3Effect of Ca2+treatment on Ca2+-ATPase activities in plasma membrane,endoplasmic membrane,tonoplast membrane and mitochondrial membrane in loquat leaves under low temperature stress
2.4钙处理对低温胁迫下枇杷叶片CAT和SOD活性的影响
逆境条件下,CAT和SOD是细胞内酶促防御系统中2个重要的保护酶,可清除胞内的活性氧(AOS)以减轻对膜脂的过氧化损伤,提高植物的抗逆性[24-25]。从图4可以看出,T1处理枇杷叶片细胞的CAT活性比CK高34.72%,两者差异达显著水平(P<0.05),说明外源Ca2+处理缓解了低温胁迫对枇杷叶片细胞CAT活性的抑制作用。低温胁迫下, T2处理叶片细胞的CAT活性低于CK,而T3处理叶片细胞的CAT活性略高于CK,但T2和T3处理与CK差异不显著,但均显著低于T1处理,表现出TFP对细胞CAT活性的抑制作用,并抵消了外源Ca2+处理对CAT活性的激活作用。
由图4还可知,T1处理枇杷叶片细胞的SOD活性是CK的1.33倍,而其CAT活性是CK的 1.62 倍,表明钙处理激活了低温胁迫下CAT和SOD活性,但SOD活性受钙处理的影响程度小于CAT。T2和T3处理叶片细胞SOD活性均低于CK,但T2和T3处理与CK差异不显著,但三者均显著低于T1处理;而T3处理的CAT活性略高于CK,表明TFP对SOD的抑制作用大于CAT。适当的钙处理在一定程度上激活了低温胁迫下枇杷叶片CAT和SOD的活性,而钙调素拮抗剂TFP则表现出抑制作用;相比较而言,CAT对钙处理的响应比SOD更为敏感,而SOD对钙调素拮抗剂TFP处理的响应比CAT更为敏感。

图 4 钙处理对低温胁迫下枇杷叶片CAT和SOD活性的影响
2.5钙处理对低温胁迫下枇杷叶片H2O2和MDA含量的影响
植物细胞内过量的H2O2积累会导致细胞质膜的过氧化,引起对膜系统的损伤和细胞伤害。钙处理对低温胁迫下枇杷叶片H2O2和MDA含量的影响见图5。
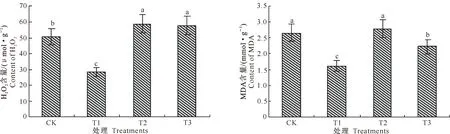
图 5 钙处理对低温胁迫下枇杷叶片H2O2和MDA含量的影响
由图5可见,各处理枇杷叶片细胞H2O2含量从高到低依次为T2>T3>CK>T1。低温胁迫下,T1处理的细胞H2O2含量低于CK,且差异达显著水平(P<0.05),说明钙处理增强了细胞清除H2O2的能力,从而减轻了活性氧对细胞的伤害。而T2和T3处理细胞H2O2含量均高于CK和T1处理,且与T1之间的差异达显著水平(P<0.05),说明TFP抑制了细胞内保护酶的活性,这是导致T2和T3处理细胞内H2O2过度积累的主要原因之一。
MDA是膜脂过氧化的产物,膜脂过氧化是低温诱导氧化损伤的一个重要表征,MDA含量是反映膜氧化损伤程度的公认指标[26]。由图5可知, CK枇杷叶片细胞MDA含量高于T1处理 (P<0.05)。T2处理叶片细胞MDA含量高于CK,T3处理叶片细胞MDA含量高于T1处理(P<0.05),说明钙调素拮抗剂TFP可能通过抑制保护酶的活性而加剧膜脂过氧化。T3处理叶片细胞MDA含量低于T2处理,且差异达显著水平(P<0.05);而T3处理叶片细胞H2O2含量虽低于T2处理,但两者差异却并不显著(P>0.05),这可能与钙处理增强了细胞膜系统结构的稳定性有关[27]。
3讨论
Ca2+、CaM和Ca2+-ATPase是钙信使系统的重要成员,Ca2+是低温下细胞信号的传导物,与其受体蛋白CaM结合形成多功能的调节蛋白Ca2+-CaM,调控SOD、GR、CAT和Ca2+- ATPase等下游靶蛋白酶的活性,从而引发相应的生理响应以抵御逆境胁迫,同时Ca2+也可诱导CaM的生成[28-29]。林善枝等[8]也发现,CaCl2处理可提高低温锻炼毛白杨(PopulustomentosaCarr.)幼苗CaM含量,抑制由低温胁迫所引起的CaM含量下降,同时钙调素拮抗剂对CaCl2处理提高低温锻炼毛白杨幼苗CaM含量起抑制作用。本试验中,钙预处理提高了低温胁迫下枇杷叶片CaM含量,而CaM拮抗剂TFP则强烈抑制了这种生理效应。预示着Ca2+可能作为第二信使诱导了低温胁迫下枇杷叶片CaM的生成,并参与了外源钙诱导枇杷对低温胁迫的生理响应。
启动Ca2+信使功能的关键在于维持胞质内Ca2+的低稳态水平,胞质内游离Ca2+浓度主要受控于质膜和细胞器外膜的Ca2+-ATPase,胞质内Ca2+浓度过高或长时间维持高浓度Ca2+会造成细胞毒害[30]。曾韶西等[6]研究认为,冷和盐预处理可增强水稻(OryzasativaL.)幼苗的抗寒力,激活Ca2+-ATPsae活性,以维持胞质Ca2+浓度的低稳态水平。本试验发现,枇杷叶片细胞Ca2+-ATPase主要分布在质膜、内质网膜和液泡膜上,钙预处理可显著提高低温胁迫下枇杷叶片细胞质膜、内质网膜、液泡膜和线粒体膜的Ca2+-ATPase活性,膜Ca2+-ATPase将Ca2+转运至细胞外或细胞器内,使细胞维持胞质内Ca2+低稳态水平的能力得以增强,从而提高了枇杷幼苗的抗冻性。钙调素拮抗剂TFP不同程度地抑制了质膜、内质网膜、液泡膜和线粒体膜的Ca2+-ATPase活性,但未经钙预处理4种膜的Ca2+-ATPase活性受到较为强烈的抑制,而经钙预处理后4种膜的Ca2+-ATPase活性受钙调素拮抗剂TFP的影响较小,这可能与钙预处理后枇杷叶片细胞CaM含量升高有关,因Ca2+-ATPase的N端有Ca2+-CaM结合域,其活性受CaM调控的缘故[28,31-33]。
Ca2+是生物膜的稳定剂,在维持细胞膜结构稳定性和功能方面发挥着重要的作用,细胞膜结合Ca2+的丧失和游离以及Ca2+浓度的增加,将导致低温胁迫过程中细胞不可逆的伤害[9,30,34-35]。张宗申等[36]发现,Ca2+处理提高了辣椒(CapsicumannuumL.)幼苗的耐热性,这可能与其增强细胞膜稳定性,使膜Ca2+-ATPase在热胁迫下得以保持较高的活性密切相关。本研究中,低温胁迫下,经钙预处理(T3)的枇杷叶片4种膜Ca2+-ATPase活性均显著高于未经钙预处理(T2)叶片,说明钙处理可在一定程度上抵消钙调素拮抗剂TFP对Ca2+-ATPase活性的抑制作用,这可能与钙预处理增强生物膜结构的稳定性和提高CaM含量有关。
外源钙处理通过提高植物低温胁迫下保护酶活性而增强抗冻性的结论已为许多研究所证实[8,37]。本研究中,钙处理使低温胁迫下枇杷叶片细胞保护酶CAT和SOD活性维持在较高的水平,细胞内的H2O2得以及时清除,减轻了活性氧对细胞膜的过氧化作用,导致膜脂过氧化产物MDA含量减少,提高了枇杷幼苗的抗冻性;而钙调素拮抗剂TFP均在一定程度上抑制了保护酶CAT和SOD活性,伴随细胞内H2O2的过度积累而导致膜脂过氧化加剧,使枇杷幼苗的抗冻能力下降,从而使幼苗出现大量死亡。作为CaM专一性拮抗剂的TFP,其在结合CaM后阻碍了CaM与CAT和SOD等靶酶的结合,从而影响了CaM在细胞中的调节作用,这表明Ca2+和CaM均参与了低温胁迫下枇杷叶片膜脂过氧化的调节。
4结论
钙处理可提高低温胁迫下枇杷叶片细胞CaM含量并激活Ca2+-ATPase活性,促进了多功能调节蛋白Ca2+-CaM的生成,激活了低温胁迫下细胞保护酶CAT和SOD活性,减少了胞内活性氧的积累,减轻膜脂过氧化的伤害程度,提高了枇杷的抗冻性,明显提高了枇杷的成活率。钙调素拮抗剂TFP则抑制了钙处理所诱导的上述生理效应,说明Ca2+和CaM均参与了调控低温胁迫下枇杷叶片膜脂的过氧化。因此,能否维持膜稳定的Ca2+-ATPase活性以及胞内CaM含量是提高枇杷对低温耐受性的关键。
[参考文献]
[1]邱武凌.福建果树50年 [M].福州: 福建教育出版社,2000:372-379.
Qiu W L.In the past 50 years of Fujian fruits [M].Fuzhou:Fujian Education Press,2000:372-379.(in Chinese)
[2]谢钟琛,李健.早钟6号枇杷幼果冻害温度界定及其栽培适宜区区划 [J].福建果树,2006(1):7-11.
Xie Z C,Li J.Freezing injury temperature limit and division of optimum cultivation area of ‘Zaozhong No.6’ loquat young fruits [J].Fujian Fruits,2006(1):7-11.(in Chinese)
[3]张夏萍,许伟东,郑诚乐.枇杷冻害及防范研究进展 [J].福建果树,2007(3):28-31.
Zhang X P,Xu W D,Zheng C L.The research progress of freezing injury and prevention of loquat [J].Fujian Fruits,2007(3):28-31.(in Chinese)
[4]孙大业.植物细胞信号传导研究进展 [J].植物生理学通讯,1996,32(2):81-91.
Sun D Y.The research progress of signal transduction in plants [J].Plant Physiology Communications,1996, 32(2):81-91.(in Chinese)
[5]陈由强,叶冰莹,高一平,等.低温胁迫下枇杷幼叶细胞内Ca2+水平及细胞超微结构变化的研究 [J].武汉植物学研究,2000,18(2):138-142.
Chen Y Q,Ye B Y,Gao Y P,et al.Changes of the level of Ca2+in cells of loquat leaflets under low temperature stress [J].Journal of Wuhan Botanical Research,2000,18(2):138-142.(in Chinese)
[6]曾韶西,李美茹.冷和盐预处理提高水稻幼苗抗寒性期间细胞Ca2+-ATP酶活性的变化 [J].植物学报,1999,41(2):156-160.
Zeng S X,Li M R.Changes of Ca2+-ATPase activities in cell of rice seedlings during the enhancement of chilling resistance induced by cold and salt pretreatment [J].Acta Botanica Sinica,1999,41(2):156-160.(in Chinese)
[7]Puhakainen T,Pihakaski-Maunsbach K,Widell S,et al.Cold acclimation enhances the activity of plasma membrane Ca2+-ATPase in winter rye leaves [J].Plant Physiology and Biochemistry,1999,37:231-239.
[8]林善枝, 张志毅.毛白杨幼苗低温锻炼过程中Ca2+的作用及细胞Ca2+-ATP酶活性的变化 [J].植物生理与分子生物学学报,2002,28(6):449-456.
Lin S Z,Zhang Z Y.Calcium effect and changes of Ca2+-ATPase activities during chilling hardening inPopulustomentosacutting [J].Acta Photophysiologica Sinica,2002,28(6):449-456.(in Chinese)
[9]陈亚华,沈振国,刘友良.低温、高pH胁迫对水稻幼苗根系质膜、液泡膜ATP酶活性的影响 [J].植物生理学报,2000,26(5):407-412.
Chen Y H,Shen Z G,Liu Y L.Effects of chilling and high pH stresses on the ATPase activities of plasma membrane and tonoplast vesicles isolated from rice (OryzasativaL.) roots [J].Acta Photophysiologica Sinica,2000,26(5):407-412.(in Chinese)
[10]李素丽,杨丽涛,李志刚,等.不同冷敏感型甘蔗茎尖Ca2+和Ca2+-ATP酶活性对低温的响应 [J].中国农业大学学报,2011,16(2):14-21.
Li S L,Yang L T,Li Z G,et al.Response of Ca2+and Ca2+-ATPase activity in the stem tip of sugarcane to low temperature stress [J].Journal of China Agricultural University,2011,16(2):14-21.(in Chinese)
[11]Jian L C,Li J H,Chen W P,et al.Cytochemical localization of calcium and Ca2+-ATPase activity in plant cells under chilling stress:A comparative study between the chilling-sensitive maize and the chilling-insensitive winter wheat [J].Plant Cell Physiology,1999,40(10):1061-1071.
[12]Somlyo A P.Cell physiology:Cellular site of calcium regulation [J].Nature,1984,309:516-517.
[13]Rasmussen H,Barrett P Q.Calcium messenger system:An integrated view [J].Physiological Reviews,1984,64(3):938-984.
[14]McAinsh M R,Pittman J K.Shaping the calcium signature [J].New Phytologist,2009,181:275-294.
[15]Bonza M C,De Michelis M I.The plant Ca2+-ATPase repertoire:Biochemical features and physiological functions [J].Plant Biology,2011,13(3):421-430.
[16]DeFalco T A,Bender K W,Snedden W A.Breaking the code:Ca2+sensors in plant signalling [J].Biochemical Journal,2010,425:27-40.
[17]Anireddy S N,Gul S,Helena Celesnik,et al.Coping with stresses:Roles of calcium and calcium/calmodulin-regulated gene expression [J].Plant Cell,2011,23:2010-2032.
[18]林素英,梁杰,黄志明,等.钙调素拮抗剂TFP对低温胁迫下枇杷幼果AsA-GSH循环的影响 [J].热带作物学报,2012,33(11):1980-1984.
Lin S Y,Liang J,Huang Z M,et al.Effects of calmodulin antagonist TFP on AsA-GSH cycle in young loquat fruits under low temperature stress [J].Chinese Journal of Tropical Crops,2012,33(11):1980-1984.(in Chinese)
[19]吴锦程,陈伟建,蔡丽琴,等.外源NO对低温胁迫下枇杷幼果抗氧化能力的影响 [J].林业科学,2010,46(9):73-78.
Wu J C,Chen W J,Cai L Q,et al.Effects of exogenous nitric oxide on anti-oxidation capacities in young loquat fruits under low temperature stress [J].Scientia Silvae Sinicae,2010,46(9):73-78. (in Chinese)
[20]赵士诚,孙静文,王秀斌,等.镉对玉米苗中钙调蛋白含量和Ca2+-ATPase活性的影响 [J].植物营养与肥料学报,2008,14(2):264-271.
Zhao S C,Sun J W,Wang X B,et al.Effects of cadmium on calmodulin content and Ca2+-ATPase activities of maize (Zeamays) seedling [J].Plant Nutrition and Fertilizer Science,2008,14(2):264-271.(in Chinese)
[21]Ohnishi T,Gall R S,Mayer M L.An improved assay of inorganic phosphate in the presence of extralabile phosphate compounds:Application to the ATPase assay in the prence of phosphocreatine [J].Analytical Biochemistry,1975,69(1):261-267.
[22]李合生.植物生理生化实验原理和技术 [M].北京:高等教育出版社,2001.
Li H S.The experimental principle and technology of plant physiology and biochemistry [M].Beijing:High Eduction Press,2001.(in Chinese)
[23]罗充,马湘陶,彭抒昂.果树生理研究中CaM的ELISA测定 [J].果树科学,1996,15(2):180-184.
Luo C,Ma X T,Peng S A.Enzyme-linked immunosorbent assay for calmodulin in physiological research of crops [J].Journal of Fruit Science,1996,15(2):180-184.(in Chinese)
[24]张素勤,程智慧,耿广东.低温胁迫对茄子幼苗生理特性的影响 [J].湖南农业大学学报:自然科学版,2006,32(4):393-396.
Zhang S Q,Cheng Z H,Geng G D.Effect of low temperature on eggplant-seeedling physiological characteristics [J].Journal of Hunan Agricultural University:Natural Sciences,2006,32(4):393-396.(in Chinese)
[25]Conrath U,Chen Z,Ricigliano J R,et al.Two inducers of plant defense responses,2,6-dichloroisonicotinic acid and salicylic acid,inhibit catalase activity in tobacco [J].Proceedings of the National Academy of Sciences,1995,92(16):7143-7147.
[26]Hodges D M,Delong J M,Forney C F,et al.Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds [J].Planta,1999,207(4):604-611.
[27]张宗申,利容千,王建波.外源Ca2+预处理对高温胁迫下辣椒叶片细胞膜透性和GSH、AsA含量及Ca2+分布的影响 [J].植物生态学报,2001,25(2):230-234.
Zhang Z S,Li R Q,Wang J B.Effects of Ca2+pretreatment on plasmalemma permeability,GSH and AsA contents,and calcium distribution in pepper mesophyll cells under heat stress [J].Acta Phytoecologica Sinica,2001,25(2):230-234.(in Chinese)
[28]Yang T B,Poovaiah B W.Calcium/calmodulin-mediated signal network in plants [J].Trends in Plant Science,2003,8(10):505-512.
[29]Minorsky P V. An heuristic hypothesis of chilling injury in plants: A role for calcium as the primary physiological transducer of injury [J].Plant,Cell and Environment,1985,8(2):75-94.
[30]Kudla J,Batistic O,Hashimoto K.Calucum signals:The lead currency of plant information processing [J].Plant Cell,2010,22(3):541-563.
[31]Nürnberger T,Scheel D.Signal transmission in the plant immune response [J].Trends in Plant Science,2001,6(8):372-379.
[32]Snedden W A,Fromm H.Calmodulin as a versatile calcium signal transducer in plants [J].New Phytologist,2001,151(1):35-66.
[33]Hu X L,Jiang M Y,Zhang J H,et al.Calcium-calmodulin is required for abscisic acid-induced antioxidant defense and functions both upstream and downstream of H2O2production in leaves of maize (Zeamays) plants [J].New Phytologist,2007,173(1):27-38.
[34]Alvarez M E,Nota F,Cambiagno D A.Epigenetic control of plant immunity [J].Molecular Plant Pathology,2010,11(4):563-576.
[35]Hashimoto K,Kudla J.Calcium decoding mechanisms in plan-ts [J].Biochimie,2011,93(12):2054-2059.
[36]张宗申,利容千,王建波.Ca2+预处理对热胁迫下辣椒叶肉细胞中Ca2+-ATPase酶活性的影响 [J].植物生理学报,2001,27(6):451-454.
Zhang Z S,Li R Q,Wang J B.Effect of Ca2+pretreatment on the Ca2+-ATPase activity in the mesophyll cells of pepper seedling under heat stress [J].Acta Photophysiologica Sinica,2001,27(6):451-454.(in Chinese)
[37]刘辉,张钢.CaCl2对金叶女贞茎抗寒性和电阻抗图谱参数的影响 [J].植物研究,2008,28(4):442-446.
Liu H,Zhang G.The influence of CaCl2on the frost hardiness and electrical impedance parameters in stems ofLigustrumvicaryiduring hardening [J].Bulletin of Botanical Research,2008,28(4):442-446.(in Chinese)
Effects of calcium on Ca2+-ATPase activity and lipid peroxidation level of loquat seedling under low temperature stress
WU Jin-cheng,CHEN Yu,WU Bi-sha,HUANG Ling-ling,ZHANG Wei-fang,ZHENG Fu-ming
(CollegeofEnvironmentalandBiologicalEngineering,PutianUniversity,Putian,Fujian351100,China)
Abstract:【Objective】 The regulation mechanism of calcium on Ca2+-ATPase activity and lipid peroxidation of loquat under low temperature stress was studied to provide basis for cold resistance of loquat.【Method】 Tow-year-old ‘Zaozhong No.6’ loquat (Eriobotrya japonica Lindl.) seedlings planted in containers with sand culture method and Hoagland nutrition solution were treated with 5 mmol/L CaCl2 and 100 mmol/L Trifluoperazine (TFP).The seedlings with pretreatment with calcium,pretreatment with TFP,pretreatment with TFP after calcium and non-pretreatment (CK) were subjected to low temperature (-6 ℃) stress in a phytotron for 6 h to investigate the effects on survival rate,activities of Ca2+-ATPase,catalase (CAT) and superoxide dismutase (SOD),as well as contents of CaM,H2O2 and MDA.【Result】 The survival rate of seedlings,CaM content,and Ca2+-ATPase activities of plasma membrane,endoplasmic membrane,tonoplast membrane and mitochondrial membrane in leaf cells were markedly enhanced by Ca2+treatment.The treatment also stimulated the activities of CAT and SOD while reduced the contents of H2O2 and MDA.The above physiological effects were all inhibited by TFP,which weakened the antioxidant capacity of loquat seedlings under low temperature stress and aggravated the damage.【Conclusion】 Ca2+treatment enhanced the cold resistance of loquat seedlings.Signal system of Ca2+·CaM may induce and regulate the cold resistance of loquat under low temperature stress.
Key words:loquat (Eriobotrya japonica Lindl.);low temperature stress;calmodulin (CaM);Ca2+-ATPase;lipid peroxidation
DOI:网络出版时间:2016-01-0810:2210.13207/j.cnki.jnwafu.2016.02.017
[收稿日期]2014-06-26
[基金项目]福建省科技厅重点项目(2011N0028);福建省高校服务海西建设重点项目(2008HX02)
[作者简介]吴锦程(1965-),男,福建莆田人,教授,主要从事果树生理学研究。
[中图分类号]S667.3;Q946.5
[文献标志码]A
[文章编号]1671-9387(2016)02-0121-08
