不同因素对赤霞珠果实理化性质及果皮花色苷含量的影响
2016-06-15乔玲玲马雪蕾吕晓彤房玉林
乔玲玲,马雪蕾,张 昂,吕晓彤,王 凯,王 琴,房玉林,5
(1 西北农林科技大学 葡萄酒学院,陕西 杨凌712100;2 新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐830052;3 秦皇岛出入境检验检疫局 河北 秦皇岛066004;4 新疆林业科学院,新疆 乌鲁木齐830063;
5 陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌712100)
不同因素对赤霞珠果实理化性质及果皮花色苷含量的影响
乔玲玲1,马雪蕾2,张昂3,吕晓彤1,王凯1,王琴4,房玉林1,5
(1 西北农林科技大学 葡萄酒学院,陕西 杨凌712100;2 新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐830052;3 秦皇岛出入境检验检疫局 河北 秦皇岛066004;4 新疆林业科学院,新疆 乌鲁木齐830063;
5 陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌712100)
[摘要]【目的】 探究不同因素对葡萄果实理化性质及果皮中花色苷含量的影响,为改善葡萄原料品质及酿酒工艺中花色苷的浸提提供理论依据。【方法】 以酿酒葡萄赤霞珠果实为原料,以未处理葡萄果粒为对照,测定温度(20,30,40 ℃)、pH(2.2,3.0,4.0,5.0,6.0,7.0,8.0)及脱水处理(用质量分数5%的食盐溶液分别脱水0.5,1,1.5,2,3,4,6,9,12 h)对果实可溶性固形物、总酸和pH等理化性质指标及果皮花色苷(可浸提花色苷、不可浸提花色苷、总花色苷)含量的影响。【结果】 (1)与对照相比,20~30 ℃处理48 h 可使葡萄果实的可溶性固形物含量增加4.12~6.52 °Brix,总酸质量浓度下降0.81~1.86 g/L,pH升高0.22~0.68;20~30 ℃处理36 h果皮中的花色苷含量均较高。(2)脱水处理12 h可使葡萄果实的可溶性固形物含量比对照提高14.5%,总酸质量浓度比对照提高2.76%,pH比对照降低3.64%;但果皮中可浸提花色苷含量较对照降低7.4%,不可浸提花色苷含量较对照降低2.45%,总花色苷含量较对照降低 8.47%。(3)随着缓冲液pH的升高,果实可溶性固形物含量先上升后降低;不同pH处理对果实pH及总酸质量浓度影响总体较小。用pH为2.2~4.0溶液处理后,果皮可浸提花色苷和总花色苷含量均高于对照,不可浸提花色苷含量基本保持不变;用pH 5.0~8.0溶液处理后,果皮总花色苷、可浸提花色苷和不可浸提花色苷含量均呈下降趋势。【结论】 20~30 ℃处理36 h可以改善葡萄果实理化性质及提高果皮中的花色苷浸提量;脱水处理能改善果实理化性质;适当酸性溶液处理葡萄,有利于可浸提花色苷的提取。
[关键词]赤霞珠;理化性质;花色苷浸提;温度;pH;脱水
品质是现代葡萄生产主要追求的目标之一[1]。葡萄果实的质量是葡萄酒品质的保证,其中可溶性固形物、总酸、pH和酚类物质等都决定着葡萄酒的品质,也是酿酒葡萄品质优劣的衡量指标[2]。葡萄果实中糖酸含量及其构成比例影响葡萄酒的平衡,花色苷是葡萄酒的主要呈色物质[3-4],其理化性质影响葡萄酒的品质和口感[5-7]。
目前,关于葡萄果实理化性质的研究主要集中在气候[8]、土壤[9-10]、栽培模式[11]及外源激素[12]处理等方面,对葡萄果皮花色苷的研究多是花色苷的提取[13-15]和稳定性[16-17]研究。而关于温度、脱水及pH处理对葡萄果实理化性质及花色苷浸提量影响的研究尚鲜见报道。
前人的研究表明,花色苷普遍具有稳定性差、极易变色的特点[18]。在整个酿酒过程中,葡萄中的花色苷会因为醪液的温度、pH等性质的变化而发生一定的变化。在炎热葡萄酒产区,葡萄原料在采收时会遇到皱缩现象,美国研究者将其命名为Berry shrivel。有研究表明,适度皱缩可以提高浆果含糖量和花色苷含量,而重度皱缩则会导致花色苷浸出率降低,从而对葡萄酒品质产生影响[19]。
为此,本试验探索了温度、脱水程度及pH对赤霞珠果实理化性质及花色苷含量的影响,以期为改善葡萄原料品质及酿酒工艺中花色苷的浸提提供理论依据。
1材料与方法
1.1试验材料
选取欧亚种葡萄(VitisviniferaL.)赤霞珠(Cabernet Sauvignon)为试验材料,于2011年9月初采自陕西省泾阳县,试验中选取果粒大小一致、着色良好、无破损腐败的果实进行试验。
1.2试剂与仪器
1.2.1主要试剂模式酒(酒精度11.0%(体积分数),苹果酸2.5 g/L,酒石酸3.5 g/L,葡萄糖2.0 g/L,SO220 mg/L,pH 3.2);酸性甲醇(盐酸体积分数为0.1%的甲醇溶液);Buffer A(含有0.2 mol/L乙酸和0.17 mol/L NaCl的pH值为4.9的缓冲液);蛋白溶液(1 mg/mL牛血清蛋白(BSA),溶液为Buffer A);漂白溶液(0.36 mol/L焦亚硫酸钾);pH值分别为2.2,3.0,4.0,5.0,6.0,7.0,8.0的磷酸二氢钠-柠檬酸缓冲液等。
1.2.2主要设备与仪器紫外可见分光光度计,UV-2450型,日本岛津公司;电热恒温水浴锅,HH.W21.600S型,上海跃进医疗器械厂;烘箱,101-2AB型,天津市泰斯特仪器有限公司;摇床,QYC-2102C,上海福玛实验设备有限公司;离心机,TGC-16C,上海安亭科学仪器厂。
1.3试验方法
1.3.1材料处理(1)温度处理。将带果柄的果粒分别平铺于20,30,40 ℃烘箱内,处理48 h,其中以未处理果粒为对照(CK)。每个试验组重复3次,每隔12 h取样1次。(2)脱水处理。制备含质量分数5%的食盐溶液作为渗透液,25 ℃下将果粒浸入渗透液中,依次脱水0.5,1,1.5,2,3,4,6,9,12 h,以未处理果粒为对照(CK),用去离子水清洗3次后取出果粒用吸水纸擦干表面多余的水分[20-21]。(3)pH处理。分别配制pH值为2.2,3.0,4.0,5.0,6.0,7.0,8.0的磷酸二氢钠-柠檬酸缓冲液,其中以未处理果粒为对照(CK),25 ℃下将果粒分别于缓冲液中浸泡30 min后,用去离子水清洗3次,用吸水纸擦干果粒表面多余水分。需特别说明的是葡萄酒酿造及贮藏过程中的pH值一般小于4.0,但为了探索不同理化条件对花色苷稳定性的影响,本研究将pH值涉及范围拓展到了5.0~8.0。
1.3.2花色苷的提取方法[22-25](1)可浸提花色苷的提取。经过上述处理的果粒,除去果肉与种子,然后用超纯水冲洗果皮,除去与果皮粘连的部分果肉与糖分等,然后用吸水纸吸干果皮表面水分,将得到的果皮材料在50 mL模式酒中于25 ℃、避光、转速100 r/min的摇床中振荡提取48 h,收集浸提液。(2)不可浸提花色苷的提取。将经过可浸提花色苷提取之后的葡萄皮在50 mL酸性甲醇溶液中于25 ℃、避光、转速100 r/min的摇床中震荡提取48 h,收集浸提液。(3)总花色苷。采用pH示差法测定葡萄果皮提取液中的花色苷含量[26-28]。 先分别配制pH 1.0的盐酸-氯化钠缓冲液和pH 4.5的醋酸-醋酸钠缓冲液,然后分别用2种缓冲液将葡萄果皮提取液稀释20倍,再分别将稀释之后的溶液在510和700 nm下测定吸光度(A510,A700),根据公式(1)计算吸光度A,根据公式(2)计算提取液中总花色苷含量(用矢车菊素-3-葡萄糖苷(CGE)含量表示,mg/g)。
A=(A510-A700)pH 1.0-(A510-A700)pH 4.5,
(1)
总花色苷含量=(A×MW×DF×Ve×1 000)/(ε×1×M)。
(2)
式中:MW为矢车菊素-3-葡萄糖苷的相对分子质量,取为449;DF为葡萄皮提取液的稀释倍数;Ve为葡萄皮提取液的总体积,本研究为0.09 L;ε为摩尔吸光系数,取为29 600;M为葡萄皮研磨粉末的取样质量(3.00 g)。
1.3.3品质指标及测定方法(1)可溶性固形物含量。参照GB/T 15038-2005葡萄酒、果酒通用分析方法,用手持糖量计进行测定。(2)pH。使用pH计进行测量[29]。(3)总酸质量浓度。参照GB 15037-2006葡萄酒国家标准方法,用NaOH滴定法测定,以酒石酸含量计。
1.4数据统计与分析
采用 DPS v7.05数据处理软件中的Duncan’s新复极差法进行数据差异显著性分析。
2结果与分析
2.1温度对葡萄果实理化性质及果皮花色苷的影响
2.1.1果实理化性质不同温度对葡萄果实可溶性固形物、pH及总酸的影响见图1。

图 1不同温度对葡萄果实可溶性固形物、pH及总酸的影响
Fig.1Effects of temperature on soluble solids,pH and acidity of berries
图1显示,不同温度处理均能显著影响葡萄果实的理化指标,随着温度处理时间的延长,葡萄果实的可溶性固形物含量表现出稳定增长趋势,并且单位时间内果实可溶性固形物含量的增量随温度的升高而增加。不同温度处理48 h后,40 ℃处理葡萄果实中可溶性固形物含量增加10.03 °Brix,20和30 ℃处理葡萄果实中可溶性固形物含量分别增加4.12和6.52 °Brix。
图1还显示,不同温度处理中,葡萄果实的pH整体呈升高趋势,其中30,40 ℃下较CK增加幅度分别为0.68和0.95;在20 ℃的温度处理中,葡萄果实的pH呈波浪起伏型缓慢增长趋势,但与CK相比增加幅度较小。不同温度处理48 h后,果实的pH表现为40 ℃>30 ℃>20 ℃。
由图1可知,不同温度处理过程中,葡萄果实的总酸质量浓度均呈稳定下降趋势,至处理48 h后,与CK相比,40 ℃处理的降低幅度最为明显(2.41 g/L),20,30 ℃处理果实的总酸质量浓度分别降低了0.81和1.86 g/L。在同一处理时间下,葡萄果实总酸质量浓度也基本上随着温度的升高而降低。
由图1还可知,在同一处理时间条件下,基本均以40 ℃处理对葡萄果实3种理化指标的影响最为明显,其次是30 ℃处理,20 ℃处理效果不明显。由此可见,适当的温度处理能够对葡萄果实的理化性质产生积极的影响,即提高果实可溶固形物含量,使果实pH升高的同时降低果实总酸质量浓度,有助于改善酿酒葡萄原料品质。
2.1.2果皮花色苷图2分别反映了各温度处理对果皮中可浸提花色苷、不可浸提花色苷及总花色苷含量的影响。图2显示,在不同温度处理下,葡萄果皮中可浸提花色苷含量变化规律并不一致。其中在20及30 ℃条件下,可浸提花色苷含量总体增高,而在40 ℃下则表现为先增高后降低进而趋近于平衡的趋势。不同温度处理48 h后,40 ℃处理的可浸提花色苷含量为0.78 mg/g,而20及30 ℃处理的可浸提花色苷含量分别为 1.29和1.31 mg/g。由此可见,温度的增高不利于葡萄中可浸提花色苷的累积。
由图2可知,在40 ℃条件下,随处理时间的延长,不可浸提花色苷含量呈持续下降趋势;在20 ℃下,不可浸提花色苷含量呈增大趋势,于36 h后达到最高,之后趋于稳定;在30 ℃下不可浸提花色苷含量则表现为先增高后降低进而在36 h之后逐渐趋于平衡。而且温度的升高对于不可浸提态花色苷含量下降的起始点具有一定的推前作用。
由图2还可知,在20 ℃条件下,葡萄果皮中的总花色苷含量持续增高并于36 h后达到平衡;在30 ℃条件下总花色苷含量持续升高于36 h时达到峰值,之后又有所降低;而在40 ℃条件下,总花色苷含量在0~12 h略有升高之后开始迅速下降,至36~48 h趋于平衡。不同温度处理48 h后,40 ℃条件下总花色苷含量仅为1.25 mg/g,20和30 ℃条件下总花色苷含量分别为1.93和1.89 mg/g。说明温度的增高不利于葡萄果皮中总花色苷的累积,温度的升高对于总花色苷含量下降的起始点具有一定的推前作用。

图 2 不同温度对葡萄果皮花色苷含量的影响
2.2脱水处理对葡萄果实理化性质及果皮花色苷的影响
2.2.1果实理化性质图3反映了不同脱水处理对葡萄果实可溶性固形物含量、总酸质量浓度及pH的影响。图3显示,葡萄果实的可溶性固形物含量随脱水时间的延长呈波浪起伏状升高趋势,且在处理12 h后,出现最大值22.74 °Brix,与CK相比提高了14.5%。总酸质量浓度随着脱水处理时间的延长呈现上下起伏波动的趋势,处理12 h后,总酸质量浓度略有升高,为8.34 g/L,较CK提高2.76%。果实的pH随着脱水时间的延长总体呈现出先升高后降低的趋势,处理12 h后,pH值为3.44,较CK降低3.64%。
2.2.2果皮花色苷图4表明,葡萄果皮中可浸提花色苷含量随脱水处理时间的延长呈现出波动下降趋势,处理12 h后,可浸提花色苷含量为0.89 mg/g,与CK相比降低了7.4%。不可浸提花色苷含量呈现波浪起伏变化趋势,处理12 h后,不可浸提花色苷含量为0.68 mg/g,与CK相比降低了2.45%。总花色苷含量也呈波动起伏变化,但总体上呈降低趋势,处理12 h后,总花色苷含量为1.52 mg/g,与CK相比降低了8.47%。
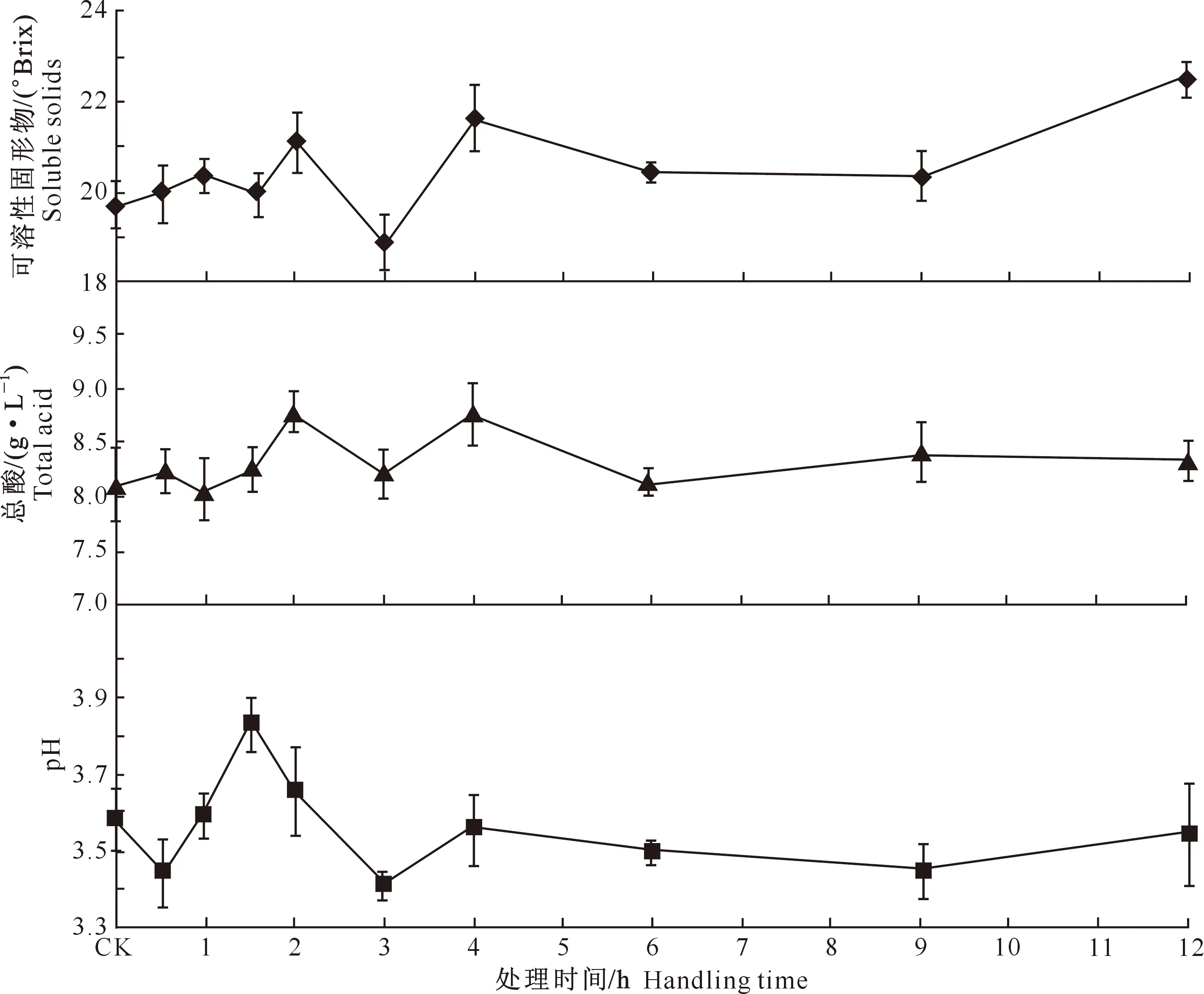
图 3 脱水处理对葡萄果实可溶性固形物、pH值、总酸的影响
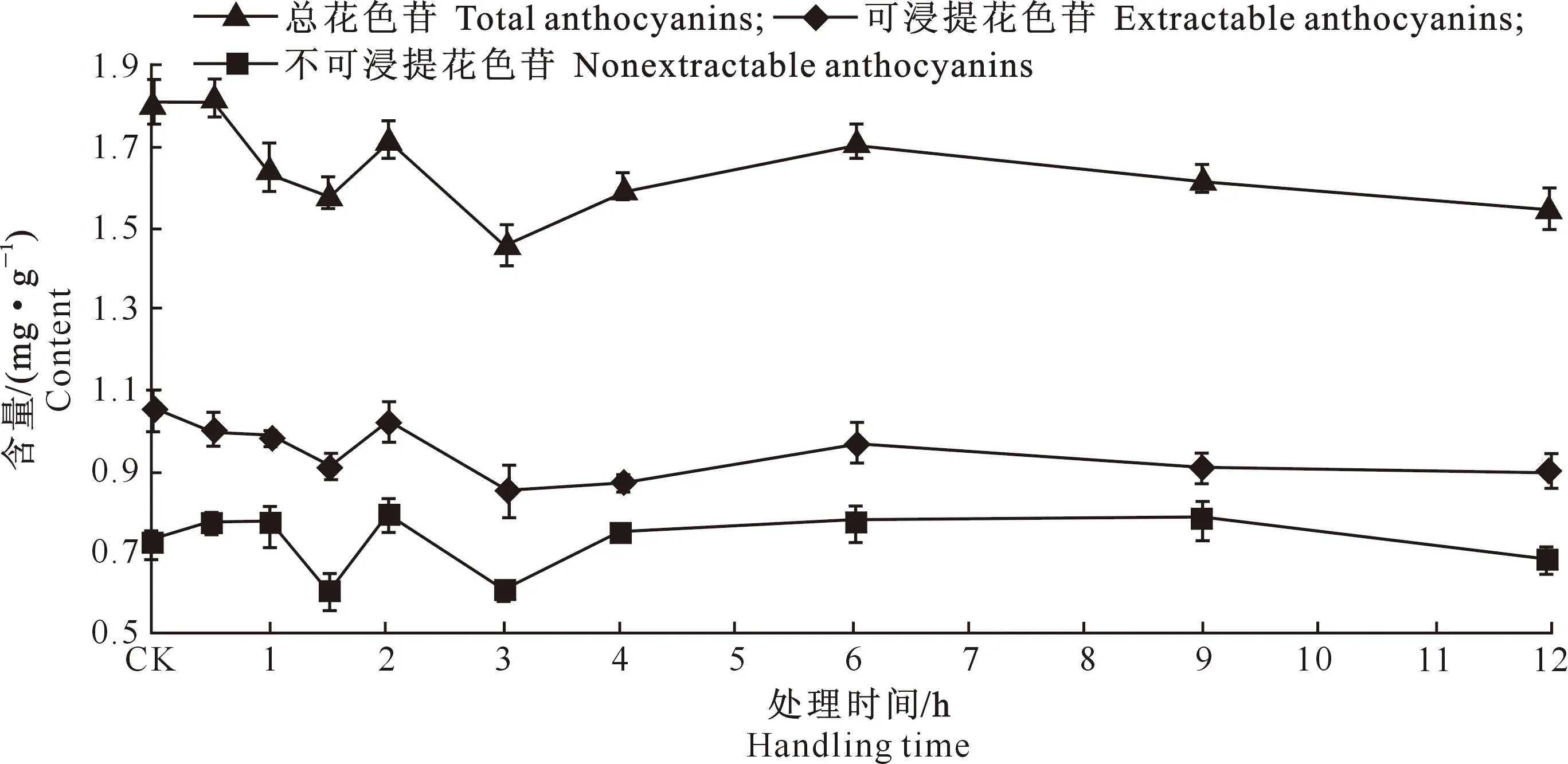
图 4 脱水处理对葡萄果皮花色苷含量的影响
2.3pH对葡萄果实理化性质及果皮花色苷的影响
2.3.1果实理化性质图5是经不同pH的缓冲液浸泡后,葡萄果实的可溶性固形物、pH及总酸的变化情况。
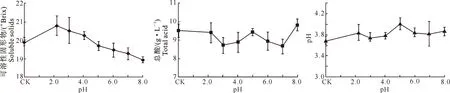
图 5 不同pH对葡萄果实可溶性固形物、pH、总酸的影响
由图5可以看出,随着溶液pH值的升高,葡萄果实的可溶性固形物含量呈先上升后下降趋势,当用pH为2.2的溶液处理时,葡萄果实可溶性固形物达到最大值,之后逐渐下降;总酸质量浓度呈起伏波动变化,无明显规律,用pH为3.0的溶液处理时,果实pH下降至3.74,此时葡萄果实可溶性固形物含量为20.69 °Brix。各处理中葡萄果实pH值均高于CK,总体呈变化不显著,pH为5.0的处理液中果实pH最大为4.02。与CK相比,pH为3.0的处理液使果实总酸质量浓度下降9.8%,果实可溶性固形物含量上升 4.2%,表明使用pH为3.0的缓冲液能提高果实品质。
2.3.2果皮花色苷不同pH处理对葡萄果皮花色苷的影响见图6。
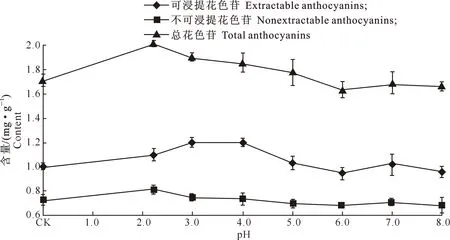
图 6 不同pH处理对葡萄果皮花色苷含量的影响
由图6可知,随着pH的升高,葡萄果实中3种花色苷的含量均表现先升高后降低的趋势,但是各自最大值出现时对应的pH并不相同。其中,总花色苷含量最大值出现在pH为2.2的溶液中,此时总花色苷含量为2.02 mg/g;可浸提花色苷含量在处理液pH为4.0之前呈上升趋势,在处理液pH为4.0时可浸提花色苷含量达到最大值,为1.20 mg/g,之后随着处理液pH的升高总体呈降低趋势;不可浸提花色苷含量与总花色苷含量的变化趋势基本一致,在处理液pH为2.2时出现最大值,为0.81 mg/g,之后随着处理液pH值的升高,其含量又呈逐渐降低趋势。
由图6还可知,在pH 2.2~4.0的处理液中,葡萄果皮中的可浸提花色苷和总花色苷含量均高于CK,但不可浸提花色苷水平却基本不变;在pH 5.0~8.0的处理液中,总花色苷、可浸提花色苷和不可浸提花色苷含量均呈下降趋势。表明适当酸性溶液处理葡萄,有利于可浸提花色苷的提取。
3讨论与结论
红葡萄酒中的花色苷主要是通过发酵过程对葡萄果皮的浸渍作用产生的[30]。随着浸渍作用的加强,包括浸渍温度的提高、浸渍时间的延长等都能使葡萄果皮中的花色素苷进入葡萄酒中。为了得到较为优质的提取液为后续酿酒工艺提供优质的原料,本试验就温度、脱水处理、pH对葡萄果实理化性质及果皮花色苷的影响进行了研究,可知以上因素的影响各不相同。
前人发现,温度可通过影响葡萄果实内相关酶的活性,进而影响果皮中花色苷、酸类物质以及糖类物质的代谢,并将进一步影响葡萄的品质及花色苷浸提[31-32]。本试验结果显示,20~30 ℃的温度处理36 h可使葡萄果实的可溶性固形物含量增加、总酸质量浓度下降、pH升高,同时可以提高葡萄果皮中可浸提花色苷、不可浸提花色苷及总花色苷的含量。因此,在葡萄酒酿造过程中可将原料于20~30 ℃处理36 h,对于改善原料理化性质及提高葡萄果皮中花色苷含量均有积极作用。
渗透脱水处理是在一定的温度条件下将果实或其他植物材料浸入到高渗透压的溶液中,通过渗透作用除掉材料中一部分水分的操作方法[33-35]。本试验结果表明,随着葡萄果实在渗透溶液中浸泡时间的延长,葡萄果实失水不断增多,糖不断浓缩,可溶性固形物含量总体呈上升趋势;伴随着水分的减少,H+的浓度逐渐增强,所以葡萄果实的总酸质量浓度略有升高。
本研究中,用不同pH磷酸二氢钠-柠檬酸缓冲液浸泡葡萄果实,浸泡期间葡萄果实可溶性固形物含量随pH的升高呈先上升后下降趋势。在酸性溶液中,存在4种花色苷的平衡,分别为醌型碱(A)、黄盐阳离子(AH+)、甲碱假碱(B)和查尔酮假碱(C)[6-7]。本试验结果显示,pH为2.2~4.0时,葡萄果皮中的可浸提花色苷含量呈上升趋势,pH为5.0~8.0时,葡萄果皮中可浸提花色苷含量降低,这是因为在此阶段,花色苷主要以无色的甲醇假碱和查尔酮假碱的形式存在,所以测量的吸光值降低。总之,pH处理对果实pH及总酸质量浓度影响不显著,但酸性(pH 2.2~4.0)溶液处理后有利于果皮可浸提花色苷的提取。
[参考文献]
[1]李记明.关于葡萄品质的评价指标 [J].中外葡萄与葡萄酒,1999(1):56-59.
Li J M.On grape quality evaluation index [J].Sino-Overseas Grapevine Wine,1999(1):56-59.(in Chinese)
[2]杨中,张静,汤兆星.新疆酿酒葡萄加工品质评价指标体系的建立 [J].广东农业科学,2011(6):119-123.
Yang Z,Zhang J,Tang Z X.Establishment of Xinjiang wine grape processing quality evaluation system [J].Guangdong Agricultural Sciences,2011(6):119-123.(in Chinese)
[3]孙欣,韩键,房经贵,等.葡萄浆果着色分子机理的重要研究进展 [J].植物生理学报,2012,48(4):333-342.
Sun X,Han J,Fang J G,et al.Important research progress of coloring molecular mechanism in grape berry [J].Plant Physiology Journal,2012,48(4):333-342.(in Chinese)
[4]陈颖秋,黄永俊,马小星,等.红葡萄酒花色苷的研究 [J].云南农业,2011(9):33-35.
Chen Y Q,Huang Y J,Ma X X,et al.Anthocyanins research of red wine [J].Yunnan Agriculture,2011(9):33-35.(in Chinese)
[5]邓洁红,谭兴和,潘小红,等.葡萄花色苷研究进展 [J].包装与食品机械,2006,24(6):22-28.
Deng J H,Tan X H,Pan X H,et al.Research progress on anthocyanins ofVitis[J].Packaging and Food Machinery,2006,24(6):22-28.(in Chinese)
[6]韩富亮,李杨,李记明,等.红葡萄酒花色苷结构和颜色的关系研究进展 [J].食品与生物技术学报,2011,30(3):328-336.
Han F L,Li Y,Li J M,et al.Relation between anthocyanin structures and color in red wine: A review [J].Journal of Food Science and Biotechnology,2011,30(3):328-336.(in Chinese)
[7]杜文华,刘忠义.葡萄酒中花色苷的研究进展 [J].食品与机械,2011,27(4):169-172,176.
Du W H,Liu Z Y.Research progress on anthocyanins of wine [J].Food & Machinery,2011,27(4):169-172,176.(in Chinese)
[8]王秀芹,陈小波,战吉成,等.生态因素对酿酒葡萄和葡萄酒品质的影响 [J].食品科学,2006,27(12):791-797.
Wang X Q,Chen X B,Zhan J C,et al.Effect of ecological factors on the wine grape and wine quality [J].Food Science,2006,27(12):791-797.(in Chinese)
[9]李记明,姜文广,于英,等.土壤质地对酿酒葡萄和葡萄酒品质的影响 [J].酿酒科技,2013(7):37-40,45.
Li J M,Jiang W G,Yu Y,et al.Effects of soil texture on wine grape and wine quality [J].Liquor-Making Science & Technology,2013(7):37-40,45.(in Chinese)
[10]徐淑伟,刘树庆,杨志新,等.葡萄品质的评价及其与土壤质地的关系研究 [J].土壤,2009,41(5):790-795.
Xu S W,Liu S Q,Yang Z X,et al.Evaluation of grape quality research and its relationship with soil texture [J].Soil,2009,41(5):790-795.(in Chinese)
[11]蒋爱丽,奚晓军,程杰山,等.设施栽培条件下葡萄产量对果实品质的影响 [J].中外葡萄与葡萄酒,2013(2):45-47.
Jiang A L,Xi X J,Cheng J S,et al.Effects on fruit quality grape production under protected cultivation [J].Sino-Overseas Grapevine Wine,2013(2):45-47.(in Chinese)
[12]崔慧琴,牛建新.植物生长调节剂对克瑞森葡萄果实品质的影响 [J].新疆农业科学,2009,46(6):1263-1265.
Cui H Q,Niu J X.Effect of lant growth regulators on fruit quality crimson grapes [J].Xinjiang Agriculture Sciences, 2009, 46(6): 1263-1265.(in Chinese)
[13]牟德华,杨晓伟,薛红伟.超声波辅助提取酿酒葡萄皮渣中花色苷的工艺研究 [J].中国食品添加剂,2010(3):143-146.
Mou D H,Yang X W,Xue H W.Ultrasound associated of anthocyanins from grape wine pomace [J].China Food Additives,2010(3):143-146.(in Chinese)
[14]李杨,韩富亮,李记明,等.葡萄皮渣中三种主要花色苷的优化提取 [J].食品工业科技,2012,33(2):257-260,264.
Li Y,Han F L,Li J M,et al.Optimization of the three key anthocyanin from wine pomace by orthogonal design and HPLC analysis [J].Science and Technology of Food Industry,2012,33(2):257-260,264.(in Chinese)
[15]张莹,丁辰,赵岩,等.葡萄酒皮渣提取花色苷研究应用进展 [J].农产品加工学刊,2012(5):95-98.
Zhang Y,Ding C,Zhao Y,et al.Progress of wine pomace extract anthocyanin research [J].Academic Periodical of Farm Products Processing,2012(5):95-98.(in Chinese)
[16]王维茜,邓洁红,魏一枝,等.葡萄花色苷的合成及稳定性研究进展 [J].中国酿造,2014,33(5):10-14.
Wang W Q,Deng J H,Wei Y Z,et al.Progress in the synthesis and stability of grape anthocyanins [J].China Brewing,2014,33(5):10-14.(in Chinese)
[17]杨夫臣,吴江,程建徽,等.葡萄果皮花色素的提取及其理化性质 [J].果树学报,2007,24(3):287-292.
Yang F C,Wu J,Cheng J H,et al.Grape anthocyanin extraction and properties [J].Journal of Fruit Science,2007,24(3):287-292.(in Chinese)
[18]王朝臣.葡萄花色苷稳定性的研究 [J].农业技术与装备,2011(4):7-8.
Wang C C.Study on the stability of anthocyanins from grape [J].Agricultural Technology & Equipment,2011(4):7-8.(in Chinese)
[19]Fang Y L,Meng J F,Zhang A,et al.Influence of shriveling on berry composition and antioxidant activity of Cabernet Sauvignon grapes from Shanxi vineyards [J].Journal of the Science of Food and Agriculture,2011,91(4):749-757.
[20]董全.蓝莓渗透脱水和流化床干燥过程中理化指标变化的研究 [J].食品科学,2009,30(8):287-290.
Dong Q.Study on physico-chemical changes of blueberries during osmotic dehydration and fluidized bed drying processes [J].Food Science,2009,30(8):287-290.(in Chinese)
[21]陈金日,冉旭,王利,等.圣女果渗透脱水试验研究 [J].北方园艺,2010(2):200-203.
Chen J R,Ran X,Wang L,et al.Cherry tomatoes permeability test of dehydration [J].Northern Horticulture,2010(2):200-203.(in Chinese)
[22]孙建霞.花青素的提取、分离以及纯化方法研究进展 [J].食品与发酵工业,2008,34(8):111-117.
Sun J X.Review on the methods of extraction,isolation and purification of anthocyanins [J].Food and Fermentation Industries,2008(8):111-117.(in Chinese)
[23]王华.葡萄果皮花色素苷提取工艺的研究 [J].西北农林科技大学学报:自然科学版,2008,36(2):129-133.
Wang H.Study on the extraction technology of anthocyanins from the grape pomace [J].Journal of Northwest A&F University:Nat Sci Ed,2008,36(2):129-133.(in Chinese)
[24]晁珍珍,李志洲.葡萄皮花色苷提取的研究进展 [J].粮油食品科技,2010,18(4):46-48.
Chao Z Z,Li Z Z.Research progress of extracting anthocyanin from grape peel [J].Science and Technology of Cereals,Oils and Foods,2010,18(4):46-48.(in Chinese)
[25]冯建光,谷文英.葡萄皮红色素的示差法测定 [J].食品工业科技,2002,23(9):84-86.
Feng J G,Gu W Y.Differential determination of grape skin red pigment [J].Science and Technology of Food Industry,2002,23(9):84-86.(in Chinese)
[26]L J M,Christopher R,Ronald E W.Correlation of two anthocyanin quantification methods:HPLC and spectrophotometric methods [J].Food Chemistry,2008,110(3):782-786.
[27]Giusti M M,Wrolstad R E.Anthocyanins characterization and measurement by UV visible spectroscopy [M].//Wrolstadre.Current protocols in food analytical chemistry.New York:Wiley,2001:1-13.
[28]郭耀东.葡萄皮花色苷提取纯化技术及其稳定性研究 [D].陕西杨凌:西北农林科技大学, 2008.
Guo Y D.Extraction,purification and stability of anthocyanins from grape skins [D].Yangling,Shaanxi:Northwest A&F University,2008.(in Chinese)
[29]王华.葡萄与葡萄酒实验技术操作规范 [M].西安:西安地图出版社,1999.
Wang H.Experimental specification of grape and wine [M].Xi’an:Xi’an Cartographic Press,1999.(in Chinese)
[30]翟衡,杜金华,管雪强,等.酿酒葡萄栽培及加工技术 [M].北京:中国农业出版社,2001:199-238.
Zhai H,Du J H,Guan X Q,et al.Wine grape cultivation and processing techniques [M].Beijing:China Agriculture Press,2001:199-238.(in Chinese)
[31]庞志申.花色苷研究概况 [J].北京农业科学,2000,18(5):37-42.
Pang Z S.Anthocyanins research survey [J].Beijing Agricultural Sciences,2000,18(5):37-42.(in Chinese)
[32]吉欣,毛立群,李霞,等.葡萄色素的提取及稳定性研究 [J].化学研究,2004,15(1):48-49,52.
Ji X,Mao L Q,Li X,et al.Study on the extraction of grape pigment from grape wine pomace and stability [J].Chemical Researches,2004,15(1):48-49,52.(in Chinese)
[33]董全,陈宗道. 国内外果蔬渗透脱水的研究进展 [J].广州食品工业科技,2004,20(2):129-132.
Dong Q,Chen Z D.Research progress on the osmotic dehydration of fruits and vegetables at home and abroad [J].Guangzhou Food Science and Technology,2004,20(2):129-132.(in Chinese)
[34]邱伟芬.果蔬渗透脱水的研究进展及应用前景 [J].食品科技,2000(4):31-32,30.
Qiu W F.Research progress in the osmotic dehydration of fruits and vegetables and its applications [J].Food Science and Technology,2000(4):31-32,30.(in Chinese)
[35]Moreno J J,Cerpa-Calderón F,Cohen S D,et al.Effect of postharvest dehydration on the composition of pinot noir grapes (VitisviniferaL.) and wine [J].Food Chemistry,2008(109):755-762.
Effects of different factors on physicochemical properties and the content of anthocyanin in the skin of Cabernet Sauvignon
QIAO Ling-ling1,MA Xue-lei2,ZHANG Ang3,LÜ Xiao-tong1,WANG Kai1,WANG Qin4,FANG Yu-lin1,5
(1CollegeofEnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2CollegeofFoodScienceandPharmaceuticalScience,XinjiangAgriculturalUniversity,Urumqi,Xinjiang830052,China;3QinhuangdaoEntry-ExitInspectionandQuarantineBureau,Qinhuangdao,Hebei066004,China;4XinjiangResearchInstituteofForestryScience,Urumqi,Xinjiang830063,China;5ShaanxiEngineeringResearchCenterforViti-Viniculture,Yangling,Shaanxi712100,China)
Abstract:【Objective】 This study explored the effects of different factors on physicochemical properties and anthocyanin extraction of grape berry to provide basis for improving the quality of grape raw materials and anthocyanin extraction in winemaking process. 【Method】 Cabernet Sauvignon was selected to investigate the effects of temperature (20,30,and 40 ℃),pH (2.2,3.0,4.0,5.0,6.0,7.0,and 8.0),and dehydration (dehydration time 0.5,1,1.5,2,3,4,6,9,and 12 h) on physicochemical properties (soluble solids,total acid content and pH) and anthocyanin extraction (extractable anthocyanins,un-extractable anthocyanins,and total anthocyanins) by comparison with untreated grape fruit.【Result】 (1) Compared to control,after 20-30 ℃ treatment for 48 hours,the grape soluble solids increased by 4.12 to 6.52 °Brix,total acid decreased by 0.81 to 1.86 g/L,and pH increased by 0.22 to 0.68 unit. After 36 h,the amount of anthocyanins from peel was higher than the control.(2) Dehydration improved ratio of soluble solids by 14.5%,increased total acid by 2.76%,decreased pH by 3.64%,and reduced contents of extractable anthocyanins,un-extractable anthocyanins and total anthocyanins by 7.4%,2.45%,and 8.47%,respectively.(3) With the increase of pH of the buffer,soluble solids offered up grade firstly than descending latter tendency,different pH treatment has little impact on the pH of grape and total acid.But pH 2.2 to 4.0 treatments increased anthocyanins and total anthocyanins in the skin.When pH was 5.0-8.0,extractable anthocyanins,un-extractable anthocyanins and total anthocyanins all decreased. 【Conclusion】 Treatment at 20-30 ℃ for 36 h improved physicochemical properties and extraction of anthocyanin from grape berry.Appropriate acidic solution was conducive to the extraction of anthocyanins.
Key words:Cabernet Sauvignon; physicochemical properties;extraction of anthocyanin;temperature;pH;dehydration
DOI:网络出版时间:2016-01-0810:2210.13207/j.cnki.jnwafu.2016.02.018
[收稿日期]2014-06-01
[基金项目]农业部“948”项目“葡萄新品种及轻简化生产技术引进”(2014-Z20);国家现代农业(葡萄)产业技术体系建设专项(nycytx-30-2p-04)
[作者简介]乔玲玲(1986-),女,河南郑州人,硕士,主要从事葡萄学研究。E-mail:qiaolinger1987@163.com[通信作者]房玉林(1973-),男,河南兰考人,教授,博士,博士生导师,主要从事葡萄学研究。E-mail:fangyulin@nwsuaf.edu.cn
[中图分类号]S663.1
[文献标志码]A
[文章编号]1671-9387(2016)02-0129-08
