介质pH及离子强度对纳米SiO2颗粒分散度的影响机制初探
2016-06-15郑立飞李忠宏李荣华张增强杨亚提
秦 睿,郑立飞,王 力,李忠宏,李荣华,张增强,杨亚提
(西北农林科技大学 a 资源环境学院,b 理学院,c 食品科学与工程学院,陕西 杨凌 712100)
介质pH及离子强度对纳米SiO2颗粒分散度的影响机制初探
秦睿a,郑立飞b,王力a,李忠宏c,李荣华a,张增强a,杨亚提b
(西北农林科技大学 a 资源环境学院,b 理学院,c 食品科学与工程学院,陕西 杨凌 712100)
[摘要]【目的】 分析介质pH及离子强度对纳米SiO2(nSiO2)颗粒分散度的影响。【方法】 采用分散试验分析了不同介质pH和NaNO3浓度对10 nm nSiO2颗粒分散度的影响,并通过多组分表面电荷调控模型理论及泊松-玻尔兹曼方程对影响机制进行了初步探讨。【结果】 nSiO2颗粒分散度随着NaNO3浓度的增加而降低,但随着介质pH的升高而增加,并在pH 7.39以后逐渐趋于稳定;随着介质pH的增大,nSiO2颗粒的表面电荷密度(σ)增加,但增加介质的离子强度及nSiO2颗粒的粒径会逐渐降低σ。nSiO2颗粒粒径的变化会导致其表面H+的分布发生改变,从而引起σ的变化。双电层结构的拟合结果表明,当双电层结构厚度与粒径比值(λD/Dp)<0.2时,nSiO2颗粒的σ主要受控于粒径大小,可忽略离子强度和pH的影响;当λD/Dp>0.2时,nSiO2颗粒的σ不仅受控于粒径大小,还与介质的离子强度和pH密切相关。【结论】 nSiO2颗粒的σ与粒径大小、介质的pH和离子强度密切相关。
[关键词]离子强度;纳米SiO2颗粒;分散度;双电层结构
纳米材料是指在三维空间中至少有一维处于纳米尺度范围(1~100 nm)或由其作为基本单元构成的材料。近年来,随着纳米科技的发展,纳米材料颗粒由于具有极高的分散度和独特的表面特性,在DNA分析及测序[1]、蛋白转运[2]、药物传输[3]、环境监测[4]、新型传感原件制备[5]等方面受到了广泛关注。一般认为,固体颗粒的表面特性与其所处的介质环境密切相关。这是因为在液相环境中,固体颗粒物的表面会发生质子化/失质子化过程,这一过程将导致固体颗粒物表面的电荷分布发生变化[6]。如有研究表明,纳米颗粒在环境介质中的迁移受颗粒表面的电荷密度控制[7-9];也有研究表明,纳米颗粒的表面电荷密度与颗粒大小无关,仅与颗粒的化学组成有关[10-12]。然而也有学者指出,纳米颗粒物的表面电荷密度不但受控于颗粒本身的化学组成,而且与介质的pH和化学组成有关[13-15]。由此可见,目前有关液相环境中纳米颗粒表面电荷特性的影响因素仍存在不同的认识。研究液相环境中纳米颗粒表面电荷特性的影响因素,对了解纳米颗粒物在自然环境多孔介质中的迁移和界面过程至关重要。本研究选择在色谱、催化剂、药物传输、污染物吸附、生物材料、化妆品等领域应用较为广泛的纳米二氧化硅(nSiO2)颗粒为材料,通过分散试验和理论计算的方法探讨介质pH及离子强度对nSiO2颗粒分散度的影响机制,以期明确介质pH及离子强度对纳米颗粒表面电荷特性及分散度的影响,从而为深入了解纳米颗粒物在自然环境多孔介质中的迁移和界面过程提供参考。
1材料与方法
1.1材料
1.1.1主要试剂HNO3、NaOH、NaNO3、nSiO2颗粒,均为分析纯试剂,购自Sigma-Aldrich公司。试验用水为去离子水。
1.1.2主要仪器Orion 868酸度计(美国奥立龙),Phenomenex H-9500透射电子显微镜(美国菲罗门),岛津U-2600型紫外可见分光光度计 (日本岛津)。
1.2方法
1.2.1nSiO2表面结构的透射电镜观察用Phenomenex H-9500透射电子显微镜(TEM)观察nSiO2的表面结构。
1.2.2介质pH和离子强度对nSiO2分散度的影响分别将一定量粒径10 nm的nSiO2颗粒加入一定体积的去离子水中,保持悬液中nSiO2颗粒的质量浓度为3.5 g/L,超声波振荡1 h后于波长450 nm处用分光光度法测定nSiO2悬液的吸光度(计作A0)。用0.100 mol/L的HNO3或0.010 0 mol/L的NaOH调节nSiO2悬液pH分别为2.98,3.49,4.03,4.47,5.01,5.20,5.89,6.50,7.01,7.47,8.02和8.52;用1 mol/L 的NaNO3溶液调节nSiO2悬液的离子强度,使NaNO3的浓度分别为0,1,5,10,20,50,80,100 mmol/L;静置4 h后于450 nm处测定不同pH和离子强度nSiO2悬液上清液中nSiO2颗粒的吸光度(计作A)。计算分散度:分散度=A/A0。所有试验重复2次,取平均值绘图。

电解质液相环境中物质的传输受控于泊松-玻尔兹曼方程:
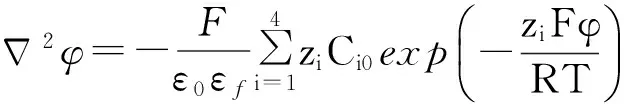
(1)
式中:φ为液相中的电势,V;F为法拉第常数,取964 60 C/mol;zi为第i种离子的电荷数;Ci0为第i种离子的浓度,mol/L;R为气体常数,取8.31 J/(K·mol);T为温度,取300 K;ε0和εf分别为真空介电常数和溶液介电常数,ε0εf=7.08×10-10F/m。当距离r→∞时,电势φ=0,nSiO2颗粒的表面电荷密度边界条件为-ε0εfn=σ。

图 1 nSiO2颗粒的双电层结构示意图

C10=10(-pH+3)且C40=10-(14-pH)+3。
(2)
pH≤7时:C20=CNaNO3且C30=CNaNO3+C10-C40。
(3)
pH>7时:C20=CNaNO3+C10-C40且C30=CNaNO3。
(4)
式中:CNaNO3表示NaNO3浓度。
由于处于溶液中的nSiO2颗粒表面官能团的质子化作用,使得nSiO2颗粒表面电荷分布状况可以用多组分表面电荷调控模型描述。nSiO2颗粒表面官能团的质子化过程可用式(5)及式(6)描述,其平衡常数Ka和Kb可以用式(7)和式(8)表示。
SiOH→SiO-+H+,
(5)
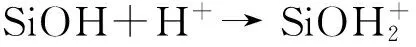
(6)
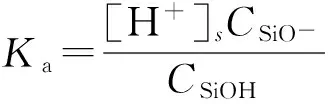
(7)
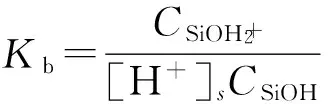
(8)

忽略相邻的nSiO2颗粒之间的斯特恩层(Stern layer)的作用,nSiO2颗粒固液界面上的硅羟基官能团总量CT为:

(9)
由式(7)~(9)可以计算出nSiO2颗粒的表面电荷密度(σ):
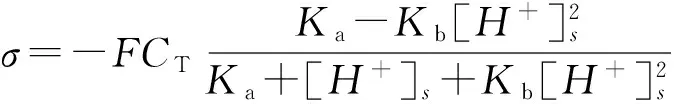
(10)
研究中,按照Yeh等[16]的方法,以玻璃片(FS)的表面电荷密度(σFS)为基准,对nSiO2颗粒的σ进行归一化处理,计算σ/σFS,并假定nSiO2颗粒的粒径分别为10,50和100 nm,采用多物理场耦合分析软件COMSOL 的有限元程序包进行数据拟合分析。计算EDL的厚度λD时,参考Barisik等[17]的方法,取d=Dp+ 60λD为双电层的边界,其中Dp为nSiO2颗粒粒径,CT= 8点/nm2,Ka=10-7.6,Kb=10-1.9,则λD可用式(11)计算:
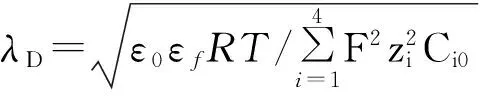
(11)
2结果与分析
2.1nSiO2颗粒的透射电子显微镜观察
采用透射电子显微镜对nSiO2颗粒的形态进行观察,结果(图2)表明,nSiO2颗粒的粒径约为10 nm,均匀度较高,分散度较好。

图 2 nSiO2颗粒的透射电镜观察结果
2.2介质pH和离子强度(NaNO3浓度)对nSiO2颗粒分散度的影响
pH和NaNO3对nSiO2颗粒分散度的影响如图3所示。由图3-a可知,随着pH的升高,nSiO2颗粒分散度增加,并在pH大于7.39时趋于稳定;nSiO2颗粒分散度随着NaNO3浓度的增加而降低,当NaNO3浓度低于5 mmol/L时分散度变化不大,但之后随着NaNO3浓度的增加,nSiO2颗粒分散度迅速降低(图3-b)。这与图4和图5的观察结果一致。
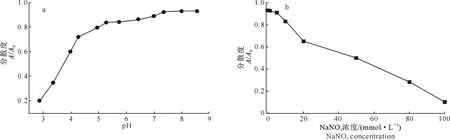
图 3 介质pH(a)和离子强度(NaNO3浓度)(b)对nSiO2颗粒分散度的影响

图 4 分散试验4 h前(A)和4 h后(B) pH对nSiO2颗粒分散度的影响

图 5 分散试验4 h前(C)和4 h后 (D) NaNO3对nSiO2颗粒分散度的影响
2.3介质pH对nSiO2颗粒σ的影响
环境介质中nSiO2颗粒的分散度与其自身所带电荷的特性密切相关,由于nSiO2颗粒本身带有负电荷,因此其所带负电荷的σ也与介质环境有关。由图3-a可知,随着pH的升高,nSiO2颗粒的分散度也逐渐增加并趋于稳定。图4-A的试验结果从事实上也证明了这一研究结果,同时也从侧面反映了介质pH可能会对nSiO2颗粒的σ产生影响。为深入分析pH对nSiO2σ的影响,本研究根据多组分表面电荷调控模型理论及泊松-玻尔兹曼方程,对nSiO2的σ和σ/σFS在1和 100 mmol/L NaNO3溶液中随介质pH的变化进行了理论分析,结果如图6-a和图6-b所示。由图6-a可见,nSiO2和玻璃片的σ随体系pH的变化趋势较为类似,即随着体系pH 的升高负电性逐渐增加。这一变化规律与Yeh等[16]研究纳米流体和Behrens等[14]研究乳胶微粒σ与介质pH关系时获得的结果相类似。这可能是由于随着H+浓度的减小,体系pH升高,更多的负电性SiO-从SiOH官能团中解离出来,导致nSiO2颗粒表面带负电性的σ增加。另外,比较图6-a中不同粒径nSiO2颗粒可见,同一pH和离子强度下,nSiO2颗粒的σ随粒径的增大而减小,说明nSiO2颗粒的σ也与nSiO2颗粒粒径大小密切相关[13,18]。
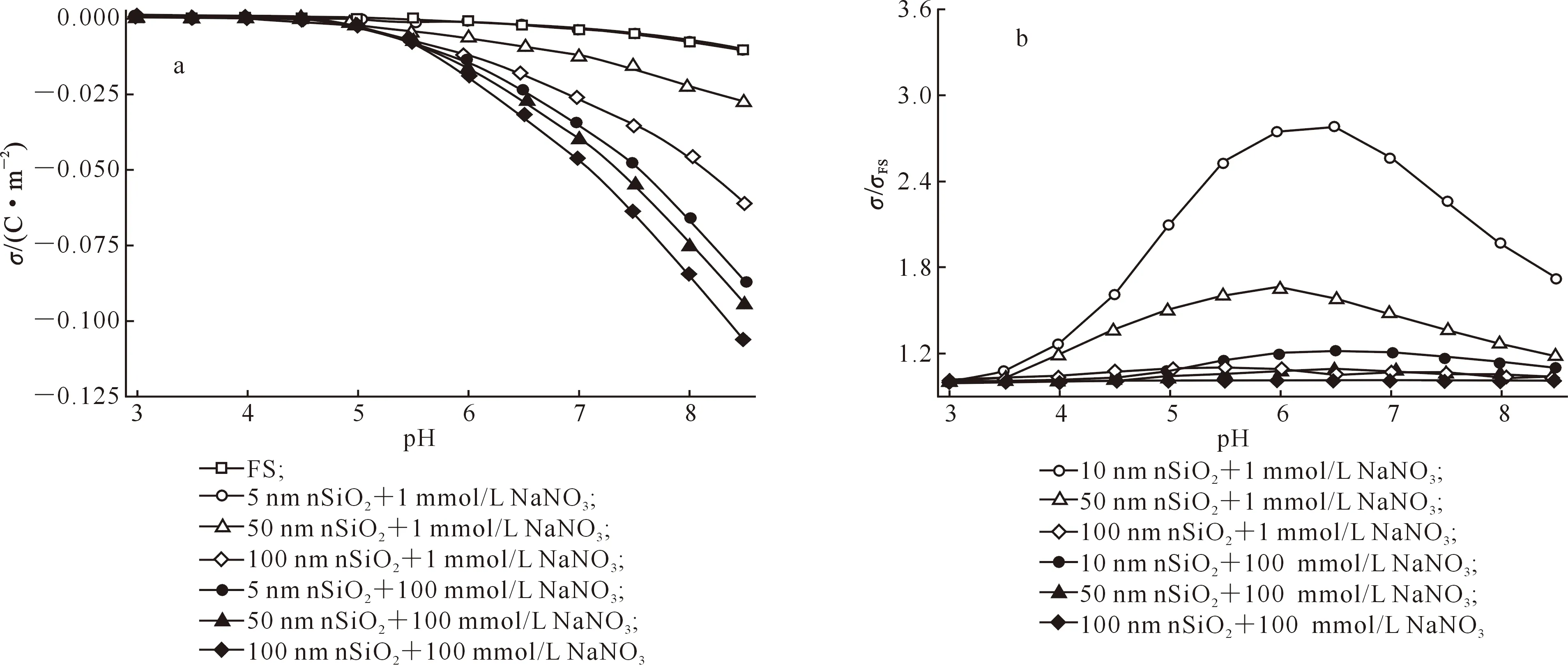
图 61和 100 mmol/L NaNO3溶液中pH对nSiO2的σ(a)及σ/σFS(b)的影响
Fig.6Surface charge density (a) and normalized surface charge density (b) of nSiO2of different
sizes as a function of pH in 1 and 100 mmol/L NaNO3solutions
图6-b表明,在离子强度和pH共同作用下,nSiO2的σ/σFS随粒径的变化存在临界值。在1 mmol/L NaNO3体系下,nSiO2颗粒临界粒径为100 nm;在100 mmol/L NaNO3体系下,nSiO2颗粒临界粒径为10 nm,这与Barisik等[14]的研究结果类似。当pH和离子强度相同时,σ/σFS随着nSiO2颗粒粒径的增加逐渐减小,且nSiO2颗粒的粒径大于100 nm后σ/σFS接近于1.0,说明在同样的pH和离子强度条件下,nSiO2颗粒的粒径将是影响其表面电荷分布的主要因素。当nSiO2颗粒的粒径小于100 nm时,σ/σFS随着体系pH的增大而增加,于pH达一定值时最高,之后逐渐降低,其中10 nm nSiO2的临界pH约为6.5,50 nm nSiO2的临界pH约为6.0。另外,随着nSiO2粒径的增加σ/σFS逐渐趋近于1.0,说明nSiO2颗粒比表面积减小,与介质接触的SiOH官能团解离负电性SiO-的几率减小,nSiO2颗粒表面负电荷的σ减小,分散度减小。
2.4介质离子强度对nSiO2颗粒σ的影响
为了分析介质离子强度对σ的影响,本研究对体系pH在6.0条件下,粒径分别为10,50和100 nm nSiO2颗粒的[H+]s和[Na+]s浓度进行了拟合计算,结果见图7。
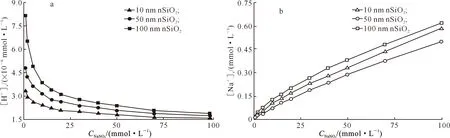
图 7 pH 6.0时NaNO3对不同粒径nSiO2 [H+]s (a)和[Na+]s (b)的影响
由图7可知,在同一pH条件下,随着离子强度的增大,[Na+]s浓度增大,[H+]s浓度减小。在同一pH和离子强度条件下,[H+]s和[Na+]s浓度随着nSiO2颗粒粒径的增大而增大;当离子强度很小时,[H+]s浓度的变化与nSiO2颗粒粒径密切相关(图7-a)。这与前人的研究结果[13-15]一致。
由图8可以看出,在NaNO3浓度为1~100 mmol/L范围内,nSiO2颗粒表面的[H+]s/[H+]FS和[Na+]s/[Na+]FS均基本在粒径Dp大于 100 nm以后接近于1.0。这是由于介质中的NaNO3会影响SiO-从SiOH官能团中的解离过程,从而通过Na+与H+的竞争过程对nSiO2颗粒的表面电荷分布产生了影响。
图 8不同离子强度和nSiO2颗粒Dp与[H+]s/[H+]FS(a)和[Na+]s/[Na+]FS(b)的关系
Fig.8[H+]s/[H+]FS(a) and [Na+]s/[Na+]FS(b)as a function of
nSiO2particlesDpin various NaNO3concentrations at pH 6.0
既然介质pH和NaNO3浓度会影响SiO-从SiOH官能团中的解离过程,则必然会影响nSiO2颗粒的双电层结构厚度(λD)。本试验进一步研究了不同介质pH和离子强度下,nSiO2颗粒的σ/σFS随双电层结构厚度与粒径比值λD/Dp的变化状况,结果见图9。

图9 不同离子强度和pH下σ/σFS与λD/Dp的关系
由图9可知,当λD/Dp<0.2时,σ/σFS趋近于1.0;当λD/Dp> 0.2时,σ/σFS随着λD/Dp的增大而增大。同时可知,当λD/Dp< 0.2时,nSiO2颗粒的表面电荷密度主要受控于粒径大小,可忽略离子强度和pH的影响;当λD/Dp> 0.2时,nSiO2颗粒的表面电荷密度不仅受控于粒径大小,还与介质的离子强度和pH密切相关。这说明nSiO2在环境介质中迁移受其颗粒分散度的限制,而分散度又受控于σ,σ不但受控于纳米颗粒本身的化学组成,而且与介质的pH和化学组成有关。
3结论
1)nSiO2颗粒的分散度与其粒径大小、介质pH和离子强度密切相关。nSiO2颗粒的分散度随着介质pH的升高迅速增加并逐渐趋于稳定,并随着NaNO3浓度的增加而逐渐降低。这是由于介质pH、离子强度及nSiO2颗粒的粒径等因素的变化,会引起nSiO2颗粒表面电荷密度发生变化所致。
2)双电层结构的拟合结果表明,当λD/Dp<0.2时,nSiO2颗粒的表面电荷密度主要受控于粒径大小,可忽略离子强度和pH的影响;当λD/Dp>0.2时,nSiO2颗粒的表面电荷密度不仅受控于粒径大小,还与介质的离子强度和pH密切相关。
[参考文献]
[1]Min S K,Kim W Y,Cho Y,et al,Fast DNA sequencing with a graphene-based nanochannel device [J].Nature Nanotechnology,2011,6:162-165.
[2]Bhattacharyya D,Singh S,Satnalika N,et al.Nanotechnology,big things from a tiny world:A review [J].International Journal of u-and e-Service,Science and Technology,2009,2(3):29-37.
[3]Liao L,Liu J,Dreaden E C,et al.A convergent synthetic platform for single-nanoparticle combination cancer therapy:ratiometric loading and controlled release of Cisplatin,Doxorubicin,and Camptothecin [J].Journal of American Chemistry Society,2014,136(16):5896-5899.
[4]张萌,杨亚提,秦睿,等.二胺基改性有序多孔SBA-15对溶液中Cd2+离子的吸附研究 [J].环境科学,2013,34(7):181-189.
Zhang M,Yang Y T,Qin R,et al.Adsorption of Cd2+ions in aqueous by diamine-modifed ordered mesoporous SBA-15 particles [J].Enviroenmtal Science,2013,34(7):181-189.(in Chinese)
[5]Kida T,Nishiyama A,Hua Z,et al.WO3nanolamella gas sensor:porosity control using SnO2nanoparticles for enhanced NO2sensing [J].Langmuir,2014,30(9):2571-2579.
[6]Hunter R J.Zeta potential in colloid science:properties and applications [M].London:Academic Press London,1981.
[7]Actis P,Vilozny B,Seger R A,et al.Voltage-controlled metal binding on polyelectrolyte-functionalized nanopores [J].Langmuir,2011,27(10):6528-6533.
[8]Ai Y,Zhang M,Joo S W,et al.Effects of electroosmotic flow on ionic current rectification in conical nanopores [J].The Journal of Physical Chemistry C,2010,114(9):3883-3890.
[9]Ali M,Yameen B,Cervera J,et al.Layer-by-layer assembly of polyelectrolytes into ionic current rectifying solid-state nanopores:insights from theory and experiment [J].Journal of American Chemistry Society,2010,132(24):8338-8348.
[10]Kreuter J.Influence of the surface properties on nanoparticlemediated transport of drugs to the brain [J].Journal of Nanoscience and Nanotechnology,2004,4(5):484-488.
[11]Verma A,Stellacci F.Effect of surface properties on nanoparticle-cell interactions [J].Small,2010,6(1):12-21.
[12]Lu Y,Yin Y,Mayers B T,et al.Modifying the surface properties of superparamagnetic iron oxide nanoparticles through a sol-gel approach [J].Nano Letter,2002,2(3):183-186.
[13]Kobayashi M,Juillerat F,Galletto P,et al.Aggregation and charging of colloidal silica particles:Effect of particle size [J].Langmuir,2005,21(13):5761-5769.
[14]Behrens S H,Christl D I,Emmerzael R,et al.Charging and aggregation properties of carboxyl latex particles:Experiments versus DLVO theory [J].Langmuir,2000,16(6):2566-2575.
[15]Gunnarsson M,Abbas Z,Ahlberg E,et al.Corrected Debye-Huückel analysis of surface complexation:Ⅲ.Spherical particle charging including ion condensation [J].Journal of Colloid Interface Science,2004,274(2):563-578.
[16]Yeh L H,Xue S,Joo S W,et al.Field effect control of surface charge property and electroosmotic flow in nanofluidics [J].The Journal of Physical Chemistry C,2012,116(6):4209-4216.
[17]Barisik M,Atalay S,Beskok A,et al.Size dependent surface charge properties of silica nanoparticles [J].The Journal of Physical Chemistry C,2014,118(4):1836-1842.
[18]Abbas Z,Labbez C,Nordholm S,et al.Size dependent surface charging of nanoparticles [J].The Journal of Physical Chemistry C,2008,112(4):5715-5723.
Effects of aqueous pH and ion strength on dispersity of nano-SiO2particles
QIN Ruia,ZHENG Li-feib,WANG Lia,LI Zhong-hongc,LI Rong-huaa,ZHANG Zeng-qianga,YANG Ya-tib
(aCollegeofNaturalResourcesandEnvironment,bCollegeofScience,cCollegeofFoodScienceandEngineering,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 This study aimed to investigate the effects of aqueous pH and ion strength on dispersity of nano-SiO2 particles.【Method】 The effects of aqueous pH and ion strength on dispersity of nano-SiO2 with diameter of 10 nm were tested through batch experiments,and the mechanism was proved through multi-ion surface charge-regulation model and Poisson-boltzmann equation analysis.【Result】 Dispersity of SiO2 particles increased with the increase of pH and gradually reached balance after pH 7.39,while it decreased with the increase of NaNO3 concentration and nSiO2 particle size.The further electrical double layer analysis proved that the surface charge density of nano-SiO2 particles increased with the increase of pH,while it decreased with increasing ionic strength and particle size.Variation of the surface charge with the particle size was attributed to the change in the surface concentration of H+ ions.Particle diameter normalized with the EDL thickness was used to combine the effects of pH and salt concentration.For λD/Dp<0.2,the effect of particle size on its surface charge density was the main factor,while the pH and salt concentration could be neglected.However,for λD/Dp>0.2,the surface charge density of silica nanoparticle was not only determined by particle size but also affected by aqueous pH and ion strength.【Conclusion】 The dispersity of SiO2 nanoparticles was affected by surface charge density which was controlled by particle size as well as media pH and salt concentration.
Key words:ion strengthen;nano-SiO2;dispersity;electrical double layer
DOI:网络出版时间:2016-02-0209:3710.13207/j.cnki.jnwafu.2016.03.013
[收稿日期]2014-07-28
[基金项目]国家自然科学基金项目(41101288,31371813)
[作者简介]秦睿(1989-),女,山西临汾人,硕士,主要从事纳米材料环境过程研究。E-mail:qinrui@nwsuaf.edu.cn[通信作者]李荣华(1977-),男,陕西洛南人,副教授,主要从事污染环境修复治理研究。E-mail:rh.lee@nwsuaf.edu.cn
[中图分类号]X703;X712
[文献标志码]A
[文章编号]1671-9387(2016)03-0089-07
