运输对养殖黄颡鱼血液生化和肌肉物性分析指标的影响
2016-06-14马玲巧李大鹏亓成龙何绪刚
田 兴,马玲巧,李大鹏,亓成龙,何绪刚,汤 蓉
(华中农业大学水产学院/池塘健康养殖湖北省工程实验室/淡水水产健康养殖湖北省协同创新中心/农业部淡水生物繁育重点实验室,武汉 430070)
运输对养殖黄颡鱼血液生化和肌肉物性分析指标的影响
田兴,马玲巧,李大鹏,亓成龙,何绪刚,汤蓉
(华中农业大学水产学院/池塘健康养殖湖北省工程实验室/淡水水产健康养殖湖北省协同创新中心/农业部淡水生物繁育重点实验室,武汉430070)
摘要:测定了在10.4~11.2 ℃下运输4 h后不同时间(0 h、1 h、3 h、6 h、12 h、1 d、3 d、7 d和20 d)养殖黄颡鱼(Pelteobagrus fulvidraco)血液生理生化指标和肌肉物性分析指标的变化。结果显示,运输引起了黄颡鱼血清皮质醇和血糖浓度的显著升高(P<0.05),在运输结束12 h后恢复到正常水平。运输后鱼体血清超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和总抗氧化能力(T-AOC)均有显著性升高,随着恢复时间的推移逐渐回降到正常水平;但过氧化物酶(POD)活性并未出现显著性差异,维持稳定的水平。运输后肌肉硬度、弹性、胶黏性、凝聚性、咀嚼性、回复性等物性分析指标均显著性降低。除了凝聚性和咀嚼性之外,其他肌肉物性分析指标在运输结束72 h后恢复到正常水平。研究表明,长途运输造成了养殖黄颡鱼的应激反应,对肌肉物性特征产生了显著的影响,但运输后的恢复可使鱼体抗氧化能力和肌肉物性分析指标回复到正常水平。
关键词:黄颡鱼(Pelteobagrus fulvidraco);运输应激;抗氧化酶;肌肉品质
黄颡鱼隶属鲶形目(Siluriformes)鲿科(Bagridae)黄颡鱼属,其含肉率较高[1-3],肉质细嫩,味道鲜美,无肌间刺,具有较高的营养价值,是我国重要的小型经济鱼类,深受养殖户和消费者的喜爱。以黄颡鱼为主的高密度人工精养模式在我国很多地区得到普及推广。随着国民生活水平的提高,水产品从养殖场到餐桌过程中的营养价值损失情况受到更多的关注。运输是养殖鱼类从养殖场所到餐桌过程中的重要环节。运输容易造成养殖鱼类受到应激[4],并使鱼体产生一系列生理生化反应的变化[5-8]。鱼类运输过程中的氨氮胁迫、低氧胁迫、剧烈振荡等不利因素刺激均会激活神经内分泌系统的级联反应[9-12],导致鱼体功能和代谢的改变[13]。运输应激还可对黄颡鱼的免疫系统造成了不可恢复的影响[14]。运输应激在改变动物机体生理状态的同时,也影响着养殖动物的肌肉品质。宰前运输改变了猪的血液生理生化环境及其肌肉品质[15];不同强度的运输应激也使得肉仔鸡的肌肉品质下降[16]。运输应激对养殖鱼类肌肉品质影响目前还未见报道。因此,笔者进行了黄颡鱼的长途运输,分析运输过后其肌肉物性分析指标和血液生化指标的变化,以此来确定运输对养殖黄颡鱼生理机能和肌肉品质的影响。
1材料与方法
1.1实验鱼
本实验于2013年12月16日进行。实验用的黄颡鱼养殖在湖北省荆州市公安县崇湖渔场的国家大宗淡水鱼类产业技术体系华中区养殖岗位的野外试验基地的精养池塘中,为2龄鱼,体质量为(93.31±34.15) g,体长为(17.57±2.45) cm。
1.2活鱼运输与样本采集
运输前15 d,将黄颡鱼捕捞起后暂养在池塘的网箱中。运输当天准备6个30 L运输专用尼龙袋,装入10 L池塘水。运输前水温为10.4 ℃、溶解氧为5.3 mg/L,每个运输袋中加2个1 L的冰袋。从同一个网箱中随机选取20尾放入每个运输袋中,充氧后扎口打包。将充好氧气的运输袋整齐严实的摆放在汽车后备箱中。运输车15:00出发,历时4 h运输至华中农业大学水产学院的室内循环水养殖系统内。运输结束时,运输袋中平均水温为11.2 ℃,溶解氧为5.2 mg/L。取16 L循环水养殖系统的水放进100 cm×80 cm×20 cm的塑料箱,将所有袋子的鱼倒入塑料箱中,鱼体正常,无死亡现象。从塑料箱中随机选取5尾鱼进行麻醉(150 mg MS-222 /L),待其完全麻醉后进行采样作为运输结束0 h的样本。将剩下的鱼随机平均放入循环水养殖系统的8个养殖缸中(直径80 cm,水深40 cm,平均水温12.3 ℃,溶解氧5.0 mg/L),分别在运输结束后1 h、3 h、6 h、12 h、1 d、3 d、7 d和20 d进行采样,每个时间点采集5尾鱼。将运输后20 d的数据作为完全恢复到正常生理状态的正常对照组。
鱼体采样时,首先使用MS-222(150 mg/L)完全麻醉黄颡鱼,然后测定体长、体重,再用2 mL注射器于尾柄中部侧线下方采血,置于无抗凝剂的采血管中,静置1 h后3 000g离心30 min制备血清,用于血液生理生化指标测定。取鱼背部侧线以上的白肌,切成3块立方体形状的肌肉(长×宽×高为1 cm×1 cm×0.5 cm)用于测定肌肉物性分析指标。
1.3血清生化指标测定
皮质醇含量使用皮质醇放射性免疫试剂盒(北京北方生物技术有限公司生产)通过γ放射免疫计数器(GC-911型,科大创新股份有限公司)进行测定。血糖、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化物酶(POD)和总抗氧化能力(T-AOC)分别使用相应的检测试剂盒(南京建成生物工程研究所有限公司)进行测定,具体测定方法按照试剂盒的说明进行,在Infinite M200酶标仪中测定吸光值,换算成相应浓度或酶活力值。
1.4肌肉物性分析的测定
参照Bourne[17]定义的方法,测定硬度、弹性、凝聚力、胶黏度、咀嚼性、回复性等参数。在室温下,取切好的白肌组织块,用TA.XT.plus型物性测试仪(英国Stable Micro Systems公司)的平底柱形探头P/35R,模拟人牙齿咀嚼食物,对其进行2次压缩质地多面剖析法(Texture Profile Analysis,TPA)测试。测试条件:测试前速率3 mm/s,测试速率2 mm/s,测试后速率2 mm/s,压缩程度为65%,停留间隔时间为5 s,负重探头类型为Auto-5g,数据收集率为200 pps。每尾鱼取3个平行肌肉样品进行检测,每个检测指标均进行5次平行测试。
1.5数据分析
实验结果用平均数±标准差(X±SD)表示,用SPSS Statistics 21.0统计分析软件对数据进行处理分析,采用单因素方差分析,P<0.05为显著性差异。
2结果与分析
2.1运输后黄颡鱼血糖和皮质醇水平
运输后,黄颡鱼的血糖和皮质醇含量有显著性变化(P<0.05,图1)。黄颡鱼血糖含量逐渐升高,并在运输过后1 h达到高峰(10.83 mmol/L),直到12 h过后恢复到对照水平。血清皮质醇水平在运输后显著升高,12 h后降低到对照水平。

图1 运输后黄颡鱼血糖和血清皮质醇含量的变化。
2.2运输后黄颡鱼抗氧化酶活性和总抗氧化能力
运输过后,血清抗氧化指标变化趋势如图2。POD活性没有显著性变化,只是在1 d到3 d时呈较低水平;SOD活性显著性升高,在3 h左右就恢复到对照水平;血清GSH-PX活性显著性升高,运输过后1 h左右达到最高值,之后逐渐降低,到12 h左右恢复到对照水平。运输后,血清T-AOC显著性升高,1 h过后逐渐回降,24 h后恢复到对照水平。
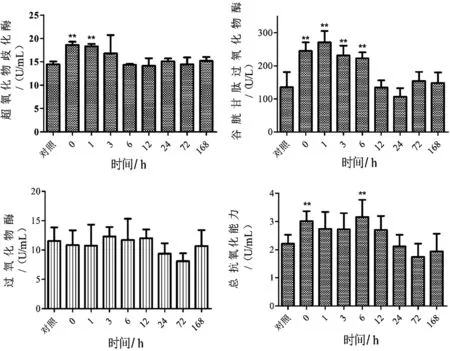
图2 运输后黄颡鱼血清中抗氧化酶活性和总抗氧化能力的变化。
2.3运输后黄颡鱼肌肉物性分析
运输后黄颡鱼肌肉的物性分析指标呈显著性变化(表1)。与对照组相比,经过运输后,肌肉的硬度、弹性、胶黏性、凝聚性、咀嚼性和回复性均显著性降低。经过72 h的恢复,各项指标均有显著回升。硬度、弹性、胶黏性和回复性恢复到对照水平,而凝聚性和咀嚼性显著高于对照水平。

表1 运输后黄颡鱼肌肉物性分析指标变化
注:同一列中参数上方标有不同字母表示有显著性差异(P<0.05).
3讨论
在水产养殖中,通过对鱼类生理指标的监测来衡量其应激水平,是追踪鱼群是否处于健康状态的有效方法[8]。通过各个指标的高低变化来指示试验鱼受应激水平,不同程度应激水平反应出不同的生理状态。运输后,黄颡鱼血清皮质醇水平立即升高,在6~12 h回降到基础水平。与此同时,血糖浓度也显著性升高,但并未立即达到最高,而是相对延迟了1 h左右,并在24 h左右回降到基础浓度。这印证了各学者对急性应激的观点,即皮质醇升高是初级应激反应的标志,血糖浓度升高则表示应激反应的持续[18]。与Aragao等[19]研究塞内加尔鳎(Soleasenegalensis)、Waring等[20]研究大菱鲆(Scophthalmusmaximus)的结论一致。皮质醇作为应激激素,常用于评价鱼类的应激状态。
本研究中,运输4 h过后血清皮质醇水平立即升高,达到对照水平的3倍左右。这表明,长途运输造成了养殖黄颡鱼的应激反应。刘小玲等[14]在实验环境温度为22 ℃时研究黄颡鱼的运输应激也发现,运输造成了皮质醇的显著升高,而且其血清最高浓度(160 ng/mL)高于本实验中检测的血清皮质醇浓度(95.8121 ng/mL)。由于黄颡鱼的最佳生长温度为25~28 ℃[18],而我们的实验环节中水温在10~13 ℃,气温在12~15 ℃,其代谢率较低,所以此次检测到的皮质醇水平较以往研究低。不同鱼类在不同的应激源刺激下,血浆皮质醇水平的变化也存在差异。
就运输应激而言,斑马鱼(Daniorerio)的皮质醇为25~30 ng/mL[18],是运输前的10倍;欧亚河鲈(Percafluviatilis)的皮质醇升高到140 ng/mL左右,是运输前的3倍[22];而大西洋鲑(Salmosalar)却高达500 ng/mL,是运输前的15倍[23]。同时,运输时间[23]、运输鱼的密度[24]和健康状态及运输过程中水质的控制[25-26]均会影响实验鱼血糖和皮质醇等应激指标的数值。
诸如温度变化、环境胁迫等各种应激因素会诱导机体产生·OH、O2-等氧自由基[27,28]。过多的氧自由基会造成机体严重的氧化损伤。机体通过调节抗氧化系统的酶类和非酶类物质的代谢来调节自由基浓度,以此来抵抗体内一定程度的氧化应激[29]。经过4 h的运输后,黄颡鱼血清SOD和GSH-PX的活性以及T-AOC都显著性增强。这说明黄颡鱼机体对抗氧自由基的能力有所提高。应激会造成机体产生过多的氧自由基并引起氧化损伤[30]。而抗氧化酶活性的升高可以消除过多的自由基,减轻氧化应激对机体的损伤。运输结束后初期的抗氧化能力的升高,似乎暗示着运输应激诱导鱼体产生了较多自由基,而抗氧化酶类的活性升高正是对自由基的积累的响应,以对抗氧化应激。随着运输结束后的恢复时间的延长,SOD和GSH-PX的活性逐渐降低。恢复后期的抗氧化能力的恢复,表明鱼体逐渐恢复到正常的“氧化—抗氧化”体系平衡状态。
硬度、弹性、凝聚性、胶黏性、咀嚼性和回复性等质地特性是食品极其重要的品质特性[31]。弹性和硬度是反映鱼类肌肉物性的主要因素[32]。硬度是指被测定物体达到一定变形所需要的力,本次试验中是指黄颡鱼背部肌肉保持形状的内部结合力。一般来说,硬度与物性成正相关。雒莎莎等[33]的研究表明,450 MPa超高压处理后,鳙(Aristichthysnobilis)肉的硬度、胶黏性、咀嚼性显著性提高,改善了鳙的肌肉品质。这说明这些指标与肌肉的品质呈正相关[34]。本试验结果显示,运输过后黄颡鱼背部肌肉的弹性、硬度明显降低,凝聚性、胶黏性、咀嚼性和回复性均有下降,这是由于其他各指标均由硬度或者弹性演变而来[31],降低了黄颡鱼的肌肉物性。运输过程中,应激刺激降低了肌原纤维蛋白凝胶的硬度与弹性等[35],影响了黄颡鱼的肌肉物性。运输后,鱼体经过72 h的恢复,生理机能逐渐恢复正常,所有的物性分析指标均回升到对照水平。但凝聚性和咀嚼性相比对照组有所提高,这可能是由于黄颡鱼恢复过后肌肉细胞间凝聚力、肌肉弹性回升的综合作用。
4结论
长途运输对养殖黄颡鱼产生了一定程度的应激胁迫,并显著降低了鱼体肌肉的硬度、弹性等物性指标,这说明运输对鱼肉品质存在一定的影响。但经过72 h的恢复,鱼体可以从运输应激中恢复过来,肌肉品质和生理机能基本可以复原。
参考文献:
[1]黄峰,严安生,熊传喜,等.黄颡鱼的含肉率及鱼肉营养评价[J].淡水渔业,1999,29(10):3-6.
[2]黄钧,杨淞,覃志彪,等.云斑鮰、泥鳅和瓦氏黄颡鱼的含肉率及营养价值比较研究[J].水生生物学报,2010,34(5):990-997.
[3]马玲巧,李大鹏,田兴,等.1 龄黄颡鱼的肌肉营养成分及品质特性分析[J].水生生物学报, 2015,39(1):193-196.
[4]杜浩,危起伟,甘芳,等.苯唑卡因对美洲鲥运输应激的缓解作用研究[J].中国水产科学,2006,13(5):787-793.
[5]Maximino C,de Brito T M,de Mattos Dias C A G,et al.Scototaxis as anxiety-like behavior in fish[J].Nat Protoc,2010,5(2):209-216.
[6]Davis M W.Fish stress and mortality can be predicted using reflex impairment[J].Fish Fish,2010,11(1):1-11.
[7]Conte F S.Stress and the welfare of cultured fish[J].Appl Anim Behav Sci,2004,86(3):205-223.
[8]Ramsay J M,Feist G W,Varga Z M,et al.Whole-body cortisol response of zebrafish to acute net handling stress[J].Aquaculture,2009,297(1):157-162.
[9]Flik G,Klaren P H M,Van den B H,et al.CRF and stress in fish[J].Gen Comp Endocrinol,2006,146(1):36-44.
[10]Aluru N,Vijayan M M.Stress transcriptomics in fish:a role for genomic cortisol signaling[J].Gen Comp Endocrinol,2009,164(2):142-150.
[11]Pankhurst N W.The endocrinology of stress in fish:an environmental perspective[J].Gen Comp Endocrinol,2011,170(2):265-275.
[12]Peter V S,Peter M C S.The interruption of thyroid and interrenal and the inter-hormonal interference in fish:Does it promote physiologic adaptation or maladaptation? [J].Gen Comp Endocrinol,2011,174(3):249-258.
[13]Tort L.Stress and immune modulation in fish [J].Dev Comp Immunol,2011,35(12):1366-1375.
[14]刘小玲,严安生.池养黄颡鱼运输应激后在实验循环系统中的恢复和适应过程[J].水产学报, 2006,30(4):495-501.
[15]张伟力,王力克.宰前运输对肥育猪胴体、内脏及肉质的影响[J].家畜生态,2001,22(3):20-23.
[16]张林,岳洪源,张海军,等.不同强度的运输应激对肉仔鸡血液应激指标和肌肉品质的影响[J].动物营养学报,2009,21(3):288-293.
[17]Bourne M C.Texture profile analysis[J].Food Technol,1978,32(7):62-66,72.
[18]Dhanasiri A K,Fernandes J M,Kiron V.Acclimation of zebrafish to transport stress[J].Zebrafish,2013,10(1):87-98.
[19]Aragao C,Corte-Real J,Costas B,et al.Stress response and changes in amino acid requirements in Senegalese sole (SoleasenegalensisKaup 1858) [J].Amino Acids,2008,34(1):143-148.
[20]Waring C P,Stagg R M,Poxton M G.Physiological responses to handling in the turbot[J].J Fish Biol,1996,48(2):161-173.
[21]Acerete L,Balasch J C,Espinosa E,et al.Physiological responses in Eurasian perch (Percafluviatilis,L.) subjected to stress by transport and handling[J].Aquaculture,2004,237(1):167-178.
[22]Iversen M,Finstad B,Nilssen K J.Recovery from loading and transport stress in Atlantic salmon (SalmosalarL.) smolts[J].Aquaculture,1998,168(1):387-394.
[23]Gomes L C,Roubach R,Araujo‐Lima C A R M,et al.Effect of fish density during transportation on stress and mortality of juvenile TambaquiColossomamacropomum[J].J World Aquacult Soc,2003,34(1):76-84.
[24]Portz D E,Woodley C M,Cech Jr J J.Stress-associated impacts of short-term holding on fishes[J].Rev Fish Biol Fisher,2006,16(2):125-170.
[25]Oyoo-Okoth E,Cherop L,Ngugi C C,et al.Survival and physiological response ofLabeovictorianus(Pisces:Cyprinidae,Boulenger 1901) juveniles to transport stress under a salinity gradient[J].Aquaculture,2011,319(1):226-231.
[26]Carneiro P C F,Urbinati E C.Salt as a stress response mitigator of matrinxã,Bryconcephalus(Gǖnther),during transport[J].Aquac Res,2001,32(4):297-304.
[27]罗义,纪靓靓,苏燕,等. 2,4-二氯苯酚诱导鲫鱼活性氧(ROS)的产生及其分子致毒机制[J].环境科学学报,2007,27(1):129-134.
[28]李大鹏,刘松岩,谢从新,等.水温对中华鲟血清活性氧含量及抗氧化防御系统的影响[J].水生生物学报,2008,32(3):327-332.
[29]Fang Y Z,Yang S,Wu G.Free radicals,antioxidants,and nutrition[J].Nutrition,2002,18(10):872-879.
[30]Lushchak V I,Bagnyukova T V.Effects of different environmental oxygen levels on free radical processes in fish [J].Comp Biochem Physiol B,2006,144(3):283-289.
[31]郝红涛,赵改名,柳艳霞,等.肉类制品的质构特性及其研究进展[J].食品与机械,2009(3):125-128.
[32]胡芬,李小定,熊善柏,等.5种淡水鱼肉的质构特性及与营养成分的相关性分析[J].食品科学,2011,32(11):69-73.
[33]雒莎莎,童彦,Jahangir M M,等.超高压处理对鳙鱼质构特性的影响[J].中国食品学报, 2012,12(5):182-187.
[34]戴志远,崔雁娜,王宏海.不同冻藏条件下养殖大黄鱼鱼肉质构变化的研究[J].食品与发酵工业,2008,34(8):188-191.
[35]李艳青,孔保华,夏秀芳,等.羟自由基氧化对鲤鱼肌原纤维蛋白乳化性及凝胶性的影响[J].食品科学,2012,33(9):31-35.
(责任编辑:张红林)
Muscular texture characteristics and blood biochemical parameters of cultured yellow catfish (Pelteobagrus fulvidraco) suffering from transport stress
TIAN Xing,MA Ling-qiao,LI Da-peng,QI Cheng-long,HE Xu-gang,TANG Rong
(CollegeofFisheries,HuazhongAgriculturalUniversity/HubeiProvincialEngineeringLaboratoryforPondAquaculture/FreshwaterAquacultureCollaborativeInnovationCenterofHubeiProvince/KeyLaboratoryofFreshwaterAnimalBreeding,MinistryofAgriculture,Wuhan430070,China)
Abstract:In order to determine the effect of transportation on physiological function and flesh quality of cultured yellow catfish, Pelteobagrus fulvidraco,we investigated the blood biochemical parameters and muscular texture profiles of yellow catfish after long-term transportation.This result showed that serum cortisol level and glucose concentration elevated significantly in cultured yellow catfish after 4-hour transportation,suggesting the transport led to fish stress.Serum concentrations of cortisol and glucose recovered to the control levels after 12 h of recovery after transportation.The activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-PX) as well as total antioxidant capacity increased significantly in catfish suffering from transport stress within 6 hours after transportation.However,there was no significant change in peroxidase (POD) activity in catfish after transportation.Transportation also exerted influence on muscular texture characteristics of cultured yellow catfish.Muscular hardness,springiness,cohesiveness,gumminess,chewiness,and resilience decreased significantly in catfish after transportation.All textural parameters recovered to the control level after 72 h of recovery from transportation,except for gumminess and chewiness.It was concluded that 4-hour transportation caused fish stress and elevation of antioxidant capacity,and altered the muscular texture.The deleterious effects of transport stress,on fish physiological function and muscular texture were reversible.Temporary culture after transportation would assist yellow catfish to recover from transport stress.
Key words:Pelteobagrus fulvidraco;transport stress;antioxidative enzyme;flesh quality
收稿日期:2015-05-21;
修订日期:2015-09-11
第一作者简介:田兴(1988-),男,硕士研究生,研究方向为水产健康养殖。E-mail:819569693@qq.com通讯作者:李大鹏。E-mail:ldp@mail.hzau.edu.cn
中图分类号:S981.16
文献标识码:A
文章编号:1000-6907-(2016)03-0087-05
资助项目:“十二五”农村领域国家科技计划课题(2012BAD25B06);中央高校基本科研业务费专项资金资助项目(2014PY041);湖北省自然科学基金重点项目(2012FFA029)
