胃血管球瘤3例临床病理分析
2016-06-14周梦云
周梦云,林 军
(1.上海中医药大学附属龙华医院病理科 201203 ;2.上海市第一人民医院/上海交通大学基础学院 200080)
胃血管球瘤3例临床病理分析
周梦云1,林军2△
(1.上海中医药大学附属龙华医院病理科201203 ;2.上海市第一人民医院/上海交通大学基础学院200080)
[摘要]目的探讨胃血管球瘤的临床病理学特点、诊断、鉴别诊断及预后。方法分析3例手术局部切除胃血管球瘤患者的临床表现、组织学特点及免疫组织化学表型并复习相关文献。结果3例患者中2名男性,1名女性,术前有胃部不适或隐痛症状。肿块位于胃窦部黏膜下层或肌层。镜下表现为小而圆形细胞围绕扩张的血管呈结节状、巢团状排列。免疫组织化学vimentin和SMA均为弥散阳性,h-caldesmon及calponin均为部分阳性。结论胃血管球瘤比较少见,临床容易误诊,免疫组织化学有助于确诊。绝大多数呈良性经过,局部手术完整切除是其最有效的治疗方法。
[关键词]胃;血管球瘤;病理学,临床;免疫组织化学
血管球瘤是由与正常血管球小体中变异的平滑肌细胞非常类似的细胞构成的间叶性肿瘤。全身都可以发生,主要好发于肢体远端[1],而原发于胃的血管球瘤非常少见。本文通过复习3例胃血管球瘤的临床病理特征及免疫组织化学表型,并结合相关文献,旨在提高对胃血管球瘤诊断、鉴别诊断及生物学行为的认识。
1资料与方法
1.1一般资料3例患者均为上海市第一人民医院2009~2013年的手术病例。
1.2方法所有标本均经4%中性甲醛固定、石蜡包埋,HE染色,镜下观察。免疫组织化学采用Envision法。抗体SMA(1∶800)、vimentin(1∶400)、h-caldesmon(1∶100)、calponin(1∶300)、CK(1∶200)、CD34(1∶200)、CD117(1∶100)、MSA(1∶100)、LCA(1∶100)、S100(1∶200)、CgA(1∶200)、NSE(1∶100)和Syn(1∶100)均购自长岛公司。二抗为基因科技(上海)的GTVisionTM抗鼠/兔通用型免疫组织化学检测试剂盒。操作按照说明书进行。
2结果
2.1临床表现病例1,男,60岁,因胃部不适发现胃窦实质性肿块,临床考虑胃肠道间质瘤。病例2,男,60岁,因上腹部不适发现胃窦占位。病例3,女,42岁,上腹部隐痛2周,超声内镜提示胃窦部胃肠道间质瘤。

病例2实体性球瘤,肿瘤细胞小而一致,胞质透明、微嗜酸性,细胞界限清楚。
图1镜检结果(HE×200)

病例3球血管瘤,肿瘤细胞围绕扩张的血管。
图2镜检结果(HE×100)
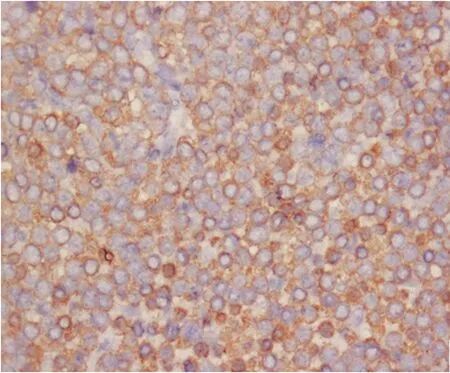
病例2 肿瘤细胞弥散阳性。
图3免疫组织化学检查结果(SMA×200)
2.2巨检3例均为部分胃组织,黏膜无明显异常,病例1和病例3肿块位于黏膜下层,边界清,无明显包膜,病例2位于肌层,边界不清;3例肿瘤大小分别为1.2 cm×1.2 cm×0.6 cm,2.2 cm×2.2 cm×2.3 cm,1.5 cm×1.2 cm×1.0 cm,切面灰白,质地中等。
2.3镜检镜下肿瘤由球细胞、血管及平滑肌组成,呈结节状、巢团状围绕血管排列。结节之间为平滑肌束或纤维组织,部分玻璃样变。肿瘤细胞小,比较一致,圆形,有中位圆形核,胞质透明,淡染或微嗜酸性,见图1。3例患者肿瘤细胞均无异型性,病例2肿瘤组织大部分位于肌层,边界不清。病例3肿瘤内的血管丰富,扩张明显,见图2。

病例2 肿瘤细胞部分阳性。
图4免疫组织化学检查结果(Syn×100)
2.4免疫组织化学3例肿瘤组织vimentin和SMA均为弥散阳性,见图3。h-caldesmon及calponin均为部分阳性。病例2和病例3 Syn为部分阳性,见图4。其余抗体均为阴性。
3讨论
3.1临床特点血管球瘤罕见,占软组织肿瘤的不到2%。近10%患者为多发性病变[2]。好发于肢体远端血管球细胞丰富的部位,最常见于手指的甲床下,少数也可见于皮肤、骨和内脏器官(如胃、食管、结直肠、胰腺、肝、宫颈等部位)[1,3]。血管球瘤几乎位于皮肤或表浅软组织,罕见于深部软组织和内脏。发生于胃的血管球瘤比较少见,发病年龄为19~90岁,多数发生在中老年人,女性多见,常见部位为胃窦。患者多因上腹部不适、隐痛、上消化道出血等症状而就诊[4]。恶性血管球瘤相当罕见,占血管球瘤的不到1%,一般位置比较深,但也可位于皮肤。
3.2诊断肿瘤多数位于胃黏膜下层和肌层,胃镜下通常可见黏膜隆起,黏膜表面无明显异常,有的有糜烂,临床术前多数诊断为胃肠道间质瘤。确诊依赖术后病理形态学及免疫组织化学检测。
光镜下根据球细胞、血管和平滑肌的相对比例,可将血管球瘤主要分为3种亚型:(1)实体性球瘤:此型最常见,约占75%,球细胞巢围绕于毛细血管周围,间质玻璃样变。(2)球血管瘤:此型约占20%,球细胞常成簇聚集于扩张的静脉周围。(3)球血管肌瘤:此型最少见,总体结构与实体性球瘤或球血管瘤类似,但存在典型球细胞和类似于成熟平滑肌的梭形细胞之间的移行。绝大多数血管球瘤细胞无异型,球细胞呈小圆形,大小一致,境界清楚,胞质透明,淡染或微嗜酸性,核圆、居中,染色质细腻,核仁不明显。偶有肿瘤细胞出现异型或侵犯静脉,但无活跃的核分裂和(或)病理性核分裂象等其他不良表现,仍被视为良性。肿瘤间质常发生透明变性或黏液变性,偶见钙化或骨化。另外,网状纤维染色显示瘤细胞间、细胞巢团周围及血管周围均可见网状纤维围绕。电镜及免疫组织化学观察均显示平滑肌分化的特点,电镜下见胞质含有肌微丝梭形致密体,相邻细胞间有连接结构,细胞周围有基膜[5]。免疫组织化学显示肿瘤细胞SMA、vimentin、h-caldesmon、calponin阳性,Syn和CD34偶可阳性[1,6-7]。其余抗体均为阴性。根据这些组织学形态表现,大部分胃血管球瘤可确诊。本组中病例1和病例2为实体性球瘤(图1),病例3为球血管瘤(图2)。vimentin和SMA均为弥散阳性;h-caldesmon及calponin均为部分阳性。病例2和病例3 Syn为阳性。与文献报道基本一致。
3.3鉴别诊断(1)胃肠道间质瘤:由于内镜下表现两者相似,间质瘤镜下细胞呈梭形,短梭形,也有上皮样表现,间质没有丰富的血管及扩张的静脉,免疫组织化学CD117、Dog-1和CD34阳性,SMA可灶性阳性,但没有血管球瘤强。(2)神经内分泌肿瘤,G1(类癌):镜下肿瘤组织富于血窦,瘤细胞大小较为一致,呈巢片状排列,但类癌多位于胃黏膜层或黏膜下层,瘤细胞胞质比较少,核染色质相对较粗,细胞边界不清,有异型性,免疫组织化学CgA、Syn和CK阳性,SMA和vinmentin阴性可鉴别。(3)副节瘤:发生在胃的副节瘤少见,瘤细胞由主细胞和支持细胞组成,围绕血管呈巢团状、器官样排列,免疫组织化学主细胞CgA和Syn阳性,支持细胞S-100阳性。(4)血管外皮瘤:两者都可见到扩张的血管,但血管外皮瘤的血管多呈鹿角状,周围的细胞呈梭形,CD34阳性,平滑肌标记阴性[1,8]。(5)淋巴瘤:冰冻切片两者难以鉴别,瘤细胞大小都比较一致,弥散排列,免疫组织化学容易鉴别。
3.4治疗和预后血管球瘤为良性肿瘤,单纯切除即可,复发率为10%[9]。Folpe等[10]提出的恶性血管球瘤诊断标准为:肿瘤直径大于2.0 cm,位置深;可见病理性核分裂象;核有异型性,核分裂象大于5个/50 HPF。如果肿瘤部不符合上述恶性指标,仅核分裂象大于5个/50 HPF,位置表浅;或仅为体积大;或仅为位置深,可归入恶性潜能未定的血管球瘤。
对于以上标准,有文献认为并不适用于胃血管球瘤。因为胃血管球瘤本身就属于深部软组织肿瘤,而且半数以上的患者肿瘤最大径大于2.0 cm[1,11-12]。绝大多数胃血管球瘤手术切除预后良好。本文病例2肿瘤最大径大于2.0 cm,而且肿瘤边界不清,经局部切除后,随访4年,现情况良好。其余2例均经局部手术切除,病例1随访5年,病例3随访1年,现患者情况良好。
综合文献报道,胃血管球瘤仅个别病例发生转移,绝大多数呈良性经过[1,12]。作者认为胃血管球瘤具有体积大、异型性大、核分裂象活跃等特点的患者均应长期随访,积累更多资料以供胃恶性血管球瘤的诊断,减少不必要的扩大手术。
参考文献
[1]Miettinen M,Paal E,Lasota J,et al.Gastrointestinal glomus tumors:a clinicopathologic,immunohistochemical,and molecular genetic study of 32 cases[J].Am J Surg Pathol,2002,26(3):301-311.
[2]Yoo YS,Choi JH,Heo G,et al.Double glomus tumors originating in the submandibular and parotid regions[J].Clin Exp Otorhinolaryngol,2011,4(1):49-51.
[3]Lee HW,Lee JJ,Yang DH,et al.A clinicopathologic study of glomus tumor of the stomach[J].J Clin Gastroenterol,2006,40(8):717-720.
[4]Fang HQ,Yang J,Zhang FF,et al.Clinicopathological features of gastric glomus tumor[J].World J Gastroenterol,2010,16(36):4616-4620.
[5]Souza FF,Chen E.Mesenchymal cystic hamartoma of the lung:MRI and PET/CT appearance[J].J Thorac Imaging,2009,24(1):52-55.
[6]Matevossian E,Brücher BL,Nährig J,et al.Glomus tumor of the stomach simulating a gastrointestinal stromal tumor:a case report and review of literature[J].Case Rep Gastroenterol,2008,2(1):1-5.
[7]Xu XD,Lu XH,Ye GX,et al.Immunohistochemical analysis and biological behaviour of gastric glomus tumours:a case report and review of the literature[J].J Int Med Res,2010,38(4):1539-1546.
[8]Kapur U,Hobbs CM,Mcdermott E,et al.Gastric glomus tumor[J].Ann Diagn Pathol,2004,8(1):32-35.
[9]范钦和.软组织病理学[M].南昌:江西科学技术出版社,2003:301-307.
[10]Folpe AL,Fanburg-Smith JC,Miettinen M,et al.Atypical and malignant glomus tumors:analysis of 52 cases,with a proposal for the reclassification of glomus tumors[J].Am J Surg Pathol,2001,25(1):1-12.
[11]Warner KE,Haidak GL.Massive glomus tumor of the stomach:20-year follow-up and autopsy findings[J].Am J Gastroenterol,1984,79(4):253-255.
[12]Haque S,Modlin IM,West AB.Multiple glomus tumors of the stomach with intravascular spread[J].Am J Surg Pathol,1992,16(3):291-299.
作者简介:周梦云(1978-),住院医师,硕士,主要从事消化道病理研究。 △通讯作者,E-mail:forestsoldier@sohu.com。
doi:·经验交流·10.3969/j.issn.1671-8348.2016.02.036
[中图分类号]R735.2
[文献标识码]B
[文章编号]1671-8348(2016)02-0250-03
(收稿日期:2015-07-18修回日期:2015-09-04)
