SIAH2和HIF-1α蛋白在喉鳞状细胞癌中的表达及临床意义∗
2016-06-12刘彩双刘卫云党晓伟秦博文马秀芬承德护理职业学院河北承德067000
刘彩双, 刘卫云, 党晓伟, 秦博文, 马秀芬(承德护理职业学院, 河北 承德 067000)
SIAH2和HIF-1α蛋白在喉鳞状细胞癌中的表达及临床意义∗
刘彩双, 刘卫云, 党晓伟, 秦博文, 马秀芬
(承德护理职业学院, 河北 承德 067000)
摘 要:目的:通过检测喉鳞状细胞癌组织、声带息肉、癌旁组织中SIAH2和HIF-1α蛋白的表达,为喉鳞状细胞癌发病机制提供理论依据,并为其早期诊断和治疗提供帮助。方法:收集喉鳞状细胞癌患者的石蜡包埋组织60例,同时收集声带息肉、癌旁石蜡包埋组织各30例,应用法免疫组织化学技术检测SIAH2和HIF-1α蛋白的表达水平。结果:SIAH2蛋白和HIF-1α蛋白在癌旁组织、声带息肉以及喉鳞状细胞癌中的阳性表达率分别为10%、33.3%、70%和3.3%、30.0%和66.7%,差异有统计学意义(P<0.05);SIAH2蛋白和HIF-1α蛋白的表达与喉鳞状细胞癌患者的分化程度、有无淋巴结转移以及临床分期有关(P<0.05)。喉鳞状细胞癌中SIAH2和HIF-1α蛋白的表达呈正相关。结论:SIAH2和HIF-1α蛋白可能与喉鳞状细胞癌的发病有关,并对喉鳞状细胞癌的侵袭性生物学行为有促进作用,联合检测二者可为预测肿瘤的生物学行为以及患者的预后提供帮助。
关键词:SIAH2; HIF-1α; 喉鳞状细胞癌
SIAH2蛋白作为一种E3泛素连接酶,能够促使底物蛋白发生泛素化降解,目前研究指出SIAH2可以通过SIAH2/ PHD/ HIF-1α信号通路发挥促癌作用。本研究通过检测SIAH2和HIF-1α蛋白的表达,探讨二者在喉鳞状细胞癌中的临床病理意义。
1 资料与方法
1.1临床资料:收集2015年6月至2015年12月承德护理职业学院附属医院病理科喉鳞状细胞癌石蜡包埋组织60例,同时收集声带息肉、癌旁石蜡包埋组织各30例。60例患者中男52例,女8例;年龄26~80岁,平均59.2岁;声门型45例,非声门型15例;高分化19例,中分化21例,低分化20例;无淋巴结转移者40例,伴有淋巴结转移者20例;无远处转移着37例,伴有远处转移者13例;临床Ⅰ期17例,临床Ⅱ期15例,临床Ⅲ期15例,Ⅳ期13例。所有患者术前均无其他原发肿瘤,并且未进行放化疗,均接受手术切除治疗,并经两位副高以上病理医师确诊为喉鳞状细胞癌。
1.2方 法
1.2.1免疫组织化学染色(PV二步法):将组织切片置于高压锅,柠檬酸钠溶液热修复,滴加一抗(SIAH2稀释度为1:100,HIF-1α为工作液无需稀释),4℃孵育过夜。滴加通用型两步法检测试剂盒(PV-9000),室温孵育15min。滴加现配制的DAB显色液,适时终止显色。以上个步骤均严格按照说明书进行,以PBS缓冲液代替一抗作为阴性对照。
1.2.2统计学分析:采用SPSS13.0统计软件进行分析,计数资料组间比较采用x2检验,相关性分析采用Spearman分析,以P<0.05为差异有统计学意义。
2 结 果
2.1SIAH2蛋白在癌旁组织、声带息肉及喉鳞状细胞癌中的表达及意义,见表1。
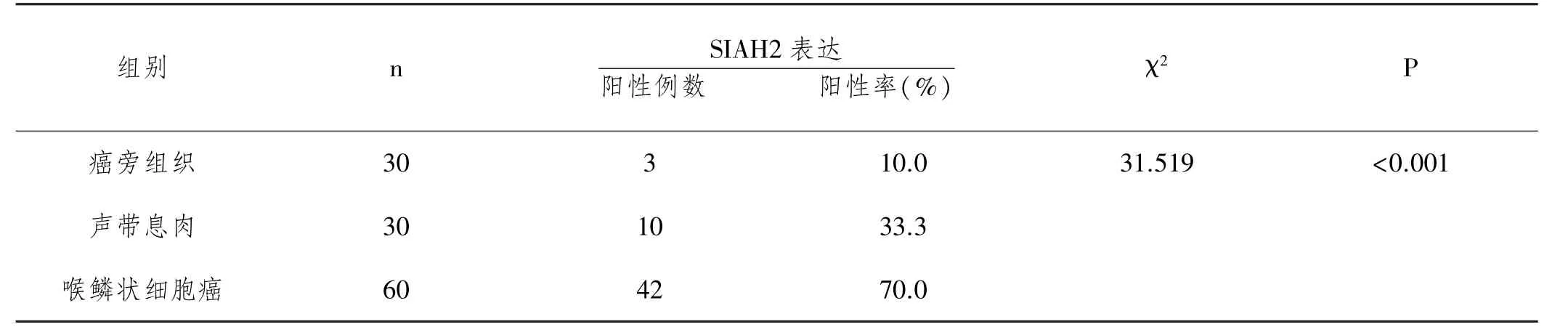
表1 SIAH2蛋白在癌旁组织、声带息肉以及喉鳞状细胞癌中的表达
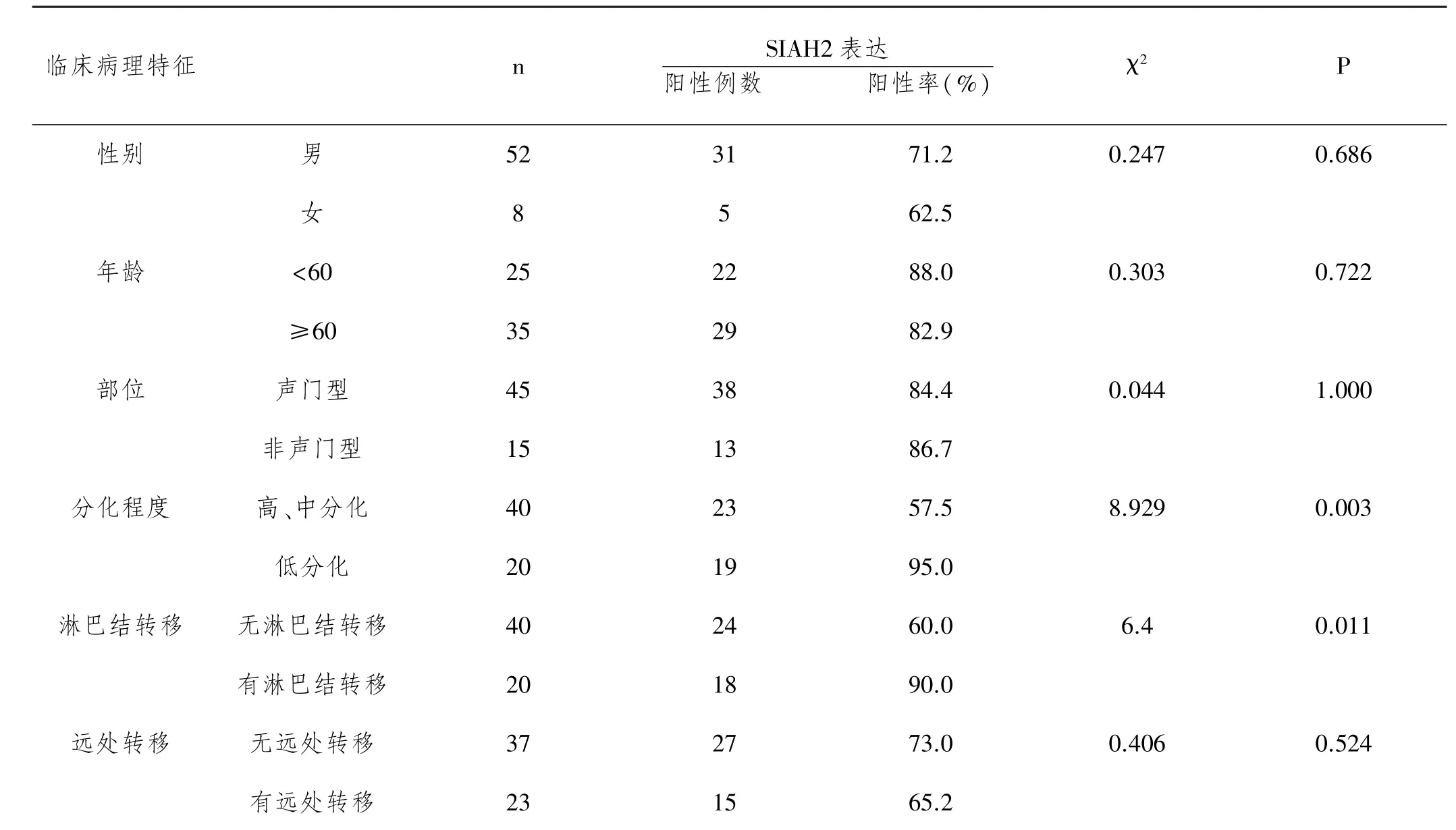
表2 SIAH2蛋白的表达与喉鳞状细胞癌临床病理特征的关系

2.2HIF-1α蛋白在癌旁组织、声带息肉以及喉鳞状细胞癌中的表达及意义,见表3。

表3 HIF-1α蛋白在癌旁组织、声带息肉以及喉鳞状细胞癌中的表达
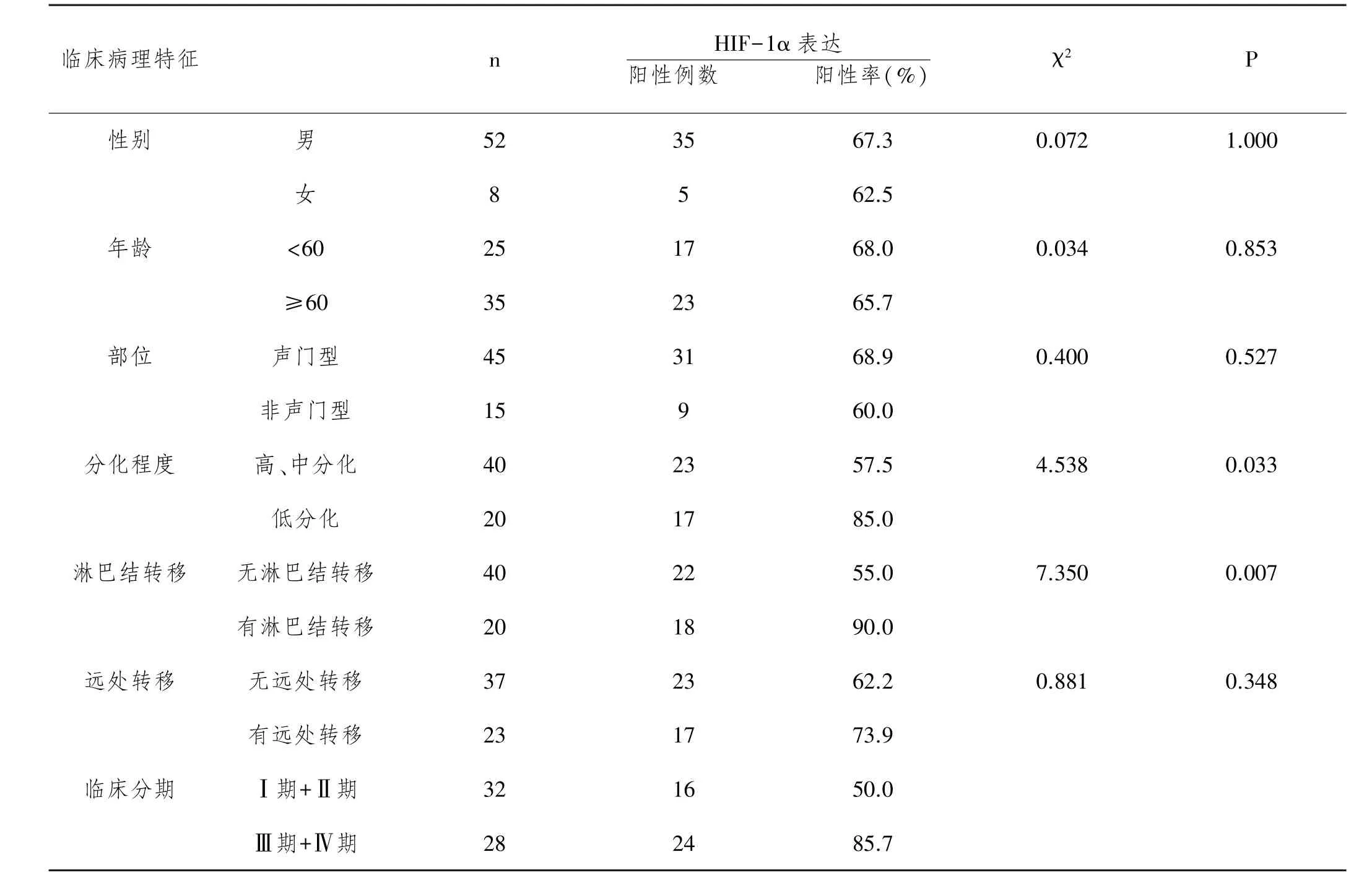
表4 HIF-1α蛋白的表达与喉鳞状细胞癌临床及病理特征的关系
2.3喉鳞状细胞癌中SIAH2和HIF-1α间的相关性: SIAH2与HIF-1α蛋白在喉癌中的表达经Spearman相关性分析得出rs=0.295(P=0.017),两种蛋白在喉鳞状细胞癌中表达呈正相关。
3 讨 论
近年来,泛素化修饰的研究日趋完善,泛素化修饰通过调控细胞周期影响着细胞的增殖和凋亡过程,当泛素化降解的过程失调时,肿瘤细胞凋亡和增殖等生物学过程发生改变,最终促使了肿瘤的发生与发展[1]。SIAH2是泛素连接酶E3家族的成员之一,研究发现,SIAH2作为一种癌基因在胰腺癌细胞株Bx-PC3、Panc-1以及肺癌细胞株BZR、A549中的表达水平升高,而且通过抑制SIAH2的表达,可以使肿瘤的生长过程受到抑制[2,3]。孟媛[4]等证实SIAH2蛋白在乳腺正常组织、原位癌、浸润性导管癌中的阳性表达率依次升高,而且与乳腺癌的组织学分级密切相关。刘瑶等[5]研究表明SIAH2蛋白在肝癌组织中的阳性表达率为78%,明显高于相应癌旁组织中的14%,并与肝癌的TNM分期密切相关。肖海等[6]研究结果显示,当SIAH2受到抑制后,肝癌细胞的增殖受到抑制,细胞周期被阻滞在G1期,而其细胞凋亡过程受到了促进。以上研究结果表明,SIAH2作为一个癌基因,参与了多种肿瘤的发生发展过程。
HIF-1是一种异源二聚体,主要是由HIF-1α亚基和HIF-1β亚基组成,HIF-1α主要存在于细胞核中,胞浆中的HIF-1α含量极少且几乎不发挥生物学功能。但是如果HIF-1α稳定性增强或表达量增加,HIF-1α不断地积聚,并且逐渐由细胞核转移至细胞浆中,其可与HIF-1β结合,最终形成具有活性的HIF -1,发挥相应的生物学功能。研究证实,抑制HIF-1α基因的表达可使胰腺癌细胞中VEGF表达下调,从而抑制肿瘤血管形成,而肿瘤细胞中HIF-1α的转录激活,则可能通过多条信号传导通路促进VEGF表达上调,从而促进肿瘤血管的形成。范平等发现HIF-1α在肝癌组织中的表达明显高于癌旁组织,并与肿瘤大小、转移、肿瘤包膜及临床TNM分期密切相关。孙国贵等[7]结果显示HIF1α在NSCLC中呈高表达,HIF-1α的表达与患者的临床分期、淋巴结转移密切相关,表明HIF-1α表达阳性增加了NSCLC发生恶性行为的风险。
SIAH2和HIF-1α关系密切,在SIAH2/ PHD/ HIF -1α通路中,常氧情况下脯氨酰羟化酶(Pro1y1 Hydroxy1ase,PHD)可以将HIF-1α降解,破坏其稳定性。同时PHD作为SIAH2的底物可通过泛素化降解途径被SIAH2所降解。本研究中SIAH2和HIF-1α蛋白在癌旁组织、声带息肉以及喉鳞状细胞癌中的阳性表达率依次升高,均与喉鳞状细胞癌患者的分化程度、有无淋巴结转移以及临床分期有关,并且二者表达呈正性相关,我们推测在喉鳞状细胞癌中SIAH2的表达与活性增强,通过泛素化降解途径促进PHD的降解,进而使HIF-1α稳定性增强并且表达量增加,HIF-1α可进一步调控其靶基因的表达,促进肿瘤细胞的迁移、侵袭。SIAH2和HIF-1α影响了喉鳞状细胞癌的分化,并可能促进了癌细胞的淋巴道播散,因此二者促肿瘤发展的作用极强,及时筛选喉鳞状细胞癌癌变过程中差异表达蛋白质对于喉鳞状细胞癌的防治具有非常重要的意义。
参考文献:
[1] 刘瑶,廖跃光,黄才斌,等.肝细胞癌组织中PEG10、SIAH2的表达及其意义[J].临床与实验病理学杂志,2012,28 (4):371~373.
[2] Confa1onieri S,Quarto M,Goisis G,et a1. A1terations of ubiquitin 1igases in human cancer and their association with the natura1 history of the tumor [ J]. Oncogene,2009,28 (33):2959~2968.
[3] Schmidt RL,Park CH,Ahmed AU,et a1. Inhibition of RAS -mediated transformation and tumorigenesis by targeting the downstream E3 ubiquitin 1igase seven in absentia homo1ogue [J].Cancer Res,2007,67(24):11798~11810.
[4] 孟媛,董经宇,甄娟,等.SIAH2与P-ERK在乳腺癌中的表达及其临床意义[J].中国组织化学与细胞化学杂志,2011,20(3):220~226.
[5] 刘瑶,廖跃光,黄才斌,等.肝细胞癌组织中PEG10、SIAH2的表达及其意义[J].临床与实验病理学杂志,2012,28 (4):371~373.
[6] 肖海,贺兴波,黄才斌,等.靶向泛素连接酶SIAH2的shRNA对人肝癌细胞株HepG2细胞周期和凋亡的影响[J].中国病理生理杂志,2013,29(8):1406~1411.
[7] 孙国贵,胡万宁,王雅棣,等.HIF-1α蛋白在非小细胞肺癌中表达的Meta分析[J].临床肿瘤学杂志,2012,17 (10):894~898.
文献标识码:B
doi:10.3969/ j.issn.1006-6233.2016.02.006
文章编号:1006-6233(2016)02-0192-04
基金项目:∗河北省高等学校科学技术研究项目,(编号:Z2015011)
