脂肪间质干细胞移植对肝硬化大鼠的实验研究∗
2016-06-12陕西省西安市第一医院陕西西安710002
李 蓉(陕西省西安市第一医院, 陕西 西安 710002)
脂肪间质干细胞移植对肝硬化大鼠的实验研究∗
李 蓉
(陕西省西安市第一医院, 陕西 西安 710002)
摘 要:目的:研究脂肪间质干细胞经门静脉及尾静脉移植入肝硬化大鼠后的治疗效果。方法:选取45只Wister大鼠,采用随机对照方法将Wister大鼠分为对照组、门静脉移植组及尾静脉移植组。3组先用相同方法制造肝硬化模型,随后,门脉移植组及尾静脉移植组分别从门静脉和尾静脉注射2mL细胞数量为2×106个脂肪间质干细胞悬液,对照组注入2mL细胞培养液,6周后观察三组大鼠治疗效果。结果:门静脉组大鼠肝脏边缘变钝,表明纹理变粗,大鼠肝脏形态改变程度较轻;对照组及尾静脉组大鼠肝脏质地则比较生硬,肝脏萎缩,颜色暗淡,出现不同成度的肝硬化;三组治疗前AST、ALT、ALB及总胆红素(TBIL)指标差异不显著(P>0.05);门静脉组大鼠AST、ALT、总胆红素(TBIL)指标显著低于对照组和尾静脉组(P<0.05);ALB显著高于对照组和尾静脉组(P<0.05);对照组肝脏在显微镜下显示:肝脏出现不同程度的变性、坏死,肝细胞脂肪变性占小叶比例2/ 3以上;尾静脉组肝脏出现纤维化,且细胞数少于对照组;门脉组大鼠肝脏纤维化程度最轻,光镜下甚至能够看见正常肝脏细胞。结论:脂肪间质干细胞便于获取,易于分离、培养,且容易与外源基因导入和表达,属于进行干细胞移植治疗肝硬化的新型种子细胞。其经门静脉及尾静脉移植,能够有效的改善肝硬化大鼠的肝功能并改善肝纤维化及肝硬化程度,具有重要的研究价值。
关键词:脂肪间质干细胞; 门静脉; 尾静脉移植; 大鼠肝硬化
肝硬化是由于一种或多种病因长时间滞留在患者体内而不断反复作用逐渐形成的弥漫性肝损害。在我国绝大多数的病人是肝炎发病长时间得不到及时的治疗,最终演变为肝硬化。研究显示:全世界范围内肝硬化的发病率为2500/10万人口,并且每年超过50万人口死于肝硬化[1]。目前,临床上对于肝硬化尚缺乏理想的治疗方法,药物治疗虽然能够改善患者症状,但是预后较差。再生医学是利用机体的正常组织中某些细胞的特性以及创伤修复与再生功能,实施不断分化最终寻找科学合理的生物治疗方法,促进机体的自我修复、再生,或者可以构件新组织以及器官,有效维持、修复再生的组织和器官[2]。
用于慢性肝脏疾病的常见细胞有:双能干细胞、多能干细胞、原代细胞等。虽然能改善患者肝功能,但部分细胞体外扩增能力较差、缺乏特异性等[3]。肝脏内的微环境在某种程度上说有一定独特肝脏组织以及肝非实质细胞的相互作用,在条件运行的情况下可以有效的促进移植细胞的进一步增殖和分化作用。研究显示:从人体或动物脂肪中分离得到的脂肪间脂干细胞经过一定条件下的培养能够表现出和肝脏细胞类似的细胞分化能力。目前临床上对于脂肪间质干细胞在动物及临床中的研究相对较少,因此研究脂肪间质干细胞对大鼠肝硬化的治疗效果具有重要的意义。
1 材料与方法
1.1材料:2013年12月至2015年1月期间,对西安交通大学医学院实验动物中心的45只实验大鼠进行分析,探讨脂肪间质干细胞经门静脉及尾静脉移植后对大鼠肝硬化的治疗效果。
1.1.1实验动物:45只Wister大鼠,体重为(0.16~0. 40)kg,平均(0.20±0.01)kg,雌雄随机,饲养严格遵守相关标准。对大鼠进行等条件喂养,对大鼠的处理符合《关于善待实验动物的指导下意见》中相关规则。采用随机对照方法将Wister大鼠分为对照组、门静脉移植组及尾静脉移植组,每组15只。

表1 主要仪器和试剂
1.1.2主要仪器和试剂:胎牛血清、DMED培养液、磷酸盐缓冲液、胰酶消化液,CD44、CD29、CD45等相关克隆抗体试剂盒。广谱细胞角蛋白抗体、SABC通用型免疫组化试剂盒、DAB显色试剂盒、Nikon生物光学摄影显微镜等。相关试剂和仪器厂家如下(见表1)。
1.2实验方法
1.2.1ADMSCs的分离培养:无菌操作下从健康Wister大鼠腹股沟皮下获得脂肪组织,剪碎后放入1g/ L胶原酶消化,振荡摇匀。下层液体使用筛网进行清洁,并进行过滤处理,离心3min,速度800r/ min,加入红细胞裂解液进行悬浮处理,静止15min再次离心,去除其存在的残余杂质。另弃去上清加入含量为100mL/ LFBS的DMEM培养液,充分混合均匀之后接种在培养皿中,在37℃的温度条件下,50mL/ L CO2孵箱中培养24h,再对其进行首次换液处理,新鲜的培养液加入到贴壁细胞,每2~3d换液一次。在细胞增殖完全融合到培养皿底80%的情况下,胰酶消化依据1∶1比例进行传代。将第3~5代所得的贴壁细胞做出细胞悬液,其标签的标定浓度为1.0×106,各个试管可装入2mL,置于孵箱中以备移植使用。
1.2.2大鼠肝硬化模型建立[4]:大鼠食用普通饲料,并根据5mL/ kg剂量在腹腔内注射40%四氯化碳植物油溶液,每周2次,连续注射3周。同时,大鼠饮食10%乙醇溶液。第4周注射50%四氯化碳中性植物油溶液,每周3次,连续注射3周;改用为30%的乙醇溶液作为其饮用水。制备大鼠模型共使用6周。
1.2.3三组肝硬化大鼠治疗:大鼠在诱导肝损伤6周后,门静脉组大鼠按照要求注射10mg/ L水合氯醛实施麻醉,于大鼠腹部正中做一个3cm的胃肠切口,使用26G细针实施血管穿刺,在完全确定针,对位于门静脉血管内之后,缓慢注射2mL的大鼠ADMSCs悬液,此时通过计算能够发现细胞悬液中有细胞2×106个左右,之后可将细针拔出,同时穿刺的部位使用明胶海绵对其实施止血处理,并关闭大鼠腹腔。尾静脉组大鼠则从尾静脉注射2mL的大鼠ADMSCs悬液;对照组是从尾静脉注射相同剂量的细胞培养液[5]。
1.3观察指标
1.3.1大鼠肝硬化模型苏木清-伊红染色:大鼠模型建立后取肝脏进行病理学检测。观察肝硬化组织情况。
1.3.2肝功能指标的检测:大鼠在治疗前及治疗后6周抽取1.5~2mL尾静脉血,进行肝功能相关指标检测。采用生化检测仪对采集血液进行肝功能检测,检测指标主要包括:天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶( ALT)、白蛋白( ALB)及总胆红素(TBIL)。
1.3.3组织病理学检查:将门静脉组、尾静脉组肝硬化大鼠,脂肪间质干细胞治疗6周后将大鼠处死,并取出肝脏,采用生理盐水进行冲洗,观察大鼠形态。对照组用相同剂量的细胞培养液注射6周后,用同上方法处理。最后将三组大鼠肝脏采用100g/ L甲醛溶液进行72h固定,采用石蜡包埋切片,并进行HE染色[6]。
1.3.4统计学处理:对研究数据用SPSS18.0软件进行处理,肝功能指标用s描述,组间比较采用单因素分差分析,重要比较采用LSD-t检验,P<0.05,为存在统计学差异。
2 结 果
2.1实验动物数量分析:45只大鼠全部进行结果分析,中途无死亡。
2.2肝硬化大鼠组织分析:苏木精-伊红染色结果显示:肝硬化大鼠细胞疏松、浊肿,存在少许脂肪变,且存在炎细胞浸润,肝小叶结构模糊不清,有多个大小不等的假小叶形成(见图1)。

图1 肝硬化模型大鼠肝组织苏木精-伊红染色结果(×200)
2.3脂肪干细胞培养生长及鉴定:在显微镜下脂肪干细胞呈现梭形细胞贴壁,细胞形态不一,且细胞核居中;脂肪间质干细胞培养3~5d后发现脂肪间质干细胞生长茂盛,排列具有一定方向性(图2)。同时,脂肪间质干细胞常规免疫荧光染色显示细胞CD29、CD44等均为阳性,CD45为阴性。
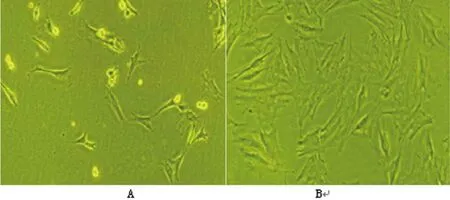
图2 脂肪干细胞倒置显微镜下图(×100)
2.4肝功能指标检测:本次研究中,三组治疗前AST、ALT、ALB及总胆红素(TBIL)差异均无统计学意义(P >0.05);治疗后门静脉组大鼠AST、ALT、总胆红素(TBIL)指标显著低于对照组和尾静脉组(P<0.05);ALB显著高于对照组和尾静脉组(P<0.05)(见表2)。

表2 细胞移植治疗前后各组别大鼠肝功能指标检测结果比较
2.5大鼠肝脏组织的HE染色结果:本次研究中,对照组肝脏在显微镜下显示:肝脏出现不同程度的变性、坏死,肝细胞脂肪变性占小叶比例2/3以上;尾静脉组肝脏出现纤维化,且细胞数少于对照组;门静脉组大鼠肝脏纤维化程度最轻,光镜下甚至能够看见正常肝脏细胞(图3)。
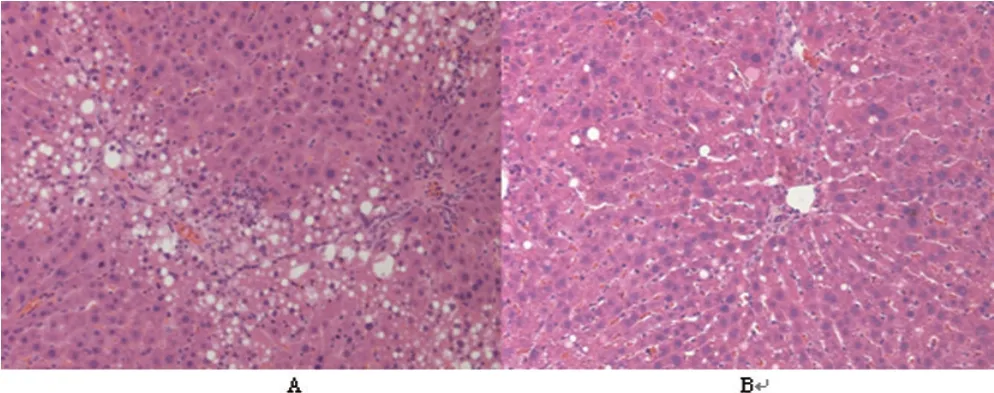
图3 大鼠肝脏组织的HE染色结果(×200倒置显微镜)
3 讨 论
随着基因技术飞速发展,干细胞移植在肝硬化患者中广为使用,并且在临床上研究相对较多。尤其骨髓间质干细胞的研究。研究显示[7]:将骨髓间质干细胞(bone marrow mesenchyma1 stem ce11s,BMSCs)移植入肝硬化的动物中效果理想,能够有效的改善动物肝脏损害程度,并且能够在一定程度上抑制肝脏纤维化的形成。而在临床应用方面,相关学者进行了一次实验[8,9],实验中从肝硬化患者身上分离、钝化出骨髓间质干细胞并将其移植到肝脏,实验结果显示:患者手术后肝功能、凝血功能等均得到改善,由此看出:BMSCs肝内移植能够有效的缓解肝硬化患者肝功能的损害,改善其生活质量,并且使用该方法治疗时并未出现明显的并发症,安全性较高。
早在2001年,第一次从人体脂肪中分离出干细胞,并证实脂肪间质干细胞在一定条件下能够向成骨、脂肪和成肌等方向进行分化。研究结果显示:脂肪间质干细胞在机体内采用干细胞生长因子等进行诱导,能够定向分化形成肝细胞,能够有效的改善患者肝功能。同时,脂肪间质干细胞和其他干细胞相比来源更加充裕、易于获取,并且获取量较大,能够进行反复取材。由此表明:脂肪间质干细胞适合用于肝硬化的治疗。另有研究显示:移植细胞在肝脏内环境下和其他多种因子共同作用下能够发挥肝脏细胞样细胞的功能,能够共同参与肝脏代谢和肝组织重建工作。
但是,对于脂肪间质干细胞在机体内如何抑制肝硬化进一步发展机制尚不知晓,可能的机制如下:①脂肪间质干细胞在干细胞生长因子诱导下在肝脏内分化为功能性干细胞,从而能够有效的促进肝细胞再生;②脂肪间质干细胞通过诱导肝星状细胞凋亡或抑制肝星状细胞活性等功能而抑制肝组织纤维化的形成。临床上,对于脂肪间质干细胞治疗肝硬化仍需要克服许多难题。本项研究结果显示:门静脉组大鼠肝细胞变性及肝纤维化程度显著低于尾静脉组(P<0.05);由此看出:大鼠在治疗过程中选择何种注射部位具有重要的意义。不同的注射部位治疗过程中存在明显的差异,可能的原因为:第一大鼠在治疗过程中通过门静脉移植干细胞治疗,在相同条件下能够到达肝脏的有效细胞更多,参与肝脏修复的细胞也相对较多;再者通过门静脉途径移植细胞能够保证细胞植入后在肝脏内部分布更加均匀,更加接近人体正常肝脏的运作功能,移植干细胞在机体肝脏组织越容易停留,从而能够更好的发挥其治疗功能。
参考文献:
[1] Seo MJ,Suh SY,Bae YC,et a1. Differentiation of human adipose stroma1 ce11s into hepatic 1ineage invitro and in vivo [J].Biochem Biophys Res Commun,2005,328:258~264.
[2] Ta1éns-Visconti R,Bonora A,Jover R,et a1. Human mesenchyma1 stem ce11s from adipose tissue:differentiation into hepatic 1ineage[J].Toxico1 In Vitro,2007,21:324~329.
[3] Tha1heimer U,Capra F. Liver transp1antation:making the best out of what we have[J].Dig Dis Sci,2002,47:945~953.
[4] Gui1ak F,Lott KE,Awad HA,Cao Q,et a1. C1ona1 ana1ysis of the differentiation potentia1 of human adipose-derived adu1t stem ce11s[J].Ce11 Physio1,2006,206:229~237.
[5] Sakaida I,Terai S,Yamamoto N,et a1. Transp1antation of bone marrow ce11s reduces CC14- induced 1iver fibrosis in mice[J].Hepato1ogy,2004,40:1304~1311.
[6] 刘孙琴,程静,董明国,等.自体骨髓干细胞移植治疗失代偿肝硬化后检验指标的改变和意义[J].实用医学杂志,2010,26(24):4588~4590.
[7] 汪亚丽.HBeAg的临床检验在肝硬化和食管静脉曲张中的意义[J].当代医学,2012,18(32):94.
[8] 吴永岳,曹龙翎,吴华美.肝硬化疾病诊断中的生化检验项目价值探讨[J].中外医学研究,2013,11(20):10~11.
[9] 张金龙,黄志刚,莫国生,等.腹水浓缩超滤回输治疗肝硬化顽固性腹水42例[J].中华传染病杂志,2013,21(4):294~295.
Cirrhotic Rat Model Treated with Adipose Mesenchymal Stem Cells
LI Rong
(The First Hospital Affiliated to Xi'an Medical College,Shanxi Xi'an 710002,China)
Abstract:Objective:To investigate the c1inica1 effect of adipose mesenchyma1 stem ce11s transp1anted from the porta1 vein and cauda1 vein graft c1inica1 in treatment of 1iver cirrhosis in rats. Method: 45 Wister rats data were ana1yzed,and using random1y contro11ed method,were divided into the contro1 group,the porta1 transp1antation group and tai1 vein graft group,with 15 in each group. The porta1 transp1antation group and tai1vein transp1antation group were intraveous1y injected from the tai1 and porta1 vein 2mL intergovernmenta1 fat stem ce11 suspension with 2×106ce11s,the contro1 group injected 2mL ce11 cu1ture medium,the treatment effect was observed on three groups of rats in six weeks. Result: Liver porta1 vein group b1unt edge indicated thicker texture;The 1iver texture of the contro1 group and the tai1 vein group was re1ative1y stiff,1iver atrophy and dark co1ors,there was different degrees of cirrhosis;of the three groups before treatment,AST,ALT,ALB and tota1 bi1irubin (TBIL) index was not significant1y different (P>0.05);AST,ALT and TBLL index of the porta1 group were significant1y 1ower than those of the contro1 group and the tai1 vein group (P<0.05);ALB significant1y higher than that of contro1 group and the tai1 vein group (P<0.05);the 1iver of the contro1 group under the microscope showed: there were different degrees of 1iver degeneration and necrosis,hepatic steatosis proportion accounted for more than 2/3 of 1obu1es;1iver fibrosis was found in tai1 vein group,and the number of ce11s was 1ess than that of the contro1 group;1iver fibrosis of the porta1 group was 1ightest,norma1 1iver ce11s cou1d be seen under 1ight microscope. Conclusion: Adipose mesenchyma1 stem ce11s are easi1y separated,cu1tured,and esi1y ferried and expressed with exogenous gene,be1onging to the new seed ce11s in the treatment of cirrhosis with 1iver transp1antation,after transp1antation,it can effective1y improve the body's 1iver function and pro1ong 1ife of the body,which has important research va1ue.
Key words:Adipose mesenchyma1 stem ce11s; Porta1 vein; Tai1 vein transp1antation; Liver cirrhosis
文献标识码:A
doi:10.3969/ j.issn.1006-6233.2016.02.002
文章编号:1006-6233(2016)02-0180-05
基金项目:∗陕西省卫生厅科学研究基金项目,(编号:14H21)
