慢性阻塞性肺疾病患者T淋巴细胞亚群表达及意义分析
2016-06-09张爱妹万引
张爱妹 万引
慢性阻塞性肺疾病患者T淋巴细胞亚群表达及意义分析
张爱妹 万引
目的 研究慢性阻塞性肺疾病(COPD)患者T淋巴细胞亚群的表达及意义。方法 随机收集COPD患者30例及健康对照组20例,分别检测两组T淋巴细胞亚群表达水平。结果 COPD患者患者CD3+、CD4+水平、CD4+/CD8+比值均低于健康对照组,CD8+高于健康对照组,差异有统计学意义(P<0.05)。结论 COPD患者存在细胞免疫功能紊乱,患者细胞免疫功能下降。T淋巴细胞亚群表达失衡在COPD发病中起着重要的作用。
慢性阻塞性肺疾病;T淋巴细胞亚群;细胞检测
我国即将步入老年社会,慢性阻塞性肺疾病是危害老年人健康的常见病、多发病,由于其缓慢进行性发展,严重影响患者的劳动能力和生活质量。COPD的发病机制尚未完全明了,随着研究的深入,近年来对COPD的发病机制有了进一步的加深,其中T淋巴细胞亚群表达失衡在其发病中起着重要的作用[1]。
1 资料与方法
1.1 一般资料 观察本院2013年9月~2014年10月住院的COPD患者30例,所选病例符合《慢性阻塞性肺疾病诊治指南》的诊断标准,并排除伴有免疫功能严重疾病、近半月内未使用糖皮质激素、免疫抑制剂及免疫调节剂。其中男25例,女5例,年龄60~70岁患者15例,70~80岁患者12例,>80岁患者3例。健康对照组20例,其中男16例,女4例,年龄60~70岁患者12例,70~80岁患者8例。健康对照组与慢性阻塞性肺疾病患者组(COPD组)在一般资料上差异无统计学意义。
1.2 实验仪器 上海汇中细胞生物科技有限公司的CytoCounter全自动可视化细胞检测仪。SEMIBLO玻片干燥仪。
1.3 操作准备 (1)配制磷酸盐缓冲液:将1包磷酸盐缓冲液粉剂倒入SemiBio®专用缸中,加水至400 mL刻度线,完全溶解后混匀即可。(2)配制过氧化酶染色液:将1包过氧化酶染色粉倒入SemiBio®专用缸中,再加95%乙醇至500 mL刻度线,充分搅拌至少5分钟。(3)配制复染液:将1包复染粉倒入SemiBio®专用缸中,再加75%乙醇至500 mL刻度线,充分搅拌至溶解。
1.4 操作方法 (1)静脉血标本:吸取20☒L摇匀K2 EDTA抗凝全血加于相对应编号的380☒L磷酸盐缓冲液中,即刻混匀。(2)将湿盒置于水平工作台,加室温水至湿盒底部被完全覆盖。注意湿盒支架处应保持干燥。(3)取出玻片,将包被面朝上,按序将标签贴于玻片一端,后将玻片置于湿盒支架上(勿使玻片接触到水)。(4)吸取5☒L稀释血样,滴入玻片方框区域中央。确认没有血样流出,且框内无气泡,盖紧盒盖,室温(20℃~30℃)孵育40 min。(5)孵育40 min后,将玻片按序插入玻片架。(6)将玻片架即刻放入磷酸盐缓冲液中,旋转提拉直至玻片呈无色透明。(7)将玻片架即刻放入过氧化酶染色液中,静置1 min。(8)在步骤7计时1 min内,将1 mL 2.5%~3.5%过氧化氢溶液加入预先盛有水(至400 mL刻度线)专用缸中,搅拌均匀后制成新鲜工作溶液。(9)将稍加沥干的玻片架转入新鲜过氧化氢工作溶液中,静置4 min。(10)将玻片架转入75%乙醇(400 mL)专用缸中,旋转提拉至干净,提出后振去多余乙醇。(11)打开玻片架搭扣,将其置于SemiBio®自动玻片干燥仪下干燥6 min,确保黑框内干燥。(12)将玻片架放入复染液中,静置1 min。(13)将玻片架转入纯水(500 mL)专用缸中,静置30秒,其后根据玻片数量不等提拉相应次数,提出后振去多余水分。注意:玻片数<15片,提拉3次;玻片数≥15片,提拉5次。(14)打开玻片架搭扣,将其置于
SemiBio®自动玻片干燥仪下吹干。注意:为缩短干燥时间,待玻片黑框内吹干后,可用纸擦干周围水分。(15)通过SemiBio®
全自动可视化细胞检测仪,现场或异地,随时进行细胞自动计数、分析。注意:若细胞颜色淡而影响软件识别,请重复步骤
12~14。
1.5 观察指标 检测COPD患者及健康对照组外周血中
T淋巴细胞亚群表达水平。
1.6 统计学方法 利用SPSS 17.0统计软件,计量资料采用“x±s”表示,组间比较采用t检验,计数资料以率(%)表示,采用χ2检验;P<0.05为差异有统计学意义。
2 结果
COPD患者CD3+、CD4+水平、CD4+/CD8+比值均低于健康对照组,CD8+高于健康对照组,差异有统计学意义(P<0.05)。见表1。
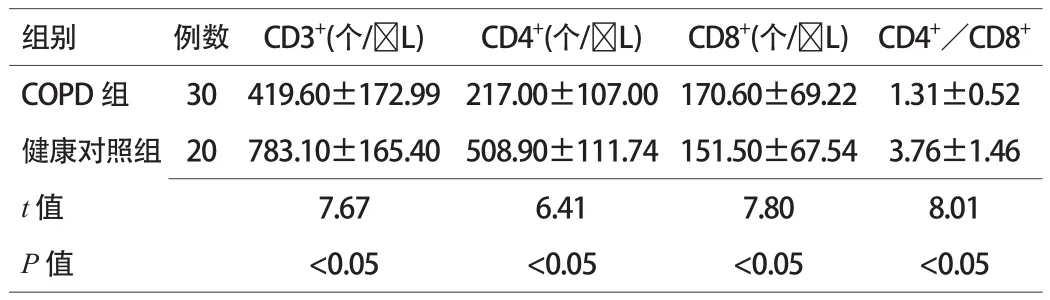
表1 2组患者CD3+、CD4+水平、CD4+/CD8+比值比较(x±s)
3 讨论
慢性阻塞性肺疾病是一种破坏性的肺部疾病,是以不完全可逆的气流受限为特征的疾病,气流受限通常呈进行性发展并与肺对有害颗粒或气体的异常炎症反应有关。COPD是一种可以预防和治疗的慢性气道炎症性疾病。该病患病人数众多,是目前全球第四大死因,且发病率仍不断上升[2]。除目前公认的发病机制外,近年来越来越多的研究显示自身免疫可能是COPD发病的关键机制。T淋巴细胞是人体内主要的免疫功能细胞,主要分为CD4、CD8两个亚群。本资料显示COPD患者CD3+、CD4+水平、CD4+/CD8+比值均低于健康对照组,CD8+高于健康对照组,与早期研究报告一致[3-6]。CD3+是人体总的T淋巴细胞,CD4+为辅助性T淋巴细胞,调控免疫反应,直接反应人体的免疫状况,CD4+/CD8+比值降低是机体免疫功能下降的重要标志,可反应疾病的严重程度[7]。本资料中,COPD患者CD3+、CD4+下降,CD8+增高,说明CD3+下降主要由CD4+下降所致,外周血中成熟T淋巴细胞总数下降。CD4+下降及CD4+/CD8+比值降低,说明COPD患者免疫功能下降,继发感染风险性增加。故临床上可将CD4+/CD8+比值测定来反应COPD患者的严重程度及预后。目前COPD治疗主要以抗感染、解痉平喘等传统治疗为主,随着患者年龄增大及人体免疫力持续下降,更易反复感染导致发作加重,而COPD反复急性加重将导致患者免疫力进一步下降,形成恶性循环,增加患者痛苦及经济负担。因此,提高人体自身免疫,预防COPD发生及进展引起了众多研究者的重视,我们期待越来越多的研究者投入到此项研究中来,为我们广大的COPD患者带来新的希望。
[1] BarceloB,Pons J,Ferrer JM,et al.Phenotypic characterisati-on of T-lymphocytes in COPD: abnormal CD4+CD25+regula-tory T-lymphocyte response to tobacco smoking[J].EuropeanRespiratory Journal,2008,31(3): 555-562.
[2] Anna M.Stefanska,Patrick T.Walsh.Chronic Obstructive Pulmonary Disease:Evide-nce for an Autoimmune Component[J].Cellular & Molecular Immunology,2009,6(2):81-86.
[3] kemeny DM,Vyas B,Vukmanovic-stejic M,et al.CD8+T cell subsets and chronic obstructive pulmonary disease.AMJ Respir Crit care Med,1999, 160:33-37.
[4] 黄美建,冷报浪,梁斌,等.慢性阻塞性肺疾病不同病期细胞免疫功能德国临床研究[J].浙江临床医学,2004(8):664-665.
[5] 赵寅滢,惠复新.慢性阻塞性肺疾病患者T淋巴细胞亚群变化[J].中国现代药物运用,2008(2):69-70.
[6] Davidson WJ,Verity WS,Traves SL,et al.Effect of incre-mental exercise on airway and systemic inflammation inpatients with COPD[J].J Appl Physiol,2012,112(12):2049-2056.
[7] Synala H,Surcel HM,Honen J.Low CD4/CD8 lymphocyte ratio in acute myo-cardial infarction[J].Clin Exp Immunol,1991,83:326.
10.3969/j.issn.1009-4393.2016.34.034
江西 330006 江西省胸科医院呼吸二科(张爱妹 万引)
