藤茶二氢杨梅素提取工艺优化
2016-06-08吴正奇万端极陈爱洋
郭 巍, 吴正奇, 万端极, 吴 欢, 陈爱洋
(1 湖北工业大学资源与环境工程学院, 湖北 武汉 430068; 2 湖北工业大学食品与制药工程学院, 湖北 武汉 430068)
藤茶二氢杨梅素提取工艺优化
郭巍1, 吴正奇2, 万端极1, 吴欢1, 陈爱洋1
(1 湖北工业大学资源与环境工程学院, 湖北 武汉 430068; 2 湖北工业大学食品与制药工程学院, 湖北 武汉 430068)
[摘要]采用响应面分析法对藤茶中二氢杨梅素的提取工艺进行优化研究。在单因素实验的基础上,通过响应面法(RSM)确定最佳提取条件为:提取温度78℃,提取时间64 min,pH=8。在此最佳提取工艺条件下,二氢杨梅素提取率预测值可达15.926%,实测值为15.860%,相对误差为0.42%;对二氢杨梅素进行重结晶纯化实验,5次重结晶后二氢杨梅素纯度达97.8%。
[关键词]二氢杨梅素; 提取率; 响应面法; Box-Behnken设计
藤茶是葡萄科蛇葡萄属植物显齿蛇葡萄(Ampelopsis grossedentata)的茎叶,味甘淡,性凉,具有清热解毒、祛风湿、强筋骨之功效,广泛分布于广东、广西、云南、湖南、湖北、江西等地[1]。二氢杨梅素(dihydromyricetin,DMY)是一种多酚基双氢黄酮醇,又称蛇葡萄素,属黄酮类化合物,其结构式如图1所示。藤茶中二氢杨梅素的含量为30%~40%[2-3]。研究表明,二氢杨梅素是清除自由基、抗高血压、降血脂、抗肿瘤、保肝护肝等诸多生理活性物质,此外,还具有良好的抑菌、抗氧化作用[4-7],极具开发潜力。
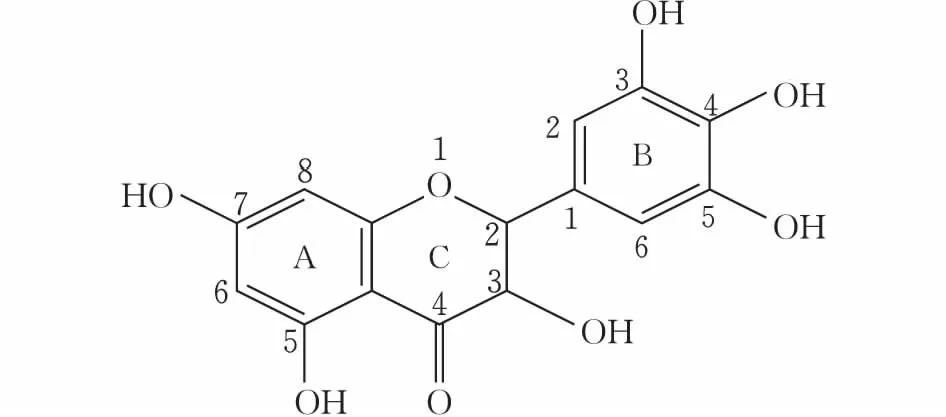
图 1 二氢杨梅素结构式
本试验在单因素实验的基础上,以二氢杨梅素提取率为考查指标,利用Design Expert统计软件对影响显著的3个因素作响应面[8]优化,确定最佳提取工艺,以便改进提取条件,为规模化生产提供依据。
1实验部分
1.1实验材料与主要仪器
主要原料和试剂:藤茶干叶;二氢杨梅素对照品(99.8%纯度);甲醇(色谱纯);冰乙酸(色谱纯);丙酮(分析纯);95%无水乙醇。其他试剂均为市售分析纯。
主要仪器和设备:高效液相色谱仪,美国戴安;DFY-500摇摆式高速旋转粉碎机,温岭市林大机械有限公司;三足式离心机,苏州优耐特机械制造有限公司;RE52CS旋转蒸发仪,上海亚荣生化科技;PHS-2C数显酸度计,上海方瑞仪器有限公司;电热恒温水浴锅S21-4,上海医疗器械五厂;分析天平,沈阳龙腾电子称量仪器有限公司;SHB-Ⅲ循环水真空泵,巩义市予华仪器有限公司。
1.2方法
1.2.1DMY提取工艺流程藤茶干叶→粉碎→水提→抽滤→滤液→冷却结晶→抽滤→干燥→粗提物→丙酮回流提取→浓缩→多次重结晶→二氢杨梅素[9]。
1.2.2DMY的HPLC检测方法二氢杨梅素的检测采用HPLC法。具体操作条件:色谱柱,Agilent TC-C18柱(250 mm×4.6 mm);流动相,V(甲醇)∶V(含0.1%冰乙酸水)=28∶72,pH=3.5;柱温,35℃;流速,1.0 mL/min;检测波长,292 nm;进样量,20 μL。
标准曲线绘制方法:先准确称取DMY标准品100 mg,流动相精确定容至100 mL,得到1 mg/mL母液。然后取适量上述线液,分别稀释至1、5、10、20、40倍,即分别得体积浓度梯度为1 、0.2 、0.1、0.05、0.025 g/L的标准溶液。将配制好的标准溶液用高效液相色谱(HPLC)进行测定,得回归线性方程为
y=738.17x-0.7232(R2=0.9998)
样品浓度在0.025~1 g/L范围内线性关系良好。

y=738.17x-0.7232 R2=0.9998图 2 HPLC法测定二氢杨梅素标准曲线及回归方程
1.2.3藤茶中DMY含量测定精确称取粉碎并过40目筛的藤茶粉末15 g,置于索氏提取器中,用适量石油醚加热回流2 h,脱脂后的样品,再用无水乙醇在80℃下加热回流6 h,得到醇提取液,趁热过滤,然后经真空浓缩后移至干燥皿,干燥至恒重,得到提取物[9]。平行5次,取平均值。测定得到藤茶中二氢杨梅素含量为30.5%[10-13]。
1.2.4DMY的纯化方法藤茶粗提物中黄酮物质主要为二氢杨梅素和杨梅素,两者均易溶于甲醇、热水和乙醇,但杨梅素不溶于丙酮。根据两者在相同溶剂中溶解度的差异,可用丙酮将粗提物回流,进而分离杨梅素,再对二氢杨梅素进行多次重结晶,即可得到高纯度二氢杨梅素[14-15]。
1.2.5提取率计算二氢杨梅素提取率
式中:m1为DMY粗品质量;p为纯度;m2为藤茶粉末质量。
2结果与分析
2.1提取剂的选择
分别选用蒸馏水、30%乙醇(体积分数)、60%乙醇(体积分数)、90%乙醇(体积分数)、甲醇作为提取剂,每种溶剂平行3组。在提取温度70℃、提取时间60 min、液料比30∶1、pH=8的条件下,按照1.2.1的提取流程进行提取,测定结果取平均值,其提取率分别为15.30%、16.68%、13.15%、11.31%、13.12%,结果显示30%乙醇提取效果最好,蒸馏水次之,90%乙醇效果最差。考虑水提取率较高,而且简单易得,污染小,能耗小,所以选用蒸馏水作为藤茶二氢杨梅素的提取溶剂。
2.2单因素试验设计
2.2.1提取温度对二氢杨梅素提取率的影响固定提取时间60 min、液料比30∶1、pH=8,提取温度梯度为40℃、50℃、60℃、70℃、80℃,每个提取温度平行3份,取平均值。由图3可知,提取温度对二氢杨梅素提取率影响较显著,40℃~70℃之间,提取率呈上升趋势,70℃后提取率反而下降。原因可能是温度升高,二氢杨梅素发生氧化作用,反而导致提取率的下降。故温度70℃为最优条件。
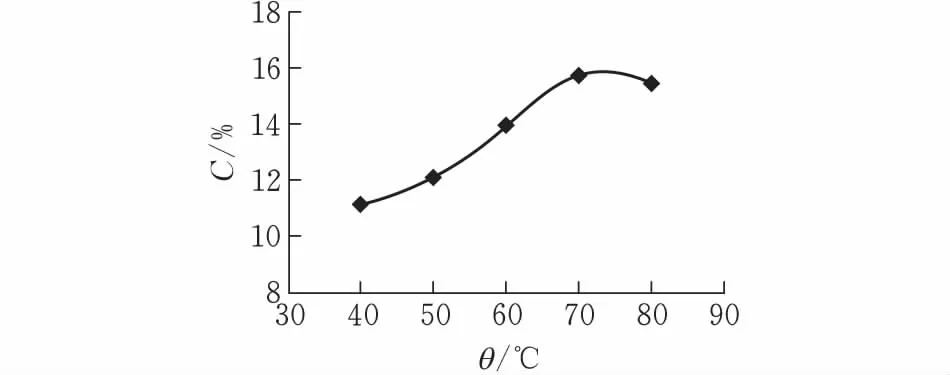
图 3 提取温度对二氢杨梅素提取率的影响
2.2.2提取时间对二氢杨梅素提取率的影响固定提取温度为70℃、液料比30∶1、pH=8,提取时间梯度为30 min、40 min、50 min、60 min、70 min,每个提取时间平行三份,取平均值。由图4可知,二氢杨梅素提取率先升后降,60 min时提取率达到最大。可能原因是60 min时细胞内外二氢杨梅素浓度达到平衡,时间延长,反而导致其他杂质溶出[16],不仅能耗增加,反而不利于最优化提取。故提取时间60 min为最优条件。

图 4 提取时间对二氢杨梅素提取率的影响
2.2.3液料比对二氢杨梅素提取率的影响固定提取温度70℃、时间60 min、pH=8,液料比梯度为10∶1、20∶1、30∶1、40∶1、50∶1,每个体积质量平行三份,取平均值。由图5可知,二氢杨梅素提取率随液料比增大而升高,先上升较快,但到体积质量为30 mL/g时,上升趋势平缓。可见,当达到30 mL/g时二氢杨梅素溶出已经比较完全,从生产节约资源、利益最大化考虑,故体积质量30 mL/g为最优条件。

图 5 液料比对二氢杨梅素提取率的影响
2.2.4pH对二氢杨梅素提取率的影响固定提取温度70℃、时间60 min、体积质量30 mL/g,pH梯度为5、6、7、8、9,每个pH值平行3份,取平均值。由图6可知,在pH值5~9的范围内,弱碱条件下的提取率比弱酸条件下的提取率要高。二氢杨梅素的等电点在5.0左右,所以弱碱条件有利于二氢杨梅素的提取,强碱条件会导致二氢杨梅素的开环[17]。故pH=8为最优条件。
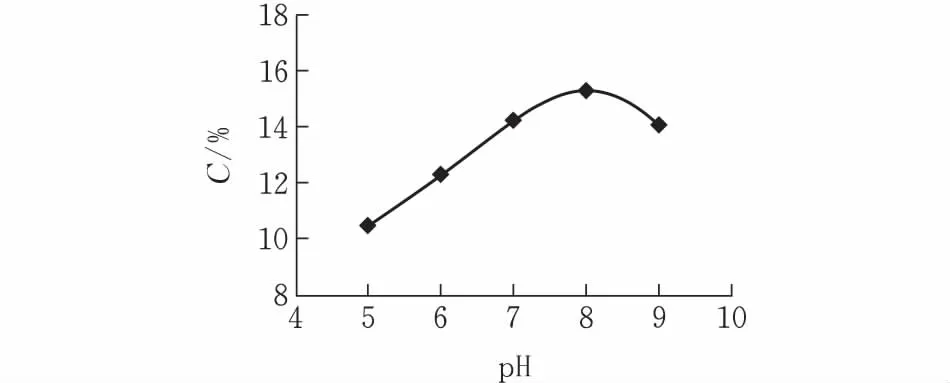
图 6 pH值对二氢杨梅素提取率的影响
2.3响应面分析法优化提取工艺
根据Box-Behnken的中心组合设计原理,选择提取温度、提取时间和pH等3个因素为自变量,分别以x1、x2、x3表示,并以+1、0、-1分别代表自变量的高、中、低水平,按方程xi=(Xi-Xo)/X对自变量进行编码。其中,xi为自变量的编码值,Xi为自变量的真实值,X为自变量的变化步长。采用三因素三水平的响应面分析法进行试验设计,试验因素水平及编码见表1。

表1 Box-Behnken设计因素与水平
编码值与真实值之间的关系x1=(X1-70)/10,x2=(X2-60)/10,x1=X3-8。
2.3.1响应面分析方案及结果以3次平行实验所得提取率平均值为响应值(Y),Box-Behnken试验设计与结果见表2。对表2实验结果用Design Expert统计软件包进行方差分析,结果见表3。各因素经回归拟合后,得回归方程
Y=15.63+0.51x1+0.32x2+0.20x3+
0.10x1x2+0.13x1x3+0.15x2x3-
0.37x12-0.51x22-0.64x32
回归系数R2=0.8960,表明实验值与预测值高度拟合。

表2 Box-Behnken试验设计与结果

表3 回归模型的方差分析

表3数据显示,提取温度、提取时间的“Pr>F”值小于0.05,表明其影响显著,但pH的“Pr>F”值大于0.05表明其影响不显著。整体模型的“Pr>F”值小于0.05,表明该二次方程模型高度显著。
2.3.2提取工艺条件优化根据回归方程,作出响应面和等高线,以最大提取率为优化指标,考察拟合响应曲面的形状[18],分析提取温度、提取时间和pH对其影响(图7)所示。

(a)

(b)
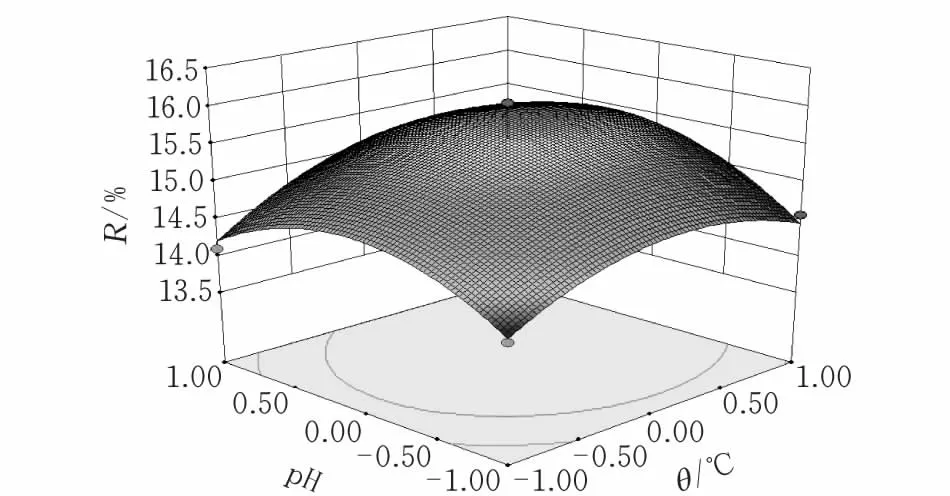
(c)图 7 DMY提取率的响应面和等高线分析图
通过Design-expert软件分析,得到二氢杨梅素提取的最优工艺条件为:提取温度77.8℃,提取时间64.3 min,pH8.29。在此条件下,提取率预测值为15.93%。为检验响应面所得结果的可靠性,采用上述优化提取条件进行提取,考虑到实际操作的便利,将提取工艺参数修正为:提取温度78℃,提取时间64 min,pH8.3,实际提取率为15.86%,与理论预测值相比,其相对误差为0.42%。因此,基于响应面分析得到的优化工艺参数准确可靠,具有使用价值。
2.4二氢杨梅素纯化
将粗提物用丙酮回流提取两次,液料比分别为5∶1和3∶1,合并丙酮提取液,浓缩至适当体积,然后加水溶解进行重结晶。采用30∶1的液料比进行重结晶,结果见4表。

表4 重结晶次数对得率和纯度的影响
由表4可知,结晶样品随重结晶次数的增加,得率从第1次的13.8%降低至第5次的3.1%,DMY的纯度从第1次的67.8%降低到第5次的97.8%。且经过3次重结晶后,纯度提高不再明显。考虑时间和能耗因素,重结晶次数取4次为宜。
3结论
1)以热水为提取剂,通过单因素实验对影响藤茶二氢杨梅素提取率的4个因素(提取温度、提取时间、液料比、pH)进行了考察,然后从中筛选出提取温度、提取时间和pH进行响应面分析,最终确定藤茶中二氢杨梅素(DMY)提取的最佳工艺条件,即:提取温度78℃,提取时间64 min,pH8.3,在此条件下,提取率可达到15.86%。
2)通过丙酮回流提取,对二氢杨梅素进行除杂浓缩后,通过多次重结晶得到高纯度二氢杨梅素。5次重结晶后,得率为4.2%,二氢杨梅素纯度可达97.8%。
3)本实验对二氢杨梅素的提取纯度过程进行了优化,可为二氢杨梅素的工业化提取提供良好的基础数据。但没有对二氢杨梅素在不同提取条件下的结构特性进行研究,这也是下一步工作的重点。
[参考文献]
[1]张友胜,杨伟丽,熊皓平.显齿蛇葡萄研究应用现状[J].茶叶通讯,2001(1):19-31.
[2]谢郁峰,陈卓涵,吕华冲.响应面分析法优化藤茶中二氢杨梅素的提取工艺[J].中国实验方剂学杂志,2012,18(17):46-49.
[3]谭斌,周双德,张友胜.二氢杨梅素纯化方法的比较研究[J].现代食品科技,2008,24(7):631-634.
[4]郭清泉,林淑英,李大光,等.二氢杨梅素抗氧化机制探讨[J].食品科学,2006b(5):121-123.
[5] 林淑英,张友胜.天然抗氧化剂二氢杨梅素的热稳定性及抗氧化性质研究[J].现代化工,2003,23:188-190.
[5]兰成生,蓝树彬.二氢杨梅素研究进展[J].中国民族民间医药杂志,2009,17(12):18-21.
[7]罗祖友,付晓芳,吴谋成.藤茶的研究进展[J].食品科学,2005,26(8):513-516.
[8]吴有炜.试验设计与数据处理[M].苏州:苏州大学出版社,2002:135-142.
[9]郑成,高晓明,杨铃,等.藤茶中二氢杨梅素的微波萃取[J].广州化工,2005(2):12-15.
[10] 熊璞,姚茂君,肖凯军,等.藤茶中二氢杨梅素的提取工艺研究[J].现代食品科技,2009,25(8):907-910.
[11] 韦星船,郑成,等.藤茶二氢杨梅的提取新工艺研究[J].食品科技,2007(9):103-107.
[12] 李卫,宁正祥.逆流法提取二氢杨梅索研究[J].食品科学,2004,25(11):192-194.
[13] 张友胜,杨伟丽,胡自勇.“增温溶解,保温过柱,温水解吸”提纯二氢杨梅索[J].天然产物研究与开发,2002(3):50-53.
[14] Wang D Y, Zhang S Z.The chemical constituents of Ampelopsis grossedentata[J].Subtrop Plant Research Commun,1998,27(2):39-44.
[15] 张友胜,杨伟丽,崔春,等.显齿蛇葡萄化学成分的研究[J].中草药,2003(5):46-48.
[16] 王岩,王婴,周莉玲,等.正交试验法优选藤茶的提取工艺[J].中国中药杂志,2002,4(27):302-303.
[17] 胡远艳.藤茶中双氢杨梅树皮素的研究进展[J].时珍国医国药,2005,16(2):157-158.
[18] Muralidhar R V,Chirumamila R R,Marchant R,et al.A response surface approach for the comparison of lipase production by Candida cylindrace using two different carbon sources[J].Biochem Engin,2001,9(1):17-23.
[责任编校: 张众]
The Extraction Process of Dihydromyricetin from Ampelopsis Grossedentata by Response Surface Analysis
GUO Wei1,WU Zhengqi2,WAN Duanji1,WU Huan1,CHEN Aiyang1
(1SchoolofResourcesandEnvironmentalEngin.,HubeiUniv.ofTech. ,Wuhan430068,China;2SchoolofFoodandPharmaceuticalEngin.,HubeiUniv.ofTech.,Wuhan430068,China)
Abstract:The opitimized extraction of dihydromyricetin from ampelopsis grossdentata by response surface analysis is researched in this paper. On the basis of single factor experiment, three key factors were screened out, and the best extraction condition was determined by the response surface method(RSM). The results showed that: extraction temperature78℃,extraction time 64min,the pH8.3. Under such condition, the predictive value of the dihydromyricetin extraction rate can reach 15.926%, and the measured value is 15.860%,the relative error 0.42%; and after five recrystallization and purification experiments, the purity of DMY can be 97.8%.
Keywords:Dihydromyricetin(DMY);Extraction rate;Response Surface Methodology(RSM);Box-Behnken design
[收稿日期]2016-01-20
[基金项目]“十二五”国家科技支撑计划项目(2012BAD33B03)
[作者简介]郭巍(1989-), 男, 湖北随州人,湖北工业大学硕士研究生,研究方向为新型分离技术 [通讯作者] 吴正奇(1966-),男,湖北武汉人,湖北工业大学教授,研究方向为食品加工、食品添加剂
[文章编号]1003-4684(2016)02-0106-05
[中图分类号]TS21
[文献标识码]:A
