着丝粒蛋白W在脑胶质瘤中的表达及其对侵袭的作用
2016-06-08吴淼经汲乾坤范阳华吕世刚叶敏华祝新根
吴淼经,汲乾坤,范阳华,吕世刚,叶敏华,吴 雷,祝新根
(南昌大学第二附属医院神经外科,江西南昌 330006)
◇基础研究◇
着丝粒蛋白W在脑胶质瘤中的表达及其对侵袭的作用
吴淼经,汲乾坤,范阳华,吕世刚,叶敏华,吴雷,祝新根
(南昌大学第二附属医院神经外科,江西南昌330006)
摘要:目的探讨着丝粒蛋白W(centromere protein W, CENP-W)在人脑胶质瘤中的表达水平及与预后的相关性,并探讨其对脑胶质瘤细胞侵袭作用的影响。方法在高级别胶质瘤组织、低级别胶质瘤及瘤旁正常脑组织中,采用蛋白质印迹法、实时荧光定量PCR法检测CENP-W的表达水平,并统计分析表达水平与胶质瘤临床病理特征及预后的相关性,应用特异性siRNA干扰U251细胞中CENP-W表达使其下调后,通过Transwell侵袭实验观察转染CENP-W siRNA对U251细胞侵袭能力的影响。结果胶质瘤组织CENP-W表达水平明显高于正常脑组织,并且与胶质瘤的病理级别呈正相关性;转染成功后,与空白对照组及阴性对照组比较,转染CENP-W-siRNA组的细胞侵袭及迁移能力均下降,Kaplan-Meier生存分析及Log-rank检验显示低表达CENP-W患者的PFS明显长于高表达组。结论CENP-W表达与胶质瘤的病理级别呈正相关,CENP-W可以促进脑胶质瘤的侵袭,预示CENP-W可作为胶质瘤治疗新靶点。
关键词:着丝粒蛋白W;脑胶质瘤;侵袭;
脑胶质瘤是常见的成人恶性脑肿瘤,确诊后5年存活率小于3%,预后极差[1-2]。其生长迅速且呈恶性侵袭性发展,虽可采用手术切除、放化疗以及生物治疗等多方案对肿瘤进行干预,但肿瘤仍可在短时间内复发及远处转移,严重威胁患者的生命安全,至今仍是神经外科最棘手的问题,其本质上是一种多基因异常疾病,针对与胶质瘤发生、发展相关的基因异常的治疗已成为研究热点[3]。
着丝粒蛋白W(centromere protein W, CENP-W)是一个新发现的致癌基因,于2007年首次被报道[4],研究表明CENP-W广泛高表达于卵巢、肝脏、肺、结肠、胃、胰腺等多种癌症组织中,最初因确定为一个假定的致癌基因而被命名为肿瘤上调蛋白-2(cancer-upregulated gene 2, CUG2)[4-5]。但是,CENP-W在脑胶质瘤中的作用机制尚不明确。本文通过检测不同级别胶质瘤组织和正常脑组织中CENP-W表达水平、并通过转染小干扰RNA(small interfering RNA, siRNA)至U251细胞分析CENP-W在脑胶质瘤中的作用机制及与侵袭的关系,为脑胶质瘤的基因治疗靶点提供新的思路。
1材料与方法
1.1标本来源及临床资料共纳入脑胶质瘤标本63例,均取自2011年1月至2014年12月于南昌大学第二附属医院神经外科,其中男性36例,女性27例,年龄19~70岁,平均49.2岁。按照WHO神经系统肿瘤分类标准(2007)进行分级:25例低级别脑胶质瘤中20例低级别星形细胞瘤(WHO Ⅰ~Ⅱ级)和5例少突胶质细胞瘤(WHO Ⅱ级);38例高级别胶质瘤中16例间变性星形细胞瘤(WHO Ⅲ级)和22例胶质母细胞瘤的(WHO Ⅳ级)。正常对照组:颅脑外伤手术切除的正常脑组织(12例),并其基线资料可比。本研究获得所有患者的知情同意,并经本院医学伦理委员会审核通过。
1.2实验材料及来源人脑胶质瘤U251细胞株由本实验室存储;胎牛血清和DMEM培养基均购自美国HyClone公司;针对CENP-W基因序列的特异性小干扰RNA(small interference RNA, siRNA),CENP-W、β-actin的PCR引物由美国Invitrogen公司设计并合成;RNA提取试剂盒、逆转录试剂盒、QRT-PCR试剂盒、LipofectAMINE2000均购自日本TaKaRa公司;蛋白抽提试剂盒购自北京普利莱基因技术有限公司;兔抗人CENP-W多克隆抗体购自美国RayBiotech公司,Transwell板购自美国Corning公司,聚偏二氟乙烯(PVDF)膜购自北京全式金生物技术有限公司。
1.3Real-time PCR检测脑胶质瘤组织及细胞中CENP-W mRNA的表达用Trizol提取细胞总RNA,TaKaRa公司逆转录试剂盒合成cDNA。以qPCR检测各组CENP-W mRNA的表达量。反转录条件:37 ℃反应15 min,85 ℃反应5 s。采用SYBR Green荧光染料掺入法在美国ABI 7300扩增仪上进行扩增,扩增反应条件:95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s,40次循环。CENP-W基因的上下游引物分别为:5′-AGTGGTGACTTATTGGTCCATCTG-3′和5′-AAGCGTTTGTCCTGGACTCTTC-3′。GAPDH的上
下游引物分别为:5′-GTTGGAGGTCGGAGTCAACGG-3′和5′-GAGGGATCTCGCTCCTGGAGGA-3′。整个反应过程中荧光信号的变化由qPCR仪监测。2-△△CT为RWDD3 mRNA的相对表达量。
1.4蛋白质印迹法检测脑胶质瘤组织及细胞中CENP-W蛋白的表达提取脑胶质瘤组织及细胞总蛋白,利用生物分光光度计比色分析总蛋白含量。进行聚丙烯酰胺凝胶电泳,电泳结束后将蛋白胶条转移至PVDF膜,TBST洗膜后加入膜封闭液,37 ℃封闭2 h,TBST洗膜3次,加入CENP-W(1∶800稀释)、β-actin内参一抗,4 ℃过夜,洗膜3次后加入二抗(1∶5 000稀释)室温孵育2 h,TBST洗膜10 min 3次,置增强化学发光试剂ECL底物中反应5 min,TBST洗膜后用化学发光法进行曝光、定影。利用凝胶图像分析系统对胶片进行灰度扫描和净吸光度值分析。
1.5随访随访全部胶质瘤术后患者,无失访,随访时间:6~45个月,记录患者无进展生存期(progress free survival, PFS),观察CENP-W表达水平与PFS的关系。
1.6细胞培养与CENP-W siRNA转染将U251细胞用含100 mL/L胎牛血清的DMEM培养液,在37 ℃、50 mL/L CO2的恒温培养箱中培养。感染前取对数生长期的U251细胞接种于6孔细胞培养板中,每孔5×104个细胞;使用不含抗生素的含100 mL/L胎牛血清(FBS)的DMEM培养基,待细胞融合度达到约60%左右时用Lipofectamine 2000转染,分3组:空白对照组、阴性对照组和CENP-W siRNA组。CENP-W siRNA序列为5′-GCAGAAGAGTCCAGGACAA-3′,阴性对照组siRNA阴性对照序列为5′-GCATGGAGAGAGCAACCAA-3′;转染后24 h后,将细胞置于荧光显微镜下观察,细胞内可见点状荧光,若荧光细胞比例占50%以上则判断为转染成功。
1.7Transwell实验检测转染后U251细胞侵袭、迁移能力的变化转染48 h后在Transwell上室中加入1∶2(基质胶∶DMEM)稀释后的基质胶60 μL,37 ℃ 30 min使其聚合成凝胶。在下室中加入细胞条件培养液600 μL。待检细胞用无血清培养基制成单细胞悬液,上室中加入1×105个细胞,24 h后弃上室液体,擦去Transwell小室上室面未穿过膜的细胞,甲醇固定30 min风干后用结晶紫染色20 min。200倍下计数上、中、下、左、右5个视野中粘附细胞数,计算平均值. 每组设4个复孔,以上所有实验均重复3次。
细胞迁移实验同侵袭实验,只是Transwell小室上室面不铺Matrigel基质胶,其余方法同上。

2结果
2.1Real-time PCR法检测脑胶质瘤组织中CENP-W mRNA表达差异Real-time PCR检测正常脑组织,低级别及高级别脑胶质瘤组织的CENP-W mRNA相对表达水平分别为0.46±0.09、0.82±0.04、1.18±0.07。结果显示高级别脑胶质瘤中CENP-W mRNA表达水平较正常组及低级别脑胶质瘤相比显著增高,并随胶质瘤恶性程度的增高而表达增高(F=130.2,P<0.000 1,图1)。
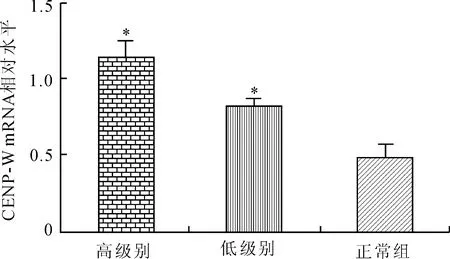
图1Real-time PCR检测CENP-W mRNA在胶质瘤组织及正常脑组织中的表达
Fig.1 The expressions of CENP-W mRNA in glioma tissues and adjacent brain tissues detected by Real-time PCR
与正常组比较,*P<0.05。
2.2免疫蛋白印迹法检测脑胶质瘤组织中CENP-W蛋白表达及差异Western blot检测正常脑组织,低级别及高级别脑胶质瘤组织中CENP-W的蛋白相对表达水平分别为1.00±0.24、4.21±0.64、7.21±0.98,结果显示高级别脑胶质瘤中CENP-W蛋白表达水平较正常组及低级别脑胶质瘤相比显著增高,并随胶质瘤恶性程度的增高而表达增高(F=101.5,P=0.000 4,图2)
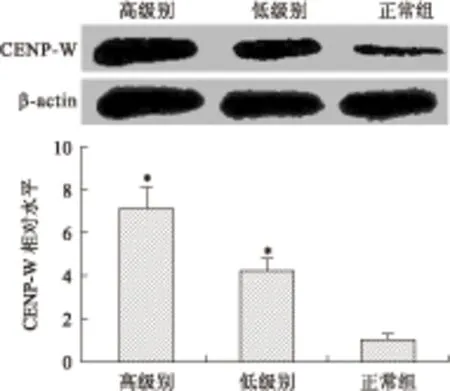
图2Western blot检测CENP-W蛋白在胶质瘤组织及正常脑组织中的表达
Fig.2 The expression of CENP-W protein in glioma tissues and adjacent brain tissues detected by Western blot
与正常组比较,*P<0.05。
2.3CENP-W的表达对胶质瘤患者预后的影响Kaplan-Meier 生存分析显示,CENP-W低表达的胶质瘤患者的无进展生存期为18.31月,高表达组的无进展生存期为28.22月,CENP-W单变量分析显示, CENP-W低表达患者的PFS明显长于高表达组(χ2=18.92,P=0.001),差异有统计学意义(图3)。
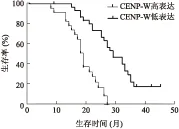
图3CENP-W的表达水平对胶质瘤患者PFS的影响
Fig.3 Comparison of PFS of CENP-W high expression and low-expression group in human gliomas
2.4Real-time PCR检测转染后细胞CENP-W mRNA表达Real-time PCR检测结果显示空白对照组、阴性对照组和转染组(CENP-W siRNA)的CENP-W mRNA值分别为1.35±0.10、1.37±0.05、0.25±0.08,与空白对照组和阴性对照组比较.CENP-W siRNA组细胞CENP-W mRNA的表达降低,差异有统计学意义(F=364.0,P<0.000 1),空白对照组与阴性对照组相比差异无统计学意义(图4)。
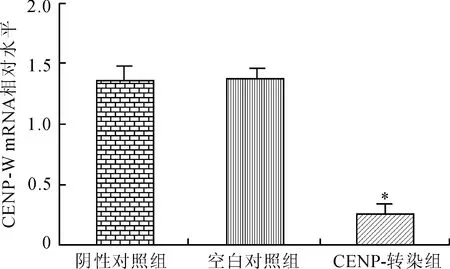
图4CENP-W siRNA感染U251细胞对CENP-W 的mRNA表达的影响
Fig.4 The mRNA expression level of CENP-W in the U251 cells after transfection with CENP-W siRNA detected by Real-time PCR
与阴性对照组和空白对照组比较,*P<0.05。
2.5Western blot检测转染后细胞CENP-W的蛋白表达Western blot检测结果显示空白对照组、阴性对照组和CENP-W siRNA转染组的CENP-W蛋白表达值分别为1.00±0.11、1.08±0.09、0.31±0.08,与空白对照组和阴性对照组比较,CENP-W siRNA转染组细胞CENP-W蛋白的表达降低,差异有统计学意义(F=214.2,P=0.0018),空白对照组与阴性对照组相比差异无统计学意义(图5)。
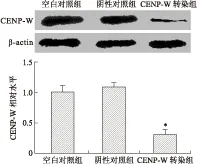
图5CENP-W siRNA感染U251细胞对CENP-W蛋白表达的影响
Fig.5 The protein levels of CENP-W in the U251 cells after transfection with CENP-W siRNA detected by Western blotting
与阴性对照组和空白对照组比较,*P<0.05。
2.6Transwell实验检测细胞迁移能力Transwell实验检测细胞迁移能力结果见图6。3组穿膜细胞数不同,与空白对照组及阴性对照组相比较,CENP-W siRNA转染组穿膜细胞数明显减少,差异具有统计学意义(F=13.13,P=0.001),空白对照组与阴性对照组相比差异无统计学意义。
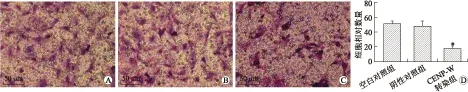
图6转染RWDD3-shRNA对U251细胞迁移能力的影响
Fig.6 The effects of CENP-W siRNA transfection on the migration ability of the U251 cells (×200)
A:空白对照组;B:阴性对照组;C:CENP-W转染组;D:统计学分析结果。与阴性对照组和空白对照组比较,*P<0.05。
2.7Transwell实验检测细胞侵袭能力Transwell实验检测细胞侵袭能力结果见图7。3组穿过基质膜细胞数不同,与空白对照组及阴性对照组相比较,CENP-W siRNA转染组穿膜细胞数明显减少,差异具有统计学意义(F=18.34,P=0.000 7),空白对照组与阴性对照组相比差异无统计学意义。

图7转染CENP-W siRNA对U251细胞侵袭能力的影响
Fig.7 The effects of CENP-W siRNA transfection on the invasion ability of the U251 cells (×200)
A:空白对照组;B:阴性对照组;C:CENP-W转染组;D:统计学分析结果。与阴性对照组和空白对照组比较,*P<0.05。
3讨论
脑胶质瘤的预后极差,特别是脑胶质母细胞瘤,是中枢神经系统常见的高度血管化恶性肿瘤之一,患者中位生存期不超过12个月,而传统的治疗方法效果较差,因此,急需找到脑胶质瘤相关基因作用靶点,为脑胶质瘤的基因治疗靶点提供新的思路。
LEE等[4]于2007年通过检测分析卵巢、肝、肺、肠及胰等8种癌组织与正常组织中发现了CENP-W异常明显的高表达,起初命名为一个假定的致癌基因CUG2(cancer-upregulated gene 2),CENP-W定位于染色体6q22.32,基因组DNA全长约8 500 bp,包含了3个外显子,cDNA全长约531 bp,mRNA全长约600 bp,蛋白质约10 ku。CENP-W在染色体上的定位区——人类6号染色体长臂的缺失,在恶性淋巴瘤及卵巢癌等恶性肿瘤中是很常见的染色体改变[6-7]。同时有研究发现阻断CENP-W可在哺乳动物细胞有丝分裂过程中观察到多极纺锤体和染色体错位等异常染色体结构的出现,并诱导异常的有丝分裂来影响细胞的活性[8]。SUZUKI等[9]研究证实CENP-W/CENP-T是着丝粒内板变形允许细胞分裂时着丝粒拉伸所必需的关键一员。PRENDERGAST等[10]研究发现CENP-W/T复合物是其他CCAN蛋白形成的上游(除外CENP-A),只有CENP-W/T复合物形成后才能诱导其他着丝粒蛋白的形成和动粒的组装。
同时有研究报道,将CENP-W基因重组到小鼠胚胎成纤维NIH3T3细胞中,使其高表达CENP-W,发现CENP-W-NIH3T3细胞和空白对照组相比生长明显加快,有些细胞出现瘤变的表型;软琼脂克隆实验也发现CENP-W-NIH3T3细胞株明显比对照组生长快,同时CENP-W-NIH3T3细胞的一些转移特性(如细胞的侵袭力和运动能力)明显增强;在克隆形成实验中,CENP-W-NIH3T3细胞在细菌培养皿中的密度极高,初步猜测CENP-W高表达可能使小鼠胚胎成纤维细胞失去了细胞接触抑制;另外该研究还将高表达CENP-W的细胞株行体外成瘤实验,结果发现CENP-W组无论在成瘤速度还是成瘤大小上都比阳性对照组强,由此推测CENP-W与肿瘤的发生、发展、侵袭和转移密切相关[11-12]。
综上研究表明,CENP-W与肿瘤的发生发展关系密切,但其具体机制及与脑胶质瘤的关系尚不明确。本研究证实,随胶质瘤恶性程度增高,CENP-W mRNA及蛋白表达水平增高,进一步的CENP-W蛋白分子的干扰实验结果表明,CENP-W升高可以促进脑胶质瘤的迁移及增殖能力。研究发现,性别、年龄与脑胶质瘤患者预后关系不密切[1,13]。我们发现CENP-W与患者预后指标PFS密切相关,表明CENP-W与胶质瘤的恶性程度及复发情况有关。表明CENP-W对脑胶质瘤的发生发展具有重要的作用,进一步在胶质瘤细胞中调控CENP-W的表达,进而观察胶质瘤细胞的增殖、周期、凋亡等生物学表型的改变及验证其相关作用通路及机制是我们进一步研究的重要方向。CENP-W作为一个新的脑胶质瘤发病机制的重要原因,与患者的预后密切相关,其更加深入的研究,为胶质瘤的治疗有望提供新的靶点。
参考文献:
[1] 范阳华,叶敏华,吴雷,等. 人脑胶质瘤中RSUME的SUMO化与HIF-1α/VEGF通路的相关性[J]. 西安交通大学学报(医学版), 2015, 36(4):472-478.
[2] WU L, YANG L, XIONG Y, et al. Annexin A5 promotes invasion and chemoresistance to temozolomide in glioblastoma multiforme cells[J]. Tumour Biol, 2014, 35(12):12327-12337.
[3] 李蕴潜,赵丽艳,石艳,等. miR-181b过表达对胶质瘤U87细胞中MT1-MMP和TIMP3蛋白表达和细胞侵袭能力的影响[J]. 吉林大学学报(医学版), 2015 41(5):925-931.
[4] LEE S, GANG J, JEON SB, et al. Molecular cloning and functional analysis of a novel oncogene, cancer-upregulated gene 2 (CUG2)[J]. Biochem Biophys Res Commun, 2007, 360(3):633-639.
[5] CHUN Y, PARK B, KOH W, et al. New centromeric component CENP-W is an RNA-associated nuclear matrix protein that interacts with nucleophosmin/B23 protein[J]. J Biol Chem, 2011, 286(49):42758-42769.
[6] TABORELLI M, TIBILETTI M G, MARTIN V, et al. Chromosome band 6q deletion pattern in malignant lymphomas[J]. Cancer Genet Cytogenet, 2006, 165(2):106-113.
[7] TIBILETTI MG, BERNASCONI B, FURLAN D, et al. Chromosome 6 abnormalities in ovarian surface epithelial tumors of borderline malignancy suggest a genetic continuum in the progression model of ovarian neoplasms[J]. Clin Cancer Res, 2001, 7(11):3404-3409.
[8] KIM H, LEE M, LEE S, et al. Cancer-upregulated gene 2 (CUG2), a new component of centromere complex, is required for kinetochore function[J]. Mol Cells, 2009, 30, 27(6):697-701.
[9] SUZUKI A, HORI T, NISHINO T, et al., Spindle microtubules generate tension-dependent changes in the distribution of inner kinetochore proteins[J]. Cell Biol, 2011, 193(1):125-140.
[10] PRENDERGAST L, VUUREN C, KACZMARCZYK A, et al. Premitotic assembly of human CENPs-T and -W switches centromeric chromatin to a mitotic state[J]. PLoS Biol, 2011, 9(6):e1001082.
[11] KIM H, LEE M, LEE S, et al. Cancer-upregulated gene 2 (CUG2), a new component of centromere complex, is required for kinetochore function[J]. Mol Cells, 2009, 27(6):697-701.
[12] PARK EH, PARK EH, CHO IR, et al. CUG2, a novel oncogene confers reoviral replication through Ras and p38 signaling pathway[J]. Cancer Gene Ther, 2010, 17(5):307-314.
[13] 廖长春,范阳华,肖兵,等. 缺氧诱导因子-1α与着丝粒蛋白W在人胶质瘤组织及细胞中表达的相关性[J]. 肿瘤, 2014, 34(11):1045-1051.
(编辑韩维栋)
Expression of CENP-W in gliomas and its effect on invasion of gliomas cells
WU Miao-jing, JI Qian-kun, FAN Yang-hua, LÜ Shi-gang, YE Min-hua, WU Lei, ZHU Xin-gen
(Department of Neurosurgery, the Second Affiliated Hospital of Nanchang University, Nanchang 330006, China)
ABSTRACT:ObjectiveTo investigate the expression of CENP-W in gliomas and its relationship with clinicopathological parameters and prognosis and to explore the effects of centromere protein W (CENP-W) on the invasion of gliomas cells. MethodsThe expressions of CENP-W in high-grade glioma tissues, low-grade glioma tissues, and adjacent brain tissues were detected by real-time fluorescence quantitative PCR and Western blotting. The correlation of the expression of CENP-W with clinicopathological parameters and prognosis was analyzed statistically. Human gliomas U251 cells in vitro were transfected with small interfering RNA to downregulate the expression of CENP-W. The invasion and migration capabilities of gliomas cancer cells were assessed by Transwell assays. ResultsThe expression level of CENP-W was significantly higher in glioma tissues than in normal tissues. There was a positive correlation between the three protein expression levels and the pathological grade of gliomas. CENP-W siRNA was successfully transfected into U251 cells. Compared with those of the cells transfected with the scramble siRNA and control cells, the invasive and migration activities were inhibited in the U251 cells transfected with CENP-W siRNA. The Kaplan-Meier analysis and Log-Rank test showed significant differences in progress free survival (PFS) between the CENP-W high-expression and low-expression groups. ConclusionThe expression level of CENP-W was positively correlated with the pathological grade of gliomas and CENP-W can promote glioma cell invasion. It implicates that CENP-W can be a novel target in gliomas treatment.
KEY WORDS:centromere protein W (CENP-W); glioma; invasion
收稿日期:2015-07-26修回日期:2015-10-08
基金项目:江西省自然科学基金计划项目(No.20132BAB205043)、江西省教育厅科学技术研究项目(No.GJJ14066)
通讯作者:祝新根. E-mail: zxg2008vip@163.com
中图分类号:R739.41
文献标志码:A
DOI:10.7652/jdyxb201603018
Supported by the Natural Science Foundation of Jiangxi Province (No.20132BAB205043) and Jiangxi Province Department of Education Science and Technology Research Project (No.GJJ14066)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160407.1735.012.html(2016-04-07)
