大剂量盐酸氨溴索对大鼠肺缺血再灌注损伤后的肺保护机制
2016-06-08张卫东李小飞李建忠李晓平李明江杜洪印
杨 波,张卫东,李小飞,王 荣,李建忠,李晓平,李明江,杜洪印,姜 涛
(1. 天津市第一中心医院胸外科,天津 300192;2. 第四军医大学唐都医院胸外科,陕西西安 710038;3. 西安交通大学航天航空学院,陕西西安 710049;4. 哈尔滨医科大学附属第二医院心血管外科,黑龙江哈尔滨 150001;5. 天津市第一中心医院麻醉科,天津 300192)
◇基础研究◇
大剂量盐酸氨溴索对大鼠肺缺血再灌注损伤后的肺保护机制
杨波1,张卫东1,李小飞2,王荣3,李建忠4,李晓平1,李明江1,杜洪印5,姜涛2
(1. 天津市第一中心医院胸外科,天津300192;2. 第四军医大学唐都医院胸外科,陕西西安710038;3. 西安交通大学航天航空学院,陕西西安710049;4. 哈尔滨医科大学附属第二医院心血管外科,黑龙江哈尔滨150001;5. 天津市第一中心医院麻醉科,天津300192)
摘要:目的探讨大剂量盐酸氨溴索对大鼠肺缺血再灌注损伤后肺的保护作用以及可能的作用机制。方法将健康雄性SD大鼠60只随机分成4组:对照组、氨溴索组、肺缺血再灌注(I/R)组、I/R+氨溴索组,每组15只。造模前分别给予大剂量氨溴索组和I/R+氨溴索组静脉注射盐酸氨溴索0.75 g/L,分别给予对照组和I/R组注射与上述氨溴索治疗量等容量的生理盐水。观察肺组织病理学改变并评分,检测湿干重比值(W/D)、白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、细胞凋亡数目、核转录因子-κB(NF-κB),Western blot方法观察大鼠肺组织Toll样蛋白4(Toll-like receptor 4, TLR4)信号通路的蛋白表达水平。结果与对照组相比,I/R组肺泡壁增宽,肺泡腔内可见出血等炎症表现,W/D、炎症因子显著升高,肺组织W/D、IL-1β、TNF-α、凋亡细胞、NF-κB活性和TLR4信号通路相关蛋白表达水平明显升高;与(I/R)组相比,I/R+氨溴索组肺泡腔内出血、水肿等炎症表现减轻,W/D、炎症因子、凋亡细胞显著降低,肺组织NF-κB转录活性及TLR4信号通路表达水平明显降低。结论大剂量盐酸氨溴索通过下调TLR4信号通路发挥对缺血再灌注损伤大鼠的肺保护作用。
关键词:大剂量盐酸氨溴索;肺缺血再灌注损伤;肺保护;Toll样蛋白受体4(TLR4)
随着肺移植、心脏手术、心肺脑复苏以及血栓溶栓治疗的深入研究,肺缺血再灌注损伤(LIRI)及其所导致的肺功能障碍的发生机制和防治受到人们的高度重视。LIRI仍然是导致早期高发病率和晚期高死亡率最重要的原因[1-2]。大量临床实验研究证实,盐酸氨溴索大剂量应用时可对肺脏发挥抗炎、抗氧化等保护作用[3-5]。
本课题组前期研究发现,预先给予大剂量盐酸氨溴索对大鼠肺移植术后急性肺损伤有重要的保护作用,而其具体机制尚不清楚[3]。本实验拟进一步探讨大剂量盐酸氨溴索对大鼠LIRI后的肺保护作用,以及对Toll样蛋白4/核转录因子-κB信号通路的影响,以期为其临床应用提供更多的基础理论和实验依据。
1材料与方法
1.1实验动物健康的成年SD大鼠60只,均为雄性,由第四军医大学基础动物实验中心提供,体质量200~230 g。
1.2实验仪器及试剂电热恒温干燥箱(北京科伟永兴仪器有限公司),显微镜(德国徕卡公司),Western-blot蛋白电泳仪(Bio-Rad公司),盐酸氨溴索(勃林格殷格翰公司),兔抗大鼠TLR4抗体(美国CST公司),兔抗大鼠NF-κBp65抗体(美国CST公司),兔抗大鼠β-actin抗体(美国CST公司),免疫组化试剂盒(北京四正柏生物科技有限公司),BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),ELISA试剂盒(上海通蔚生物科技有限公司),TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司)。
1.3方法
1.3.1动物模型的建立、分组及给药健康成年雄性SD大鼠随机分为对照组、氨溴索组、I/R组和I/R+氨溴索组,每组15只。氨溴索组和I/R+氨溴索组在造模型前30 min给予静脉注射盐酸氨溴索0.75 g/L,对照组和I/R组则注射与上述治疗量等容量的生理盐水。腹腔注射10 g/L戊巴比妥40 mg/kg麻醉后,将大鼠仰卧固定于手术板上,经口气管插管,并连接呼吸机,呼吸机辅助通O2(60%),最高峰压在10 cm H2O,最大呼气末压力为2 cm H2O,呼吸频率60次/min,呼吸比2∶3,潮气量为9 mL,这些参数可以排除其他原因导致的急性肺损伤[2,6]。胸部备皮常规消毒后铺巾,无菌条件下取左侧第4肋间前外侧切口入胸腔,分离肌层,剪开胸膜,游离左肺门,尾静脉注射肝素50单位,混合盐水总体积500 μL,待5 min后肝素开始发挥作用时,以无创伤动脉夹夹闭肺门处血管,缝合切口,60 min后经原切口进胸,取出动脉夹,恢复血供,形成缺血再灌注。对照组全麻后方法同上,但不需夹闭肺门。
1.3.2肺组织湿/干重比值(W/D)立即获取样本右肺上叶称湿重后70 ℃电热恒温干燥箱中烤24 h后为干重,计算肺组织W/D。
1.3.3大鼠缺血再灌注损伤肺组织的HE染色右肺中叶经过固定、包埋、切片、染色,光镜下观察各组肺组织病理学变化。
1.3.4ELISA对大鼠缺血再灌注损伤炎症因子的检测麻醉处死大鼠,结扎肺门,支气管肺泡灌洗液(BALF)收集大鼠炎症因子,在4 ℃下灌洗液离心(1 000 r/min)5 min后取上清。根据产品说明书进行BCA蛋白定量。通过ELISA试剂盒检测IL-1β和TNF-α的表达水平。
1.3.5TUNEL对大鼠缺血再灌注损伤凋亡细胞的检测样本经过二甲苯脱蜡、梯度乙醇、不含DNase的蛋白酶K和TUNEL检测液孵育,最后用抗荧光淬灭封片液封片。随意选取镜下10个视野(×100),分别计数凋亡细胞和总细胞数,根据公式凋亡指数=凋亡细胞数/总细胞数计算凋亡指数(AI)。
1.3.6免疫组化对大鼠缺血再灌注损伤NF-κBp65的检测常规石蜡切片依次经过二甲苯、梯度乙醇脱蜡至水后,3 mol/L尿素消化,柠檬酸盐缓冲液(pH 6.0)进行抗原修复,新鲜配置30 mL/L H2O2封闭,滴加血清封闭液30 min,甩去血清,加一抗NF-κBp65(1∶150),4 ℃冰箱孵育过夜,37 ℃复温,滴加试剂B(生物素标记二抗)室温37 ℃孵育45 min,PBS冲洗,试剂C(亲和素)室温37 ℃孵育40 min。滴加新鲜配制的DAB显色液避光显色,8 min后中止显色,水洗,再以苏木素染色,依次经乙醇梯度脱水、二甲苯透明及中性树胶封片。设置空白对照以PBS代替一抗,其余步骤同上。
1.3.7Western blot对大鼠TLR4/NF-κB信号通路蛋白表达水平的检测肺组织加入细胞裂解液、充分匀浆,于4 ℃离心后,用BCA法进行蛋白定量,加上样缓冲液并煮沸5 min,上样10 μL,进行SDS-PAGE并转移到PVDF膜上。滴加50 g/L脱脂奶封闭1 h后,分别滴加兔抗大鼠TLR4抗体、phospho-IκBα抗体NF-κBp65抗体以及β-actin抗体(室温封闭1 h)及辣根过氧化酶标记的羊抗兔IgG二抗(室温封闭1 h)。滴加ECL反应混合液,置入仪器观察结果,分析灰度值。
2结果
2.1大剂量盐酸氨溴索对大鼠肺组织W/D的影响与对照组(4.2±0.2)及氨溴索组(4.1±0.1)相比,I/R
组(7.4±0.3)肺组织W/D明显升高,而I/R+氨溴索组(5.5±0.1)肺组织W/D明显降低(P<0.05,图1)。

图1肺缺血再灌注损伤后大鼠肺组织湿干重比值(W/D)

与对照组及氨溴索组比较,*P<0.05。
2.2各组大鼠肺组织的病理学变化对照组和氨溴索组大鼠肺组织小叶结构清晰,肺泡腔内无明显渗出,肺泡间质无明显炎性浸润,肺泡壁无明显增厚;而I/R组大鼠肺泡壁增宽,肺泡间质有炎性浸润,肺泡腔内可见大量出血和渗出等炎症表现;I/R+氨溴索组大鼠肺泡壁明显变薄,肺泡腔内出血量减少,炎性渗出减少(图2)。
2.3大剂量盐酸氨溴索对LIRI大鼠IL-1β和TNF-α炎症因子的影响大鼠LIRI后,IL-1β和TNF-α炎症因子的水平明显升高;大剂量盐酸氨溴索能显著降低IL-1β和TNF-α炎症因子的表达水平(表1)。

图2各组大鼠肺组织的病理学变化
Fig.2 Effect of ambroxol hydrochloride on pulmonary histopathologic changes of rats (HE, ×200)
A:对照组;B:氨溴索组;C:I/R组;D:I/R+氨溴索组。
表1ELISA检测缺血再灌注损伤后大鼠IL-1β和TNF-α水平的变化
Tab.1 Effect of ambroxol hydrochloride on the expressions of IL-1β and TNF-α in BALF
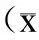
±s, n=15)
与对照组及氨溴索组比较,*P<0.05。
2.4盐酸羟考酮注射液对大鼠损伤肺组织凋亡细胞的影响TUNEL染色显示,凋亡细胞的细胞核发出强烈的红色荧光,I/R组凋亡指数为(31.22±2.04)%,与对照组[(1.27±0.58)%]和氨溴索组[(1.13±0.59)%]相比,凋亡细胞指数明显升高;I/R+氨溴索组[(20.03±0.41)%]凋亡细胞指数显著下降(P<0.05)。
2.5大剂量盐酸氨溴索对大鼠NF-κBp65活性的影响肺组织NF-κBp65蛋白在对照组与氨溴索组胞质、胞核中几乎无表达。与对照组相比较,I/R组NF-κBp65蛋白在胞质和胞核中表达量明显增多,处于活化状态;而I/R+氨溴索组NF-κBp65蛋白在胞质和胞核中表达量相对减少(图3)。

图3各组大鼠肺组织NF-κBp65的免疫组化结果
Fig.3 Expression of NF-κBp65 of lung tissues of rats with LIRI detected by Immunohistochemistry (×400)
A:对照组;B:氨溴索组;C:I/R组;D:I/R+氨溴索组。
2.6各组肺组织TLR4/NF-κB信号通路相关蛋白的表达水平对照组与氨溴索组中TLR4信号通路相关蛋白几乎无明显变化;I/R组中肺组织TLR4、phospho-IκBα以及NF-κBp65DNA binding的表达水平显著增高(P<0.05);而I/R+盐酸氨溴索组上述信号通路蛋白表达水平相对降低(P<0.05,表2)。
表2Western blot检测TLR4/NF-κB信号通路的蛋白含量
Tab.2Effect of ambroxol hydrochloride on the expression of TLR4/NF-κB signaling protein in lung tissues of rats with LIRI
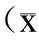
±s,n=15)
与对照组及氨溴索组比较,*P<0.05,#P<0.05。
3讨论
自1983年后,随着现代外科的发展,尽管脏器的保存、外科手术操作和围手术期处理有了很大的改进,但缺血再灌注损伤被认为是组织器官致伤的潜在重要因素,更是器官移植术后的常见并发症[6-7]。进一步加深LIRI发生发展机制的认识以及针对损伤机制寻找新的医疗预防及治疗思路是摆在临床工作者面前亟待解决的难题。
TLR4是识别细菌脂多糖(LPS)、炎症因子、活性氧的最主要受体,TLR4表达的水平决定着肺内炎症反应的程度[8]。通过对TLR4-髓样分化因子88(MyD88)的识别,使核转录因子-κB(NF-κB)活化,从而释放大量细胞因子及炎症介质,最终导致肺损伤。研究还发现,SARS冠状病毒及H5N1禽流感病毒产生的氧化磷脂类(OxPAPC)同样是重要的直接致损因素,而OxPAPC也正是通过触发TLR4而进一步导致肺损伤的发生[9]。因此,在众多致损因素导致肺损伤的机制中,TLR4通路都起到了关键作用。
已知TLR4/NF-κB信号传导通路的激活是直接导致再灌注损伤的主要因素之一[8,10]。TLR4与MyD88样衔接蛋白(MAL)聚集MyD88后,IL-1受体相关激酶 4 (IRAK4)与IL-1受体相关激酶1(IRAK1)在其下游聚集,IRAK1下游的肿瘤坏死因子受体相关因子6(TRAF6)向下继续作用在NF-κB激酶抑制物(IKK)α/β/γ复合物上,NF-κB被激活。激活后的NF-κB导致肺泡上皮细胞及肺泡巨噬细胞释放大量细胞因子及趋化因子,如IL-1β、TNF-α、IL-6、IL-8、单核细胞趋化因子1(MCP-1)与人生长调节致癌基因α(GROα)[11]。若能阻断TLR4/NF-κB信号传导通路,调控炎症反应的发生发展,可有效地减轻机体组织的损伤。
大剂量盐酸氨溴索对LIRI的保护机制国内外报道较少。延续前期课题,本课题组进一步研究发现,I/R+盐酸氨溴索可减轻大鼠肺水肿,减少细胞凋亡数目,降低IL-1β和TNF-α水平表达,同时抑制NF-κB转录活性;Western blot检测发现TLR4信号通路的相关蛋白表达水平显著下降。表明大剂量盐酸氨溴索可通过下调TLR4信号通路的表达,减少下游TRAF6作用于IKKα/β/γ复合物,从而抑制NF-κB的活化,最终缓解肺水肿、减轻炎症反应,发挥保护肺泡上皮细胞的作用。
综上所述,本实验初步探讨了大剂量应用盐酸氨溴索对大鼠LIRI具有显著的保护作用,为肺损伤后的恢复创造了有利条件。进一步发现TLR4/NF-κB信号通路可能作为盐酸氨溴索发挥保护作用的靶向调控位点,这为研究其临床药物的靶向治疗提供新的指导价值。
参考文献:
[1] ZHANG C, GUO Z, LIU H, et al. Influence of levosimendan postconditioning on apoptosis of rat lung cells in a model of ischemia-reperfusion injury[J]. PLoS One, 2015, 10(1):e0114963.
[2] 杨波,陈家宽,李文海,等. NDRG2在大鼠肺缺血再灌注损伤中的表达[J]. 现代生物医学进展, 2013, 13(5):828-831,913.
[3] 李明江,张卫东,王旭晖,等. 大剂量盐酸氨溴索对鼠肺移植后急性肺损伤的影响[J]. 中华老年医学杂志, 2012, 31(1):71-72.
[4] HUANG J, XU J, TIAN L, et al. A thioredoxin reductase and/or thioredoxin system-based mechanism for antioxidant effects of ambroxol[J]. Biochimie, 2014, 97:92-103.
[5] LU D, MA J, YANG X. Salmeterol combined with fluticasone propionate improved COPD in patients during stable stage[J]. Int J Clin Exp Med, 2014, 7(9):2907-2911.
[6] 杨波,张志培,姜鹏,等. N-myc下游调节基-2在大鼠肠缺血再灌注肺损伤中的表达及其与NF-κBp65的相关研究[J]. 创伤外科杂志, 2012, 14(6):543-546.
[7] YANG B, NI YF, WANG WC, et al. Melatonin attenuates intestinal ischemia-reperfusion induced lung injury in rats by up-regulating NDRG2[J]. J Surg Res, 2015, 194(1):273-280.
[8] ZHOU Z, ZHU X, CHEN J, et al. The interaction between Toll-like receptor 4 signaling pathway and hypoxia-inducible factor 1α in lung ischemia-reperfusion injury[J]. J Surg Res, 2014, 188(1):290-297.
[9] IMAI Y, KUBA K, NEELY GG, et al. Identification of oxidative stress and Toll-like receptor 4 signaling as a key pathway of acute lung injury[J]. Cell, 2008, 133(2):235-249.
[10] SHIMAMOTO A, POHLMAN TH, SHOMURA S, et al. Toll-like receptor 4 mediates lung ischemia-reperfusion injury[J]. Ann Thorac Surg, 2006, 82(6):2017-2023.
[11] YANG B, LI XP, NI YF, et al. Protective effect of isorhamnetin on lipopolysaccharide-induced acute lung injury in mice[J]. Inflammation, 2016, 39(1):129-137.
(编辑卓选鹏)
Protective effect of large dose of ambroxol hydrochloride on lung ischemia-reperfusion injury in rats
YANG Bo1, ZHANG Wei-dong1, LI Xiao-fei2, WANG Rong3, LI Jian-zhong4,LI Xiao-ping1, LI Ming-jiang1, DU Hong-yin5, JIANG Tao2
(1. Department of Thoracic Surgery, Tianjin First Central Hospital, Tianjin 300192;2. Department of Thoracic Surgery, Tangdu Hospital of the Fourth Military Medical University,Xi’an 710038; 3. School of Aerospace, Xi’an Jiaotong University, Xi’an 710049;4. Department of Cardiovascular Surgery, the Second Affiliated Hospital of Harbin Medical University, Harbin 150001; 5. Department of Anesthesiology,Tianjin First Central Hospital, Tianjin 300192, China)
ABSTRACT:ObjectiveTo observe the effects of large-dose ambroxol hydrochloride on lung ischemia-reperfusion injury (LIRI) and discuss the protection of ambroxol hydrochloride on Toll-like receptor 4 (TLR4)/nuclear transcription factor-kappa B (NF-κB) after lung ischemia-reperfusion injury in rats. MethodsWe randomly assigned 60 healthy SD rats into four groups (n=15 for each): control group, ambroxol hydrochloride group (0.75 g/L), ischemia-reperfusion group (I/R), and I/R+ambroxol hydrochloride group. The ambroxol hydrochloride group and I/R+ambroxol hydrochloride group were injected large dose of ambroxol hydrochloride by intravenous injection. The control group and the I/R group received normal saline. The effects of ambroxol hydrochloride on lung ischemia-reperfusion (LIR)-induced pathological changes and inflammatory cytokines release level were examined. DNA ends situ labeling assay (TUNEL) was used to detect the apoptosis of cells. NF-κBp65 was detected by immunohistochemistry. In addition, the TLR4 signaling pathway activation in lung tissues was detected by Western blot analysis. ResultsCompared with those in the control group, some hemorrhage and inflammation changes of lung tissues were observed; the W/D ratio, inflammatory cytokines, apoptosis of cells, NF-κBp65 and TLR4 signaling pathway protein expression in I/R group was obviously increased. Compared with I/R group, some mild hemorrhage and inflammation changes of lung tissues were observed; W/D ratio, inflammatory cytokines, apoptosis of cells, NF-κBp65 activity, and TLR4 signaling pathway expression were all decreased significantly in I/R+ambroxol hydrochloride group. ConclusionLarge dose of ambroxol hydrochloride can protect rats with lung ischemia-reperfusion injury by downregulating TLR4 signaling pathway.
KEY WORDS:large dose of ambroxol hydrochloride; lung ischemia-reperfusion injury; lung protection; Toll-like receptor 4
收稿日期:2015-03-25修回日期:2015-12-24
基金资助:国家自然科学基金资助项目(No.81070062);军队“十二五”课题(12MA208)
通讯作者:姜涛. E-mail: jiangtaochest@163.com;杜洪印. E-mail: duhongyin123@sina.com
中图分类号:R655.3
文献标志码:A
DOI:10.7652/jdyxb201603014
Supported by the National Natural Science Foundation of China (No.81070062) and the Military Medical Scientific Research Items of China (12MA208)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160411.1047.016.html(2016-04-11)
