超高效液相色谱—串联质谱测定猪肉中16种喹诺酮药物残留量
2016-06-07张颖颖李莹莹
张颖颖 李莹莹

摘 要:建立同时测定猪肉中萘啶酸、恶喹酸、依诺沙星、氟甲喹、诺氟沙星、环丙沙星、洛美沙星、丹诺沙星、恩诺沙星、氧氟沙星、沙拉沙星、二氟沙星、麻保沙星、培氟沙星、司帕沙星、奥比沙星16 种喹诺酮类药物残留的超高效液相-串联质谱(ultra performance liquid chromatography-tandem mass spectrophy,UPLC-MS/MS)的检测方法。样品采用乙酸-乙腈(1∶99,V/V)一次性振荡提取,用弱阴离子固相萃取柱净化,内标法定量。结果表明:16 种喹诺酮药物的检出限为0.2 ?g/kg,定量限为0.8 ?g/kg,空白猪肉中添加2.0、5.0、10.0 ?g/kg水平,16 种喹诺酮的回收率在70%~120%。该方法分析速度快、样品前处理干净、杂质污染少,可用于猪肉样品中喹诺酮类的残留检测。
关键词:喹诺酮;超高效液相色谱-串联质谱;猪肉;残留
Determination of Sixteen Quinolones Residues in Pork by Ultra Performance Liquid
Chromatography-Tandem Mass Spectrometry
ZHANG Yingying, LI Yingying
(China Meet Research Center, Beijing Academy of Food Sciences, Beijing 100068)
Abstract: An efficient ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was established for the analysis of residues of 16 quinolones (danofloxacin, difloxacin, lomefloxacin, pefloxacin, enoxacin, orbifloxacin, marbofloxacin, sparfloxacin, oxolinic acid, nalidixic acid, ofloxacin, norfloxacin, flumequine, enrofloxacin, sarafloxacin, and ciprofloxacin) in pork. Samples were extracted with 1% acetic acid-acetonitrile, and the extract was subjected to chromatographic separation on a weak anion solid-phase extraction column. Quantification of 16 quinolones was achieved by UPLC-MS/MS using internal standard method. The detection limit and quantification limit of the method were 0.2 ?g/kg and 0.8 ?g/kg respectively for all 16 quinolones. The average recoveries of 16 quinolones in blank pork at three spiked levels of 2.0, 5.0 and 10.0 ?g/kg ranged from 70% to 120%, with relative standard deviation (RSD) less than 6%. The method had the advantages of fast analysis, clean sample pretreatment and less pollution. Therefore, it can be used for the detection of quinolone residues in pork.
Key words: quinolones; ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); pork; residue
DOI:10.15922/j.cnki.rlyj.2016.05.008
中图分类号:TS207.3 文献标志码:A 文章编号:1001-8123(2016)05-0036-06
引文格式:
张颖颖, 李莹莹. 超高效液相色谱-串联质谱测定猪肉中16 种喹诺酮药物残留量[J]. 肉类研究, 2016, 30(5): 36-41. DOI:10.15922/j.cnki.rlyj.2016.05.008. http://rlyj.cbpt.cnki.net
ZHANG Yingying, LI Yingying. Determination of sixteen quinolones residues in pork by ultra performance liquid chromatography-tandem mass spectrometry[J]. Meat Research, 2016, 30(5): 36-41. (in Chinese with English abstract) DOI:10.15922/j.cnki.rlyj.2016.05.008. http://rlyj.cbpt.cnki.net
喹诺酮类是一类含4-喹诺酮基本结构的抗菌药,以细菌的脱氧核糖核酸(DNA)为靶,妨碍DNA回旋酶,进一步造成细菌DNA的不可逆损害,达到抗菌效果。主要作用于革兰阴性菌的抗菌药物,对革兰阳性菌的作用较弱。由于该药物抗菌广,与其他药物无交叉耐药性、不良反应少,所以被广泛用于畜类、禽类、水产品及蜜蜂等养殖业。若长期食用喹诺酮药物残留的食物,会造成胃肠道及中枢反应,并诱导耐药性的传递,不利于临床治疗[1]。联合国粮农组织/世界卫生组织食品添加剂专家联席委员会、欧盟都已制定了多种喹诺酮类药物在动物组织中的最高残留限量。美国食品药品监督管理局于2005年宣布禁止用于治疗家禽细菌感染的抗菌药物恩诺沙星的销售和使用[2]。我国也于2002年规定了环丙沙星、单诺沙星、恩诺沙星、沙拉沙星、二氟沙星、恶喹酸和氟甲喹等7 种喹诺酮类药物在动物肌肉组织中的最高残留限量。
目前,有关喹诺酮类药物残留的检测方法的报道较多,有微生物法[3-5]、液相色谱法[6-13]、液相色谱-质谱联用法[14-26]、酶联免疫法[27-31]等。由于液质分辨率高、选择性强、无需强调分离、一次性检测多种化合物、准确性高等优点,是检测喹诺酮药物残留的主要方法。本实验通过对国内外文献及相关标准进行总结分析,优化了一种快速分析、样品处理干净、杂质污染少的用于测定猪肉中16 种喹诺酮残留的液质联用方法。
1 材料与方法
1.1 材料与试剂
萘啶酸、恶喹酸、依诺沙星、氟甲喹、诺氟沙星、环丙沙星、洛美沙星、丹诺沙星、恩诺沙星、氧氟沙星、沙拉沙星、二氟沙星、麻保沙星、培氟沙星、司帕沙星、奥比沙星、环丙沙星-D8、恩诺沙星-D5 德国Dr. Ehrenstorfer公司;乙腈(色谱纯) 德国Merck公司;乙腈、乙酸、甲醇、氨水(分析纯) 国药集团化学试剂(上海)有限公司。HLB、MCX固相萃取柱 美国Waters公司;WAX固相萃取柱 天津博纳艾杰尔科技有限公司。
1.2 仪器与设备
TSQ超高效液相色谱串联四级杆质谱仪(配有电喷雾(electrospray ionization,ESI)离子源及Xcalibur 2.2数据处理系统) 美国Thermo公司;固相萃取装置
美国Agilent公司;20PR-520离心机 日本Hitachi公司;旋转蒸发仪 上海亚荣生化仪器厂;氮吹仪 天津市恒奥科技发展有限公司。
1.3 方法
1.3.1 标准溶液的配制
分别准确称取萘啶酸、恶喹酸、依诺沙星、氟甲喹、诺氟沙星、环丙沙星、洛美沙星、丹诺沙星、恩诺沙星、氧氟沙星、沙拉沙星、二氟沙星、麻保沙星、培氟沙星、司帕沙星、奥比沙星16 种标准品,用甲醇配制成100 ?g/mL的标准溶液(根据溶解度可适当加水溶解),于4 ℃的冰箱中冷藏保存。使用时依次用水稀释至相应质量浓度。
分别准确称取环丙沙星-D8及恩诺沙星-D5标准品,用甲醇配制为100 ?g/mL的标准溶液,于4 ℃的冰箱中冷藏保存。使用时用水稀释至100 ?g/L。
1.3.2 样品制备
准确称取10 g样品,加入100 ?L 100 ?g/L的内标溶液,加入10 mL乙腈-乙酸(99∶1,V/V)提取溶液,用玻璃棒搅拌后,继续加入10 mL的乙腈-乙酸溶液,振荡1 h,取出,12 000 r/min离心5 min,取上清液于梨形瓶中,加入10 mL异丙醇,混匀,于50 ℃条件下旋转蒸发至干,残渣用5 mL氨水-水(5∶95,V/V)溶解。若脂肪含量较大,则加入5 mL正己烷,混匀,待分层后,弃去上层。依次用5 mL甲醇、5 mL氨水-水(5∶95,V/V)淋洗WAX固相萃取柱,上样,再用5 mL水淋洗萃取柱,而后用甲酸-甲醇(2∶98,V/V)洗脱,洗脱溶液在50 ℃条件下氮气吹干,用1 mL流动相溶解残渣。
1.3.3 仪器条件
1.3.3.1 液相色谱条件
色谱柱:Thermo Hypersil Gold C18(100 mm×
2.1 mm,1.9 ?m);柱温:30 ℃;进样体积:10 ?L;流动相A:甲酸-水溶液(1∶99,V/V);流动相B:乙腈;二元梯度程序见表1。
表 1 二元梯度洗脱程序
Table 1 Binary gradient elution program
时间/min 体积分数/%
流动相A 流动相B
0~1 95 5
1~5 95~5 5~95
5.0~6.9 5 95
7~8 95 5
1.3.3.2 质谱条件
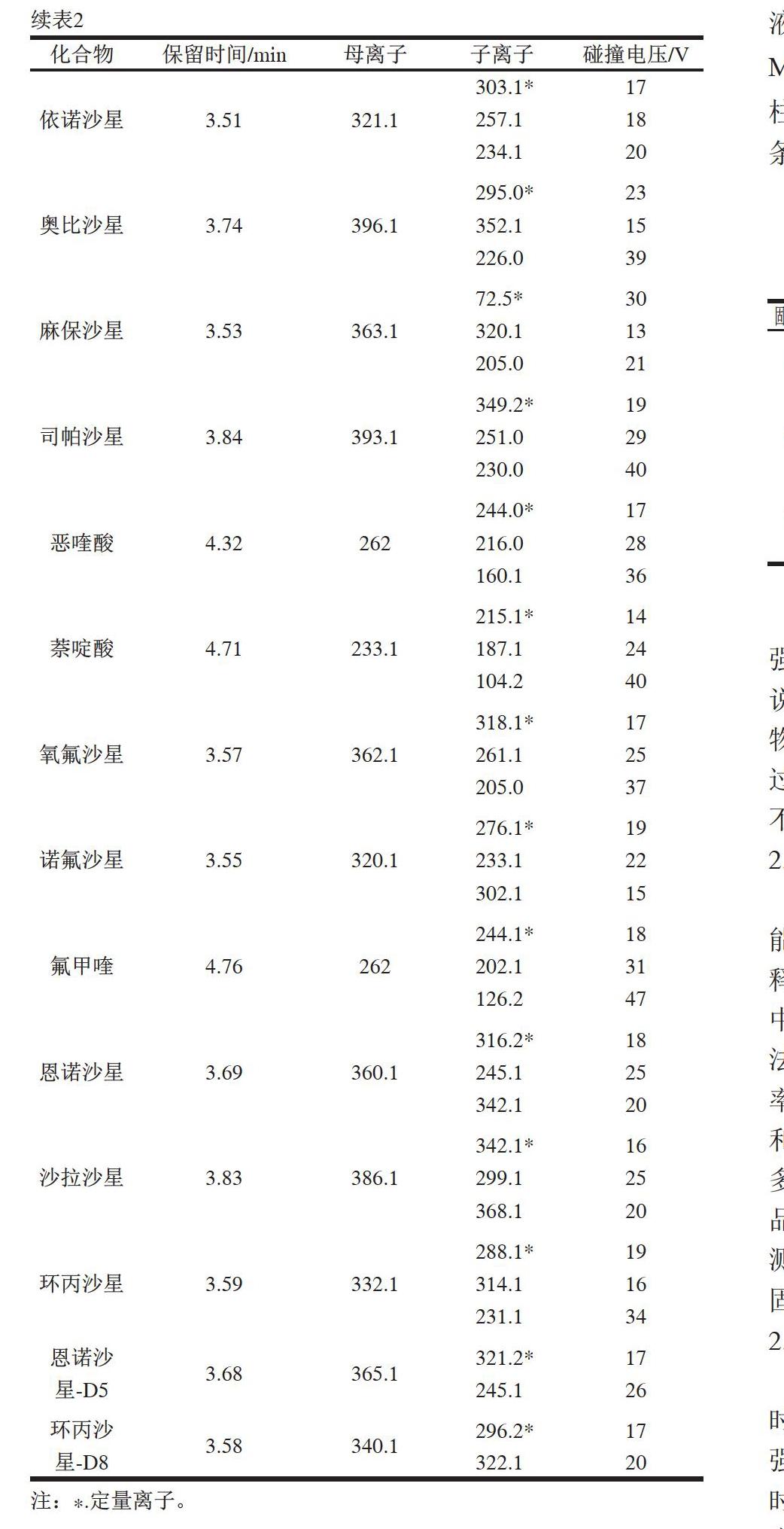
ESI离子源;正离子模式;毛细管电压:3 000 V;毛细管温度:350 ℃;雾化温度:350 ℃;辅助气压力:30 Arb;鞘气压力:10 Arb;质谱多反应监测(multiple reaction monitoring,MRM)采集参数见表2。
2 结果与分析
2.1 优化前处理条件
2.1.1 固相萃取柱的选择
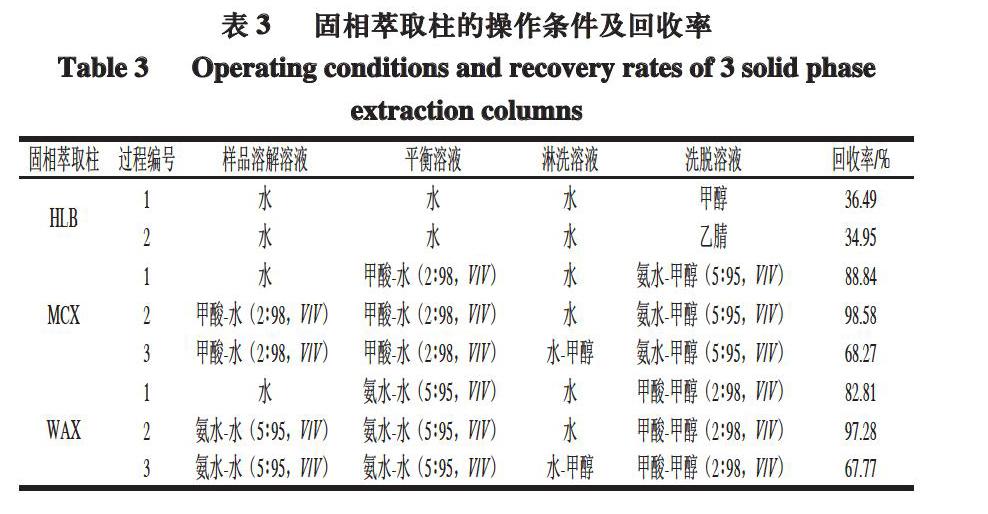
喹诺酮类药物的基本结构中既含有羧基官能团又含有叔胺基,是两性化合物,可以在反相柱、阳离子柱和阴离子柱中保留;在按SN/T 1751.2—2007《进出口动物源食品中喹诺酮类药物残留量检测方法》[14]操作的整个过程中,仅用正己烷萃取净化,效果不好,易损失且溶液浑浊。因此,样品净化过程中,考察了HLB反相柱、MCX阳离子交换柱和WAX弱阴离子交换柱3 类固相萃取柱对喹诺酮类药物的净化作用。每种固相萃取柱的操作条件及沙拉沙星回收率见表3。
由表3可知,HLB回收率均较低,说明离子相互作用强于疏水作用。WAX-3柱和MCX-3柱的回收率均较低,说明在淋洗过程中,甲醇在洗脱杂质时也洗脱了待测物。虽然MCX-2和WAX-2的回收率均较高,但是在实验过程中,MCX柱最后洗脱下的溶液较浑,说明洗脱效果不及WAX柱,最终使用WAX柱,过程即WAX-2。
2.1.2 样品提取过程优化
本实验的提取溶液为乙酸-乙腈(1∶99,V/V),既能够较好地沉淀蛋白,又能够破坏细胞组织,使之完全释放出来。相比于GB/T 21312—2007《动物源性食品中14 种喹诺酮药物残留检测方法 液相色谱-质谱/质谱法》[15]的提取溶剂EDTA-Mellvaine,提取效率高,回收率好,并且提取溶剂的配制过程简便。此外考察了超声和振荡的提取方式,超声的回收率稍高一些,但是杂质多,影响最低检出限,所以选择振荡的方式。最终的样品前处理过程即用20 mL乙酸-乙腈(1∶99,V/V)提取待测物,振荡1 h,移取上清液于梨形瓶中,旋蒸,过WAX固相萃取柱。
2.2 仪器条件优化
由于喹诺酮类药物是两性化合物,在优化质谱条件时,比较了正负离子扫描模式,发现正模式下离子响应强度更高,所以采用正离子扫描模式。在优化色谱条件时,流动相中加入适量甲酸会增强离子的响应信号。本实验采用甲酸-水溶液(1∶99,V/V)与乙腈为流动相对16 种化合物进行优化,由于分析的化合物较多,并且氟甲喹与萘啶酸的母离子与定量子离子相同,故选择梯度洗脱来进行分离,以保证良好的分离度和峰形。
2.3 线性范围及检出限
16 种喹诺酮类药物质量浓度在1~50 ?g/L,采用内标法,以待测物的定量离子峰面积与内标定量离子峰面积之比作为纵坐标,以待测物的质量浓度作为横坐标,绘制标准曲线,16 种化合物的线性方程及相关系数见表4。
在空白猪肉样品中加入16 种喹诺酮类药物的标准溶液,经过提取和净化后,上机,以3 倍信噪比为检出限,以10 倍信噪比为定量限,分别为0.2、0.8 ?g/kg。图1为空白猪肉样品中添加5.0 ?g/kg标准溶液的质谱图。
2.4 回收率和精密度
空白猪肉中分别添加2.0、5.0、10.0 ?g/kg的混合标准溶液,每个添加水平分别做6 个平行,按照1.3.2节的样品制备方法进行回收率实验。由表5可知,16 种喹诺酮的回收率在70%~120%,相对标准偏差(relative standard deviation,RSD)1%~6%,其精密度和回收率均符合残留分析方法的要求。
3 结 论
本方法建立了猪肉中16 种喹诺酮类药物残留的超高效液相色谱-串联质谱的检测方法。该方法采用乙酸-乙腈(1∶99,V/V)一次性振荡提取,用弱阴离子固相萃取柱净化,整个样品运行时间为8 min,简便快速。该方法采用内标法定量,空白猪肉中添加2.0、5.0、10.0 ?g/kg的水平,16 种喹诺酮的平均回收率为70%~120%,总体相对偏差小于6%。该方法操作简便,前处理干净,杂质污染少,重现性好,回收率高,并且满足国内外相关法规的要求,适合大批量样品的监测分析。
参考文献:
[1] NIWA H, CHUMA T, OKAMOTO K, et al. Simultaneous detection of mutations associated with resistance to macrolides and quinolones in Campylobacter jejuni and C. coli using a PCR-line probe assay[J]. International Journal of Antimicrobial Agents, 2003, 22(4): 374-379. DOI:10.1016/S0924-8579(03)00178-X.
[2] FDA. FDA Announces Final decision sbout veterinary medicine. FDA news[EB/OL]. [2005-7-28](2015-11-17). http://www.fda.gov/bbs/top ics/news/2005 /new01212. html.
[3] 黄晓蓉, 郑晶, 李寿崧, 等. 鳗鱼及其制品中喹诺酮类药物残留的微生物快速检测方法研究[J]. 淡水渔业, 2005, 35(4): 3-6. DOI:10.3969/j.issn.1000-6907.2005.04.001.
[4] 沈翠香. 微生物抑制法检测动物性食品中喹诺酮类药物残留的研究[D]. 乌鲁木齐: 新疆农业大学, 2010. DOI:10.3969/j.issn.1000-6907.2005.04.001.
[5] MAKI K, TOMOTO K, SETSUKO K, et al. Rapid determination of fluoroquinolone residues in honey by a microbiological screening method and liquid chromatography[J]. Journal of AOAC International, 2010, 93(4): 1331-1339.
[6] 中华人民共和国农业部. 农业部公告1025号-14—2008 动物性食品中氟喹诺酮类药物残留检测高效液相色谱法[S]. 北京: 中华人民共和国农业部, 2008.
[7] 刘靖靖, 林黎明, 江志刚, 等. 高效液相色谱法同时检测8 种喹诺酮类兽药残留量[J]. 分析试验室, 2007, 26(8): 5-9.
[8] TURIEL E, MARTIN-ESTEBAN A, TADEO J L. Multiresidue analysis of quinolones and fluoroquinolones in soil by ultrasonic-assisted extraction in small columns and HPLC-UV[J]. Analytica Chimica Acta, 2006, 562 (1): 30-35. DOI:10.1016/j.aca.2006.01.054.
[9] 宫小明, 于金玲, 孙军, 等. 固相萃取-高效液相色谱-荧光检测法同时测定动物源性食品中8种氟喹诺酮类药物残留[J]. 中国食品卫生杂志, 2014, 26(5): 460-464.
[10] 林玲, 杨春亮, 查玉兵, 等. 高效液相色谱法同时测定禽蛋中4 种氟喹诺酮类药物残留量[J]. 分析仪器, 2010(2): 17-20.
[11] LIU Guiying, WANG Nianbin, LI Wan, et al. Determination of fluoroquinolone residues in penaeus japonicas by microwave-assisted extraction and ion-pair high performance liquid chromatography[J]. Journal of Liquid Chromatography & Related Technologies, 2012, 35(9): 1270-1282. DOI:10.1080/10826076.2011.619036.
[12] PRAT M D, BENITO J, COMPANO R, et al. Determination of quinolones in water samples by solid-phase extraction and liquid chromatography with fluorimetric detection[J]. Journal of Chromatography A, 2004, 1041(1/2): 27-33. DOI:10.1016/j.chroma.2004.04.042.
[13] 潘媛, 牛华, 程晓云, 等. 高效液相色谱法检测六种氟喹诺酮类兽药残留前处理的优化[J]. 分析试验室, 2011, 30(5): 69-72. DOI:10.3969/j.issn.1000-0720.2011.05.016.
[14] 中华人民共和国出入境检验检疫行业标准, 中华人民共和国国家质量监督检验检疫总局. SN/T 1751.2—2007 进出口动物源食品中喹诺酮类药物残留量检测方法 第2部分: 液相色谱-质谱/质谱法[S]. 北京: 中国标准出版社, 2007.
[15] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准管理委员会. GB/T 21312—2007 动物源性食品中14 种喹诺酮药物残留检测方法 液相色谱-质谱/质谱法[S]. 北京: 中国标准出版社, 2007.
[16] 包晓丽, 任一平, 张虹. 超高效液相色谱-电喷雾串联四极杆质谱法检测牛奶中22 种喹诺酮类抗菌素[J]. 分析化学, 2009, 37(3): 389-394.
[17] CHIAOCHAN C, KOESUKWIWAT U, YUDTHAVORASIT S, et al.
Efficient hydrophilic interaction liquid chromatography-tandem mass spectrometry for the multiclass analysis of veterinary drugs in chicken muscle[J]. Analytica Chimica Acta, 2010, 682(1/2): 117-129. DOI:10.1016/j.aca.2010.09.048.
[18] 李雅丽, 晓蕾, 冀宝庆, 等. HPLC-ESI-MS/MS测定动物性食品中19 种喹诺酮类药物残留的研究[J]. 食品科学, 2008, 29(8): 502-506.
[19] 岳振峰, 林秀云, 唐少冰, 等. 高效液相色谱-串联质谱法测定动物组织中的16 种喹诺酮类药物残留[J]. 色谱, 2007, 25(4): 491-495.
[20] SAMANIDOU V, EVAGGELOPOULOU E, TROTZMULLER M, et al. Multi-residue determination of seven antibiotics in gilthead seabream using liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2008, 1203(2): 115-123.
[21] 祝子铜, 徐佳文, 雷美康, 等. HPLC-MS-MS同位素内标法测定火腿中14 种喹诺酮类残留量[J]. 食品科学, 2014, 35(20): 258-264. DOI:10.7506/spkx1002-6630-201420051.
[22] KANTIANI L, FARRE M, BARCELO D. Rapid residue analysis of fluoroquinolones in raw bovine milk by online solid phase extraction followed by liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(50): 9019-9027. DOI:10.1016/j.chroma.2011.09.079.
[23] RENATA P L, REYES R C, ROMERO R G, et al. Multiresidue determination of veterinary drugs in aquaculture fish samples by ultra high performance liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography B, 2012, 895/896 (3): 39-47. DOI:10.1016/j.jchromb.2012.03.011.
[24] AGUILERA-LUIZ M M, MARTINEZ-VIDAL J L, ROMERO-GONZALEZ R, et al. Multiclass method for fast determination of veterinary drug residues in baby food by ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2012, 132(4): 2171-2180. DOI:10.1016/j.foodchem.2011.12.042.
[25] 李佩佩, 张小军, 梅光明, 等. 分散固相萃取-超高效液相色谱-串联质谱检测水产品中14 种喹诺酮类药物[J]. 食品科学, 2014, 35(24): 265-270. DOI:10.7506/spkx1002-6630-201424051.
[26] 许蔚, 辛志宏, 张晓燕, 等. LC-MS/MS法测定蜂花粉中18 种喹诺酮类药物残留[J]. 环境化学, 2015, 34(4): 810-813.
[27] JIANG Wenxiao, WANG Zhanhui, ROSS C B, et al. Simultaneous determination of 13 fluoroquinolone and 22 sulfonamide residues in milk by a dual-colorimetric enzyme-linked immunosorbent assay[J]. Analytical Chemistry, 2013, 85(4): 1995-1999. DOI:10.1021/ac303606h.
[28] 李新朋, 姜金庆, 钱爱东, 等. 氟喹诺酮类药物多残留酶联免疫检测方法的建立[J]. 中国农业科学, 2014, 47(23): 4726-4735. DOI:10.3864/j.issn.0578-1752.2014.23.017.
[29] 郑晶, 黄晓蓉, 李耀平, 等. 鳗鱼中恩诺沙星残留量的酶联免疫检测方法[J]. 食品科学, 2004, 25(10): 247-250. DOI:10.3321/j.issn:1002-6630.2004.10.060.
[30] 李源珍. 喹诺酮类兽药多残留酶联免疫检测方法的建立[D]. 天津: 天津科技大学, 2011.
[31] SILVERLIGHT J, COLDHAM N, THORNE L, et al. Antibodies to the quinolones and fluoroquinolones for the development of generic and specific immunoassays for detection of these residues in animal products[J]. Food Additive and Contaminants, 2003, 20(3): 221-228. DOI:10.1080/0265203021000055388.
