固体乙醛酸法合成香兰素工艺中氧化反应研究
2016-06-06马境含刘福胜
马境含,刘福胜
(青岛科技大学 化工学院,山东 青岛 266042)
香兰素,俗称香草醛或香兰醛,化学名称为3-甲氧基-4-羟基苯甲醛,是一种白色或浅黄色结晶状粉末,具有香荚兰特有的香气及浓郁奶香味[1]。香兰素是一种广谱型香料,广泛应用于食品、化工、医药等行业。此外香兰素还是重要的有机合成中间体,其下游产品有 4,5-三甲氧基苯甲醛(TMB)、儿茶酸(3,4-二羟基苯甲酸)、藜芦醛(3,4-二甲氧基苯甲醛)等诸多产品,国内应用前景广阔[2]。目前,主要有三类方法获取香兰素:化学合成法、生物合成法和天然获取法[3-5]。但由于天然香兰素的产量难以满足世界的需求,仍需要人工合成。其中生物合成法目前还处于实验室研究阶段[6-7],难以大量生产,故化学法仍是合成香兰素的主流方法。化学法可分为乙醛酸法、木质素法、黄樟素法、丁香酚法、对羟基苯甲醛法等。木质素法[8]合成工艺路线生成废料多,在国外正被陆续淘汰;丁香酚法[9]采用价位较高的丁香酚为原料,但丁香酚来源难保证;黄樟素法[10]工艺复杂,路线长,同时生成异香兰素,产品收率低;而我国对羟基苯甲醛[11]产量极低使得该法难以工业化。其中以乙醛酸为原料制备香兰素,因其具有工艺路线成熟、反应程度易于控制、产品收率较高、整体环境污染较小的优点,因而该工艺的深入研究很有必要[12-14],但目前市面上多采用液体乙醛酸作为原料,乙醛酸水溶液中存在一定量的水,而且含有大量的醛类杂质如乙二醛等,难以满足高纯度香兰素制备的需求,故选择固体乙醛酸法合成香兰素,对氧化反应阶段的合成工艺进行了研究,考察了催化剂的种类及用量、反应时间、反应温度、反应体系碱性强弱、氧气压力等因素对实验结果的影响,得到了较为满意的研究结果。
1 实验部分
1.1 试剂与仪器
固体乙醛酸:工业品,青岛国林实业有限责任公司;愈创木酚:分析纯,天津市光复化工研究所;氢氧化钠、硫酸、甲苯:分析纯,莱阳经济技术开发区精细化工厂。
红外光谱仪:Nicolet 510P FT-IR,美国Thermo Nicolet公司; 超导核磁共振波谱仪:AVANCE500,布鲁克光谱仪器有限公司;气相色谱仪:Varian CP-3800,美国Varian公司;色谱柱DB-5:30 m×0.25 mm×0.25 μm,进样口温度250 ℃,检测器温度250 ℃,柱温:初始温度60 ℃保持1 min后,以25 ℃/ min的速率升温至220 ℃,在220 ℃保持12 min,分流比10∶1,直接进样,进样量1 μL。
1.2 实验原理
实验原理如下。
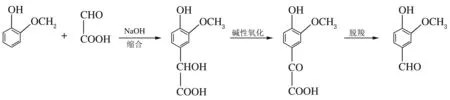
1.3 实验方法
(1) 在三口烧瓶中加入愈创木酚,用氢氧化钠调节pH值为碱性,在搅拌条件下同时滴加固体乙醛酸的水溶液和剩余氢氧化钠溶液,升温反应,反应结束后加入硫酸调节其为酸性,用甲苯萃取,水相为扁桃酸,待用。
(2) 向扁桃酸水溶液中加入氧化催化剂并调节溶液为碱性,转移至高压反应釜中,充入氧气,升温反应。
(3) 将反应后的产品进行脱羧,并用甲苯萃取,经减压蒸馏后得到粗品香兰素,计算收率。重结晶后,采用气相色谱法测产品纯度。香兰素收率通过以下公式计算:Y=m2/m1×100%,其中,m1为香兰素的理论产量;m2为香兰素的实际产量。
2 结果与讨论
2.1 氧化催化剂的选择
选取不同催化剂,在n(催化剂)∶n(扁桃酸)=0.67∶1,pH=13,pO2=2.0 MPa,反应温度控制在93 ℃,反应时间为8 h条件下,考察了氧化催化剂种类对收率的影响,结果见表1。

表1 催化剂种类对反应的影响1)
1) 收率以扁桃酸计。
由表1可知,选用了4种氧化性较弱的过渡金属铜作为催化剂,其中选取氧化铜为催化剂时,实验为非均相反应,香兰素收率不高,选择后三种铜盐作催化剂时,产品收率明显提升,羧酸铜作为催化剂具有较高的收率,因此选取羧酸铜为该反应的催化剂。
2.2 氧化催化剂用量的影响
选取羧酸铜为催化剂,在pH=13,pO2=2.0 MPa,反应温度控制在93 ℃,反应时间为8 h条件下,考察了氧化催化剂用量对收率的影响,结果见图1。
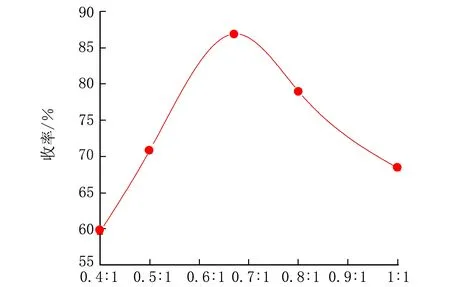
n(羧酸铜)∶n(扁桃酸)图1 氧化催化剂用量对香兰素收率的影响
由图1可见,以羧酸铜为氧化催化剂进行实验,催化剂过少,氧化反应未能完全进行,因而香兰素收率较低,随着氧化催化剂用量的增加,香兰素收率明显增加,但过量的铜盐会降低实验收率,生成树脂状物质。经实验,初步确定n(羧酸铜)∶n(扁桃酸)=0.67∶1时收率最高为86.9%。
2.3 反应时间的影响
在n(羧酸铜)∶n(扁桃酸)=0.67∶1,pH=13,pO2=2.0 MPa,反应温度控制在93 ℃条件下,考察了反应时间对收率的影响,结果见图2。
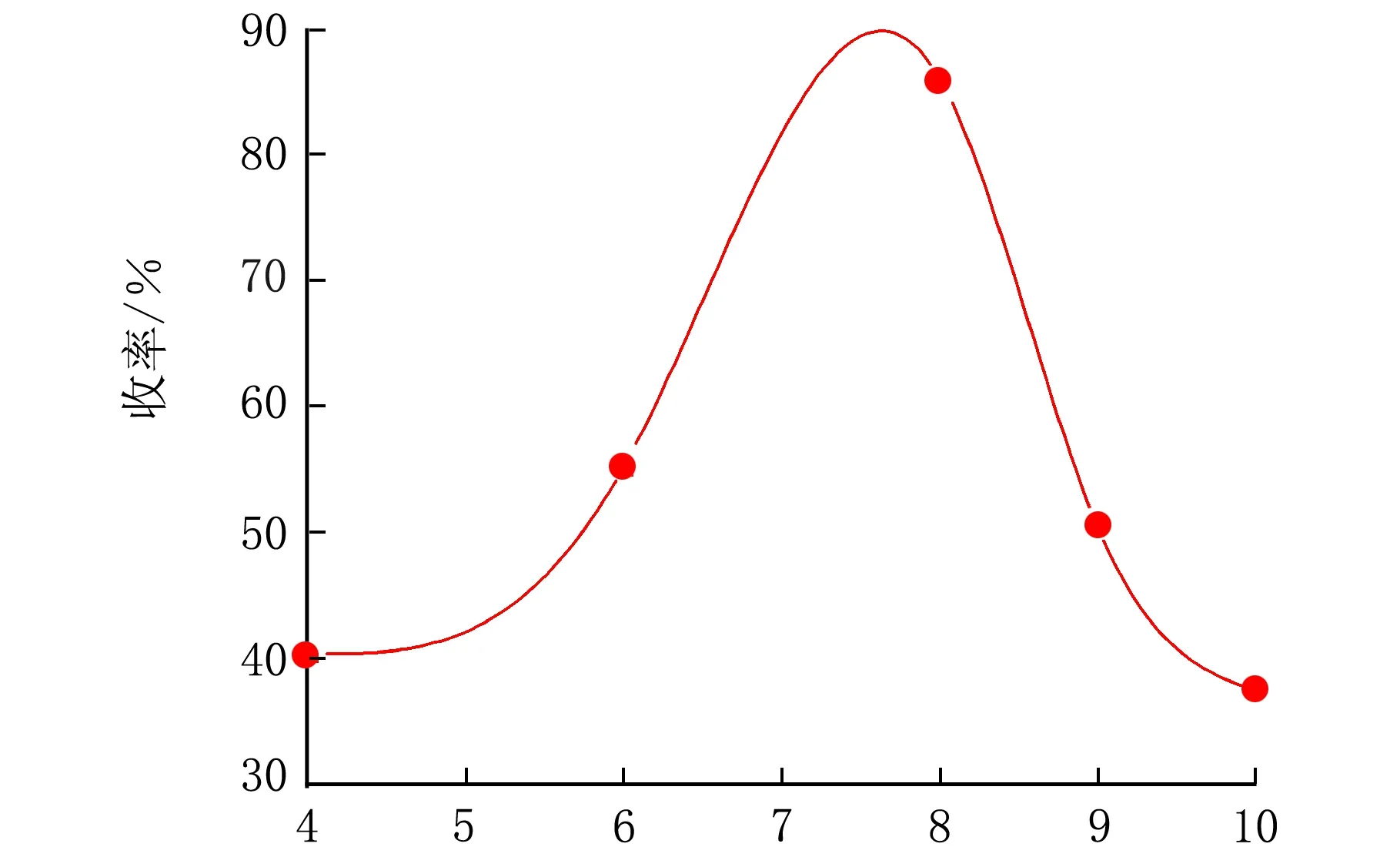
t/h图2 反应时间对香兰素收率的影响
由图2可见,随着时间的延长,香兰素的收率呈上升趋势,但在约8 h时,达到峰值,随后收率开始下降,因此选择8 h为较佳反应条件。
2.4 反应温度的影响
在n(羧酸铜)∶n(扁桃酸)=0.67∶1,pH=13,pO2=2.0 MPa,反应时间控制在8 h条件下,考察了反应温度对收率的影响,结果见图3。
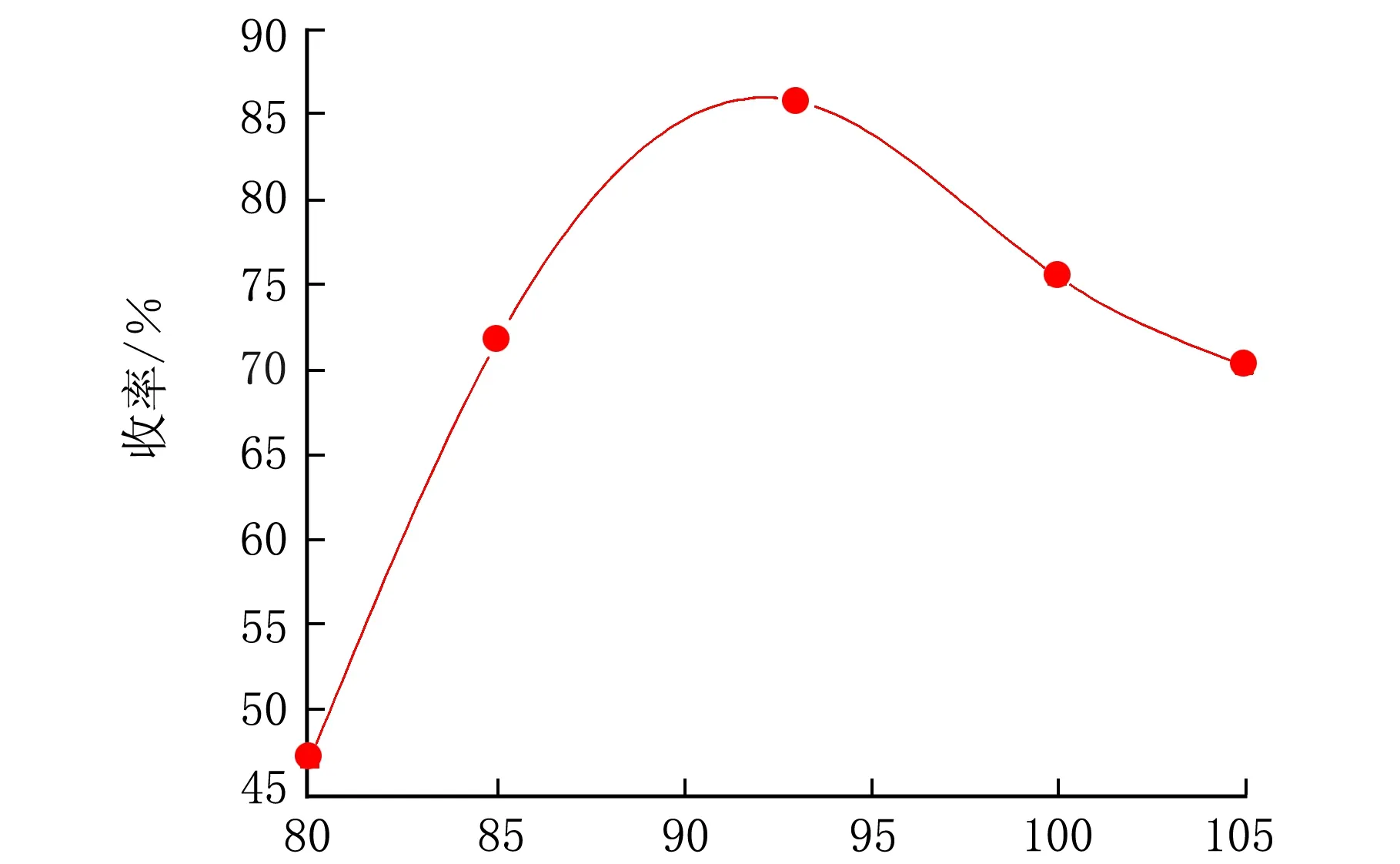
t/℃图3 反应温度对香兰素收率的影响
由图3可知,随着反应温度的升高,收率有明显提升,在93 ℃时有较高的收率,随后收率开始下降,是因为温度过高产生黑色焦油,有副产物生成,大大影响了产品收率。
2.5 碱性强弱的影响
在n(羧酸铜)∶n(扁桃酸)=0.67∶1,pO2=2.0 MPa,反应时间为8 h,反应温度控制在93 ℃条件下,考察了碱性强弱对收率的影响,结果见图4。
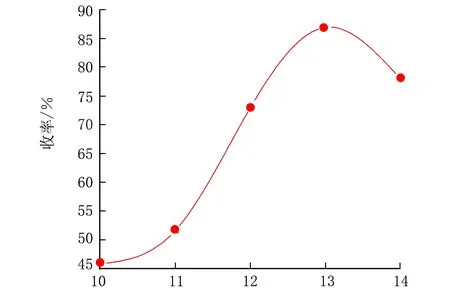
pH图4 反应pH值对香兰素收率的影响
在该反应中,当反应体系的pH<12时,反应体系中的二价铜离子在碱性条件下先是以氢氧化铜的形式存在,随着反应体系温度升高,氢氧化铜脱水生成氧化铜,即二价铜离子始终是以氧化铜的形式存在,该状态的二价铜离子氧化效果并非最佳,反应体系在气液固三相共存的条件下,反应物之间的接触效果不佳直接导致了香兰素最终产率的降低。
2.6 氧气压力的影响
在n(羧酸铜)∶n(扁桃酸)=0.67∶1,pH=13,反应温度为93 ℃,反应时间控制在8 h条件下,考察了氧气压力对收率的影响,结果见图5。
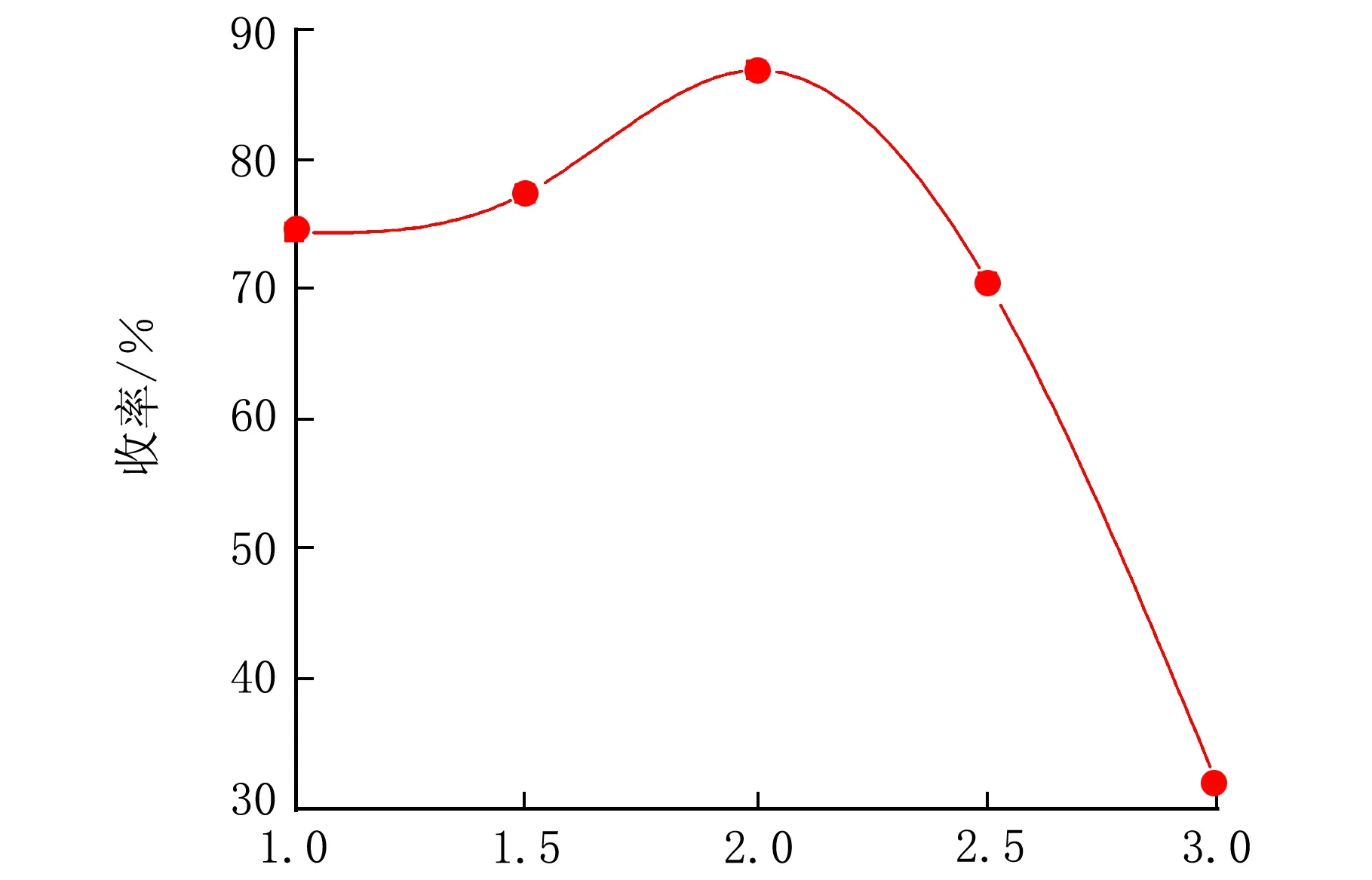
pO2/MPa图5 氧气压力对香兰素收率的影响
由图5可以看出,随着氧气的通入,香兰素的收率有明显提升,在2.0 MPa时收率最高为86.4%。因为在反应时,溶液中的氢氧化铜被还原为氢氧化亚铜,易失水生成氧化亚铜,降低了催化剂的利用率。通入氧气,使氧化亚铜被氧气氧化为氢氧化铜,既减少了催化剂的用量,又提高了产品的收率。但通入的氧气过多则易造成过氧化,降低收率。
2.7 较佳条件下的重复性实验
由上述实验确定的较佳反应条件为n(羧酸铜)∶n(扁桃酸)=0.67∶1,pH=13,pO2=2.0 MPa,釜内温度控制在93 ℃,反应时间为8 h。在该条件下进行5次重复性实验,结果见表2。

表2 较佳条件下重复实验结果
由表2可知,在较佳条件下,产品收率可达约86%,实验结果的重复性较好。
2.8 产品的表征
采用气相色谱法对所得到的香兰素的纯度进行了分析,结果表明,产品质量分数99.5% 。
所得产物的红外谱图见图6。
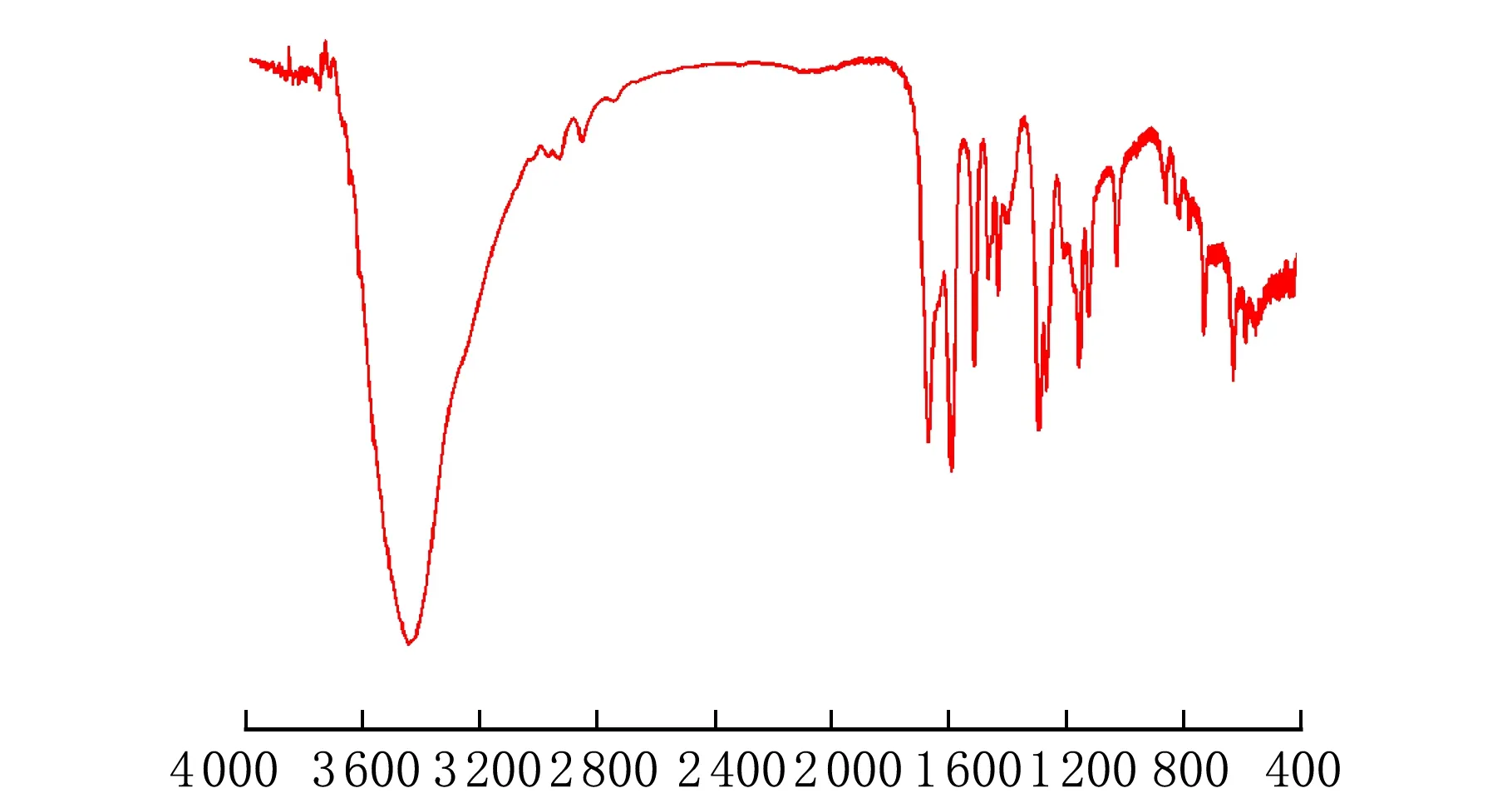
σ/cm-1图6 香兰素红外谱图

所得产物的1H NMR谱图见图7。
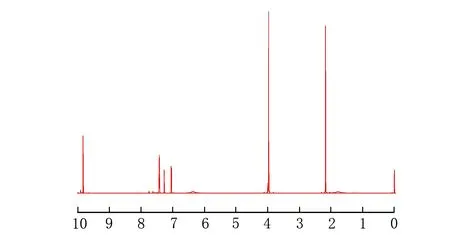
δ图7 香兰素的核磁共振氢谱图
1H NMR(500 MHz,CDCl3):δ=9.83(s,1H,—CHO),δ=7.43(s,1H,—CH),δ=7.27(s,1H,—CH),δ=6.48(s,1H,—OH),δ=7.05(s,1H,—CH),δ=3.97(s,3H,—OCH3)。
通过上述表征可以确定,所得产物为香兰素。
3 结 论
(1) 以固体乙醛酸、愈创木酚、氢氧化钠为原料,选择羧酸铜做催化剂对香兰素合成中的氧化阶段进行了考察。确定的较佳反应条件为n(羧酸铜)∶n(扁桃酸)=0.67∶1、pO2=2.0 MPa、pH=13、温度93 ℃,反应时间8 h。在上述条件下,香兰素收率约在86%(以扁桃酸计);
(2) 采用FT-IR和1H NMR对产物的结构进行了表征,证明所得产物结构正确。
参 考 文 献:
[1] 游佳勇,郑凌云,张淑玲.乙醛酸制备香兰素工艺条件的优化[J].食品与生物技术学报,2005,24(4):97-99.
[2] 赵光辉,任敦泾,李建忠,等.乙醛酸的生产市场及其衍生物的开发[J].化工科技市场,2006,29(2):32-35.
[3] 李真顺,迟玉杰.香兰素的合成方法及应用[J].中国食品添加剂,2004(6):101-106.
[4] 焦玉英,王瑶,李涵,等.香荚兰豆的超临界二氧化碳萃取[J].食品研究与开发,1998,19(1):14-17.
[5] ODOUX E,GRISONI M.Vanilla[M].New York:CRC Press,2010:173-188.
[6] HUA D L,MA C Q,SONG L F,et al.Enhanced vanillin production from ferulic acid using adsorbent resin[J].Applied Microbiology and Biotechnology,2007,74(4):783-790.
[7] ASHENGROPH M,NAHVI I,ZARKESH-ESFAHANI H,et al.Pseudomonas resinovorans SPR1,a newly isolated strain with potential of transforming eugenol to vanillin and vanullic acid[J].New Biotechnology,2011,28(6):656-664.
[9] 郑立稳,高永超,张强,等.香兰素的化学合成方法研究[J].化工时刊,2012,26(6):43-46.
[10] 杨怀深.香兰素市场近期预测与生产技术进展[J].化学工业,2012 (6):24-29.
[11] 黄筱雄,肖琉敏.香兰素生产技术进展[J].化工科技市场,2003,26(6):15-19.
[12] NIU D F,LI H C,ZHANG X S.Improved synthesis of 3-methoxy-4-hydroxymandelic acid by glyoxalic acid method[J].Tetrahedron,2013,69:8174-8177.
[13] 唐忠涛,陈朗秋,成昌梅.铜配合物催化合成香兰素[J].化学试剂,2012,34(12),1065-1067.
[14] KALIKAR RAJENDRA G,DESHPANDE RAMESH S.Synthesis of vanillin and 4-hydroxy benzaldehyde by a reaction scheme involing condensation of phends with glyoxylic acid[J].J Chem Technol Biotechnol,1986,36(1):38-46.
