NVP-BEZ235诱导多囊肾大鼠胆管上皮细胞自噬的机制研究*
2016-06-06刘特思金贤国朴英实赵元媛韩晶邑林贞花原田宪一任香善
叶 晶, 刘特思, 金贤国, 朴英实, 赵元媛, 韩晶邑, 林贞花, 原田宪一, 任香善△
(1延边大学医学院病理学教研室, 2延吉市中医医院消化内科,吉林 延吉 133000; 3金泽大学医学部病理学教研室,日本 金泽 9208640)
NVP-BEZ235诱导多囊肾大鼠胆管上皮细胞自噬的机制研究*
叶晶1▲,刘特思1▲,金贤国2,朴英实1,赵元媛1,韩晶邑1,林贞花1,原田宪一3,任香善1△
(1延边大学医学院病理学教研室,2延吉市中医医院消化内科,吉林 延吉 133000;3金泽大学医学部病理学教研室,日本 金泽 9208640)
[摘要]目的: 探讨PI3K/Akt/mTOR双靶点抑制剂NVP-BEZ235诱导多囊肾(polycystic kidney,PCK)大鼠胆管上皮细胞自噬的作用。方法: 免疫组化法检测p-mTOR和p-Akt在PCK大鼠胆管上皮细胞中的水平。WST-1比色法检测NVP-BEZ235对胆管细胞活力的抑制作用以及LC3、Beclin 1基因沉默和自噬特异性抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)对细胞活力的影响。蛋白免疫印迹法检测NVP-BEZ235对PI3K/Akt/mTOR信号通路相关蛋白及自噬标志蛋白LC3和Beclin 1的变化。结果: p-mTOR和p-Akt在PCK大鼠胆管上皮细胞中显著升高,NVP-BEZ235可明显抑制胆管上皮细胞的活力,且呈浓度和时间依赖性改变(P<0.05);NVP-BEZ235明显抑制PI3K/Akt/mTOR信号通路相关蛋白的水平;并上调自噬标志蛋白LC3 II/LC3 I比值和Beclin 1蛋白的表达水平。LC3、Beclin 1 基因沉默和3-MA均可明显减弱NVP-BEZ235对细胞活力的抑制作用(P<0.01)。结论: NVP-BEZ235可抑制PCK大鼠胆管上皮细胞的活力,其机制与自噬密切相关。
[关键词]自噬; PI3K/Akt/mTOR信号通路; 多囊肾; NVP-BEZ235
多囊肾(polycystic kidney,PCK)大鼠为Caroli病的动物模型,常表现为多发性胆管囊状扩张和肝门静脉纤维化[3]。Caroli 病的胆管上皮细胞过度增殖是导致胆管囊状扩张的主要机制之一[4-5]。而磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路参与和调节细胞的增殖、凋亡、自噬等重要的细胞信号转导,其异常活化引起包括乳腺癌、宫颈癌、肺癌、胃癌等多种疾病的发生[6-9]。蛋白激酶B(protein kinase B,PKB/Akt)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是PI3K的主要下游效应分子之一。研究发现,ARPKD患者的肾脏和肝脏中Akt、mTOR、S6等蛋白的磷酸化水平异常增高,因此该信号通路的异常活化是ARPKD发生的主要机制[10]。NVP-BEZ235是一种新型的PI3K/mTOR 双靶向抑制剂[11],在多种肿瘤中通过诱导细胞凋亡和自噬抑制细胞的增殖[12-13],但国内尚未见NVP-BEZ235与ARPKD治疗方面的研究。
本研究旨在明确NVP-BEZ235对细胞生长和自噬的影响,阐明其相关机制,为Caroli病的临床治疗提供实验依据。
材料和方法
1材料
1.1试剂与抗体NVP-BEZ235(Selleck Chemicals)溶于DMSO中;3-甲基腺嘌呤(3-methyladenine, 3-MA; Calbiochem);Alexa-488荧光 II 抗以及Akt、p-Akt(Ser473)、S6、p-S6(Ser235/236)、mTOR、p-mTOR(Ser2448)、p-mTOR(Ser2481)、4E-BP1、p-4E-BP1(Thr37/46)、LC3、Beclin 1抗体(CST);β-actin抗体(Abcam)。
1.2组织标本正常和PCK大鼠肝组织蜡块由日本金泽大学病理学教研室提供。10月龄大鼠的肝组织取出后,浸泡在4%甲醛缓冲液(pH 7.4)中进行固定,经石蜡包埋处理后,将蜡块切成4 μm厚的切片,备免疫组化染色用。
2主要方法
2.1细胞培养正常和PCK大鼠胆管上皮细胞由日本金泽大学病理学教研室提供。细胞培养用DMEM/F-12培养液(含10% 胎牛血清、5 μmol/L 毛喉素、20 μmol/L表皮生长因子和1% 青-链霉素),于37 ℃、5% CO2细胞培养箱中常规培养。
本研究采用真假词识别和褒贬判断两个任务揭示了社群性和能动性信息加工过程的ERP特征。研究结果表明,个体对社群性词语的识别和褒贬判断要快于能动性词汇。在词语识别任务中社群性词汇诱发的N400潜伏期较长,而两类词汇诱发的波幅大小没有差异;在褒贬判断任务中社群性词汇诱发的N400波幅较小,两类词汇诱发的潜伏期不存在差异。
2.2免疫组织化学染色免疫组化染色采用EnVision法,切片常规脱蜡,梯度乙醇入水,抗原修复分别用10 mmol/L枸橼酸盐柠檬酸钠缓冲剂(pH 6.0)微波加热20 min或乙二胺四乙酸(EDTA,pH 9.0)高压加热,p-mTOR (Ser2448)(1∶200)和p-Akt(1∶25) I 抗4 ℃过夜。 II 抗室温孵育30 min,二甲基联苯胺(DAB)显色,苏木素核染,中性树脂封片。
2.3免疫蛋白印迹实验0、10、50、100 nmol/L NVP-BEZ235处理PCK大鼠胆管上皮细胞24 h,用T-PER蛋白提取液(Pierce)提取细胞总蛋白,40 μg蛋白经4%~12% 梯度胶电泳,电转至硝酸纤维膜,加 I 抗[Akt(1∶1 000)、p-Akt (1∶1 000)、S6(1∶500)、p-S6 (1∶500)、4E-BP1(1∶1 000)、p-4E-BP1(1∶1 000)、LC3(1∶500)和Beclin 1(1∶500)]4 ℃过夜,加HRP标记 II 抗室温孵育30 min,DAB显色。
2.4LC3和Beclin1基因沉默实验LC3和Beclin1的siRNA和阴性对照均购自于Qiagen。siRNA转染使用HiPerFect转染试剂,具体实验步骤依据试剂盒说明进行。用标准培养液培养PCK大鼠胆管上皮细胞24 h后换成DMEM/F-12培养液、siRNA(10 nmol/L)和3 μL HiPerFect转染试剂液的混合液,继续培养72 h。
2.5WST-1比色法用NVP-BEZ235药物之前,加入500 nmol/L 3-MA预处理PCK大鼠胆管上皮细胞1 h,再用100 nmol/L NVP-BEZ235与500 nmol/L 3-MA 共同处理细胞24 h,细胞活力用WST-1 比色法测定,按照试剂盒使用说明书操作。
2.6免疫荧光染色细胞接种于8孔荧光染色载玻片,NVP-BEZ235(100 nmol/L)处理24 h,用4% 多聚甲醛固定,用1% 的Triton X-100处理 10 min,血清封闭,加入LC3抗体(1∶200)4 ℃孵育过夜,加10 μg/L Alexa-488,DAPI染细胞核。
3统计学处理
实验数据应用Prism 5.0统计学软件进行处理。所有数据使用均数±标准差(mean±SD)表示;两组间数据比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1在PCK大鼠胆管上皮细胞中p-mTOR和p-Akt蛋白水平增高
10月龄大鼠肝组织免疫组化染色示,p-mTOR蛋白阳性颗粒位于肝细胞和胆管细胞的细胞核和细胞浆,p-Akt蛋白主要位于肝细胞和胆管细胞的细胞核。这2种蛋白在正常大鼠胆管上皮细胞中显色较弱,而在PCK大鼠胆管上皮细胞显色较强,见图1。

Figure 1. The p-mTOR and p-Akt in the bile duct epithelial cells were examined by immunohistochemistry. In the pictures, the arrows showed the interlobular bile ducts of normal rats and PCK rat dilated bile ducts (×400).
图1PCK大鼠胆管上皮细胞中的p-mTOR和p-Akt蛋白
2NVP-BEZ235 抑制胆管上皮细胞活力
0、10、50和100 nmol/L NVP-BEZ235 分别作用正常和PCK大鼠胆管上皮细胞24 h、72 h和120 h后发现,NVP-BEZ235组与对照组相比可显著抑制胆管上皮细胞活力,且在同一时间内,随药物浓度增加其抑制效果更明显,呈浓度和时间依赖性改变(P<0.05),见图2A。
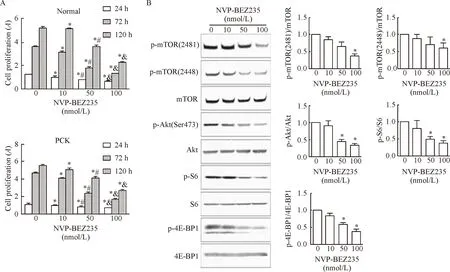
Figure 2. The effect of NVP-BEZ235 on viability of cholangiocytes detected by WST-1 assay (A) and the effect of NVP-BEZ235 on the levels of PI3K/Akt/mTOR signaling pathway-related proteins in the PCK rat cholangiocytes detected by Western blot (B). Mean±SD. n=3.*P<0.05 vs 0 nmol/L group;#P<0.05 vs 10 nmol/L group;&P<0.05 vs 50 nmol/L group.
图2不同浓度NVP-BEZ235对细胞活力及PI3K/Akt/mTOR信号通路相关蛋白水平的影响
3NVP-BEZ235 下调PI3K/Akt/mTOR信号通路相关蛋白的水平
不同浓度NVP-BEZ235 处理PCK大鼠胆管上皮细胞24 h后,p-mTOR(Ser2448)、p-mTOR(Ser2481)、p-Akt、p-S6和p-4E-BP1蛋白水平明显下降,且呈剂量依赖性改变,NVP-BEZ235在100 nmol/L时,其抑制效果最为明显(P<0.05),见图2B。
4NVP-BEZ235诱导PCK大鼠胆管上皮细胞自噬
蛋白免疫印迹法检测自噬相关蛋白LC3和Beclin 1蛋白表达结果显示,与对照组相比,NVP-BEZ235作用PCK大鼠胆管上皮细胞24 h后,LC3 II/ LC3 I比值逐渐升高,表明NVP-BEZ235 能够诱导细胞内自噬活性。Beclin 1蛋白表达水平也随药物浓度的增加逐渐增高(P<0.01)。LC3免疫荧光染色结果显示,100 nmol/L NVP-BEZ235处理的PCK大鼠胆管上皮细胞的胞浆中用药组LC3 阳性颗粒数量均明显增加(P<0.05),见图3。

Figure 3. Effect of NVP-BEZ235 on the autophagy of PCK rat cholangiocytes.A: the PCK cells treated with different concentrations of NVP-BEZ235 for 24 h, and then LC3 II/I ratio and Beclin 1 were significantly increased; B: the protein expression of LC3 increased in the PCK rat cholangiocytes treatment with NVP-BEZ235 (immunofluorescence staining,×400). Mean±SD. n=3~4.*P<0.05,**P<0.05 vs 0 nmol/L group.
图3NVP-BEZ235对PCK大鼠胆管上皮细胞自噬的影响
5LC3、Beclin1 siRNA和3-MA可明显逆转NVP-BEZ235对PCK大鼠胆管上皮细胞活力的抑制效应
LC3和Beclin1基因沉默方法干扰PCK大鼠胆管上皮细胞72 h,免疫荧光染色方法示LC3基因沉默后细胞浆内绿色荧光颗粒(LC3阳性颗粒)明显减少(P<0.05),见图4A。蛋白免疫印迹法显示,Beclin1 基因沉默的细胞Beclin1表达显著下调,说明siRNA干扰有效(P<0.05),见图4B。LC3和Beclin 1siRNA对胆管上皮细胞的活力影响甚微,而与NVP-BEZ235共同处理可显著逆转NVP-BEZ235对细胞活力的抑制效果(P<0.01),见图4C。0.5 μmol/L 3-MA本身对PCK胆管上皮细胞活力的影响甚微,但与NVP-BEZ235共同处理后,NVP-BEZ235对细胞活力的抑制效果显著逆转(P<0.01),见图4D。上述结果提示NVP-BEZ235诱导的自噬是抑制PCK胆管上皮细胞生长的主要机制。
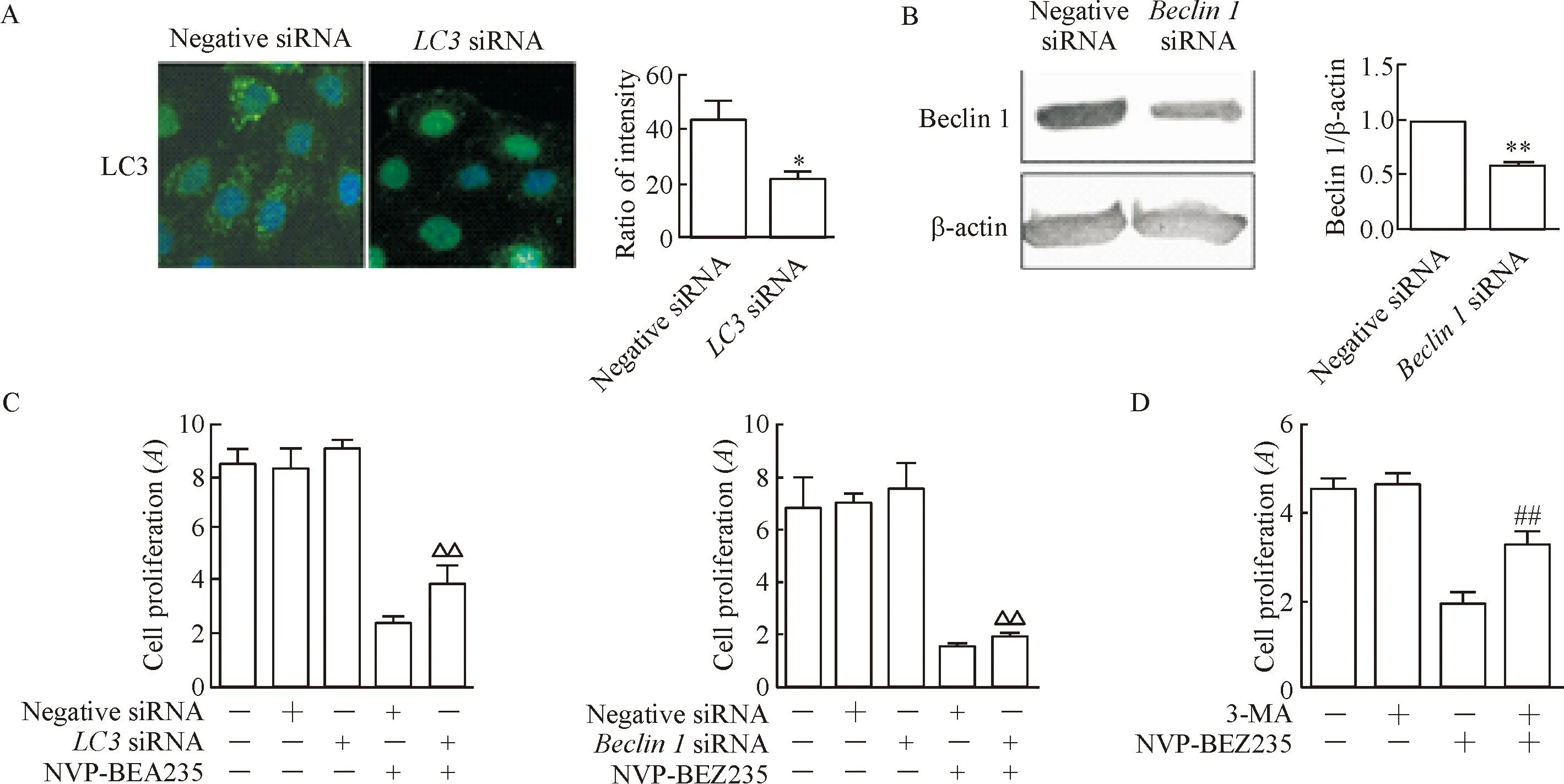
Figure 4. Effects of LC3 siRNA, Beclin 1 siRNA and 3-MA on the viability of PCK rat cholangiocytes inhibited by NVP-BEZ235. A: the results of immunofluorescence showed the silencing of LC3 for 72 h; B: the results of Western blot showed the silencing ofBeclin1 for 72 h; C: WST-1 assay determined the effect ofLC3 siRNA orBeclin1 siRNA for 72 h and NVP-BEZ235 for 48 h together on the viability of the cholangiocytes; D: WST-1 assay determined the effect of 3-MA and NVP-BEZ235 together for 48 h on the viability of in the cholangiocytes. Mean±SD. n=3~6.*P<0.05,**P<0.01 vs negative siRNA group;△△P<0.01vsNVP-BEZ235+negative siRNA group;##P<0.01 vs NVP-BEZ235 group.
图4RNA干扰LC3、Beclin1基因表达和自噬抑制剂3-MA对NVP-BEZ235抑制细胞活力的影响
讨论
PI3K/Akt/mTOR 信号传导通路参与调节细胞的增殖、凋亡、自噬等生物学功能,是抗肿瘤药物研发的一个潜在靶点。NVP-BEZ235作为PI3K/Akt/mTOR的靶向抑制剂已用于多种肿瘤的治疗。魏娟等[14]研究发现,NVP-BEZ235可通过抑制 mTOR 信号通路诱导肝癌细胞凋亡,抑制肝癌HepG2细胞的增殖及转移。NVP-BEZ235不仅诱导细胞凋亡,亦可引起细胞自噬。Yothaisong等[15]研究中表明,NVP-BEZ235可通过下调Akt/mTOR 通路诱导细胞自噬,抑制胆管上皮细胞的增殖。在本研究中,PCK大鼠胆管上皮细胞中磷酸化Akt 和磷酸化mTOR 水平增高,提示Akt/mTOR 信号通路的活化是导致PCK大鼠胆管上皮细胞过度生长的机制之一。
自噬与人类肿瘤的发生、发展密切相关,并影响肿瘤进程、肿瘤细胞凋亡及抗肿瘤治疗等。mTOR是调控细胞自噬的重要通路。曹锦霞等[16]的研究表明,EGCG可通过mTOR通路诱导PC12细胞凋亡和自噬,从而抑制细胞增殖。谢彪等[17]的研究也提示,5-Aza诱导胃癌细胞自噬和凋亡,进而抑制细胞增殖。本文为进一步阐明NVP-BEZ235诱导PCK大鼠胆管上皮细胞发生自噬的分子机制, 对Akt/mTOR 信号通路中一些关键蛋白的变化进行了检测。结果表明,NVP-BEZ235呈浓度依赖性地抑制Akt 及其下游靶蛋白mTOR、S6以及4E-BP1蛋白的磷酸化,但其总蛋白无变化,提示NVP-BEZ235仅抑制Akt/mTOR 信号通路关键蛋白的活化。
自噬发生后,LC3 I和磷脂酰乙醇胺偶联形成LC3 II,因此LC3 I向LC3 II的转变代表了自噬的诱导。本研究用NVP-BEZ235处理细胞后,LC3 II/LC3 I 比值逐渐增高,另一自噬标识蛋白Beclin 1蛋白表达量也随药物浓度增高而增高,说明NVP-BEZ235可诱导PCK大鼠胆管上皮细胞的自噬。
为了反证NVP-BEZ235诱导的自噬在抑制胆管上皮细胞生长中的机制,本研究观察了LC3、Beclin1基因沉默和自噬抑制剂3-MA对胆管上皮细胞活力的影响。结果发现自噬相关基因沉默和3-MA本身对细胞活力影响甚微,但可显著逆转NVP-BEZ235对细胞活力的抑制效应,提示诱导细胞自噬是其主要机制之一。LC3、Beclin1基因沉默和3-MA 虽然明显逆转NVP-BEZ235对细胞活力的抑制作用,但并没有完全逆转,说明除自噬外,其它死亡方式亦可能存在。
综上所述,PCK大鼠胆管上皮细胞过度生长与PI3K/mTOR 通路被异常激活相关。NVP-BEZ235通过诱导细胞自噬抑制胆管上皮细胞活力,提示NVP-BEZ235 有望成为Caroli病的治疗药物。
[参考文献]
[1] Nakanuma Y, Harada K, Sato Y, et al. Recent progress in the etiopathogenesis of pediatric biliary disease, particularly Caroli’s disease with congenital hepatic fibrosis and biliary atresia[J]. Histol Histopathol, 2010, 25(2): 223-235.
[2]Harris PC, Torres VE. Polycystic kidney disease[J]. Annu Rev Med, 2009, 60: 331-337.
[3]Sanzen T, Harada K, Yasoshima M, et al. Polycystic kidney rat is a novel animal model of Caroli’s disease associated with congenital hepatic fibrosis[J]. Am J Pathol, 2001, 158(5):1605-1612.
[4]Wilson PD. Polycystic kidney disease[J]. N Engl J Med, 2004, 350(2): 151-164.
[5]Gunay-Aygun M, Avner ED, Bacallao RL, et al. Autosomal recessive polycysitic kidney disease and congenital hepatic fibrosis: summary statement of a first National Institutes of Health/Office of Rare Disease conference[J]. J Pediatr, 2006, 149(2):159-164.
[6]Bean JR, Hosford SR, Symonds LK, et al. The PI3K/mTOR dual inhibitor p7170 demonstrates potent activity against endocrine-sensitive and endocrine-resistant ER+breast cancer[J]. Breast Cancer Res Treat, 2015, 149(1):69-79.
[7]Dobbin ZC, Landen CN. The importance of the PI3K/Akt/mTOR pathway in the progression of ovarian cancer[J]. Int J Mol Sci, 2013, 14(4): 8213-8227.
[8]Cheng HY, Shcherba M, Pendurti G, et al. Targeting the PI3K/Akt/mTOR pathway: potential for lung cancer treatment[J]. Lung Cancer Manag, 2014, 3(1):67-75.
[9]费洪荣,赵莹,王凤泽,等. PI3K/mTOR双重抑制剂PF-04691502诱导人胃癌SGC-7901细胞凋亡[J]. 中国病理生理杂志, 2013, 29(11): 1962-1965.
[10]Fischer DC, Jacoby U, Pape L, et al. Activation of the Akt/mTOR pathway in autosomal recessive polycystic kidney disease (ARPKD)[J]. Nephrol Dial Transplant, 2009, 24(6):1819-1827.
[11]Zhou H, Huang S. The complexes of mammalian target of rapamycin[J]. Curr Protein Pept Sci, 2010, 11(6):409-424.
[12]Maira SM, Stauffer F, Brueggen J, et al. Identification and characterization of NVP-BEZ235, a new orally available dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor with potentinvivoantitumor activity[J]. Mol Cancer Ther, 2008, 7(7):1851-1863.
[13]Becker JU, Opazo Saez A, Zerres K, et al. The mTOR pathway is activated in human autosomal-recessive polycystic kidney disease[J]. Kidney Blood Press Res, 2010, 33(2):129-138.
[14]魏娟,祁继平,郑勤,等. NVP-BEZ235对肝癌HepG2细胞增殖、凋亡及侵袭转移的影响[J]. 临床肿瘤学杂志, 2014, 19(7):594-598.
[15]Yothaisong S, Dokduang H, Techasen A, et al. Increased activation of PI3K/Akt signaling pathway is associated with cholangiocarcinoma metastasis and PI3K/mTOR inhibition presents a possible therapeutic strategy[J]. Tumour Biol, 2013, 34(6):3637-3648.
[16]曹锦霞,王浩,游咏,等. EGCC通过mTOR通路拮抗低氧诱导的PC12细胞的凋亡与自噬[J]. 中国病理生理杂志, 2014, 30(11):1960-1966.
[17]谢彪,陈金辉,刘斌,等. 5-Aza诱导胃癌细胞株GC-7901凋亡及自噬的相关性研究[J]. 医学临床研究, 2015, 32(1):57-60.
(责任编辑: 卢萍, 罗森)
NVP-BEZ235 induces autophagy of polycystic kidney rat cholangiocytes
YE Jing1, LIU Te-si1, JIN Xian-guo2, PIAO Ying-shi1, ZHAO Yuan-yuan1, HAN Jing-yi1, LIN Zhen-hua1, HARADA Kenichi3, REN Xiang-shan1
(1Department of Pathology, Yanbian University Medical College,2Department of Gastroenterology, Yanbian Hospital of Traditional Chinese Medicine, Yanji 133000, China;3Department of Pathology, School of Medical Sciences, Kanazawa University, Kanazawa 9208640, Japan. E-mail: renxsh@ybu.edu.cn)
[ABSTRACT]AIM: To explore the effect of dual PI3K/Akt/mTOR inhibitor NVP-BEZ235 on autophagy of polycystic kidney (PCK) rat cholangiocytes. METHODS: The protein levels of p-mTOR and p-Akt in the bile duct epithelial cells were examined by immunohistochemistry. The effect of NVP-BEZ235 on the viability of cholangiocytes was detected by WST-1 assay. The levels of PI3K/Akt/mTOR signaling pathway and autophagy-related proteins with NVP-BEZ235 treatment were determined by Western blot. The effects of LC3 and Beclin 1 silencing, and authophagy-specific inhibitor 3-methyladenine (3-MA) on the cell viability were analyzed by WST-1 assay. RESULTS: The protein levels of p-Akt and p-mTOR were highly increased in the bile duct epithelium of the PCK rats. NVP-BEZ235 significantly inhibited the viability of the cholangiocytes in a dose- and time-dependent manner (P<0.05). NVP-BEZ235 significantly reduced the levels of PI3K/Akt/mTOR signaling pathway-related proteins in the PCK rat cholangiocytes. NVP-BEZ235 upregulated the autophagy-specific proteins LC3 II and Beclin 1. The inhibitory effect of NVP-BEZ235 on the cell viability was weakened by treatment with 3-MA and knockdown of LC3 and Beclin 1 (P<0.01).CONCLUSION: The PI3K/Akt/mTOR inhibitor NVP-BEZ235 suppresses the viability of PCK rat cholangiocytes, and the mechanism is closely related with autophagy.
[KEY WORDS]Autophagy; PI3K/Akt/mTOR signaling pathway; Polycystic kidney; NVP-BEZ235
[文章编号]1000- 4718(2016)05- 0886- 06
[收稿日期]2015- 11- 23[修回日期] 2016- 03- 03
*[基金项目]国家自然科学基金资助项目(No. 413010033);延边大学自然科学基金资助项目(No. 602013109)
通讯作者△Tel: 0433-2435092; E-mail: renxsh@ybu.edu.cn
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.020
杂志网址: http://www.cjpp.net
▲ 并列第1作者
