T0901317通过上调LXRα表达促进人乳腺癌MDA-MB-231细胞凋亡*
2016-06-06陆凯强丁维珂刘晓旺周志刚
涂 剑, 陆凯强, 丁维珂, 刘晓旺, 熊 婷, 刘 伶, 严 欣, 周志刚
(南华大学 1药物药理研究所, 2第一附属医院,湖南 衡阳 421001)
T0901317通过上调LXRα表达促进人乳腺癌MDA-MB-231细胞凋亡*
涂剑1,陆凯强1,丁维珂1,刘晓旺1,熊婷1,刘伶1,严欣1,周志刚2△
(南华大学1药物药理研究所,2第一附属医院,湖南 衡阳 421001)
[摘要]目的: 观察肝X受体(LXR)激动剂T0901317对人乳腺癌细胞MDA-MB-231凋亡的作用及其机制。方法: 不同浓度(0、10、20、40 μmol/L)T0901317处理人乳腺癌MDA-MB-231细胞不同时间(0、12、24、48 h),用Hoechst 33342染色及流式Annexin V-FITC/PI双染法检测细胞凋亡;Western blot进一步检测细胞凋亡相关蛋白Bcl-2、cleaved caspase-3和LXRα的表达,RT-qPCR检测Bcl-2和LXRα的mRNA表达。结果: 随着T0901317处理浓度的增加和时间的延长,凋亡现象逐渐明显。进一步通过Western blot检测发现,T0901317可下调Bcl-2 蛋白表达,cleaved caspase-3表达增多,而LXRα的表达上调;RT-qPCR检测结果也显示,T0901317可下调Bcl-2 mRNA表达,而上调LXRα表达。结论: T0901317能上调LXRα表达,从而促进MDA-MB-231细胞凋亡。
[关键词]T0901317; 肝X受体α; MDA-MB-231细胞; 细胞凋亡
近年有研究指出,肝X受体(liver X receptor, LXR)激动剂T0901317可抑制多种肿瘤包括乳腺癌细胞的增殖[1-4]。另有文献提出,T0901317还能诱导前列腺癌和黑色素瘤细胞凋亡[5-6]。那么,T0901317对乳腺癌细胞凋亡的作用和机制如何?虽有文献提示[7],迄今未见具体报道。本研究主要围绕T0901317对人乳腺癌MDA-MB-231细胞凋亡的影响展开。
材料和方法
1材料
MDA-MB-231细胞购自中科院上海生命科学研究院细胞资源中心;T0901317为Cayman产品;Hoechst 33342和β-actin的 I抗购自Sigma;Annexin V-FITC/PI试剂盒来自Becton-Dickinson;LXRα的 I 抗(Epitomics);Bcl-2、caspase-3和cleaved caspase-3的 I抗(CST); II 抗均购自联科生物公司;TRIzol购自Invitrogen;cDNA逆转录试剂盒购自Thermo;LXRα、Bcl-2和β-actin引物由上海生工合成。
2方法
2.1Hoechst 33342染色检测细胞凋亡浓度分别为0、10、20和40 μmol/L的T0901317处理细胞24 h,4%多聚甲醛固定。Hoechst 33342染色液室温下避光孵育,封片后用荧光显微镜观察、拍照。
2.2流式细胞术Annexin V-FITC/PI双染法检测细胞凋亡分别加入浓度为0、10、20和40 μmol/L的T0901317处理MDA-MB-231细胞不同时间(0、12、24、48 h),PBS清洗、回收至相应流式管内。加入不含EDTA的0.25%的外用胰酶消化,吹打后的悬液吸入对应的流式管中,稍混匀。1 800 r/min离心3 min,预冷PBS重悬细胞,重复2次。1 500 r/min离心5 min,弃上清,每管加入195 μL Annexin V-FITC buffer轻重悬细胞,再加入5 μL Annexin V-FITC和10 μL PI染液轻柔混匀。室温避光孵育20 min,冰浴后迅速使用流式细胞仪检测样品,Annexin V-FITC激发绿色荧光而PI则激发红色荧光。
2.3Western blot法检测细胞中LXRα、Bcl-2、caspase-3和cleaved caspase-3的蛋白水平收集各组细胞,蛋白定量后加入适量5×上样缓冲液,沸水煮10 min,积层胶80 V、分离胶120 V电泳后湿转至PVDF膜。室温封闭约2 h,分别加入 I 抗4 ℃过夜,TBST洗涤3次;再加入 II 抗,37 ℃孵育0.5 h,TBST洗涤4次;用Western blot荧光检测试剂盒显影,以内参为对照,扫描结果进行半定量分析。
2.4RT-qPCR检测LXRα和Bcl-2的mRNA含量按照试剂盒说明书采用TRIzol溶液提取各组细胞总RNA,按逆转录试剂盒程序得到相应的cDNA。LXRα的上游引物序列为5’-TCTGGAGACATCTCGGAGGTACAAC-3’,下游引物序列为5’-AGCAAGGCAAACTCGGCATC-3’;Bcl-2上游引物序列为5’-CTGCACCTGACGCCCTTCACC-3’,下游引物序列为5’-CACATGACCCCACCGAACTCAAAGA-3’。加cDNA 0.1 μL,相应基因上、下游引物各1 μL,用无酶水补齐至20 μL,使用95 ℃30 s;95 ℃ 30 s,60 ℃ 30 s,40个循环,进行qPCR扩增。根据Ct值,使用2-ΔΔCt法统计结果。
3统计学处理
实验所得数据采用均数±标准差(mean±SD)表示,用SPSS 13.0进行统计处理,组间比较采用单因素方差分析及t检验,以P<0.05为差异有统计学意义。
结果
1T0901317对MDA-MB-231细胞凋亡的影响
与control组比较,随着T0901317处理浓度的增加,细胞核发生固缩,核膜溶解,细胞核明显缩小甚至碎裂,形态呈不规则状,荧光不均且强度变大,部分细胞可观察到凋亡小体,尤以20 μmol/L和40 μmol/L的T0901317处理细胞组更为明显,见图1A。
流式结果显示,T0901317处理MDA-MB-231细胞 12 h后,与control组相比,20 μmol/L以及40 μmol/L组出现了凋亡,而处理24 h以及48 h发现20 μmol/L以及40 μmol/L组的凋亡更明显,活细胞总数下降,见图1B。上述结果提示,T0901317可随浓度的增加和时间的推移明显诱导MDA-MB-231细胞凋亡。
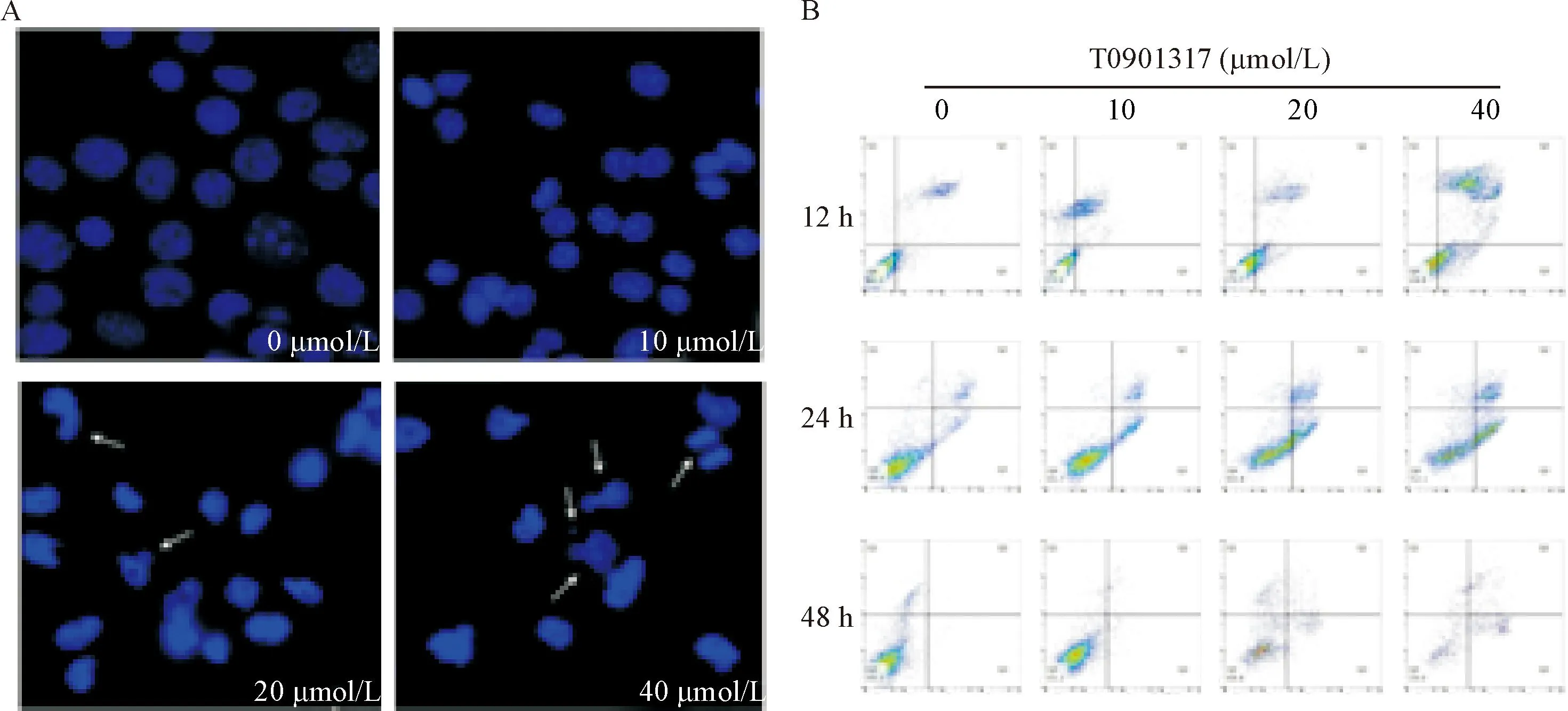
Figure 1.The effect of T0901317 on the apoptosis of MDA-MB-231 cells. A: Hoechst 33342 staining (×200); B: Annexin V/propidium iodide staining and flow cytometry.
图1T0901317对MDA-MB-231细胞凋亡的影响
2T0901317对MDA-MB-231细胞中凋亡相关蛋白和LXRα蛋白水平的影响
Western blot结果显示,随着T0901317处理浓度的增加,与0 μmol/L组相比,LXRα蛋白表达逐渐增强,Bcl-2蛋白表达逐渐减弱,cleaved caspase-3蛋白量增加明显,差异具有统计学显著性(P<0.05)。随着T0901317处理时间的延长,与0 h组相比,LXRα蛋白表达逐渐增强,Bcl-2蛋白表达下降,但是cleaved caspase-3的蛋白量明显增加,差异有统计学显著性(P<0.05),见图2。以上结果说明随着T0901317孵育浓度的增加和时间的延长,可明显促进MDA-MB-231细胞凋亡。
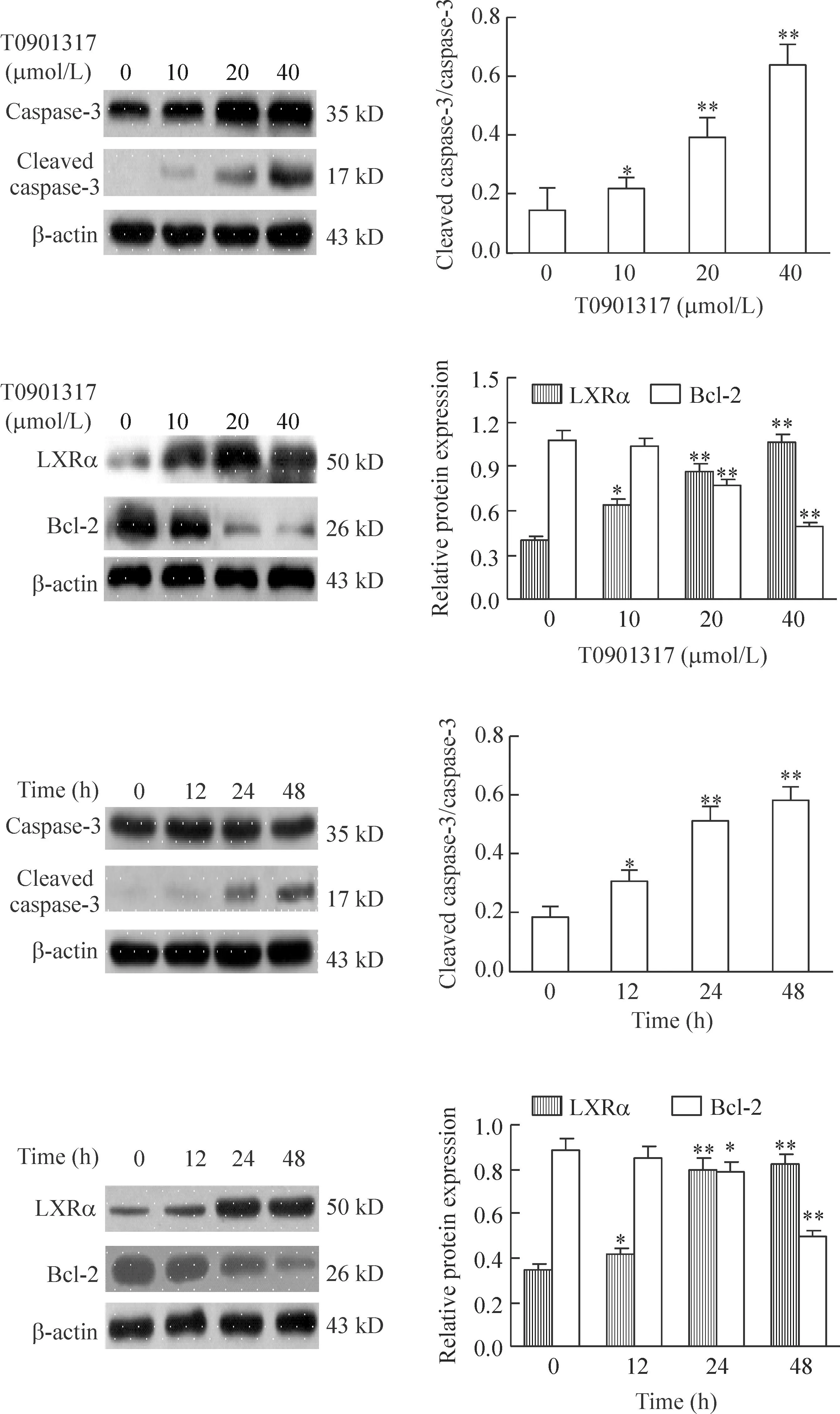
Figure 2.The effect of T0901317 on the protein levels of LXRα and apoptosis-related proteins, such as Bcl-2 and cleaved caspase-3, in MDA-MB-231 cells detected by Western blot. Mean±SD. n=3.*P<0.05,**P< 0.01 vs 0 μmol/L or 0 h.
图2T0901317对MDA-MB-231细胞中LXRα和凋亡相关蛋白Bcl-2和cleaved caspase-3蛋白水平的影响
3T0901317对MDA-MB-231细胞中LXRα和Bcl-2 mRNA表达的影响
RT-qPCR结果显示,与control组相比,随着T0901317处理浓度的增加,LXRα 的mRNA水平明显增高,Bcl-2的 mRNA表达明显降低。与0 h组相比,随着T0901317处理时间的延长,LXRα的mRNA水平明显增高,Bcl-2的mRNA表达明显降低,差异具有统计学显著性(P<0.05),见图3。这说明T0901317能上调LXRα的mRNA水平,抑制抗凋亡蛋白Bcl-2的mRNA表达。
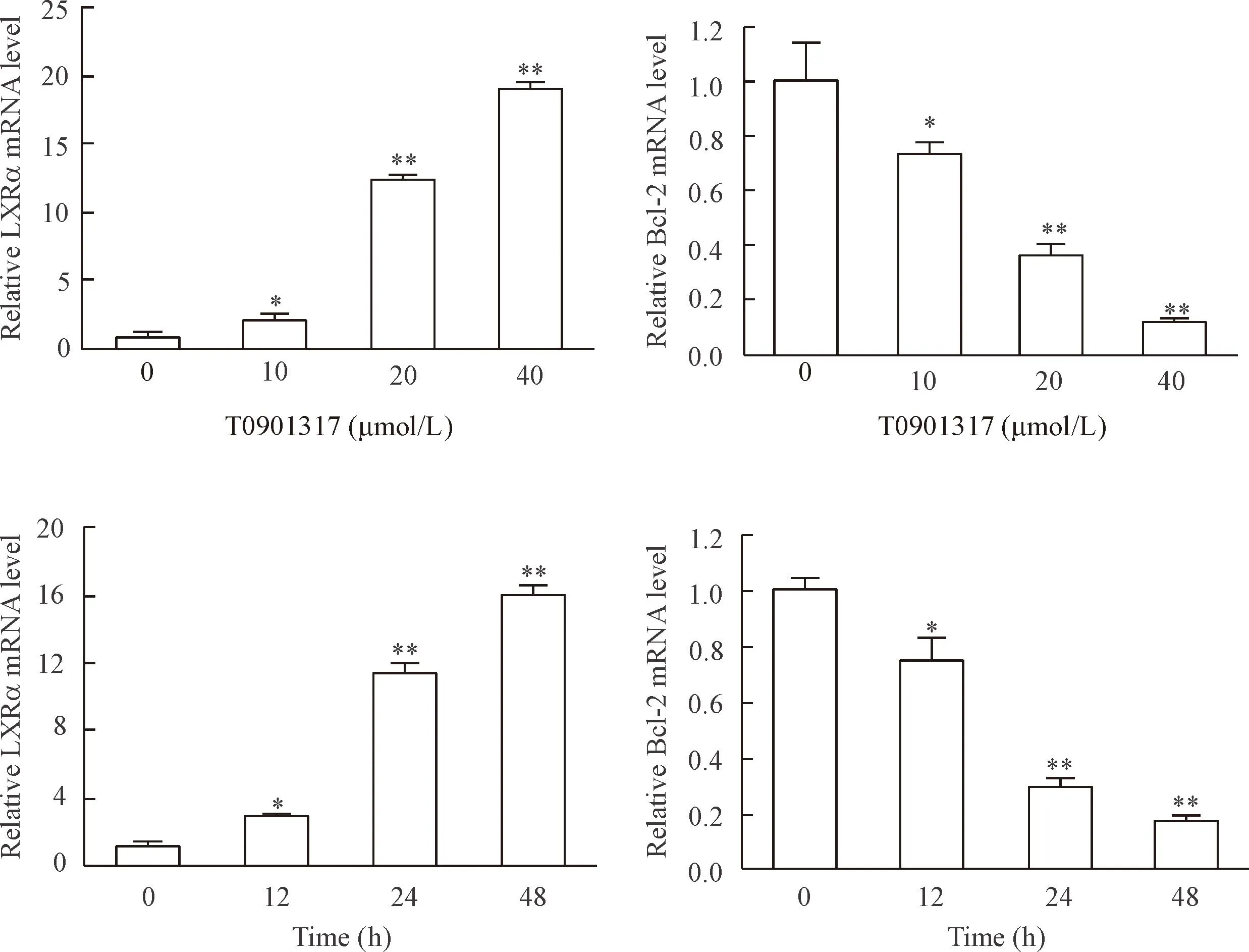
Figure 3.The effect of T0901317 on the mRNA expression of LXRα and Bcl-2 in MDA-MB-231 cells detected by RT-qPCR. Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 μmol/L or 0 h.
图3T0901317对MDA-MB-231细胞中LXRα和Bcl-2 mRNA表达的影响
讨论
乳腺癌的发病机理至今仍未阐明,诱导乳腺癌细胞凋亡可作为生物治疗的一种有效手段[7-9]。而T0901317能否诱导乳腺癌细胞凋亡,成为乳腺癌防治的新药?El Roz 等[7]2012年报道,MCF-7细胞中激动LXR可促进细胞内胆固醇流出,抑制细胞增殖,略有提示检测了其间细胞凋亡相关蛋白Bax和Bcl-2的基因表达。据此,我们围绕T0901317对乳腺癌细胞凋亡的影响做了系统的检测。
不仅MCF-7细胞,针对MDA-MB-231细胞,我们运用Hoechst 33342染色和流式Annexin V-FITC/PI双染法检测,结果均发现随着T0901317处理浓度的增加,活细胞总数下降,细胞核发生固缩甚至碎裂,荧光不均且强度变大,可观察到凋亡小体。
半胱天冬酶(caspase)在正常细胞处于非活化的酶原状态;被活化后,可经凋亡蛋白酶的层叠级联反应,发生不可逆的凋亡[10]。Caspase-3在caspase家族中是数条细胞凋亡信号通路的下游聚点,一般为最后决定其细胞死亡的关键蛋白激酶,可作为凋亡发生的观察指标之一[11-12]。而Bcl-2蛋白属于 Bcl-2 蛋白家族抗凋亡蛋白[13]。我们的检测结果显示,Bcl-2蛋白表达下降,caspase-3蛋白的表达量不变或略为增加,cleaved caspase-3蛋白量明显增加,说明caspase-3被激活。进一步提示T0901317随孵育细胞浓度的增加和时间的延长,明显促进乳腺癌MDA-MB-231细胞凋亡。
凋亡过程受到多种细胞内外因素的调节,其中NF-κB通路在炎症、细胞增殖及凋亡等过程中均发挥着重要的调控作用[14-15]。有研究表明,NF-κB可以调控多种与凋亡相关的基因转录,抑制细胞凋亡[16]。且NF-κB抑制细胞凋亡主要是上调拥有相应结合位点的抗凋亡基因(如Bcl-2)的表达[17]。T0901317是肝X受体人工合成激动剂,尤其对LXRα具有高亲和力。我们的实验结果也证实,T0901317上调了LXRα的mRNA和蛋白表达。我们另有结果发现,T0901317可下调乳腺癌细胞中NF-κB p65的表达[18],而生物信息学分析提示,人LXRα序列含有NF-κB的结合位点[19]。这是否提示T0901317促使乳腺癌细胞凋亡的机制可能通过LXRα/NF-κB p65/Bcl-2途径。接下来我们将进一步通过激动剂和阻断剂的应用探讨T0901317诱导乳腺癌细胞凋亡的可能机制。
综上所述,我们认为T0901317能上调LXRα的表达,诱导MDA-MB-231细胞凋亡。
[参考文献]
[1]El Roz A, Bard JM, Valin S, et al. Macrophage apolipoprotein E and proliferation of MCF-7 breast cancer cells: role of LXR[J]. Anticancer Res, 2013, 33(9):3783-3789.
[2]Chuu CP. Modulation of liver X receptor signaling as a prevention and therapy for colon cancer[J]. Med Hypo-theses, 2011, 76(5):697-699.
[3]Yang CM, Lu YL, Chen HY, et al. Lycopene and the LXRα agonist T0901317 synergistically inhibit the proliferation of androgen-independent prostate cancer cells via the PPARγ-LXRα-ABCA1 pathway[J]. J Nutr Biochem, 2012, 23(9): 1155-1162.
[4]Jia Y, Viswakarma N, Reddy JK. Med1 subunit of the mediator complex in nuclear receptor-regulated energy metabolism, liver regeneration, and hepatocarcinogenesis[J]. Gene Expr, 2014, 16(2):63-75.
[5]Zhang W, Jiang H, Zhang J, et al. Liver X Receptor activation induces apoptosis of melanoma cell through caspase pathway[J]. Cancer Cell Int, 2014, 14(1):1-6.
[6]Pommier AJ, Alves G, Viennois E, et al. Liver X receptor activation downregulates AKT survival signaling in lipid rafts and induces apoptosis of prostate cancer cells[J]. Oncogene, 2010, 29(18):2712-2723.
[7]El Roz A, Bard JM, Huvelin JM, et al. LXR agonists and ABCG1-dependent cholesterol efflux in MCF-7 breast cancer cells: relation to proliferation and apoptosis[J]. Anticancer Res, 2012, 32(7):3007-3013.
[8]EBCTCG(Early Breast Cancer Trialists’Collaborative Group). Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8135 women in 22 randomised trials[J]. Lancet, 2014, 383(9935):2127-2135.
[9]陆英,刘相富,刘玲玲,等. ARHI 基因抑制U937白血病细胞株生长并诱导其G2/M期阻滞及凋亡[J]. 中国病理生理杂志, 2015, 31(11):1950-1955.
[10]Delgado ME, Olsson M, Lincoln FA, et al. Determining the contributions of caspase-2, caspase-8 and effector caspases to intracellular VDVADase activities during apoptosis initiation and execution[J]. Biochim Biophys Acta, 2013, 1833(10):2279-2292.
[11]Kuboki M, Ito A, Simizu S, et al. Activation of apoptosis by caspase-3-dependent specific RelB cleavage in anticancer agent-treated cancer cells: involvement of positive feedback mechanism[J]. Biochem Biophys Res Commun, 2015, 456(3):810-814.
[12]Boing AN, Stap J, Hau CM, et al. Active caspase-3 is removed from cells by release of caspase-3-enriched vesicles[J]. Biochim Biophys Acta, 2013, 1833(8):1844-1852.
[13]Asmarinah A, Paradowska-Dogan A, Kodariah R, et al. Expression of the Bcl-2 family genes and complexes involved in the mitochondrial transport in prostate cancer cells[J]. Int J Oncol, 2014, 45(4):1489-1496.
[14]Rai A, Kapoor S, Singh S, et al. Transcription factor NF-κB associates with microtubules and stimulates apoptosis in response to suppression of microtubule dynamics in MCF-7 cells[J]. Biochem Pharmacol, 2015, 93(3):277-289.
[15]Pateras I, Giaginis C, Tsigris C, et al. NF-κB signaling at the crossroads of inflammation and atherogenesis: searching for new therapeutic links[J]. Expert Opin Ther Targets, 2014, 18(9):1089-1101.
[16]Feng XJ, Liu SX, Wu C, et al. The PTEN/PI3K/Akt signaling pathway mediates HMGB1-induced cell proliferation by regulating the NF-κB/cyclin D1 pathway in mouse mesangial cells[J]. Am J Physiol Cell Physiol, 2014, 306(12):C1119-C1128.
[17]Cao JP, Niu HY, Wang HJ, et al. NF-κB p65/p52 plays a role in GDNF up-regulating Bcl-2 and Bcl-w expression in 6-OHDA-induced apoptosis of MN9D cell[J]. Int J Neurosci, 2013, 123(10):705-710.
[18]李涛. T0901317通过LXRα/NF-κB p65/cyclinD1途径抑制人乳腺癌MCF-7细胞增殖[D]. 衡阳: 南华大学, 2014.
[19]Castrillo A, Joseph SB, Marathe C, et al. Liver X receptor-dependent repression of matrix metalloproteinase-9 expression in macrophages[J]. J Biol Chem, 2003, 278(12):10443-10449.
(责任编辑: 卢萍, 罗森)
T0901317 induces apoptosis of human breast cancer MDA-MB-231 cells by up-regulating LXRα expression
TU Jian1, LU Kai-qiang1, DING Wei-ke1, LIU Xiao-wang1, XIONG Ting1, LIU Ling1, YAN Xin1, ZHOU Zhi-gang2
(1Institute of Pharmacy and Pharmacology,2The First Affiliated Hospital, University of South China, Hengyang 421001, China. E-mail: zhouzhigang0734@sina.com)
[ABSTRACT]AIM: To investigate the pro-apoptotic effect of T0901317, an artificial agonist of liver X receptor α (LXRα), on human breast cancer MDA-MB-231 cells and its mechanism. METHODS: MDA-MB-231 cells were treated with different concentrations (0, 10, 20 and 40 μmol/L) of T0901317 for different time (0, 12, 24 and 48 h). The cell apoptosis was determined by Annexin V/propidium iodide staining and Hoechst 33342 staining. The expression of apoptosis-related proteins, such as Bcl-2, caspase 3 and cleaved caspase-3, and LXRα was determined by Western blot. The mRNA expression of Bcl-2 and LXRα was analyzed by RT-qPCR. RESULTS: T0901317 induced the cell apoptosis in a dose-and time- dependent manner. The expression of cleaved caspase-3 and LXRα was up-regulated, but Bcl-2 was down-regulated by T0901317. The mRNA expression of Bcl-2 was down-regulated, while LXRα was up-regulated by T0901317.CONCLUSION: T0901317 up-regulates LXRα expression and induces the apoptosis of MDA-MB-231 cells.
[KEY WORDS]T0901317; Liver X receptor α; MDA-MB-231 cells; Apoptosis
[文章编号]1000- 4718(2016)05- 0836- 05
[收稿日期]2015- 12- 21[修回日期] 2016- 02- 23
*[基金项目]国家自然科学基金资助项目(No. 81541163); 湖南省自然科学基金资助项目(No. 2015JJ3101); 湖南省教育厅创新平台项目(No. 15K111);“湖南省分子靶标新药研究协同创新中心”培育项目(No. 2014-405)
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.011
杂志网址: http://www.cjpp.net
△通讯作者Tel: 0734-8578508; E-mail: zhouzhigang0734@sina.com
