伊马替尼一线治疗慢性粒细胞白血病慢性期患者-单中心十年回顾性分析*
2016-06-06李菲张晓洁张荣艳肖承京卢炜饶佳周玉兰陈国安杨赣萍
李菲 张晓洁 张荣艳 肖承京 卢炜 饶佳 周玉兰 陈国安 杨赣萍
伊马替尼一线治疗慢性粒细胞白血病慢性期患者-单中心十年回顾性分析*
李菲张晓洁张荣艳肖承京卢炜饶佳周玉兰陈国安杨赣萍
摘要目的:总结以伊马替尼为一线治疗的慢性粒细胞白血病(chronic myeloid leukemia,CML)初治患者的疗效和生存。方法:回顾性分析南昌大学第一附属医院2003年1月至2013年12月间收治的295例CML初治患者的临床资料,其中185例为入组格列卫全球患者援助项目(GIPAP)行伊马替尼治疗、30例为干扰素(IFN-α)治疗、50例为羟基脲单药治疗和30例为异基因外周血造血干细胞移植(allogeneic hematopoietic stem cell transplantation,Allo-HSCT)治疗的患者,分析各组患者的治疗疗效和生存情况。结果:伊马替尼治疗组和Allo-HSCT治疗组患者完全血液学缓解率(complete hematologic remission,CHR)均为96.7%,完全细胞遗传学缓解率(complete cytogenetic remission,CCyR)为89.7%和93.3%,完全分子学缓解率(complete molecular remission,CMoR)为49.7%和83.3%(P=0.001);而干扰素和羟基脲治疗组CHR、CCyR和CMoR均明显低于伊马替尼治疗组和Allo-HSCT治疗组。伊马替尼组患者的总生存时间(overall survival,OS)明显优于其他组(P<0.001),甚至优于Allo-HSCT治疗组(10年OS为89.0%vs.67.0%,P<0.001)。Cox多因素分析显示接受伊马替尼治疗(HR=5.267,95%CI为1.054~1.940,P=0.022)和获得CCyR(HR=9.541,95%CI为1.692~10.513,P=0.002)是影响本组患者预后良好的独立因素。结论:CML初治患者接受伊马替尼治疗可以获得更高的CHR和CCyR,且OS更优,伊马替尼适合作为中国初治CML患者的一线治疗。
关键词伊马替尼慢性粒细胞白血病治疗反应预后
作者单位:南昌大学第一附属医院血液科(南昌市330006)
*本文课题受江西省青年科学家培养项目(编号:20153BCB23040)和江西省教育厅科技计划(编号:GJJ11335)资助通信作者:杨赣萍yangganping@medmail.com.cn
慢性粒细胞白血病(chronic myeloid leukemia,CML)是一种由BCR-ABL融合基因转录导致的血液系统恶性肿瘤,约占成人白血病的15%[1]。9号染色体长臂3区4带(q34)的原癌基因c-ABL和22号染色体长臂1区1带(q11)的BCR基因形成BCR-ABL融合基因,继而编码融合蛋白p210BCR-ABL[2-3],其酪氨酸激酶活性被异常激活,产生持续的细胞增殖信号致白血病发生[4]。CML患者通常经过3~5年的慢性期(CML-CP)随后进入加速期(CML-AP)直至急变期(CML-BP),产生类似急性白血病的表现[5]。
一项多中心随机临床研究即国际随机化研究(international randomized study,IRIS)比较了伊马替尼(STI571)和干扰素(IFN-α)联合阿糖胞苷治疗CML患者的疗效,随访18个月,伊马替尼组患者无论是完全细胞遗传学缓解率(complete cytogenetic re⁃mission,CCyR)还是主要细胞遗传学反应率(major cytogenetic response,MCyR)均明显优于干扰素联合阿糖胞苷组(76%vs.15%和87%vs.35%),且转化为CML-AP或CML-BP的患者比例明显更低[6]。基于该项研究结果,2001年美国食品药品监督管理局(FDA)批准伊马替尼用于干扰素治疗失败的CML患者。目前,伊马替尼已被广泛用于CML-CP患者的一线治疗[7],但在中国由于治疗费用昂贵,除非入组格列卫全球患者援助项目(GIPAP),大部分患者仍然在接受IFN-α联合阿糖胞苷,羟基脲(HU)或异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,Allo-HSCT)治疗,且国内伊马替尼治疗CML-CP患者的长期回顾性分析尚少。本研究回顾性分析南昌大学第一附属医院自2003年至2013年期间接受不同治疗的CML-CP患者的临床资料,比较不同治疗背景下患者的血液学、细胞遗传学和分子生物学治疗反应和生存情况,旨在为中国CML患者提供更多的伊马替尼一线治疗临床依据。
1 材料与方法
1.1临床病例
本研究回顾性分析2003年1月至2013年12月南昌大学第一附属医院诊断为CML-CP的初治患者共397例。诊断标准根据患者的症状、体征、血细胞计数、骨髓形态学、细胞遗传学和分子生物学指标(荧光原位杂交检测BCR-ABL融合基因或逆转录PCR定性或定量检测BCR-ABL融合基因转录本)[8]。所有患者如白细胞≥50×109/mL,加用羟基脲降白细胞,随后根据治疗将患者分为伊马替尼治疗组、IFN-α联合阿糖胞苷治疗组、羟基脲单药治疗组和Allo-HSCT治疗组4组。评估指标包括年龄、性别、Sokal评分、血细胞计数、染色体和BCR-ABL融合基因检测和患者的生存时间(overall survival,OS)。患者在治疗中如果丧失CCyR或MCyR、12个月未达到MCyR或疾病进展至CML-AP或CML-BP则行BCR-ABL激酶区突变分析。
1.2方法
1.2.1治疗方法CML-CP患者初始的伊马替尼使用剂量为400 mg/d。如果出现3级或4级的血液学不良反应,则将伊马替尼的剂量减量至300 mg/d或暂时停药。药物不良反应根据美国国家癌症研究所(NCI)制定的常见不良反应标准(CTC 2.0版)进行评估[9]。如果治疗3个月未达到血液学缓解率(com⁃plete hematologic remission,CHR)或6~12个月未达到MCyR,则伊马替尼的剂量增加至600~800 mg/d。IFN-α为5 MU/m2隔天肌肉注射,阿糖胞苷20 mg/m2每月皮下注射10天,羟基脲用量根据血细胞计数调整,维持白细胞4.0~10.0×109/L。
1.2.2疗效评价治疗评估标准参照欧洲白血病网(European Leukmia Net,ELN)推荐的成人CML患者的疗效监测标准[10]。CHR定义为白细胞计数<10×109/ L,血小板计数<450×109/L,外周血中幼粒和晚幼粒细胞<5%,外周血涂片无原始或早幼粒细胞,无髓外累及,无CML加速期或急变期的表现。细胞遗传学反应分为:CCyR定义为无pH染色体阳性细胞,部分细胞遗传学缓解(partial cytogenetic remission,PCyR)定义为1%~35%pH染色体阳性细胞。MCyR定义为pH染色体阳性率0~35%。遗传学评估根据G显带计数≥20个中期细胞。完全分子学缓解率(complete molecular remission,CMoR)定义为未检测到BCRABL转录本,主要分子学缓解(major molecular remis⁃sion,MMoR)定义为治疗后BCR-ABL转录本降低≥3个对数级以上。
1.3统计学方法
采用SPSS 20.0软件进行统计学分析。无事件生存时间(event free survival time,EFS)从患者治疗初始直至出现治疗失败,如出现疾病进展、伊马替尼治疗中断或患者死亡。OS从治疗初始至患者死亡。不同组间的差异性分析采用χ2检验。采用Kaplan-Meier法计算EFS和OS时间,并绘制生存曲线,采用Log rank法检验各组患者OS的差异。多因素分析采用Cox回归模型。以P<0.05为差异具有统计学意义。
2 结果
2.1临床特征
CML慢性期的初治患者397例中94例患者由于联系电话或地址不明失去随访,8例患者由于3级或4级血液学不良反应而放弃伊马替尼治疗。最终295例患者列入本项研究,男性193例,女性102例,中位年龄40(15~77)岁。伊马替尼治疗的患者为185例,IFN-α联合阿糖胞苷治疗为30例,羟基脲单药治疗为50例,Allo-HSCT治疗为30例。除Allo-HSCT治疗组患者Sokal评分显示高危患者比例更高60%(18/30)之外,其他4组患者的临床特点差异均无统计学意义(表1)。
2.2临床疗效
伊马替尼治疗组患者中96.7%(179/185)获得CHR,3.3%(6/185)出现持续白细胞减少(3.0~4.0×109/L),89.7%(166/185)获得CCyR,92.4%(171/185)获得MCyR。此外,49.7%(92/185)的患者在治疗过程中获得CMoR。Allo-HSCT治疗组患者也获得较好的治疗反应,96.7%(29/30)获得CHR,3.3%(1/30)患者移植后出现继发性纯红细胞再生障碍性贫血;93.3%(28/30)和100.0% (30/30)获得CCyR和MCyR,83.3%(25/30)获得CMoR。Allo-HSCT治疗组患者获得CMoR的比例高于伊马替尼治疗组患者(83.3%vs.49.7%,P=0.001)。而干扰素治疗组患者获得CHR、CCyR、MCyR和CMoR的比例明显更低,羟基脲治疗组仅有14.0%(7/50)获得CHR,无患者获得CCyR和CMoR(表2)。

表2 各组患者的治疗反应Table 2 Treatment response of patients from four groups
本研究进一步分析是否伊马替尼和Allo-HSCT治疗能克服高危Sokal评分带来的不良反应,结果发现即使Sokal评分为高危的患者仍能取得较好的治疗反应。在伊马替尼治疗组,13.5%(25/185)的患者Sokal评分为高危,其中92.0%(23/25)获得CHR、8.0%(2/25)出现持续白细胞减少,76.0%(19/25)获得CCyR和36.0%(9/25)获得CMoR。在Allo-HSCT治疗组中,60.0%(18/30)的患者为高危Sokal评分,所有患者100.0%(30/30)均获得CHR和CCyR,72.2%(13/18)获得CMoR。Allo-HSCT治疗组患者获得CCyR为(100.0%vs.76.0%,P=0.025)和CMoR(72.2%vs.36.0%,P=0.019)的比例明显高于伊马替尼治疗组。而在羟基脲和干扰素治疗组患者中,高危Sokal评分的患者均未获得CCyR和CMoR。
2.3生存分析
为评估不同治疗对CML-CP患者的生存影响,本研究分析295例患者的临床、实验室和生存数据,295例患者的中位随访时间为34(7~132)个月。伊马替尼治疗组患者的中位EFS时间最优,其次是Allo-HSCT治疗组患者(伊马替尼治疗组vs.Allo-HSCT治疗组,P=0.003),但在干扰素治疗组和羟基脲治疗组患者中,中位EFS时间分别为(44.0±5.9)个月和(40.0±4.6)个月,差异均无统计学意义(上述4组患者EFS的比较差异具有统计学意义,P<0.001)。同样,伊马替尼治疗组和Allo-HSCT治疗组患者的OS明显优于干扰素治疗组和羟基脲治疗组患者,4组间的比较差异具有统计学意义(P<0.001),而干扰素和羟基脲治疗组患者的OS为(55.0±6.0)个月和(52.0±5.0)个月。本研究还比较伊马替尼治疗组和Allo-HSCT治疗组患者的OS,尽管Allo-HSCT治疗组患者较伊马替尼治疗组患者有更高的CMoR(83.3%vs.49.7%,P=0.001),但伊马替尼治疗组患者的10年OS明显优于Allo-HSCT治疗组(89.0%vs.67.0%,P<0.001)。而干扰素治疗组和羟基脲治疗组的患者OS差异无统计学意义(P=0.621,图1)。
相比治疗反应较差的患者,在治疗中获得CHR、CCyR 或CMoR的患者具有更优的EFS和OS(均P<0.001,图2,表3)。本研究进一步分析伊马替尼治疗组患者中,第12个月获得CCyR和CMoR是否对患者的生存有影响。166例获得CCyR的患者中,91.6%(152/166)在12个月内获得CCyR,8.4%(14/166)超过12个月获得CCyR。92例获得CMoR的患者中,47.8%(44/92)在12个月内获得CMoR;但未观察到第12个月获得CCyR和 CMoR对患者的生存影响,差异无统计学意义(P>0.05)。

图1 CML患者的伊马替尼治疗组、Allo-HSCT治疗组、IFN-α治疗组和羟基脲单药治疗组EFS和OS比较Figure 1 Comparison of EFS and OS among 295 newly diagnosed CMLCP patients in imatinib,alloSCT,IFN-α,and HU groups
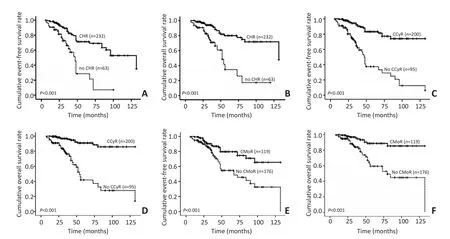
图2 各亚组患者的EFS和OS比较Figure 2 EFS and OS among different subgroups from 295 newly diagnosed CML-CP patients
本研究将白细胞计数、血红蛋白、血小板计数、脾肿大、乳酸脱氢酶(LDH)、Sokal评分、伊马替尼治疗、获得CHR、CCyR和CMoR等因素纳入多因素分析,结果显示接受伊马替尼治疗(HR=5.267,95%CI为1.054~1.940,P=0.022)和获得CCyR(HR=9.541,95%CI为1.692~10.513,P=0.002)为预后良好的独立影响因素。
2.4BCR-ABL激酶区(KD)突变
11例患者检测到KD突变,突变率为5.9%(11/ 185)。距离伊马替尼治疗的中位时间为30(9~56)个月。7例患者处于CHR时检测到KD突变,4例患者进入CML-AP或CML-BP时监测到KD突变。至随访结束时仅有3例患者(F359V、E255V和G250E突变)仍处于CML-CP,其他患者均进展至CML-AP或死亡。
2.5不良反应
大部分患者对伊马替尼耐受性良好,仅有8例患者因3级或4级血液学不良反应而中断伊马替尼治疗。6例患者出现持续的1度白细胞减少,伊马替尼减量至300 mg/d(白细胞范围3.0~4.0×109/L)。其他不良反应包括疲乏62.2%(115/185),恶心/呕吐68.1% (126/185),腹泻20.0%(37/185),胃部不适82.2% (152/185)和液体潴留65.4%(121/185)。通常经过短暂的伊马替尼停药或减量上述症状可以缓解。

表3 不同亚组患者的生存时间Table 3 Cumulative survival of 295 patients in different subgroups
3 讨论
伊马替尼自问世以来,治疗CML-CP患者已取得很多令人振奋的临床结果,并成为CML患者的标准一线治疗方案[11]。但中国大部分患者自2003年9月GIPAP项目开展才开始接受伊马替尼治疗,而且在中国CML患者中,大样本的伊马替尼治疗CML的疗效和生存数据仍然报道尚少。为给中国CML患者一线使用伊马替尼提供更多的临床数据支持,本研究回顾性分析2003年至2013年10年间在南昌大学第一附属医院收治的CML-CP患者接受伊马替尼组、IFN-α联合阿糖胞苷治疗组、羟基脲单药治疗组和Allo-HSCT治疗组患者的临床和生存资料。本研究数据显示接受伊马替尼一线治疗的CML-CP患者在治疗过程中获得MCyR为92.4%(171/185),CCyR为89.7%(166/185)和CMoR为49.7%(92/185),本研究结果和IRIS临床试验的结果相似[12]。此外,Sokal评分显示为高危的患者接受伊马替尼和Allo-HSCT治疗后仍然能获得更佳的治疗反应。患者生存数据分析显示伊马替尼治疗组和IFN-α联合阿糖胞苷治疗组较羟基脲单药治疗组具有更佳的EFS和OS,甚至优于Allo-HSCT治疗组患者。
2006年ELN推荐CML-CP患者的疗效评估标准。患者在治疗中出现下列情况被视为治疗反应不良:1)3个月未获得CHR;2)6个月未达到CCyR;3)12个月未达到CMoR。患者出现上述情况通常预示着预后不佳或很快将出现疾病进展[13]。由于本组患者的依从性较差,本研究未获得患者在治疗不同时间点(3、6、12、18个月)的完整遗传学和分子学资料,部分患者仅行BCR-ABL转录本的定性检测。然而,本研究仍然观察到患者在治疗过程中获得CHR、CCyR 和CMoR并有更佳的OS(图2),提示获得CHR、CCyR 和CMoR能作为预测CML慢性期患者良好预后的指标。近年来,国内一项多中心临床研究总结了伊马替尼治疗CML患者的疗效,获得CCyR和CMoR的患者比例分别为47.1%~92.9%和29.4%~54.9%。本研究结果与IRIS试验或国内其他中心的研究结果类似甚至更优[6,14],可能和本研究总结的是整个治疗过程中获得CHR、CCyR和CMoR,而不是不同时间点的结果有关。当然,如果条件允许,还是应该严格按照ELN推荐的时间点观察患者疗效,这将有助于及时调整新的治疗策略,如增加伊马替尼治疗的剂量,选择二代酪氨酸激酶或调整其他治疗以延缓患者疾病进展的时间。
诸多证据表明KD突变的患者可能会出现伊马替尼耐药,特别是T315I、E255K和F317L等突变,其能阻止伊马替尼和BCR-ABL结合,致使疾病向CML-AP和CML-BP进展,上述患者应尽早换用二代酪氨酸激酶抑制剂治疗,但有些突变如T315I对二代酪氨酸激酶抑制剂也产生耐药,这类患者采用Allo-HSCT可能为更佳选择[15-17]。本研究中5.9%(11/185)CML初治患者出现KD突变,检测到突变的中位时间为伊马替尼开始治疗后30(9~56)个月。7例患者在CHR状态时监测到KD突变,4例患者在CML-AP和CML-BP检测到KD突变。至随访结束时,仅有3例患者(F359V、E255V和G250E)仍处于CML-CP,其他患者均进展至CML-AP或已经死亡。近年来,部分研究报道患者在疾病进展过程中可以同时伴有几种类型突变,甚至丢失原有的突变而出现新的突变[18-19]。本研究中未观察到上述现象,但当患者丧失CCyR或MCyR或出现疾病进展时应及时监测KD突变,将有助于临床医生尽早调整治疗策略。
Allo-HSCT曾在20世纪90年代被作为CML-CP患者的一线治疗,但各种并发症的发生率较高,如移植物抗宿主病、病毒感染和间质性肺炎等。对酪氨酸激酶抑制剂耐药的慢性期或疾病进展至CML-AP 和CML-BP的患者来说,Allo-HSCT仍然不失为一种有效的治疗选择[20-22]。本研究结果提示尽管Allo-HSCT治疗组患者有更高的CMoR,但由于Allo-HSCT治疗后并发症和死亡率更高,Allo-HSCT治疗组患者的EFS和OS仍较伊马替尼治疗组更差。Cox多因素分析显示伊马替尼治疗组(HR=5.267,95%CI为1.054~1.940,P=0.022)和获得CCyR(HR=9.541,95% CI为1.692~10.513,P=0.002)是影响OS的独立因素。
综上所述,本研究单中心的回顾性分析结果提示中国CML-CP患者伊马替尼治疗后,与行羟基脲、干扰素联合阿糖胞苷及Allo-HSCT治疗相比,能获得较高的治疗反应率和生存率,伊马替尼适合作为中国CML患者的一线治疗。
参考文献
[1]Jemal A,Siegel R,Xu J,et al.Cancer statistics[J].CA Cancer J Clin,2010,60(5):277-300.
[2]Quintás-Cardama A,Cortes J.Molecular biology of bcr-abl1-positive chronic myeloid leukemia[J].Blood,2009,113(8):1619-1630.
[3]Rowley JD.Letter:a new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining[J].Nature,1973,243(5405):290-293.
[4]Deininger MW,Goldman JM,Melo JV.The molecular biology of chronic myeloid leukemia[J].Blood,2000,96(10):3343-3356.
[5]O'brien S,Radich JP,Abboud CN,et al.Chronic myelogenous leukemia,version 1.2014[J].J Natl Compr Canc Netw,2013,11(11):1327-1340.
[6]O'brien SG,Guilhot F,Larson RA,et al.Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia[J].N Engl J Med,2003,348(11):994-1004.
[7]Gugliotta G,Castagnetti F,Apolinari MA,et al.First-Line treatment of newly diagnosed elderly patients with chronic myeloid leukemia:current and emerging strategies[J].Drugs,2014,74(6):627-643.
[8]Arber DA,Orazi A,Hasserjian R,et al.The 2016 revision to the World Health Organization(WHO)classification of myeloid neoplasms and acute leukemia[J].Blood,2016[Epub ahead of print].
[9]Trotti A,Byhardt R,Stetz J,et al.Common toxicity criteria:version 2.0.an improved reference for grading the acute effects of cancer treatment:impact on radiotherapy[J].Int J Radiat Oncol Biol Phys,2000,47(1):13-47.
[10]Baccarani M,Saglio G,Goldman J,et al.Evolving concepts in the management of chronic myeloid leukemia:recommendations from an expert panel on behalf of the European LeukemiaNet[J].Blood,2006,108(6):1809-1820.
[11]Druker BJ,Talpaz M,Resta DJ,et al.Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia[J].N Engl J Med,2001,344(14):1031-1037.
[12]Druker BJ,Guilhot F,O'brien SG,et al.Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia[J].N Engl J Med,2006,355(23):2408-2417.
[13]Marin D,Milojkovic D,Olavarria E,et al.European LeukemiaNet criteria for failure or suboptimal response reliably identify patients with CML in early chronic phase treated with imatinib whose eventual outcome is poor[J].Blood,2008,112(12):4437-4444.
[14]Zhu Y,Qian SX.Clinical efficacy and safety of imatinib in the management of Ph(+)chronic myeloid or acute lymphoblastic leukemia in Chinese patients[J].Onco Targets Ther,2014,7(2):395-404.
[15]Shah NP,Nicoll JM,Nagar B,et al.Multiple BCR-ABL kinase domain mutations confer polyclonal resistance to the tyrosine kinase inhibitor imatinib(STI571)in chronic phase and blast crisis chronic myeloid leukemia[J].Cancer Cell,2002,2(2):117-125.
[16]Nicolini FE,Corm S,Le QH,et al.Mutation status and clinical outcome of 89 imatinib mesylate-resistant chronic myelogenous leukemia patients:a retrospective analysis from the French intergroup of CML(Fi(phi)-LMC GROUP)[J].Leukemia,2006,20(6):1061-1066.
[17]Branford S,Rudzki Z,Walsh S,et al.Detection of BCR-ABL mutations in patients with CML treated with imatinib is virtually always accompanied by clinical resistance,and mutations in the ATP phosphate-binding loop(P-loop)are associated with a poor prognosis [J].Blood,2003,102(1):276-283.
[18]Cortes J,Jabbour E,Kantarjian H,et al.Dynamics of BCR-ABL kinase domain mutations in chronic myeloid leukemia after sequential treatment with multiple tyrosine kinase inhibitors[J].Blood,2007,110(12):4005-4011.
[19]He H,Shen Y,Zhu Y,et al.Prognostic analysis of chronic myeloid leukemia in Chinese population in an imatinib era[J].Front Med,2012,6(2):204-211.
[20]Baccarani M,Deininger MW,Rosti GA,et al.European LeukemiaNet recommendations for the management of chronic myeloid leukemia:2013[J].Blood,2013,122(6):872-884.
[21]Pavlu J,Szydlo RM,Goldman JM,et al.Three decades of transplantation for chronic myeloid leukemia:what have we learned[J]?Blood,2011,117(3):755-763.
[22]O'brien S,Abboud CN,Akhtari M,et al.Chronic myelogenous leukemia[J].J Natl Compr Canc Netw,2012,10(1):64-110.
(2016-03-19收稿)
(2016-04-15修回)
(编辑:孙喜佳校对:张抿)
李菲专业方向为血液恶性肿瘤的临床诊治和基础研究。E-mail:yx021021@sina.com

·临床研究与应用·
Imatinib mesylate therapy for patients with chronic myeloid leukemia:long-term outcome from a single center in China
Fei LI,Xiaojie ZHANG,Rongyan ZHANG,Chengjing XIAO,Wei LU,Jia RAO,Yulan ZHOU,Guo'an CHEN,Ganping YANG
Department of Hematology,The First Affiliated Hospital of Nanchang University,Nanchang 330006,China
This study was supported by the Young Scientist Training Program of Jiangxi Province(No.20153BCB23040)and The Science and Technology Program from the Department of Education in Jiangxi Province(No.GJJ11335)
Correspondence to:Ganping YANG;E-mail:yangganping@medmail.com.cn
AbstractObjective:Imatinib is extensively used as a first-line therapeutic agent for patients with chronic myeloid leukemia(CML)at the chronic phase(CP).Although CML patients undergoing imatinib treatment are enrolled mainly in the Glivec International Patient Assistance Program(GIPAP)in China since 2003,limited data have been reported on the long-term outcome of these patients.This study aims to compare the treatment response and prognosis of CML-CP patients who received different treatments from January 2003 to December 2013 in the First Affiliated Hospital of Nanchang University.Methods:A total of 295 patients were enrolled,including 185,30,50,and 30 patients for imatinib,interferon-alpha(IFN-α)plus Ara-C,hydroxycarbamide(HU),or allogeneic hematopoietic stem cell transplantation(Allo-HSCT)treatments,respectively.Results:Patients in imatinib and Allo-HSCT groups achieved excellent complete hematologic remission(CHR)(i.e.,96.7%vs.96.7%),complete cytogenetic response(CCyR)(i.e.,89.7%vs.93.3%),and complete molecular remission(CMoR)(i.e.,49.7%vs.83.3%,P=0.001).However,significantly low rates of CHR,CCyR,McyR,and CMoR were observed in IFN-α and HU groups.Moreover,patients from imatinib group showed longer overall survival(OS)time than patients from other groups(P<0.001),even patients in Allo-HSCT group(10-year OS,89.0%vs.67.0%,P<0.001)because of high risk of Allo-HSCT-related complication.Multivariate analysis showed that receiving imatinib treatment(HR=5.267,95%CI:1.054-1.940,P=0.022)and achieving CCyR(HR=9.541,95%CI:1.692-10.513,P=0.002)were independent predictors for OS.Conclusion:Imatinib treatment may be an optimal first-line choice for Chinese patients with CML-CP who have not received any previous treatments.
Keywords:imatinib,chronic myeloid leukemia,treatment response,prognosis
doi:10.3969/j.issn.1000-8179.2016.10.319
作者简介
