聚乙烯亚胺纳米纤维的制备及其胆红素吸附性能研究
2016-06-05徐先林庄旭品
张 方,徐先林,2,王 航,石 磊,庄旭品,2
(1.天津工业大学,天津 300387;2.省部共建膜材料与膜过程国家重点实验室,天津 300387)
聚乙烯亚胺纳米纤维的制备及其胆红素吸附性能研究
张 方1,徐先林1,2,王 航1,石 磊1,庄旭品1,2
(1.天津工业大学,天津 300387;2.省部共建膜材料与膜过程国家重点实验室,天津 300387)
文章利用同轴溶液喷射纺丝技术制备了聚乙烯亚胺(PEI)/ 聚偏氟乙烯(PVDF)皮芯型纳米纤维,其中,PEI为皮层充当吸附剂,PVDF为芯层以解决PEI难于成纤的难题;所制纤维呈三维卷曲形态并杂乱堆积形成高孔隙率的PEI/PVDF纳米纤维膜(PEI/PVDF)。为提高PEI/PVDF的胆红素吸附性能,将赖氨酸固载其表面制得赖氨酸修饰的PEI/PVDF(PEI/PVDF-lysine)。结果显示,PEI/PVDF和PEI/PVDF-lysine的胆红素吸附量分别可达376.57 mg/g和386.97 mg/g。
聚乙烯亚胺纳米纤维;同轴溶液喷射纺丝;胆红素;亲和吸附
1 引言
亲和色谱法是一种生物大分子纯化分离的方法,此方法通过配体和特定的生物分子之间相互作用表现出高特异性[1]。由于其利用凝胶粒子层析柱,具有一定的局限性,如高压降、低流速,因此生产力低[2]。作为亲和分离新技术,亲和膜分离技术是一种利用亲和配基修饰的膜(亲和膜)为介质的分离纯化生物大分子的技术,是亲和色谱和膜分离技术的结合。相比于传统的亲和色谱法,具有传质性能好、流动速率高、压降低和扩散路径短等优点。其中膜基质的种类以及配基的选择是亲和分离的关键。
近年来,纳米纤维[3]引起了广泛关注,其大的横纵比,大的比表面积使其纤维表面具有或可增加更多配基活性位点,因此可将其组成的膜材料用于亲和膜基质。溶液喷射纺丝技术是一种新型的纳米纤维制备方法[4~6],此技术利用高速气流对纺丝液细流进行拉伸并使溶剂挥发从而制得纳米纤维,生产效率高[5];由于成形过程中受高速气流场的紊流剪切力作用,所制纤维呈现三维卷曲形态;此形态的纤维杂乱堆积形成的纳米纤维膜具有高的孔隙率和蓬松度,在气体和液体过滤中均表现出较低的流动阻力;卷曲的纤维形成的曲径式微孔结构延长了流体穿行的路径,从而增加了目标分子与亲和基团接触的几率,提高膜亲和吸附能力。
本文采用同轴溶液纺丝技术[6]制备的PEI/PVDF纳米纤维膜(PEI/PVDF)为亲和吸附材料。然而,PEI是多功能团的小分子聚合物,在纺丝过程中难以成纤,因此设计了PEI/PVDF皮芯型纳米纤维。其中PEI作为皮层,可以充分发挥其官能团的作用,PVDF作为芯层,既解决了PEI难于纺丝的问题,又增加了纤维的机械性能。此外,PEI是水溶性聚合物[7],为保持其纤维结构的稳定性,选择戊二醛(GA)进行交联,将所得的PEI/PVDF吸附胆红素。
胆红素是一种四吡咯二羧酸,其中羧基可以与胺基发生静电相互作用,羧基或者吡咯氮可与含氧或氮的基团形成氢键,吡咯甲基可与疏水结构苯环、长碳链发生疏水相互作用[8]。而PEI具有高的胺密度,在链端上可接近的伯胺位点可作为吸附剂的结构单元[9]。由上述可知,PEI与胆红素间可以发生相互作用,从而实现PEI/PVDF对胆红素的亲和吸附。
为了提高PEI/PVDF的胆红素吸附性能,选择具有多功能基团并可与胆红素产生相互作用的配基偶联到PEI/PVDF。近来,氨基酸由于其亲水性和多功能基团作为亲和配基引起了广泛关注,如薛茂强等[10]用聚赖氨酸为配基的尼龙膜亲和吸附胆红素;徐堃等[11]以L-丝氨酸(Ser)为配基制备了PVDF中空纤维亲和膜并将其用于人血浆中内毒素的脱除;其中,赖氨酸(Lys)具有胺基,羧基和疏水性长碳链,本文选其作为配基固载于PEI/PVDF上,制得赖氨酸修饰的PEI/PVDF(PEI/PVDF-lysine)。将PEI/PVDF和PEI/PVDF-lysine用于胆红素吸附并研究了其吸附性能。
2 实验部分
2.1 实验原料与试剂
聚偏氟乙烯(PVDF),由上海三爱富有限公司提供;聚乙烯亚胺(PEI),由天津光复精细化工研究所提供;N,N-二甲基乙酰胺,由天津光复精细化工研究所提供;赖氨酸,由天津光复精细化工研究所提供;胆红素,由上海笃玛生物科技有限公司提供;PBS缓冲液,由北京索莱宝科技有限公司提供;其他的试剂均由天津科密欧有限公司提供。
2.2 纺丝液的配置
将PVDF粉末溶解于N,N-二甲基乙酰胺(DMAc)中,获得20 wt% 的均匀混合液作为芯层溶液;PVDF粉末和聚乙烯亚胺(PEI)粘稠液以质量比1∶9溶解到DMAc中获得10 wt%的溶液作为皮层溶液,过滤后备用。
2.3 PEI/PVDF及PEI/PVDF-lysine的制备
利用实验室自制的同轴溶液喷射纺丝设备纺制了PEI纳米纤维,同轴的喷丝头的示意图如图1所示。将纺丝液以一定的速率喂入喷丝头,其中皮芯纺丝液的给液速率如表1所示;然后,利用高速气流(压力在0.05 MPa~0.1 MPa之间)对纺丝液细流进行牵伸,在纺丝箱体中逐渐形成纳米纤维并利用风机的抽吸装置将产生的纤维收集到网帘上形成PEI/PVDF纳米纤维膜。最后,真空干燥后进行热压加固处理。选择皮层给液速率为3 mL/h,芯层给液速度为9 mL/h的条件下制备的皮芯纳米纤维进行下一步处理和研究。

图1 同轴喷丝头

实验编号皮层给液速度(mL/h)芯层给液速度(mL/h)成纤效果1510纤维表面液滴很多,纤维形态良好2412纤维表面液滴较多,纤维形态良好339纤维表面液滴较少,纤维形态良好
由于PEI易溶于水,将 PEI/PVDF 纳米纤维膜浸没在0.2 wt%的戊二醛的磷酸盐缓冲溶液中室温下处理3 h。交联后的PEI/PVDF 纳米纤维膜在0.14 wt%的赖氨酸磷酸盐缓冲溶液中45℃下反应24 h, 实现了赖氨酸亲和配基的固载,获得PEI/PVDF 纳米纤维亲和膜。
2.4 测试与表征
2.4.1 形貌观察
将所制得的PEI/PVDF和PEI/PVDF-lysine喷金处理后,通过场发射扫描显微镜(SEM)观察样品的形貌。PEI/PVDF纳米纤维放置在铜网上,在投射电子显微镜(TEM)下观察纤维的皮芯结构。
2.4.2 PEI/PVDF的结构和性能测试
PEI/PVDF的孔径大小通过孔径测定仪(PSM 165)被测定,得到孔径的大小分布及不同的孔径所占比例;利用全自动气体吸附分析仪测得膜的孔隙率。
为了研究PEI/PVDF的流通性能,采用低压平板膜实验设备(TYLG-18)测试了PEI/PVDF的纯水通量。在不同压力下,记录一定量的纯水流过一定面积的膜所需的时间,进而计算出单位压力下,单位时间内流过单位面积膜的水量即膜的水通量,其水通量看可通过式(1)计算:
(式1)
其中,Q是膜的纯水通量[mL/(cm2·s)];Pw是流过膜的水量(mL);Ea是膜的有效面积(cm2);Pt是水流过膜的时间(s)。
2.4.3 傅里叶红外光谱(FITR)测试
对PEI/PVDF、PEI/PVDF-GA和PEI/PVDF-lysine进行红外测试,通过红外特征峰来分析膜的化学结构以及膜表面的基团组成;将三者的红外特征峰进行对比,找出新出现的特征峰对应的官能团,进而判定GA交联及赖氨酸偶联效果。
2.5 吸附实验
将20mg的PEI/PVDF和PEI/PVDF-lysine分别分散于10mL浓度为1mg/mL的胆红素溶液中,进行多组实验。在37℃下,以160rpm的振速振荡,每隔2h取出一组,同时对膜进行清洗,避免膜上残留的胆红素对吸附效果的影响。研究了吸附动力学以及温度和pH对PEI/PVDF-lysine吸附胆红素的影响。所有吸附实验均在暗室中进行,同时与PEI/PVDF作对比。
利用酶标仪测试吸附后胆红素的吸光度,依据胆红素浓度与吸光度的标准曲线获得出胆红素的浓度。本研究中,PEI/PVDF和PEI/PVDF-lysine的胆红的吸附量可通过式(2)计算:
(式2)
其中,q是单位膜的胆红素的吸附量(mg/g);Cb和Ca是吸附前后胆红素的浓度(mg/L);V是胆红素溶液的体积(L);m是膜的质量(g)。
3 结果与讨论
3.1PEI/PVDF的结构与性能
胆红素是有毒血红蛋白的分解代谢产物,血液中高水平的胆红素可能导致永久性脑损伤或死亡。PEI是具有大量伯、仲和叔氨基的阳离子水溶性聚合物[12~13]。在PEI大分子链上,胺基的质子化使其带正电荷,促进了对带负电荷的化合物的静电吸引[14];另一方面,大量的氨基可以通过氢键使PEI和一些有机化合物之间产生非常强的相互作用[15];PEI的疏水乙烯基还可以与一些化合物的疏水链相互作用[16]。因此,PEI对一系列物质具有强的吸附能力[17~19]。
本文利用同轴溶液喷射纺丝技术[6]纺制了PEI/PVDF皮芯纳米纤维,通过透射电子显微镜(TEM)观察了所制纤维的皮芯结构,见图2(a)。从图2可以清楚地看见皮层和芯层间存在明显的接口且纤维有一个连续的芯层。通过场发射扫描电镜(SEM)观察了PEI/PVDF的微观形貌,见图2(b),纤维直径在50nm~250nm并且纤维呈三维卷曲形态,此形态使膜具有高的孔隙率,可达85.6%。
为了探索PEI/PVDF的流通性能,测试了其水通量,见图3(a)。当压力小于0.18MPa时,PEI/PVDF的纯水通量随着压力的递增呈现快速上升趋势,之后趋于平衡,其平衡水通量为1.25mL/(cm2·s)。PEI/PVDF的平均孔径小于2um和80%以上的孔径小于1.4um,见图3(b)。

图2 (a)PEI/PVDF纳米纤维的透射电镜图
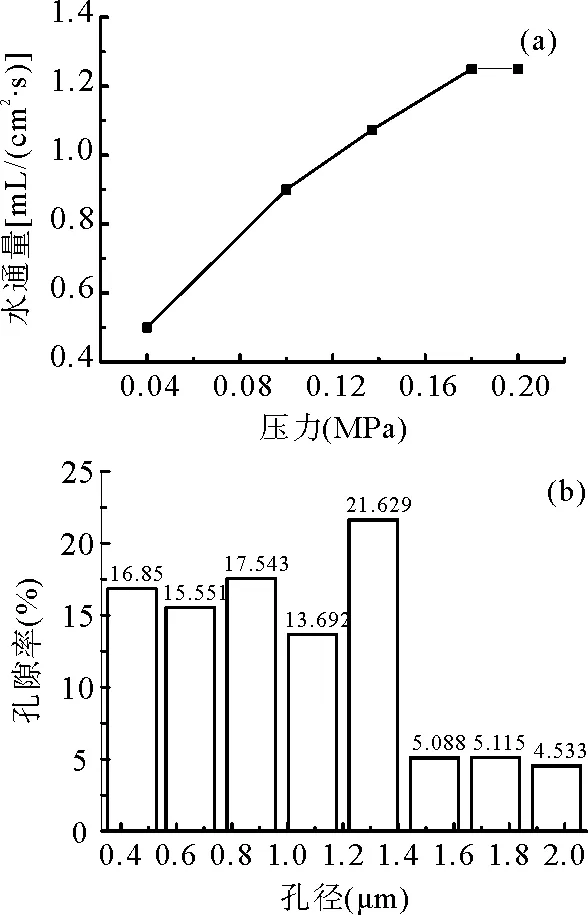
图3 (a)PEI/PVDF的水通量 (b) PEI/PVDF的孔径
3.2 PEI/PVDF修饰前后的结构表征
为了提高PEI/PVDF的吸附性能,进一步将赖氨酸固载到膜的表面,得到PEI/PVDF-lysine。偶联赖氨酸后,膜的表面形貌几乎不变,如图2(c)所示。PEI/PVDF修饰前后的化学结构通过红外光谱进行了分析(图4)。从图4 a曲线可以看出,在1200 cm-1处的是-CF2的吸收峰,此峰是PVDF的特征峰;在1640 cm-1和1469 cm-1处分别对应着-NH2的变形振动和-C-N的伸缩振动,这两个峰是PEI的特征峰;由上述特征峰可推测出PEI/PVDF纳米纤维被成功纺制。1650 cm-1处的特征吸收峰被认定为C=O的伸缩,源于用于交联PEI的交联剂戊二醛(图4 b曲线)。1700 cm-1处的峰认定为C=O的伸缩振动吸收峰,归因于赖氨酸的羧基,由此得出赖氨酸作为配基被固载于PEI/PVDF的表面,见图4 c曲线。除此之外,通过分光光度仪,在570 nm处测定赖氨酸的固载量是每克膜大约6 mg。
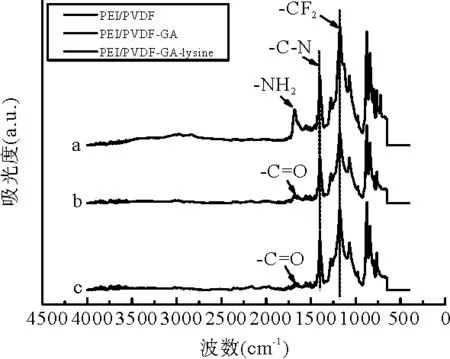
图4 PEI/PVDF 修饰前后的化学结构
3.3 吸附性能测试
将PEI/PVDF和PEI/PVDF-lysine用于吸附胆红素并研究了其吸附行为,见图5。PEI/PVDF在前8 h呈现快速吸附趋势,吸附量由开始2 h的304.31 mg/g到8 h的371.97 mg/g,之后趋于平衡,吸附量达到372.87 mg/g,可归因于PEI分子链上的氨基和胆红素分子结构的羧基间的静电相互作用。PEI/PVDF-lysine具有相似的吸附趋势,PEI/PVDF在前8 h呈现快速吸附趋势,吸附量由开始2 h的314.12 mg/g到8 h的386.97 mg/g,之后趋于平衡,吸附量达到387.69 mg/g,见图5(a)。与PEI/PVDF对比,PEI/PVDF-lysine具有更好的胆红素吸附能力。产生此现象的原因是赖氨酸的长碳链与胆红素的吡咯甲基发生疏水作用;胆红素的羧基或吡咯氮和赖氨酸的含氧基团形成氢键;赖氨酸的氨基与胆红素的羧基间存在静电相互作用。相对以往研究,本文制备的PEI/PVDF和PEI/PVDF-lysine的胆红素吸附量大幅度地提高,可以归因于PEI和赖氨酸好的吸附性能以及纳米纤维大的比表面积。
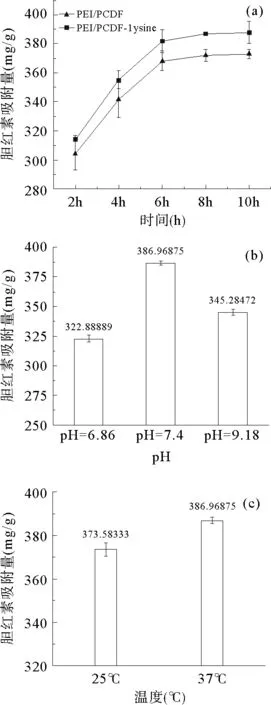
图5 (a)膜胆红素的吸附量与时间的关系曲线
接下来,研究了pH和温度对PEI/PVDF-lysine吸附性能的影响。当pH为6.86、7.4和9.18时,PEI/PVDF-lysine所对应的胆红素吸附量分别为322.89 mg/g、386.97 mg/g和345.28 mg/g,见图5(b)。当pH 在6.86~7.4之间时,分子内氢键逐渐遭到破坏,胆红素的溶解度随之增大,PEI/PVDF-lysine的胆红素吸附量也随之增大。当pH为9.18时,胆红素解离出更多的羧基,使胆红素分子带有大量负电荷,赖氨酸亲和配基上的羧基也会发生解离,在膜的表面形成负电荷,使赖氨酸配基与胆红素分子间产生静电排斥,导致胆红素吸附量降低。
为了研究温度对膜亲和吸附胆红素的影响,分别在25℃和37℃下进行胆红素吸附实验,PEI/PVDF-lysine在25℃和37℃下的胆红素吸附量分别达到373.58 mg/g和386.97 mg/g并且其胆红素吸附量随温度的提高而增加,见图5(c)。产生此现象的原因可能是胆红素分子构象发生改变,使胆红素与赖氨酸间的空间维位阻减小[20]。
4 结论
本文采用同轴溶液喷射纺丝技术制备了一种新型的纳米纤维膜(PEI/PVDF),并将其用用于胆红素吸附。为了提高PEI/PVDF的胆红素吸附性能,将赖氨酸作为亲和配基偶联于PEI/PVDF上制得PEI/PVDF-lysine。实验结果表明,PEI/PVDF 的吸附量可达372.87 mg/g;PEI/PVDF-lysine在37℃下,pH为7.4时其胆红素的吸附量可达393.95 mg/g。由此可以得出,PEI/PVDF和PEI/PVDF-lysine对胆红素均有好的吸附能力,并且赖氨酸的固载在一定程度上提高了PEI/PVDF吸附能力。
[1] Xue M,Ling Y,Wu G,et al. Surface-modified Anodic Aluminum Oxide Membrane with Hydroxyethyl Celluloses as A Matrix for Bilirubin Removal[J].Journal of Chromatography B,2013,912:1—7.
[2] MA Z,RAMAKRISHNA S. ElectrospunRegenerated Cellulose Nanofiber Affinity Membrane Functionalized with Protein A/G for IgG Purification[J].Journal of Membrane Science,2008,319 (1—2):23—28.
[3] Zhang H,Wu C,Zhang Y,et al. Elaboration Characterization and Study of A Novel Affinity Membrane Made from Electrospun Hybrid Chitosan/nylon-6 Nanofibers for Papain Purification [J].Journal of Materials Science,2010,45(9):2296—2304.
[4] Zhuang X,Shi L,Jia K,et al. Solution Blown NanofibrousMembrane for Microfiltration[J].Journal of Membrane Science,2013,429:66—70.
[5] Shi L,Zhuang X,Tao X,et al. Solution Blowing Nylon 6 Nanofiber Mats for Air Filtration [J].Fibers and Polymers,2013,14 (9):1485—1490.
[6] Tong J,Xu X,Wang H,et al. Solution-blown Core-shell Hydrogel Nanofibers for Bovine Serum Albumin Affinity Adsorption[J].RSC Advances,2015, 5(101):83232—83238.
[7] Wang S,Li Z,Lu C. Polyethyleneimine as A Novel Desorbentfor Anionic Organic Dyes on Layered Double Hydroxide Surface[J].Journal of Colloid and Interface Science,2015,458:315—322.
[8] 鞠佳,聂飞,段志军,等.亲和膜配基的结构和密度对胆红素吸附的影响[J].化工学报,2013,64(1): 303—310.
[9] Ma Y,Zhang B,Ma H,et al. Polyethylenimine Nanofibrous Adsorbent for Highly Effective Removal of Anionic Dyes from Aqueous Solution[J].Science China Materials,2016,59(4):38—50.
[10] 薛茂强, 石巍,张其清. 新型亲和膜的制备及其吸附胆红素的性能研究 [J]. 功能材料, 2010, (06): 1106—1109.
[11] 徐堃,黄曼,吴礼光,等.丝氨酸配基PVDF亲和膜脱除人血浆中内毒素的研究[J].膜科学与技术,2011,(02):28—34.
[12] Ling Y,Gao Z F,Zhou Q,et al. Multidimensional Optical Sensing Platform for Detection of Heparin and Reversible Molecular Logic Gate Operation Based on the PhloxineB/PolyethyleneimineSystem[J].Analytical Chemistry,2015,87(3):1575—1581.
[13] Zhang S,Kang P,Ubnoske S,et al. Polyethylenimine-enhanced ElectrocatalyticReduction of CO2to Formateat Nitrogen-doped Carbon Nanomaterials[J].Journal of the American Chemical Society, 2014,136(22):7845—7848.
[14] Schulz C,Ludwig R,Gorton L. Polyethyleneimine as A Promoter Layer for the Immobilization of Cellobiose Dehydrogenase from Myriococcumthermophilum on Graphite Electrodes[J].Analytical Chemistry,2014,86(9):4256—4263.
[15] Chibowski S,Patkowski J,Grzadka E. Adsorption of Polyethyleneimineand Polymethacrylic Acid onto Synthesized Hematite[J].Journal of Colloid & Interface Science,2009,329(1):1—10.
[16] Li Z,Rosen M J. Two-phase Mixed Indicator Titration Method for Determination of Anionic Surfactants[J].Analytical Chemistry,1981,53(9):1516—1519.
[17] Maketon W,Zenner C Z,Ogden K L. Removal Efficiency and Binding Mechanisms of Copper and Copper-EDTA Complexes Using Polyethyleneimine[J].Environmental Science & Technology,2008,42(6):2124—2129.
[18] An F,Gao B. Adsorption of Phenol on A Novel Adsorption Material PEI/SiO2[J].Journal of Hazardous Materials,2008,152(3):1186—1191.
[19] Chen Z Y,He Y Y,Gao H W. PEI@SiO2:Synthesis from Diatomite and Application for Capturing Phenolic Compounds from Aqueous Solution[J].RSC Advances,2014,4(50):26309—26315.
[20] Shi W,Zhang F,Zhang G. Adsorption of Bilirubin with Polylysine Carrying Chitosan-coated Nylon Affinity Membranes[J].Journal of Chromatography B,2005,819(2):301—306.
Fabrication of Polyethylenimine Nanofibers for Bilirubin Affinity Adsorption
ZhangFang1,XuXianlin1,2,WangHang1,ShiLei1,ZhuangXupin1,2
(1.Tianjin Polytechnic University, Tianjin 300387, China; 2.Key Laboratory of Membrane Materials and Membrane Process of Ministry of Construction, Tianjin 300387, China)
Polyethylenimine(PEI)/polyvinylidene fluoride (PVDF) core-shell nanofiber was fabricated via coaxial solution blowing, in which PEI was shell to act as adsorbent and PVDF was core to solve the difficulty of spinning PEI. The nanofibers were disorderly piled into PEI/PVDF nanofiber membrane (PEI/PVDF) with high porosity which was used to adsorb bilirubin. To improve the adsorption performance of the membrane, lysine was further attached on its surface to obtain lysine modified PEI/PVDF(PEI/PVDF-lysine).The results indicate that the adsorption capacity of PEI/PVDF and PEI/PVDF-lysine for bilirubin reach to 376.57 mg/g and 386.97 mg/g, respectively.
PEI nanofibers; coaxial solution blowing; bilirubin; affinity adsorption
2016-11-06
国家自然科学基金 (51476121);天津市应用基础与前沿技术研究计划资助项目(14TXGCCX00014)
张 方(1992—),女,河北南宫人,硕士研究生。
TQ317
B
1009-3028(2016)06-0006-06
